 与唇
与唇 及其正反杂交子代的微卫星标记分析
及其正反杂交子代的微卫星标记分析 与唇
与唇 及其正反杂交子代的微卫星标记分析
及其正反杂交子代的微卫星标记分析摘要:利用12对微卫星引物对花 和唇
和唇 及其正反杂交子代 (花
及其正反杂交子代 (花 ♀×唇
♀×唇 ♂F1和唇
♂F1和唇 ♀×花
♀×花 ♂F1)共4个群体进行微卫星分析,计算等位基因数 (Na)、有效等位基因数 (Ne)、多态性信息含量 (PIC)、观测杂合度 (Ho)、期望杂合度 (He)、遗传分化系数 (Fst)、Nei氏遗传距离 (DS)。结果表明:在4个群体中,反交F1的平均Ne最大 (3.453 7),花
♂F1)共4个群体进行微卫星分析,计算等位基因数 (Na)、有效等位基因数 (Ne)、多态性信息含量 (PIC)、观测杂合度 (Ho)、期望杂合度 (He)、遗传分化系数 (Fst)、Nei氏遗传距离 (DS)。结果表明:在4个群体中,反交F1的平均Ne最大 (3.453 7),花 的平均Ne最小 (3.049 7);花
的平均Ne最小 (3.049 7);花 和唇
和唇 及其正反杂交子代4个群体的平均PIC分别为0.599 4、0.602 6、0.628 0、0.637 4;反交F1的平均Ho最高 (0.411 1),花
及其正反杂交子代4个群体的平均PIC分别为0.599 4、0.602 6、0.628 0、0.637 4;反交F1的平均Ho最高 (0.411 1),花 的平均Ho最低 (0.208 3)。聚类分析结果表明,正交F1和母本花
的平均Ho最低 (0.208 3)。聚类分析结果表明,正交F1和母本花 先聚为一支,再和父本唇
先聚为一支,再和父本唇 聚为一支,最后同反交F1聚在一起。遗传距离和遗传相似系数结果显示:正交F1与母本花
聚为一支,最后同反交F1聚在一起。遗传距离和遗传相似系数结果显示:正交F1与母本花 的遗传相似系数最大,与反交F1的遗传相似系数最小;反交F1同父本花
的遗传相似系数最大,与反交F1的遗传相似系数最小;反交F1同父本花 的遗传相似系数最大,同母本唇
的遗传相似系数最大,同母本唇 的遗传相似系数最小。杂交子代群体的等位基因基本来自父母本双方,可以推断杂交子代的遗传物质来自父母双方,属两性融合生殖,且杂交子代的遗传变异水平明显高于父母本,是真正意义上的杂交种。
的遗传相似系数最小。杂交子代群体的等位基因基本来自父母本双方,可以推断杂交子代的遗传物质来自父母双方,属两性融合生殖,且杂交子代的遗传变异水平明显高于父母本,是真正意义上的杂交种。
关键词:花 ;唇
;唇 ;杂交F1;微卫星分析
;杂交F1;微卫星分析
花 Hemibarbus maculatus和唇
Hemibarbus maculatus和唇 H.labeo同属于鲤形目 Cypriniformes、鲤科 Cyprinidae、鮈亚科Gobioninae、
H.labeo同属于鲤形目 Cypriniformes、鲤科 Cyprinidae、鮈亚科Gobioninae、 属Hemibarbus。除新疆和青藏高原外,花
属Hemibarbus。除新疆和青藏高原外,花 和唇
和唇 在中国各大水系都有分布,是淡水水域常见的两种中小型经济鱼类。两种鱼均肉质鲜美、营养丰富、蛋白质含量高,近年来畅销于华东地区且供不应求,其深加工产品很受东南亚消费者的欢迎,具有广阔的市场前景[1]。花
在中国各大水系都有分布,是淡水水域常见的两种中小型经济鱼类。两种鱼均肉质鲜美、营养丰富、蛋白质含量高,近年来畅销于华东地区且供不应求,其深加工产品很受东南亚消费者的欢迎,具有广阔的市场前景[1]。花 和唇
和唇 均生活在水流速度大、沙石底质的水域中下层,但数量不多,经济价值受到限制[2]。目前,有关花
均生活在水流速度大、沙石底质的水域中下层,但数量不多,经济价值受到限制[2]。目前,有关花 和唇
和唇 的研究主要集中在人工繁殖、胚胎发育、肌肉营养组成、养殖技术、染色体分析、形态分析、分子遗传等方面[1-15],对其杂交子一代遗传背景分子水平的分析尚未见报道。在养殖实践中,发现二者的生长速度有着明显的差异,唇
的研究主要集中在人工繁殖、胚胎发育、肌肉营养组成、养殖技术、染色体分析、形态分析、分子遗传等方面[1-15],对其杂交子一代遗传背景分子水平的分析尚未见报道。在养殖实践中,发现二者的生长速度有着明显的差异,唇 生长比花
生长比花 快[3]。浙江省淡水水产研究所种质资源室研究人员进行了花
快[3]。浙江省淡水水产研究所种质资源室研究人员进行了花 和唇
和唇 的杂交试验,期望通过基因重组获得更具养殖性能的新品种。
的杂交试验,期望通过基因重组获得更具养殖性能的新品种。
微卫星又称简单重复序列 (SSR),是由1~6 bp的简单重复序列组成,广泛存在于真核生物基因组中,因其具有多态性丰富、信息含量多、杂合度高、共显性遗传、数量多、分布广以及检测快速方便等优点而备受青睐[16-18]。本研究中,作者以花 、唇
、唇 及其正交和反交 F14个群体为研究对象,应用12对微卫星标记分析了花
及其正交和反交 F14个群体为研究对象,应用12对微卫星标记分析了花 和唇
和唇 及其亲子代间的遗传关系,旨在从分子水平上为其杂种优势和育种研究奠定基础。
及其亲子代间的遗传关系,旨在从分子水平上为其杂种优势和育种研究奠定基础。
1.1 材料
花 和唇
和唇 均采自浙江省湖州市沈氏水产苗种开发有限公司,杂交试验于2009年7—8月在浙江省淡水水产研究所特种水产苗种基地进行,分别以花
均采自浙江省湖州市沈氏水产苗种开发有限公司,杂交试验于2009年7—8月在浙江省淡水水产研究所特种水产苗种基地进行,分别以花 和唇
和唇 为亲本进行正反杂交。选择健康、性腺发育成熟的个体作为亲鱼,人工挤压亲鱼腹部采集成熟的卵子和精液,干法人工授精,将孵化的仔鱼移至池塘培育,获得杂交一代(F1)。亲鱼和杂交F1各取30尾,均为2龄鱼,剪取部分尾鳍保存在体积分数为90%的酒精中,用于DNA提取。
为亲本进行正反杂交。选择健康、性腺发育成熟的个体作为亲鱼,人工挤压亲鱼腹部采集成熟的卵子和精液,干法人工授精,将孵化的仔鱼移至池塘培育,获得杂交一代(F1)。亲鱼和杂交F1各取30尾,均为2龄鱼,剪取部分尾鳍保存在体积分数为90%的酒精中,用于DNA提取。
1.2 方法
1.2.1 基因组DNA的提取 用常规苯酚/氯仿/异戊醇法抽提DNA,用琼脂糖凝胶电泳检测提取的DNA样品,用紫外分光光度计测定其浓度。将DNA溶液稀释至50 ng/μL,于-20℃下保存备用。
1.2.2 引物筛选及PCR扩增 引物序列及PCR反应程序见文献[19],引物序列和退火温度见表1。所有引物序列由上海生工生物工程技术服务有限公司合成,其他试剂均为国产分析纯。PCR反应体系25 μL,其中 DNA模板1.0 μL,2×Taq PCR Master Mix(0.1 U/μL Taq polymerase,400 μmol/L dNTP each,20 mmol/L pH 8.3 Tris-HCl,100 mmol/L KCl,3 mmol/L MgCl2,均为康为世纪有限公司产品)12.5 μL,10 μmol/L上、下游引物各1 μL,加灭菌去离子水补至25 μL。PCR产物经8%非变性聚丙烯酰胺凝胶电泳检测,上样量为8 μL,在10 V/cm下电泳3 h左右,参照文献[20]中的方法进行凝胶银染,在凝胶成像系统下观察与拍照。
1.3 数据处理
微卫星属共显性遗传,可从电泳图谱上直接判别个体的基因型,用PopGen 3.2软件[21]统计各微卫星位点的等位基因数 (Na)、有效等位基因数(Ne)、观测杂合度 (Ho)、期望杂合度 (He)、遗传分化系数 (Fst)、Hardy-Weinberg平衡 (PHW)和遗传距离 (DS)等参数,多态性信息含量(PIC)的计算公式[22]为
其中:Pi、Pj分别为群体中第i和第j个等位基因频率;n为某一基因座上的等位基因数。根据群体间的遗传距离,用Mega 4.0软件构建系统树 (UPGMA法)。
表1 12对微卫星引物及退火温度
Tab.1 Twelve pairs of microsatellite primers and their annealing temperature
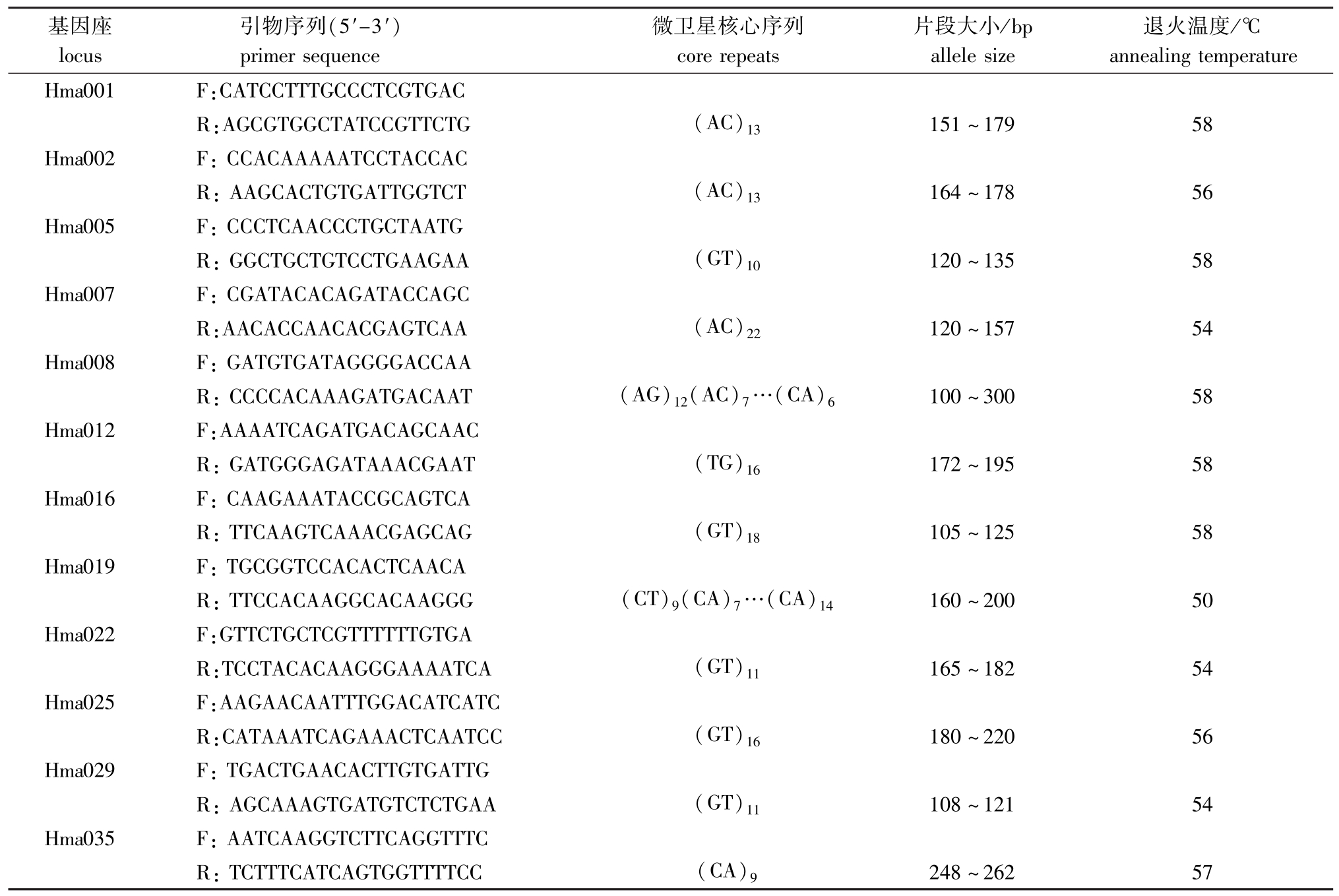
基因座locus引物序列(5'-3') primer sequence微卫星核心序列core repeats片段大小/bp allele size退火温度/℃annealing temperature Hma001 F:CATCCTTTGCCCTCGTGAC R:AGCGTGGCTATCCGTTCTG (AC)13151~179 58 Hma002 F:CCACAAAAATCCTACCAC R:AAGCACTGTGATTGGTCT (AC)13164~178 56 Hma005 F:CCCTCAACCCTGCTAATG R:GGCTGCTGTCCTGAAGAA (GT)10120~135 58 Hma007 F:CGATACACAGATACCAGC R:AACACCAACACGAGTCAA (AC)22120~157 54 Hma008 F:GATGTGATAGGGGACCAA R:CCCCACAAAGATGACAAT (AG)12(AC)7…(CA)6100~300 58 Hma012 F:AAAATCAGATGACAGCAAC R:GATGGGAGATAAACGAAT (TG)16172~195 58 Hma016 F:CAAGAAATACCGCAGTCA R:TTCAAGTCAAACGAGCAG (GT)18105~125 58 Hma019 F:TGCGGTCCACACTCAACA R:TTCCACAAGGCACAAGGG (CT)9(CA)7…(CA)14160~200 50 Hma022 F:GTTCTGCTCGTTTTTTGTGA R:TCCTACACAAGGGAAAATCA (GT)11165~182 54 Hma025 F:AAGAACAATTTGGACATCATC R:CATAAATCAGAAACTCAATCC (GT)16180~220 56 Hma029 F:TGACTGAACACTTGTGATTG R:AGCAAAGTGATGTCTCTGAA (GT)11108~121 54 Hma035 F:AATCAAGGTCTTCAGGTTTC R:TCTTTCATCAGTGGTTTTCC (CA)9248~262 57
2.1 PCR扩增
12对微卫星引物均能在父母本和杂交子代中扩增出清晰的条带,且都为多态性引物。12对引物在4个群体中共检测到197个等位基因,在扩增条带数量上,反交F1数量最多 (498条),其次是正交F1(459条),唇 最少 (441条)。图1为引物Hma008在4个群体中的扩增结果。
最少 (441条)。图1为引物Hma008在4个群体中的扩增结果。
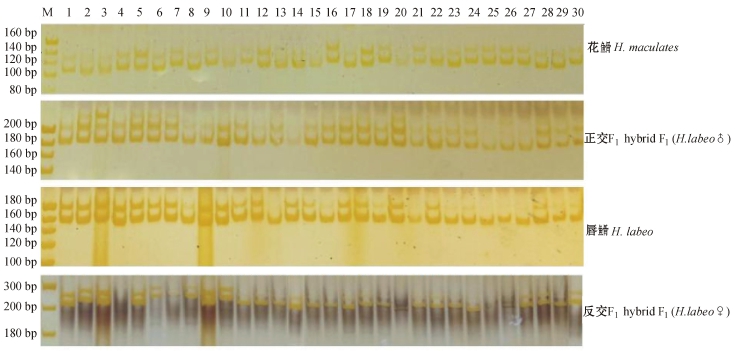
图1 引物Hma008在4个群体中的扩增图
Fig.1 Amplified gel electrophoresis of primer Hma008 in the four populations
注:M为20 bp DNA Ladder Marker;1~30为个体编号。
Note:M,20 bp DNA Ladder Marker;1-30,Individual numbers.
2.2 等位基因数、基因杂合度和多态性信息含量
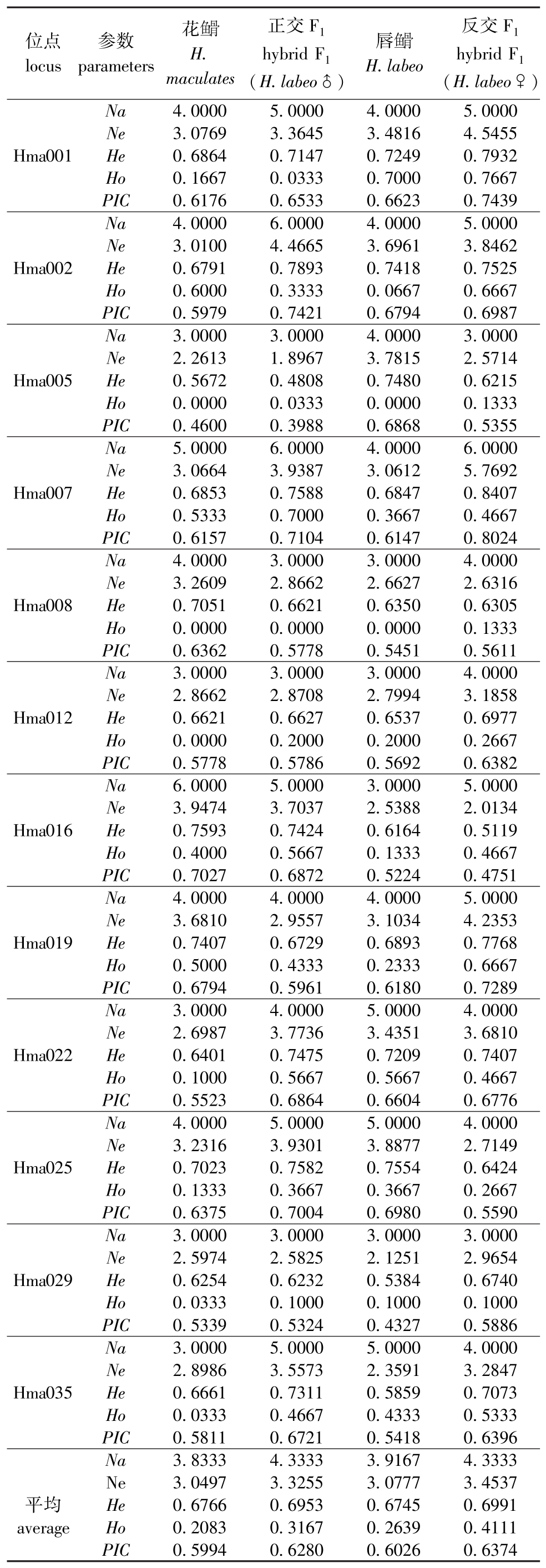
从表2可见:在4个群体中,反交F1的平均Ne最大 (3.453 7),花 的平均 Ne最小(3.049 7);反交 F1的平均Ho最大 (0.411 1),花
的平均 Ne最小(3.049 7);反交 F1的平均Ho最大 (0.411 1),花 的平均 Ho最小 (0.208 3)。根据 Botstein等[22]提出的衡量标准:当PIC<0.25时,为低度多态性位点;0.25<PIC<0.5时,为中度多态性位点; PIC>0.5时,为高度多态性位点。从位点来看,反交F1的Hma007位点的PIC最大 (0.802 4),正交F1的Hma005位点的PIC最小 (0.398 8)。从群体来看,花
的平均 Ho最小 (0.208 3)。根据 Botstein等[22]提出的衡量标准:当PIC<0.25时,为低度多态性位点;0.25<PIC<0.5时,为中度多态性位点; PIC>0.5时,为高度多态性位点。从位点来看,反交F1的Hma007位点的PIC最大 (0.802 4),正交F1的Hma005位点的PIC最小 (0.398 8)。从群体来看,花 、正交F1、唇
、正交F1、唇 、反交F14个群体的 PIC分别为 0.599 4、0.628 0、0.602 6、0.637 4,4个群体的平均PIC为0.616 9,均为高度多态性位点,说明本研究中所选用的12对引物多态性丰富,可以用作分析花
、反交F14个群体的 PIC分别为 0.599 4、0.628 0、0.602 6、0.637 4,4个群体的平均PIC为0.616 9,均为高度多态性位点,说明本研究中所选用的12对引物多态性丰富,可以用作分析花 、唇
、唇 及其杂交子代的遗传多样性。
及其杂交子代的遗传多样性。
2.3 群体Hardy-Weinberg平衡检验
用基于马尔夫链模型 (Markov chain method)的Hardy-Weinberg精确P值的无偏估测对各群体的基因座进行检测,4个群体在基因座Hma005、Hma008、Hma012、Hma019、Hma025、Hma029上极显著地偏离了遗传平衡 (P<0.01),其他6个位点至少在1个群体中偏离了遗传平衡,这些偏离平衡的位点是由杂合体缺失引起的 (Fst>0)。
2.4 群体遗传分化分析
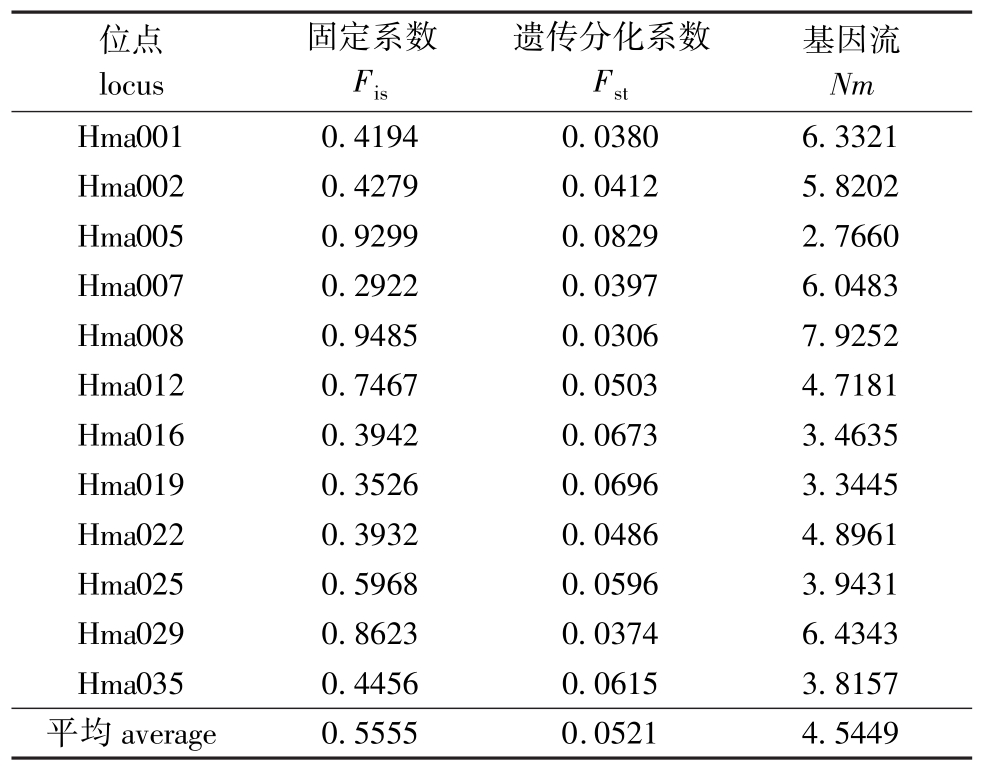
基于配子间的Fst与基因流 (Nm)分析4个群体的遗传分化情况,结果表明,4个群体在12个位点的平均Fst为0.052 1(表3),表明只有5.21%的变异是由群体间分化导致的,而94.79%的变异来源于群体内。除了在基因座Hma001、Hma002、Hma007、Hma008、Hma022、Hma029上的 Fst<0.05,其余均大于种群间无遗传分化的标准。
2.5 遗传距离、遗传相似系数及聚类分析
4个群体中,花 与正交F1的遗传相似系数最大 (0.946 2),唇
与正交F1的遗传相似系数最大 (0.946 2),唇 与反交F1的遗传相似系数最小 (0.818 8)。与遗传距离之间的关系相对应,花
与反交F1的遗传相似系数最小 (0.818 8)。与遗传距离之间的关系相对应,花 与正交F1的遗传距离最小 (0.055 3),唇
与正交F1的遗传距离最小 (0.055 3),唇 与反交F1的遗传距离最大 (0.199 9)(表4)。根据遗传距离,采用UPGMA法构建它们之间的聚类图,结果表明:花
与反交F1的遗传距离最大 (0.199 9)(表4)。根据遗传距离,采用UPGMA法构建它们之间的聚类图,结果表明:花 与正交F1先聚为一支,再和唇
与正交F1先聚为一支,再和唇 聚为一支,反交F1位于最外支 (图2)。
聚为一支,反交F1位于最外支 (图2)。
远缘杂交是鱼类育种的基本手段之一,广泛应用于水产养殖生产中[23],微卫星标记在鱼类远缘杂交育种上有着很好的应用。王晓清等[24]对大黄鱼、鮸以及杂交子代进行了微卫星和AFLP标记的比较分析,结果表明,杂交子代和母本之间有极高的遗传同质性,属异精雌核发育个体。周翰林等[25]使用6对微卫星引物对两种杂交子一代青龙斑和虎龙斑及其亲本共5个群体进行微卫星分析,结果表明,杂交子代遗传物质一方来自父本,一方来自母本,是真正意义上的杂交种。颜标等[26]利用微卫星标记分析了尼罗罗非鱼与萨罗罗非鱼及其正反杂交子代的关系,证明了正反交子代有明显的杂种优势,杂交子代的DNA具有更丰富的多态性。本研究中使用的12对微卫星引物中,有11对引物
在4个群体中均表现为高度多态,高度多态比例为91.7%,表明这12对微卫星引物可靠性较高,可以作为分析遗传变异的标记。尤其是Hma002和Hma007,在正反交子代中的PIC接近或大于0.7,可以作为理想的遗传标记[27]。在4个群体中,正反交子代的平均PIC分别为0.628 0、0.637 4,大于父母本,表明杂交子代具有更丰富的DNA多态性。
表2 4个群体的遗传变异参数
Tab.2 Variation parameters in the four populations
位点locus参数parameters花 H. maculates正交F1hybrid F1(H.labeo♂)唇
H. maculates正交F1hybrid F1(H.labeo♂)唇 H.labeo反交F1hybrid F1(H.labeo♀) Na 4.0000 5.0000 4.0000 5.0000 Ne 3.0769 3.3645 3.4816 4.5455 Hma001 He 0.6864 0.7147 0.7249 0.7932 Ho 0.1667 0.0333 0.7000 0.7667 PIC 0.6176 0.6533 0.6623 0.7439 Na 4.0000 6.0000 4.0000 5.0000 Ne 3.0100 4.4665 3.6961 3.8462 Hma002 He 0.6791 0.7893 0.7418 0.7525 Ho 0.6000 0.3333 0.0667 0.6667 PIC 0.5979 0.7421 0.6794 0.6987 Na 3.0000 3.0000 4.0000 3.0000 Ne 2.2613 1.8967 3.7815 2.5714 Hma005 He 0.5672 0.4808 0.7480 0.6215 Ho 0.0000 0.0333 0.0000 0.1333 PIC 0.4600 0.3988 0.6868 0.5355 Na 5.0000 6.0000 4.0000 6.0000 Ne 3.0664 3.9387 3.0612 5.7692 Hma007 He 0.6853 0.7588 0.6847 0.8407 Ho 0.5333 0.7000 0.3667 0.4667 PIC 0.6157 0.7104 0.6147 0.8024 Na 4.0000 3.0000 3.0000 4.0000 Ne 3.2609 2.8662 2.6627 2.6316 Hma008 He 0.7051 0.6621 0.6350 0.6305 Ho 0.0000 0.0000 0.0000 0.1333 PIC 0.6362 0.5778 0.5451 0.5611 Na 3.0000 3.0000 3.0000 4.0000 Ne 2.8662 2.8708 2.7994 3.1858 Hma012 He 0.6621 0.6627 0.6537 0.6977 Ho 0.0000 0.2000 0.2000 0.2667 PIC 0.5778 0.5786 0.5692 0.6382 Na 6.0000 5.0000 3.0000 5.0000 Ne 3.9474 3.7037 2.5388 2.0134 Hma016 He 0.7593 0.7424 0.6164 0.5119 Ho 0.4000 0.5667 0.1333 0.4667 PIC 0.7027 0.6872 0.5224 0.4751 Na 4.0000 4.0000 4.0000 5.0000 Ne 3.6810 2.9557 3.1034 4.2353 Hma019 He 0.7407 0.6729 0.6893 0.7768 Ho 0.5000 0.4333 0.2333 0.6667 PIC 0.6794 0.5961 0.6180 0.7289 Na 3.0000 4.0000 5.0000 4.0000 Ne 2.6987 3.7736 3.4351 3.6810 Hma022 He 0.6401 0.7475 0.7209 0.7407 Ho 0.1000 0.5667 0.5667 0.4667 PIC 0.5523 0.6864 0.6604 0.6776 Na 4.0000 5.0000 5.0000 4.0000 Ne 3.2316 3.9301 3.8877 2.7149 Hma025 He 0.7023 0.7582 0.7554 0.6424 Ho 0.1333 0.3667 0.3667 0.2667 PIC 0.6375 0.7004 0.6980 0.5590 Na 3.0000 3.0000 3.0000 3.0000 Ne 2.5974 2.5825 2.1251 2.9654 Hma029 He 0.6254 0.6232 0.5384 0.6740 Ho 0.0333 0.1000 0.1000 0.1000 PIC 0.5339 0.5324 0.4327 0.5886 Na 3.0000 5.0000 5.0000 4.0000 Ne 2.8986 3.5573 2.3591 3.2847 Hma035 He 0.6661 0.7311 0.5859 0.7073 Ho 0.0333 0.4667 0.4333 0.5333 PIC 0.5811 0.6721 0.5418 0.6396 Na 3.8333 4.3333 3.9167 4.3333 Ne 3.0497 3.3255 3.0777 3.4537平均 He 0.6766 0.6953 0.6745 0.6991 average Ho 0.2083 0.3167 0.2639 0.4111 PIC 0.5994 0.6280 0.6026 0.6374
H.labeo反交F1hybrid F1(H.labeo♀) Na 4.0000 5.0000 4.0000 5.0000 Ne 3.0769 3.3645 3.4816 4.5455 Hma001 He 0.6864 0.7147 0.7249 0.7932 Ho 0.1667 0.0333 0.7000 0.7667 PIC 0.6176 0.6533 0.6623 0.7439 Na 4.0000 6.0000 4.0000 5.0000 Ne 3.0100 4.4665 3.6961 3.8462 Hma002 He 0.6791 0.7893 0.7418 0.7525 Ho 0.6000 0.3333 0.0667 0.6667 PIC 0.5979 0.7421 0.6794 0.6987 Na 3.0000 3.0000 4.0000 3.0000 Ne 2.2613 1.8967 3.7815 2.5714 Hma005 He 0.5672 0.4808 0.7480 0.6215 Ho 0.0000 0.0333 0.0000 0.1333 PIC 0.4600 0.3988 0.6868 0.5355 Na 5.0000 6.0000 4.0000 6.0000 Ne 3.0664 3.9387 3.0612 5.7692 Hma007 He 0.6853 0.7588 0.6847 0.8407 Ho 0.5333 0.7000 0.3667 0.4667 PIC 0.6157 0.7104 0.6147 0.8024 Na 4.0000 3.0000 3.0000 4.0000 Ne 3.2609 2.8662 2.6627 2.6316 Hma008 He 0.7051 0.6621 0.6350 0.6305 Ho 0.0000 0.0000 0.0000 0.1333 PIC 0.6362 0.5778 0.5451 0.5611 Na 3.0000 3.0000 3.0000 4.0000 Ne 2.8662 2.8708 2.7994 3.1858 Hma012 He 0.6621 0.6627 0.6537 0.6977 Ho 0.0000 0.2000 0.2000 0.2667 PIC 0.5778 0.5786 0.5692 0.6382 Na 6.0000 5.0000 3.0000 5.0000 Ne 3.9474 3.7037 2.5388 2.0134 Hma016 He 0.7593 0.7424 0.6164 0.5119 Ho 0.4000 0.5667 0.1333 0.4667 PIC 0.7027 0.6872 0.5224 0.4751 Na 4.0000 4.0000 4.0000 5.0000 Ne 3.6810 2.9557 3.1034 4.2353 Hma019 He 0.7407 0.6729 0.6893 0.7768 Ho 0.5000 0.4333 0.2333 0.6667 PIC 0.6794 0.5961 0.6180 0.7289 Na 3.0000 4.0000 5.0000 4.0000 Ne 2.6987 3.7736 3.4351 3.6810 Hma022 He 0.6401 0.7475 0.7209 0.7407 Ho 0.1000 0.5667 0.5667 0.4667 PIC 0.5523 0.6864 0.6604 0.6776 Na 4.0000 5.0000 5.0000 4.0000 Ne 3.2316 3.9301 3.8877 2.7149 Hma025 He 0.7023 0.7582 0.7554 0.6424 Ho 0.1333 0.3667 0.3667 0.2667 PIC 0.6375 0.7004 0.6980 0.5590 Na 3.0000 3.0000 3.0000 3.0000 Ne 2.5974 2.5825 2.1251 2.9654 Hma029 He 0.6254 0.6232 0.5384 0.6740 Ho 0.0333 0.1000 0.1000 0.1000 PIC 0.5339 0.5324 0.4327 0.5886 Na 3.0000 5.0000 5.0000 4.0000 Ne 2.8986 3.5573 2.3591 3.2847 Hma035 He 0.6661 0.7311 0.5859 0.7073 Ho 0.0333 0.4667 0.4333 0.5333 PIC 0.5811 0.6721 0.5418 0.6396 Na 3.8333 4.3333 3.9167 4.3333 Ne 3.0497 3.3255 3.0777 3.4537平均 He 0.6766 0.6953 0.6745 0.6991 average Ho 0.2083 0.3167 0.2639 0.4111 PIC 0.5994 0.6280 0.6026 0.6374
表3 4个群体在12个微卫星位点上的固定系数、遗传分化系数和基因流
Tab.3 The values of Fis,Fstand Nm for twelve microsatellite loci in the four populations
位点locus固定系数Fis遗传分化系数Fst基因流Nm Hma001 0.4194 0.0380 6.3321 Hma002 0.4279 0.0412 5.8202 Hma005 0.9299 0.0829 2.7660 Hma007 0.2922 0.0397 6.0483 Hma008 0.9485 0.0306 7.9252 Hma012 0.7467 0.0503 4.7181 Hma016 0.3942 0.0673 3.4635 Hma019 0.3526 0.0696 3.3445 Hma022 0.3932 0.0486 4.8961 Hma025 0.5968 0.0596 3.9431 Hma029 0.8623 0.0374 6.4343 Hma035 0.4456 0.0615 3.8157平均average 0.5555 0.0521 4.5449
表4 4个群体间的遗传距离和遗传相似系数
Tab.4 Genetic distances and genetic similarity among the four populations
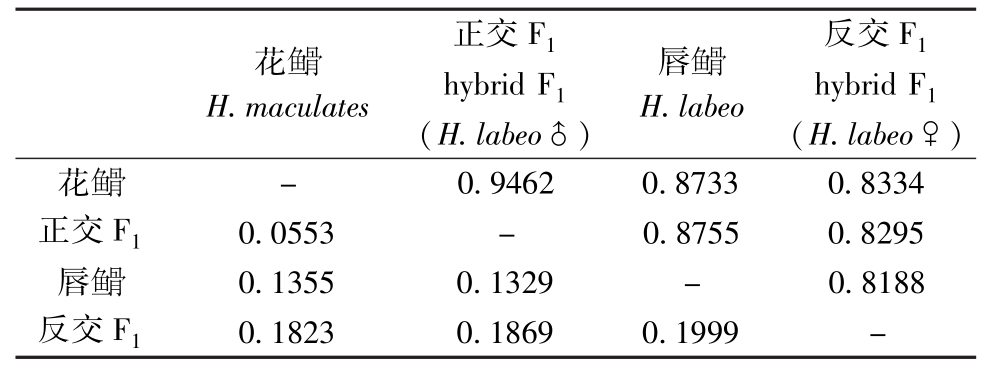
注:对角线以上为遗传相似系数,对角线以下为遗传距离。
Note:The data above diagonal line mean genetic distances and the data below diagonal line mean genetic similarity.
花 H.maculates正交F1hybrid F1(H.labeo♂)唇H.labeo反交F1hybrid F1(H.labeo♀)花
H.maculates正交F1hybrid F1(H.labeo♂)唇H.labeo反交F1hybrid F1(H.labeo♀)花 -0.9462 0.8733 0.8334正交F10.0553 - 0.8755 0.8295唇
-0.9462 0.8733 0.8334正交F10.0553 - 0.8755 0.8295唇 0.1355 0.1329 - 0.8188反交F10.1823 0.1869 0.1999 -
0.1355 0.1329 - 0.8188反交F10.1823 0.1869 0.1999 -
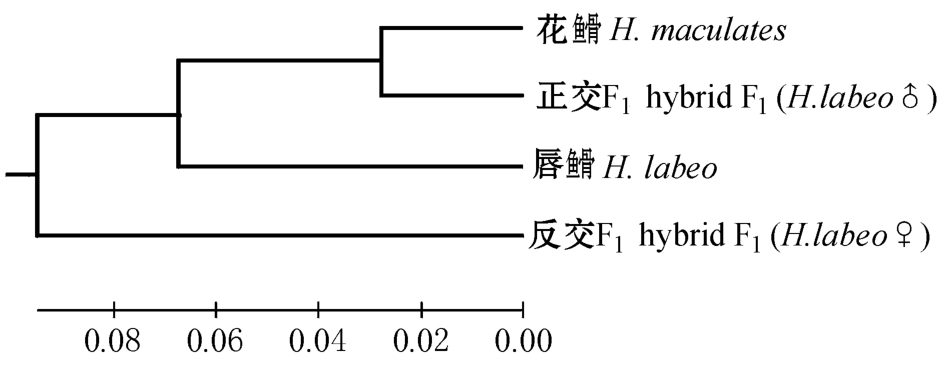
图2 4个群体的UPGMA聚类分析图
Fig.2 Cluster dengrogram of the four populations using UPGMA method
当种群处于H-D平衡时,各等位基因在群体中的分布频率应该是相对稳定的,观测杂合度和期望杂合度之间没有显著的差异。本研究结果显示,有6个基因座偏离了H-D平衡,且观测杂合度显著小于期望杂合度。究其原因,父母本均为养殖群体,且亲本数量较少,经过小群体近交繁殖,造成了部分稀有等位基因的丢失,从而在群体中出现了杂合子缺失。一般认为,群体之间的Nm>1时,群体就可以抵抗由于遗传漂变造成的影响[28],本研究中的Nm=2.7660~7.9252,平均Nm为4.544 9 (表3),排除了遗传漂变对群体的影响,表明群体间存在持续的基因交流。
杂合度又称为基因多样度,其大小可以反映群体遗传变异的高低[29]。杂合度高的生物群体具有更大的适应环境变化和自然选择的能力[30-32]。本试验中发现,正反交子代的Ho和He均大于父母本,正反交子代遗传了父母本大部分条带,且数量多于父母本,可见杂交子代的杂合度得到了提高,后代较高的杂合度一方面来自父母本双方的遗传基因,另一方面又来自杂交子代的遗传变异,这也是形成杂种优势重要的遗传物质基础之一。
在本试验中,正交和反交子代的亲缘关系都与花 较近,从聚类图上也可以看出,反交F1位于最外支,在两个亲本之外,这和王晓清等[24]、周翰林等[25]、颜标等[26]的研究结果杂交子代位于父母本之间的聚类图不同。刘毅辉等[33]、邱洋洋等[34]的研究结果表明,杂交F1更趋向于母本。练青平等[12]的研究结果表明,反交F1在形态上更趋向于母本唇
较近,从聚类图上也可以看出,反交F1位于最外支,在两个亲本之外,这和王晓清等[24]、周翰林等[25]、颜标等[26]的研究结果杂交子代位于父母本之间的聚类图不同。刘毅辉等[33]、邱洋洋等[34]的研究结果表明,杂交F1更趋向于母本。练青平等[12]的研究结果表明,反交F1在形态上更趋向于母本唇 ,与本研究结果相反。原因可能是,杂交试验易受环境的影响,而SSR标记不受环境的影响,但受亲本选择、等位基因判别、取样误差等影响,也会导致SSR分析和形态分析结果不一致。练青平等[12]的研究样本只有父母本和反交F13个群体,并没有正交F1群体,且花
,与本研究结果相反。原因可能是,杂交试验易受环境的影响,而SSR标记不受环境的影响,但受亲本选择、等位基因判别、取样误差等影响,也会导致SSR分析和形态分析结果不一致。练青平等[12]的研究样本只有父母本和反交F13个群体,并没有正交F1群体,且花 和唇
和唇 的形态近似不易区分,在具体操作中对种类准确鉴别较难,仅从形态上判别会存在误判现象,因此,作者建议谨慎运用形态学判别方式判别唇
的形态近似不易区分,在具体操作中对种类准确鉴别较难,仅从形态上判别会存在误判现象,因此,作者建议谨慎运用形态学判别方式判别唇 和唇
和唇 ♀×花
♀×花 ♂ F1子代。本研究中,杂交子代出现了部分新的等位基因,亲本的等位基因在杂交子代中也有缺失现象,可能是由于亲本部分遗传物质发生了合并或交换,造成等位基因分布不平衡,导致反交F1在聚类图上处于最外支。
♂ F1子代。本研究中,杂交子代出现了部分新的等位基因,亲本的等位基因在杂交子代中也有缺失现象,可能是由于亲本部分遗传物质发生了合并或交换,造成等位基因分布不平衡,导致反交F1在聚类图上处于最外支。
本研究中应用12对微卫星引物的研究结果表明,所检测的正反交子代的等位基因基本上来自父母本,虽然丢失了父母本部分等位基因,同时也出现了一些新的等位基因,但总体上遵循孟德尔分离规律,是真正意义上的杂交子代。一般认为,PIC高、杂合度大,说明群体内基因一致性差、遗传变异大、选择潜力也大;反之亦然[35]。从本研究结果可以看出,唇 ♀×花
♀×花 ♂ F1和亲本的亲缘关系较远,PIC和杂合度最高,可考虑作为更具育种潜力的候选群体。同时,作者也对反交子代的生长性能进行了跟踪研究,结果表明,反交F1在生长性能上较父母本均有优势,表现出一定的杂种优势,有关正交子代的生长性能还有待进一步研究。
♂ F1和亲本的亲缘关系较远,PIC和杂合度最高,可考虑作为更具育种潜力的候选群体。同时,作者也对反交子代的生长性能进行了跟踪研究,结果表明,反交F1在生长性能上较父母本均有优势,表现出一定的杂种优势,有关正交子代的生长性能还有待进一步研究。
参考文献:
[1]吕耀平,胡则辉,叶丽平.RAPD标记在唇 与花
与花 种质鉴定中的应用[J].浙江大学学报:理学版,2008,35(3):324-330.
种质鉴定中的应用[J].浙江大学学报:理学版,2008,35(3):324-330.
[2]冯晓宇,杨仲景,郭水荣,等.唇 人工繁殖和鱼苗培育初步研究[J].淡水渔业,2006,36(6):58-60.
人工繁殖和鱼苗培育初步研究[J].淡水渔业,2006,36(6):58-60.
[3]郭水荣,冯晓宇,李行先,等.唇 与花
与花 网箱养殖对比试验[J].杭州农业科技,2007(2):31-33.
网箱养殖对比试验[J].杭州农业科技,2007(2):31-33.
[4]闫有利,李文宽,邱春刚,等.花 的人工繁殖与苗种培育试验[J].水产科学,2007,26(12):656-658.
的人工繁殖与苗种培育试验[J].水产科学,2007,26(12):656-658.
[5]吕耀平,曹明富,姚子亮,等.花 和唇
和唇 的含肉率及肌肉营养成分分析[J].水生生物学报,2007,31(6):843-848.
的含肉率及肌肉营养成分分析[J].水生生物学报,2007,31(6):843-848.
[6]陈建明,叶金云,沈斌乾,等.野生和池塘养殖花 肌肉营养组成的比较分析[J].上海水产大学学报,2007,16(1):87-91.
肌肉营养组成的比较分析[J].上海水产大学学报,2007,16(1):87-91.
[7]李均详.花 染色体核型的研究[J].安徽农业科学,2008,36 (31):13658-13659,13699.
染色体核型的研究[J].安徽农业科学,2008,36 (31):13658-13659,13699.
[8]王丹,赵晓临,王晓光,等.花 胚胎和仔鱼发育的初步研究[J].水产学杂志,2008,21(1):1-8.
胚胎和仔鱼发育的初步研究[J].水产学杂志,2008,21(1):1-8.
[9]顾若波,闻海波,徐钢春,等.花 胚胎发育及卵黄囊仔鱼形态的初步观察[J].浙江海洋学院学报:自然科学版,2006,25 (4):373-378.
胚胎发育及卵黄囊仔鱼形态的初步观察[J].浙江海洋学院学报:自然科学版,2006,25 (4):373-378.
[10]甘光明,张耀光.唇 受精卵的皮层反应及其引发机制[J].水生生物学报,2005,29(5):479-487.
受精卵的皮层反应及其引发机制[J].水生生物学报,2005,29(5):479-487.
[11]胡雪松,石连玉,李池陶,等.黑龙江和乌苏里江唇 的微卫星引物筛选及群体遗传结构[J].中国水产科学,2008,15(2): 230-236.
的微卫星引物筛选及群体遗传结构[J].中国水产科学,2008,15(2): 230-236.
[12]练青平,宓国强,胡廷尖,等.唇 、花
、花 及其杂交F1的形态差异分析[J].大连海洋大学学报,2011,26(6):493-499.
及其杂交F1的形态差异分析[J].大连海洋大学学报,2011,26(6):493-499.
[13]宓国强,练青平,姚子亮,等.唇 ♀×花
♀×花 ♂杂交子一代胚胎发育研究[J].浙江海洋学院学报:自然科学版,2010,29(6): 537-543.
♂杂交子一代胚胎发育研究[J].浙江海洋学院学报:自然科学版,2010,29(6): 537-543.
[14]练青平,宓国强,胡廷尖,等.花 ♀×唇
♀×唇 ♂杂交子一代胚胎发育研究[J].湖北农业科学,2012,51(1):131-135.
♂杂交子一代胚胎发育研究[J].湖北农业科学,2012,51(1):131-135.
[15]练青平,宓国强,胡廷尖,等.花 ♀×唇
♀×唇 ♂远缘杂交的初步研究[J].水产养殖,2012,33(4):25-28.
♂远缘杂交的初步研究[J].水产养殖,2012,33(4):25-28.
[16]O'Connell M,Wright J M.Microsatellite DNA in fishes[J].Reviews in Fish Biology and Fisheries,1997,7(3):331-336.
[17]Liu Z J,Cordes J F.DNA marker technologies and their applications in aquaculture genetics[J].Aquaculture,2004,238:1-4.
[18]刘贤德,韦信键,蔡明夷,等.大黄鱼22个微卫星标记在F1家系中的分离方式及与生长性状的相关分析[J].水产学报, 2012,36(9):1322-1328.
[19]Zhu J J,Liu S L,Ma K Y,et al.Twenty-four polymorphic microsatellite markers from spotted barbell(Hemibarbus maculates) [J].Conservation Genetics Resources,2011,3(2):239-241.
[20]Wang Z Y,Tsoi K H,Chu K H.Applications of AFLP technology in genetic and phylogenetic analysis of penaeid shrimp[J].Biochemical Systematics and Ecology,2004,32(4):399-407.
[21]Yeh F,Yang R C,Boyle T.POPGENE:A user friendly shareware for population genetic analysis[M].Edmonton:Molecular and Biotechnology Center,University of Alberta,1997.
[22]Botstein D,White R L,Skolnick M,et al.Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J].American Journal of Human Genetics,1980,32(3): 314-331.
[23]楼允东,李小勤.中国鱼类远缘杂交研究及其在水产养殖上的应用[J].中国水产科学,2006,13(1):151-158.
[24]王晓清,王志勇,谢中国,等.大黄鱼♀与鮸♂杂交的遗传分析[J].水产学报,2008,32(1):51-57.
[25]周翰林,张勇,齐鑫,等.两种杂交石斑鱼子一代杂种优势的微卫星标记分析[J].水产学报,2012,36(2):161-169.
[26]颜标,李思发,蔡完其.尼罗罗非鱼与萨罗罗非鱼及其正反杂交后代的微卫星分析[J].水产学报,2007,31(3):411-415.
[27]Shoniwa F F,Howard J H.Electrophoretic identification and phylogenetic relationships of indigenous tilapiine species of Zimbaque [J].Journal of Fish Biology,1998,53(6):1178-1206.
[28]Slatkin M.Gene flow and the geographic structure of natural populations[J].Science,1987,236:787-792.
[29]Nei M,Maruyama T,Chakraborty R.The bottleneck effect and genetic variability in populations[J].Evolution,1975,29:1-10.
[30]孙翰昌,代丽.鲫(♀)×禾花鱼(♂)杂交及杂交F1亲本的形态特征研究[J].淡水渔业,2011,41(1):48-52.
[31]王炳谦,古味,高会江,等.利用配合力和微卫星标记预测虹鳟品系间的杂交优势[J].中国水产科学,2009,16(2):206-213.
[32]Kohlmann K,Kersten P.Genetic variability of German and foreign common carp(Cyprinus carpio L.)populations[J].Aquaculture, 1999,173:435-445.
[33]刘毅辉,陈永乐,朱新平,等.翘嘴鳜、斑鳜及其杂交后代的胚胎和胚后发育比较[J].大连海洋大学学报,2012,27(1):6-11.
[34]邱洋洋,陆海燕,宓华明,等.金鱼红白虎头和红白蝶尾及其杂交F1代的体色和体型的分析[J].大连海洋大学学报, 2011,26(3):209-214.
[35]孙少华,桑润滋,师守堃,等.肉牛杂交优势预测、评估及其应用研究[J].遗传学报,2000,27(7):580-589.
Microsatellite analysis of Hemibarbus maculates,H.labeo and their reciprocal hybrids
Abstract:Twelve pairs of microsatellite primers were used to analyze genetic structure of Hemibarbus maculates, H.labeo and their reciprocal hybrids,and number of alleles(Na),effective alleles(Ne),polymorphic information content(PIC),observed(Ho)and expected(He)heterozygosity values,genetic similarity index and Nei's genetic distance were all detected.It was foud that the F1of H.labeo♀×H.maculates♂showed the most effective alleles (3.453 7),while the H.maculates showed the least(3.049 7).The average values of PIC were 0.599 4 in H.maculates,0.602 6 in H.labeo,0.628 0 in H.maculates♀×H.labeo♂)and 0.637 4 in H.labeo♀×H.maculates♂.The H.labeo♀×H.maculates♂F1generations showed the maximal observed heterozygosity(Ho) (0.411 1),while H.maculates showed the minimal value of 0.208 3.The cluster results showed H.maculates♀× H.labeo♂F1and H.maculates were clustered together firstly and then with H.labeo together,and secondly with F1of H.labeo♀×H.maculates♂.The genetic distances and genetic similarity showed both F1progenies had a close relationship with the parent H.maculates,and H.labeo♀×H.maculates♂F1had the least value of genetic similarity with the female H.labeo parent which had the maxmal value of genetic similarity with the male H.maculates parent. The alleles of F1generations were mostly generated from their parents,indicating that the genetic materials were inherited from parents.The both F1had higher level of genetic variability than their parents and its real hybrids did.
Key words:Hemibarbus maculates;Hemibarbus labeo;hybrid F1;microsatellite analysis
中图分类号:Q959.46
文献标志码:A
收稿日期:2012-10-12
基金项目:浙江省科技厅公益性项目 (2011C22067);浙江省湖州市科技局科技攻关计划项目 (2011GN04);浙江省重点科技创新团队计划项目 (2011R50029)
文章编号:2095-1388(2013)03-0241-06