表1 引物序列
Tab.1 The sequences of primers
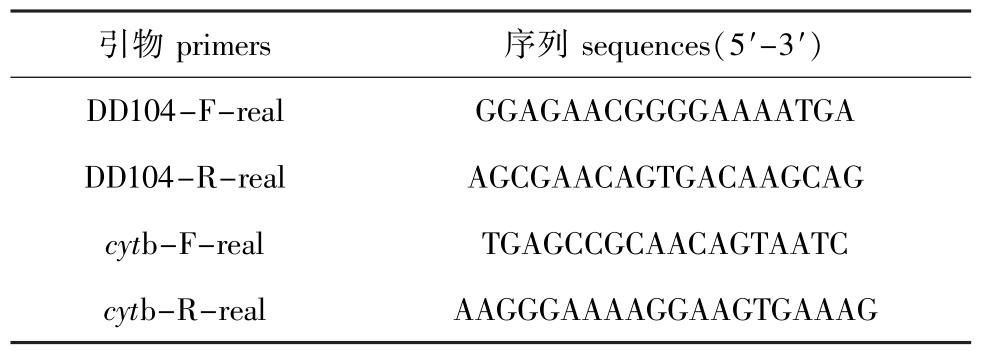
引物primers 序列sequences(5'-3') DD104-F-real GGAGAACGGGGAAAATGA DD104-R-real AGCGAACAGTGACAAGCAG cytb-F-real TGAGCCGCAACAGTAATC cyt b-R-real AAGGGAAAAGGAAGTGAAAG
摘要:以2龄仿刺参Apostichopus japonicus为试验材料,利用实时定量PCR技术分析了DD104基因在仿刺参不同组织中以及低盐胁迫后不同时间的表达情况。结果表明:DD104基因在仿刺参管足中的表达水平最高,在体腔液、触手、呼吸树中的表达水平次之,在体壁、肌肉和肠中的表达水平较低;仿刺参在受到低盐胁迫后,体内DD104 mRNA的表达随盐度胁迫时间的增加呈现波动性增减,胁迫72 h时DD104基因的表达最强,在肌肉和管足中的表达量达到最大;胁迫48 h时肠组织中的表达量最大;胁迫24 h时体腔液中的表达量最大。研究表明,低盐胁迫后DD104基因在仿刺参不同组织中的表达发生变化的时间点不同,低盐胁迫下DD104基因表达量的变化规律说明该基因的表达可能与渗透胁迫密切相关。
关键词:仿刺参;胁迫;DD104基因;实时定量PCR
仿刺参Apostichopus japonicus隶属于棘皮动物门 Echinodermata、海参纲 Holothuroidea、楯手目Aspidochirota、刺参科 Stichopodidae、仿刺参属Apostichopus。目前,国内针对盐度变化对刺参影响的研究主要集中在生长发育、生化指标、能量代谢、生存极限和适应能力等方面[1-5],研究认为,刺参在其最适温度 (15℃)条件下具有一定的渗透压调节能力。国外针对海参渗透调节的研究较为深入[6],研究认为,外环境变化引起海参体腔液渗透压改变,从而改变海参细胞的离子运输[7]及相关酶的活性[8]。海参的排脏是其对低盐度环境的适应,Fankboner[9]研究表明,海参的排脏大多发生在秋季多雨的季节,排脏可以增强海参对多雨导致的海水盐度降低的抵抗力,红海参主要通过排脏以减小体表面积和体质量来应对低盐度带来的渗透压调节的压力。Foglietta等[10]研究发现,海参呼吸树细胞遵守范托夫渗透法则,具有良好的渗透调节能力。哇巴因对Na+/K+离子泵的抑制作用使得细胞内钾离子减少,钠离子增多[11],在海水盐度改变时细胞仍能较好地进行渗透调节,不改变细胞容积。
目前,国内外对耐盐抗逆相关基因的研究相对较少,主要集中于对钠钾ATP酶基因的研究[12-13]。关于DD104基因的研究相对较少,有研究表明, DD104基因及蛋白与免疫防御密切相关,在LPS和细菌的刺激下均出现表达上调,并且在刺参个体不同发育时期均有表达[14-15]。
近年来,池塘养殖刺参在中国北方沿海迅速发展,成为许多地区的主导产业,但在夏天雨季和冬季冰冻灾害情况下,近海池塘和围堰养殖刺参容易受到降雨影响而导致盐度降低,造成刺参发病、死亡,给海参养殖业造成极大的经济损失。刺参疾病防御及对环境适应能力的研究工作已成为当务之急。本研究中,以仿刺参为试验材料,利用实时定量PCR技术对低盐胁迫下DD104基因在仿刺参不同组织中的表达情况进行研究,旨在从分子水平上研究刺参在逆境胁迫中的应答机制,为进一步研究该基因在盐度调节适应机制中的功能奠定基础。
1.1 材料
试验用2龄仿刺参取自大连海洋大学北方海水增养殖重点实验室。
主要试剂Trizol、M-MLV反转录酶、RNA酶抑制剂、Marker(DL2000)、dNTP、ExTaq DNA聚合酶、pMD19-T Vector、HindIII、BamHI购自宝生物工程 (大连)有限公司,PCR引物由宝生物公司合成。AXYGEN柱式凝胶回收试剂盒、AXYGEN小量质粒提取试剂盒均购自上海生工生物工程技术服务有限公司。
1.2 方法
1.2.1 总RNA的提取及反转录 分别取仿刺参不同组织,按Trizol法提取总RNA。采用紫外分光光度计与10 g/L琼脂糖凝胶电泳检测RNA的浓度及完整性,-80℃下保存备用。使用M-MLV反转录cDNA,反转录体系:总RNA 100 ng,oligo(dT)1 μL,5×M-MLV Buffer 2 μL,dNTP Mixture(各10 mmol/L)0.5 μL,40 U/μL RNase Inhibitor 0.25 μL,200 U/μL RTase M-MLV 0.25 μL,用RNasefree水定容至10 μL。反应条件:42℃下水浴30 min,95℃下变性5 min。
1.2.2 引物设计 应用Primer Premier 5.0软件,根据NCBI数据库中的DD104片段,设计兼并引物DD104-F和DD104-R。综合考虑荧光定量PCR引物设计原则,对仿刺参DD104基因设计荧光定量用引物,首先进行普通PCR检测,筛选出特异性好、条带单一、无引物二聚体的引物用于后续试验,再用荧光定量PCR检测引物的特异性[16]。试验用引物见表1。
表1 引物序列
Tab.1 The sequences of primers

引物primers 序列sequences(5'-3') DD104-F-real GGAGAACGGGGAAAATGA DD104-R-real AGCGAACAGTGACAAGCAG cytb-F-real TGAGCCGCAACAGTAATC cyt b-R-real AAGGGAAAAGGAAGTGAAAG
1.2.3 DD104基因的定量表达
1)不同组织中的表达。分别取健康仿刺参的体腔液、触手、管足、肠、呼吸树、肌肉和体壁组织,提取 RNA,经 DNase I处理后反转录制备cDNA模板,每次取样3个个体,每种组织均设置3个重复。
2)低盐胁迫后基因的表达规律。分别提取对照组和低盐胁迫组中的体腔液、管足、肠、肌肉4个组织的总RNA,合成cDNA第一链,每个时间点取3头仿刺参,每种组织设置3个重复。利用引物DD104-F和DD104-R对样品进行扩增,用cytb-F和cytb-R作内参引物。PCR反应条件为: 94℃下预变性5 min;94℃下变性30 s,60℃下退火30 s,72℃下延伸30 s,共进行28个循环;最后在72℃下延伸5 min,并于4℃下保存备用。对于任意一个样品,目标基因 (DD104基因)和内参基因 (cytb基因)扩增时加入等量模板,利用2-ΔΔCt分析其定量表达结果。
1.3 数据处理
采用 ABI Real-time分析软件进行分析。DD104基因表达相对浓度的计算公式为
其中:Ct为荧光信号达到设定的域值时经历的循环数;CtA为目的基因的Ct值;CtB为内参基因的Ct值;ExA为目的基因的扩增效率;ExB为内参基因的扩增效率。
表达量结果用SPSS统计软件进行显著性分析,显著性水平设为0.05。
2.1 定量引物的验证
DD104和cytb基因的熔解曲线分别在82.61℃和80.37℃时出现一个熔解峰值。在熔解温度之前均未有小峰值出现,可以推测其引物二聚体没有形成,引物的设计适合用于实时荧光定量PCR。
2.2 仿刺参DD104基因在不同组织中的表达
利用实时定量PCR方法分析了DD104基因在仿刺参不同组织中的表达 (图1)。从图1可见: DD104基因在管足中的表达水平最高,且显著高于其他各组织 (P<0.05),在体腔液、触手、呼吸树中的表达水平次之,在体壁、肌肉和肠中的表达水平均较低。
2.3 低盐胁迫后DD104基因在不同组织中的表达规律
采用Real-time PCR方法分析低盐胁迫后不同时间段DD104基因在肌肉组织中的表达情况 (图2)。从图2可见:低盐胁迫1.5~48 h时,肌肉组织中DD104基因的表达量显著高于0 h(空白组) (P<0.05);低盐胁迫72 h时,DD104基因的表达水平是空白组的829倍,且极显著高于其他时间点的表达水平 (P<0.01)。
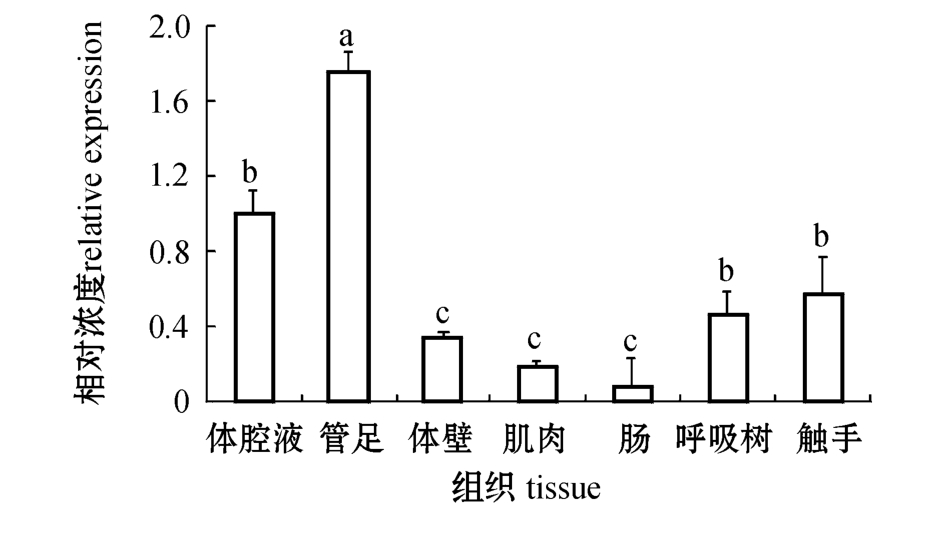
图1 DD104基因在仿刺参不同组织中的表达
Fig.1 Quantitative Real-time PCR analysis of DD104 gene expression in different tissues from the sea cucumber Apostichopus japonicus
注:标有不同大写字母者表示组间有极显著性差异 (P<0.01),标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05),下同。
Note:The means with different capital letters are very significantly different at the 0.01 probability level,with different letters being significantly different at the 0.05 probability level,and the means with the same letters are not significant differences,et sequentia.
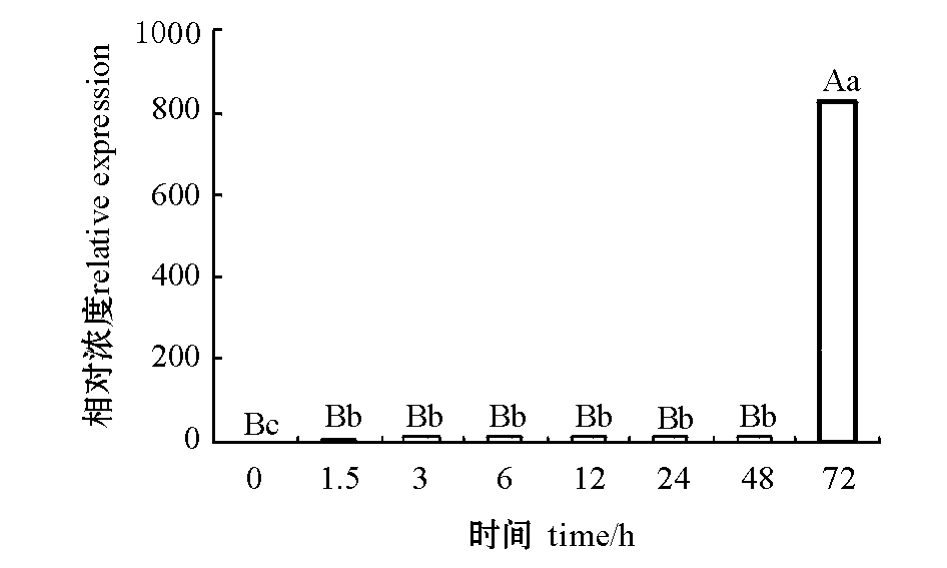
图2 低盐胁迫后不同时间段DD104基因在仿刺参肌肉组织中的表达差异
Fig.2 Quantitative Real-time PCR analysis of DD104 gene expression in muscle from different time under salt stress in the sea cucumber A.japonicus
从图3可见:在低盐胁迫72 h时,管足组织中DD104基因的表达水平是空白组的214倍,且极显著高于其他时间点的表达量 (P<0.01);低盐胁迫6 h、48 h时,DD104基因的表达量显著高于低盐胁迫 0、1.5、3、12、24 h的表达量 (P<0.05)。
从图4可见:低盐胁迫3 h和48 h时,体腔液中的DD104基因的表达量与空白组差异不明显(P>0.05);低盐胁迫1.5、6、12 h时,表达量显著低于空白组 (P<0.05),低盐胁迫24、72 h时,表达水平最高,且显著高于其他时间点的表达量(P<0.05)。
从图5可见:低盐胁迫后48 h时,肠组织中的DD104基因的表达量是空白组的25倍,且极显著高于其他时间点的表达量 (P<0.01),而其他时间点的基因表达量均无显著性差异 (P>0.05)。

图3 低盐胁迫后不同时间段DD104基因在仿刺参管足组织中的表达差异
Fig.3 Quantitative Real-time PCR analysis of DD104 gene expression in tube feet from different time under salt stress in the sea cucumber A.japonicus
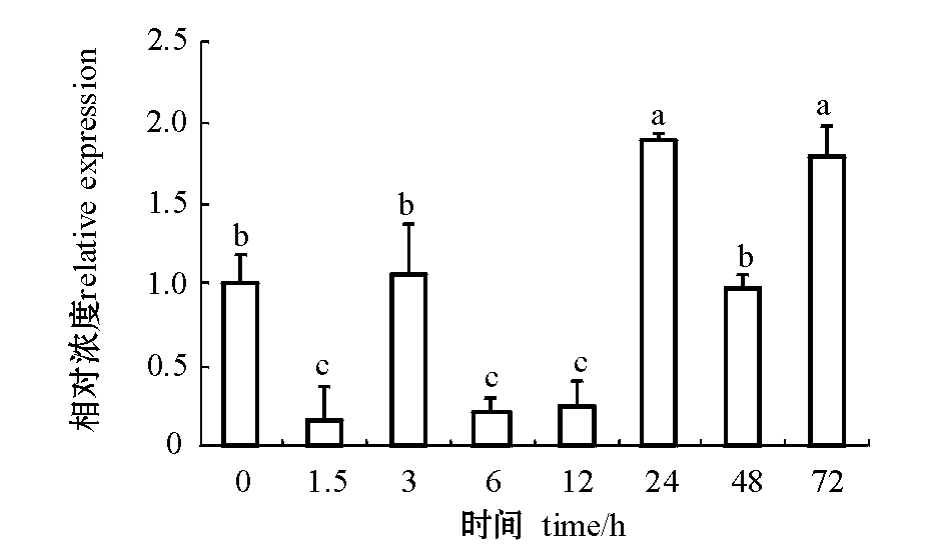
图4 低盐胁迫后不同时间段DD104基因在仿刺参体腔液中的表达差异
Fig.4 Quantitative Real-time PCR analysis of DD104 gene expression in coelomic fluid from different time under salt stress in the sea cucumber A.japonicus
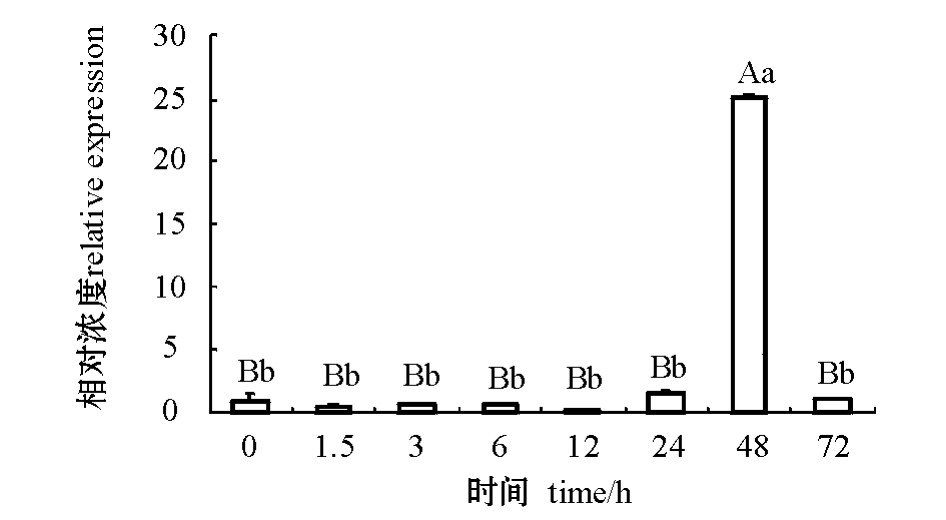
图5 低盐胁迫后不同时间段DD104基因在仿刺参肠组织中的表达差异
Fig.5 Quantitative Real-time PCR analysis of DD104 gene expression in intestine of the sea cucumber A.japonicus at different time under salt stress
盐度是影响水产动物机体生理反应的重要环境因子之一,不同盐度下水产动物表现出不同的适应状态。刺参属于狭盐性海洋生物,分布区域的盐度一般为28~34,对盐度的耐受范围狭小,海水盐度一旦超出刺参的耐受范围,就会大量死亡[17-22]。李庆彪等[17]研究表明,仿刺参在盐度低于10和高于40时,不能生存。盐度对仿刺参免疫功能、呼吸及排泄等影响国内外已有报道。以往有关盐度对刺参影响的研究主要集中在最适盐度的探讨,如不同淡化方式对刺参存活和生长的影响,盐度对能量收支及转换的影响,盐度对刺参的呼吸代谢、营养需求、渗透调节、免疫力和抗逆性等方面的影响[17,23-25]。
DD104是一种与免疫相关的基因,首先发现于海胆的体腔液细胞中[26]。有研究表明,DD104基因与生物机体的健康状况、免疫保护、环境应激等相关,可用来评判机体非特异性免疫的能力[27],是刺参防御系统的重要基因。在本试验中,通过实时定量PCR试验证实仿刺参在受到低盐胁迫后,体内DD104 mRNA随低盐胁迫时间的增加呈现出波动状态,低盐胁迫72 h时DD104基因表达最强,在肌肉和管足中的表达量达到最大;低盐48 h时肠组织中的DD104表达量最大;低盐24 h时体腔液中的DD104表达量最大。推测这是因为随着低盐胁迫时间的增加,仿刺参生命体渗透压发生改变,从而水体中的大量细菌进入仿刺参体内,造成免疫力下降,为了消除菌体的伤害,诱导DD104的表达发生变化,以提高自身免疫力。这与Rast等[26]报道的海胆体内DD104基因在细菌和创伤刺激下表达量发生变化的结果相符。DD104基因在低盐胁迫下表达发生变化,说明它的表达可能与渗透胁迫密切相关。在低盐胁迫下,仿刺参的DD104基因表达情况总体上显著高于正常状态下的表达水平,这说明仿刺参的非特异性免疫在受到刺激时基因表达上调,以应对外界刺激。龚海滨等[20]研究了仿刺参在较低盐度海水中的耐受能力,结果表明,在盐度为15的海水中,仿刺参出现了不适状态,在盐度胁迫72 h时达到最低点,随着时间的推移,仿刺参逐步适应了盐度为15的海水环境;在盐度为20的海水中,也出现了类似情况,仿刺参在盐度胁迫36 h内出现了不适状态,随着时间的推移,仿刺参逐步适应了盐度为20的海水环境。仿刺参在盐度为15和40环境中生长一段时间后,就会逐步适应其所生长的环境。仿刺参对较低和较高盐度海水的耐受能力随着时间的推移,呈现出一定规律性,其规律性表现为:不适应——最不适——逐步适应——适应[20],这与本研究结果相符。郑萍萍[28]在研究盐度胁迫对三疣梭子蟹血清非特异性免疫因子的影响中,得到的结果与本试验结果一致。
在低盐胁迫下,棘皮动物排氨率的升高被认为是在细胞内渗透压调节期间,游离氨基酸的分解作用导致了氨氮排泄量的净增加[29]。王吉桥等[3]研究了盐度骤降对不同发育阶段仿刺参存活和生长的影响,结果表明,由正常盐度33降到盐度20后,试验组存活率随时间的增加而升高。本试验中仿刺参不同组织中DD104基因的表达量分别在低盐胁迫后48 h、72 h时达到最高峰。王吉桥等[3]的养殖试验结果与本试验中对DD104基因表达量的研究结果相符合。
参考文献:
[1]吕伟志,戴晓军,李东站.低盐海水池塘养殖刺参试验[J].齐鲁渔业,2006,23:3-4.
[2]陈勇,高峰,刘国山,等.温度、盐度和光照周期对刺参生长及行为的影响[J].水产学报,2007,31:687-691.
[3]王吉桥,张筱墀,姜玉声,等.盐度骤降对不同发育阶段仿刺参存活和生长的影响[J].大连水产学院学报,2009,24(1):139-145.
[4]袁秀堂,杨红生,周毅,等.盐度对刺参(Apostichopus japonicus)呼吸和排泄的影响[J].海洋与湖沼,2006,37(4):348-354.
[5]孟雷明,王丽丽,雷艳,等.盐度对刺参碳、氮收支影响的初步研究[J].大连海洋大学学报,2013,28(1):34-48.
[6]Vidolin D,Ivonete A,Santos A.Osmotic stability of the coelomic fluids of a sea-cucumber(Holothuria grisea)and a starfish(Asterina stellifera)(Echinodermata)exposed to the air during low tide:a field study[J].Acta Biol Par Curitiba,2002,31(1/4): 113-121.
[7]Herrera F C,Herrera M I,Lopez I.Further studies on the partial double Donnan.Is isosmotic KCl solution isotonic with cells of respiratory trees of the holothurian Isostichopus badionotus Selenka? [J].Journal of Experimental Marine Biology and Ecology,2000, 247:139-152.
[8]谢忠明.海参海胆养殖技术[M].北京:金盾出版社,2004:56-57.
[9]Fankboner P.Seasonal visceral atrophy and response to salinity by Parastichopus californicus(Stimpson):Osmoregulation[J]. Beche-de-mer Information Bulletin,2002,17:22-26.
[10]Foglietta L M,Herrera F C.Ionosmotic response of respiratory trees of the holothurian Isostichopus badionotus Selenka preincubated in hyper-,iso-and hypo-osmotic seawater[J].Journal of Experimental Marine Biology and Ecology,1996,202(2):151-164.
[11]Haddad P,Beck J S,Boyer J L,et al.Role of chloride ions in liver cell volume regulation[J].Am J Physiol,1991,261(2):340-348.
[12]侯彦峰,张照斌,胡建英.皮质醇影响青鳉鳃内钠钾ATP酶基因表达的研究[J].生态毒理学报,2009,4(2):212-217.
[13]冯平,王峰,范光丽.盐度对青鳉鱼肠内Na+-K+-ATPase基因表达的影响[J].西北农业学报,2006,15(6):24-27.
[14]Yang Aifu,Zhou Zunchun,Dong Ying,et al.Expression of immune-related genes in embryos and larvae of sea cucumber Apostichopus japonicus[J].Fish&Shellfish Immunology,2010,29: 839-845.
[15]Ramírez-Gómez F,Ortíz-Pineda P A,Rojas-Cartagena C,et al. Immune-related genes associated with intestinal tissue in the sea cucumber Holothuria glaberrima[J].Immunogenetics,2008,60: 57-71.
[16]刘俊,赵金良,张敏,等.鳜胰岛素样生长因子-ⅡcDNA基因的克隆与表达特征[J].大连海洋大学学报,2012,26(6):495-501.
[17]李庆彪,邱兆星.无公害刺参标准化生产[M].北京:中国农业出版社,2003:88-89.
[18]隋锡林.刺参增养殖[M].北京:农业出版社,1985:13-14.
[19]赵斌,李成林,胡炜,等.低温对不同规格刺参幼参生长与耗氧率的影响[J].海洋科学,2011,35(12):88-91.
[20]龚海滨,王耀兵,邓欢,等.仿刺参对盐度的耐受能力研究[J].水产科学,2009,28(5):284-286.
[21]陈爱华.环境因子对刺参的影响及对策[J].河北渔业,2007 (3):19-22.
[22]张少华,张秀丽,刘振林,等.刺参对盐度的适应范围试验[J].齐鲁渔业,2004,21(12):9-10.
[23]Trotter J A,Salgado J P,Koob T J.Mineral content and salt dependent viscosity in the dermis of the sea cucumber Cucumaria frondosa[J].Com Biochem Physiol,1997,116(4):329-335.
[24]Asha P S,Muthiah P.Effects of temperature,salinity and pH on larval growth,survival and development of the sea cucumber Holothuria spinifern Thee[J].Aquaculture,2005,250:823-829.
[25]Dong Yunwei,Dong Shuanglin,Meng Xianliang.Effects of thermal and osmotic stress on growth,osmoregulation and Hsp70 in sea cucumber(Apostichopus japonicus Selenka)[J].Aquaculture,2008, 276:179-186.
[26]Rast J P,Amore G,Calestani C,et al.Recovery of developmentally defined gene sets from high-density cDNA macroarrays[J].Developmental Biology,2000,228:270-286.
[27]孔样会,王桂忠,艾春香,等.锯缘青蟹不同器官组织中总抗氧化能力和SOD活性的比较研究[J].台湾海峡,2003,22 (4):469-474.
[28]郑萍萍.盐度胁迫对三疣梭子蟹血清非特异性免疫因子的影响[J].水产科学,2010(11):634-638.
[29]Diehl W J.Osmoregulation in echinoderms[J].Comp Biochem Physiol,1986,84A:199-205.
Expression of DD104 gene in sea cucumber Apostichopus japonicus under salinity stress
Abstract:To understand the molecular level of the Stress Response Mechanism in sea cucumber Apostichopus japonicus(2 year old),the trial use sea cucumber as experimental material and use Real-time quantitative PCR technology to study DD104 gene in sea cucumber in different tissues and low salinity stimulation to analyze the expression of DD104 gene.The results of Real-time quantitative PCR show that DD104 have the highest expression in the tube feet under normal circumstances;Then it has higher expression in body cavity fluid,tentacles and respiratory tree.At last,it has a small amount of expression in intestine,body wall and the muscle.Under lower salinity stress,DD104 mRNA in sea cucumber was fluctuant.The highest gene expression in tube feet and muscle emerged at 72 hour.The maximum expression in intestine tissue appeared at 48 hour and at 24 hour emerge the maximum expression in body cavity fluid.The test results showed that in the process of sea cucumber in low salinity stress, DD104 gene in different tissues expression changed as time was different.The regular pattern of DD104 expression in low salinity stress was possible closely related with osmotic stress.
Key words:Apostichopus japonicus;stress;DD104 gene;qRT-PCR
中图分类号:S917.4
文献标志码:A
收稿日期:2012-10-18
基金项目:国家 “863”计划项目 (2012AA10A412);国家自然科学基金资助项目 (31072230,41106128)
文章编号:2095-1388(2013)03-0236-05