6个建鲤家系的遗传结构及不同亲缘关系个体间的遗传差异分析
李建林,唐永凯,李红霞,俞菊华,董在杰
(中国水产科学研究院淡水渔业研究中心农业部淡水渔业和种质资源利用重点实验室,江苏无锡214081)
摘要:选用12个微卫星位点对6个建鲤Cyprinus carpio var.jian家系的遗传结构和不同亲缘关系个体间的遗传差异进行分析。结果表明:12个位点在6个建鲤家系中共检测出80个等位基因和172种基因型,平均每个位点检测到等位基因6.7个和基因型14.3种;各家系平均观察杂合度(Ho)和期望杂合度(He)分别为0.725~0.883和0.533~0.656;平均多态信息含量(PIC)为0.440~0.584;固定系数(FIS)计算结果表明,6个建鲤家系都表现为杂合子过剩(FIS<0);6个建鲤家系遗传分化系数(Fst)值为0.209 4,家系间平均遗传距离为0.458 7;6个家系中的父子间、母子间和同胞子代间的平均遗传距离分别为0.333 1、0.347 7和0.318 0,没有血缘关系个体间的平均遗传距离为0.635 3,且极显著大于亲子之间和同胞子代之间的遗传距离(P<0.01)。本研究表明,6个建鲤家系的多态信息含量丰富,遗传多样性水平较高,具有较大的选育潜力。
关键词:微卫星标记;建鲤;家系;遗传结构;遗传差异
建鲤Cyprinus carpio var.jian是以荷包红鲤和元江鲤为亲本,通过家系选育、多系杂交、雌核发育和横交固定等育种技术相结合而培育成的鱼类新品种[1]。该品种具有生长快、肉质好、抗逆性强、易起捕等经济性状[2],虽然建鲤遗传性状比较稳定,但要保持或更进一步提高其经济性状,仍需要对建鲤不断地进行选育保种和遗传保护。
分子标记直接反映的是亲本间基因组水平上的遗传差异,能够在一定程度上预测后代优势的产生。目前对鲤功能基因组学及其遗传连锁图谱的研究较为深入[3],分子标记辅助选育技术也已逐步应用于鲤育种中。微卫星标记具有多态性频率高、共显性的孟德尔式遗传等优点,是实现家系间和个体间的遗传差异、亲缘关系分析等较为理想的分子标记[4], 如在大菱鲆[5]、 真鲷[6]、 大西洋比目鱼[7]、 牙鲆[8]、 虹鳟[9]、 马氏珠母贝[10]等水产生物中都有相关报道。为进一步提高建鲤的生长速度和遗传稳定性,2011年本课题组运用与建鲤生长相关的SNP标记[11]构建了30个家系进行了育种试验,本研究中,作者采用微卫星标记技术分析了其中6个家系的遗传结构及不同亲缘关系个体间的遗传差异,旨在为应用微卫星标记辅助构建建鲤家系和保种选育提供参考。
1 材料与方法
1.1 材料
试验鱼取自于中国水产科学研究院淡水渔业研究中心宜兴养殖基地,从30个建鲤家系中随机取6个家系,编号为3#、5#、7#、8#、9#、10#。剪取各家系亲本以及各家系子代共30尾个体的鳍条,用体积分数为95%的酒精保存备用。
1.2 方法
1.2.1 基因组DNA的提取 样本鳍条经蛋白酶K消化后,用保和酚、氯仿抽提总DNA[12],用琼脂糖凝胶电泳测定DNA基因组的完整性,再用紫外分光光度计测定DNA样品的浓度和纯度,稀释DNA至50~100 ng/μL,于4℃下保存备用。从每个家系中随机取12尾子代及其亲本的DNA样品用于试验分析。
1.2.2 引物合成及PCR反应 微卫星引物为中国水产科学研究院黑龙江水产研究所开发的镜鲤微卫星标记引物[13-14],由上海博尚生物技术有限公司合成。表1列出了经筛选得到的12对在建鲤中能扩增出清晰条带的引物序列和退火温度。PCR反应总体积为10 μL,其中含10×buffer 1.0 μL,2 mmol/L MgCl21.0 μL,2.5 mmol/L dNTP 0.8 μL, 10 μmol/L引物0.1 μL,5 U/μL Taq酶0.1 μL, 50~100 ng/μL DNA 1.0 μL。PCR反应条件为:94℃下预变性3 min;94℃下变性20 s,退火20 s, 72℃下延伸20 s,共进行30个循环;最后在72℃下延伸8 min,于4℃下保存备用。
1.2.3 电泳及染色 PCR产物用8.0%的非变性聚丙烯酰胺凝胶电泳分离。电泳结束后,用硝酸银染色后拍照记录电泳结果。根据25 bp DNA Step Ladder(Promega)分子量标记和PCR扩增片段大小,分析各位点的等位基因,并确定基因型。
表1 12对微卫星引物序列及其反应条件
Tab.1 The sequences and PCR reaction conditions of 12 primer pairs

位点locus引物序列(5′-3′) primer sequence(5′-3′)退火温度/℃annealing temperature HLJ328 F:cctgacacctgccgttct R:tcctctgttctgcctccc 51 HLJ368 F:caggaggacgtaagggag R:agggctgaggagtgatgaa 59 HLJ382 F:cccctctgcccaatgaca R:cggtgagcgagaaacgaa 60 HLJ458 F:gaaaggagttcccacaag R:agctgaggacctagacgt 58 HLJ930 F:agatttcgtctaccaagga R:cttccacctgagacaacac 60 HLJ1211 F:tcctgcatctgagtgacagc R:cagacattagccgggtagga 57 HLJ1285 F:gtgacgacagcgttagcatt R:aacaagcgcaggctaatcat 60 HLJ1301 F:acacacctgcgctcactaaa R:ttgtgtttcaggctacaaaagg 60 HLJ1316 F:aaacacagccagacatgcag R:tgcttcaaatcaatccacaaa 60 HLJ1410 F:ctgagctgacctcgtgtctg R:ttttctgcggaaacattgtg 58 HLJ1438 F:ctgcccaacatcaacaagtg R:catgcaaactgcaaggacat 58 HLJ1458 F:tgcattattgtgtccctcca R:cacagcatgagcagaggaag 60
1.3 数据处理
根据每个个体的PCR扩增条带建立基因型数据矩阵,用Cervus 3.0和GenAlEx 6.2软件分析每一位点的等位基因数(Na)、观测杂合度(Ho)、期望杂合度(He)、多态信息含量(PIC)和遗传分化系数(Fst)等参数;用Populations软件计算群体和个体间的DA遗传距离[15];使用SPSS统计软件对不同亲缘关系个体间的遗传距离进行单因素方差分析;根据遗传距离用Mgea 5.1软件按非加权配对算术平均法(UPGMA)对不同家系建立聚类图。
2 结果与分析
2.1 12个微卫星位点的扩增结果及多态性
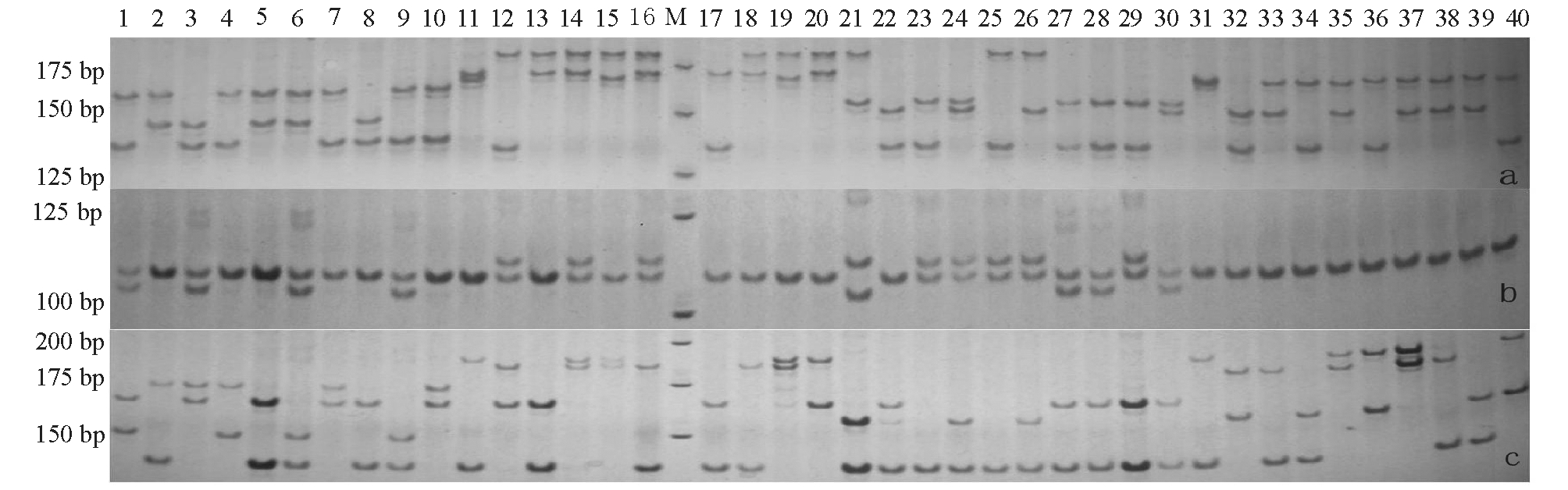
本试验中所选出的12对微卫星引物在建鲤群体中均能扩增出清晰的条带,并且重复性好,PCR产物通过8.0%非变性聚丙烯酰胺凝胶电泳可以清楚地分辨基因型,图 1为位点 HLJ1316(a)、HLJ1410(b)和HLJ1458(c)的部分电泳结果。经统计分析,各位点在6个建鲤家系中共检测出80个等位基因,每个位点检测到的等位基因为3~10个,平均为6.7个;共检测出基因型172种,每个位点检测到的基因型为5~24种,平均为14.3种。12个位点中HLJ1458的多态性最高,检测到10个等位基因和24种基因型。
2.2 6个家系的遗传多样性及遗传分化
2.2.1 遗传多样性 12个微卫星位点中,只有位点HLJ1211在5#家系以及位点HLJ1410在10#家系表现为单态性,其他均为多态性。从表2可见:12个微卫星位点分别在6个建鲤家系中平均检测到等位基因2.9~3.3个;平均Ho和He分别为0.725~0.883和 0.533~0.656;平均 PIC为 0.440~0.584;3#家系各遗传多样性参数均为最高;6个建鲤家系平均固定系数(FIS)为-0.422~-0.318,都表现为杂合子过剩(FIS<0)。
表2 12个微卫星位点在6个建鲤家系中的平均遗传信息
Tab.2 Average genetic information of the 12 microsatellite loci in 6 common carp Cyprinus carpio var.jian families
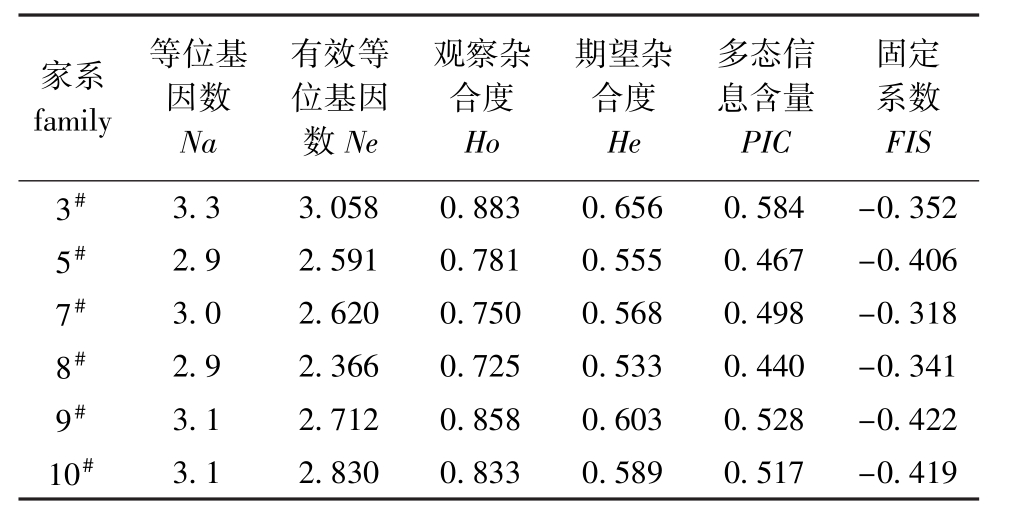
家系family等位基因数Na有效等位基因数Ne观察杂合度Ho期望杂合度He多态信息含量PIC固定系数FIS 3#3.3 3.058 0.883 0.656 0.584 -0.352 5#2.9 2.591 0.781 0.555 0.467 -0.406 7#3.0 2.620 0.750 0.568 0.498 -0.318 8#2.9 2.366 0.725 0.533 0.440 -0.341 9#3.1 2.712 0.858 0.603 0.528 -0.422 10#3.1 2.830 0.833 0.589 0.517 -0.419
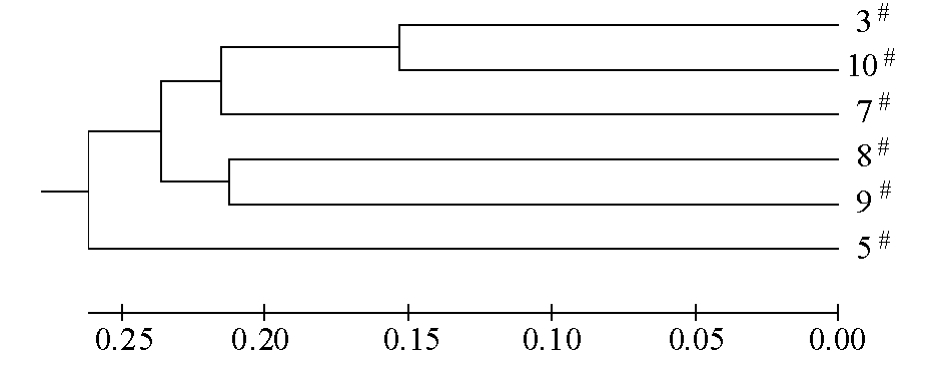
2.2.2 家系间的遗传分化 从表3可见:各家系间的遗传距离为 0.312 9~0.578 9,平均为0.458 7,3#家系与10#家系间的遗传距离最小,5#家系与8#家系间的遗传距离最大。UPGMA聚类分析结果表明(图2),3#家系与10#家系以及8#与9#家系亲缘关系比较近,聚类在同一小分支上,其他家系亲缘关系相对较远。AMOVA分析结果表明, 6个家系的Fst为0.115~0.390,平均为0.209 4,说明有21%的遗传变异来源于家系间,79%来源于家系内。6个建鲤家系中,12个位点的基因流(Nm)为0.368~1.404,平均为0.962 3,其中5个位点的Nm大于1,7个位点的Nm小于1。
表3 6个建鲤家系间的遗传距离
Tab.3 Genetic distance of 6 common carp C.carpio var.jian families
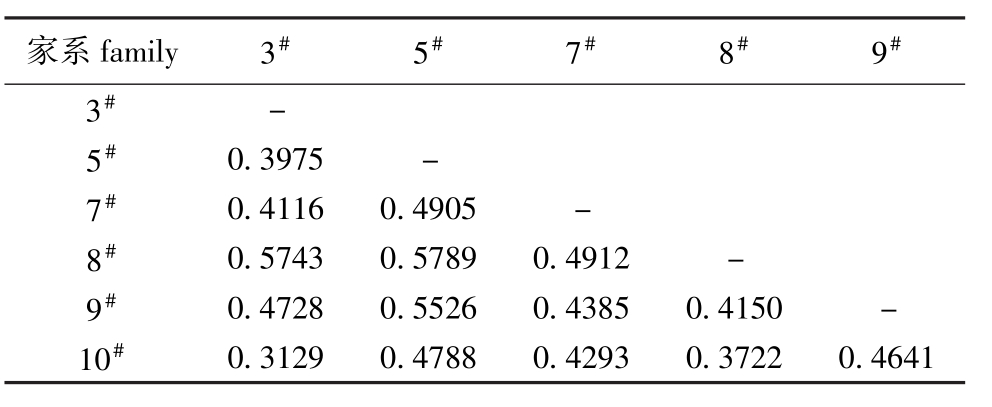
家系family 3#5#7#8#9#3#-5#0.3975 -7#0.4116 0.4905 -8#0.5743 0.5789 0.4912 -9#0.4728 0.5526 0.4385 0.4150 -10#0.3129 0.4788 0.4293 0.3722 0.4641
2.3 不同亲缘关系个体间的遗传差异
经Populations软件计算得到84×84所有个体间的遗传距离矩阵,在不分家系的情况下,个体间的遗传距离为0.108~0.875,平均为0.587 2;按不同亲缘关系进行分析结果表明:父本与子代的遗传距离为0.257 0~0.448 2,平均为0.333 1;母本与子代的遗传距离为0.240~0.507,平均为0.347 7;同胞子代间的遗传距离为0.108~0.591,平均为0.318 0;不同家系没有血缘关系个体间的遗传距离为0.358~0.875,平均为0.635 3。父子间、母子间和同胞子代间的遗传距离相近,但无显著性差异(P>0.05),不同家系没有血缘关系个体间的遗传距离要大于亲子间和同胞子代间的遗传距离,且差异极显著(P<0.01)。表4列出了各家系不同亲缘关系个体间的平均遗传距离。
表4 不同亲缘关系个体间的平均遗传距离
Tab.4 Average genetic distance between the individuals with different genetic relationship
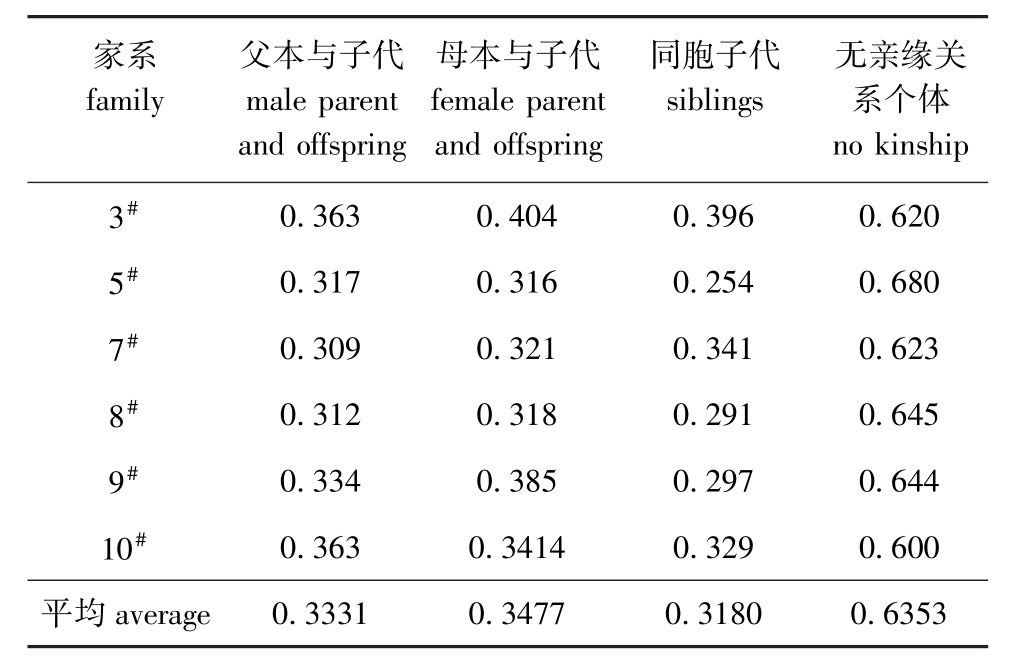
家系family父本与子代male parent and offspring母本与子代female parent and offspring同胞子代siblings无亲缘关系个体no kinship 3#0.363 0.404 0.396 0.620 5#0.317 0.316 0.254 0.680 7#0.309 0.321 0.341 0.623 8#0.312 0.318 0.291 0.645 9#0.334 0.385 0.297 0.644 10#0.363 0.3414 0.329 0.600平均average 0.3331 0.3477 0.3180 0.6353
3 讨论
3.1 6个建鲤家系的遗传多样性
通过对不同家系的遗传多样性分析,可了解各家系的遗传潜力和选育空间。本试验中所筛选到的12个微卫星标记在6个建鲤家系中平均检测到6.7个等位基因和14.3种基因型,具有较高的多态性,能很好地用于建鲤群体的遗传多样性评估。杂合度和多态信息含量都是度量种群遗传多样性程度的重要参数,其含量越大群体遗传结构变异越大,对环境适应能力就越强[16]。Dewoody等[17]利用微卫星标记分析得出13种淡水鱼类的平均Ho为0.46。本试验中建鲤各家系的平均Ho为0.725~0.883,说明这6个建鲤家系的遗传变异水平较高,有较强的适应力;12个位点在各家系中的平均 PIC为0.440~0.584,根据Botstein等[18]提出的衡量基因变异程度高低的多态信息含量指标,12个位点在5#、7#、8#家系中表现为高度多态(PIC>0.50),在3#、9#和10#家系中表现为中度多态(0.25<PIC<0.50),但接近于高度多态。群体内FIS反映了观察杂合度和期望杂合度之间的平衡关系,FIS值越接近零,基因型的分布就越接近平衡状态。当FIS>0时,表明杂合子缺失;当FIS<0时,表明杂合子过剩[19]。本试验中6个建鲤家系FIS都小于零,表明这6个建鲤群体存在杂合子过剩现象。综合各遗传参数,6个建鲤家系遗传多样性较为丰富,具有较大的遗传潜力和选育空间。
3.2 6个建鲤家系间的遗传差异和分化
聚类分析结果可以明显地表现群体间亲缘关系的远近[20],本试验中聚类结果表明,3#家系与10#家系间以及8#家系与9#家系间遗传距离较小,亲缘关系比较近;5#家系与8#家系间遗传距离较大,亲缘关系相对比较远。本试验中得到的不同家系遗传距离和聚类关系树可为今后建鲤家系的选留、构建新家系等提供参考。Fst是衡量群体间遗传分化的重要指标,当0<Fst<0.05时,表明群体遗传分化较弱;当0.05<Fst<0.15时,为中度分化;当0.15<Fst<0.25时,为分化较大;当Fst>0.25时,表明群体遗传分化很大[18]。本试验中AMOVA结果表明,12个位点的Fst值平均为0.209 4,即有21%的遗传变异来源于家系间,79%来源于家系内的个体间,说明家系间有较大的遗传分化。Nm则是抵抗群体分化、维持群体遗传均质化的力量,如果群体间Nm>1,基因流则能发挥均质化作用,能有效防止不同群体间产生遗传分化;反之,如果群体间Nm<1,则表明各群体间基因流受阻,群体可能走向遗传分化[21]。本试验中平均Nm为0.962 3,说明6个建鲤家系基因交流程度偏低,可能会导致家系遗传分化,可扩大建鲤的选育空间。
3.3 6个建鲤家系个体间的遗传差异
本试验中检测了所有个体间的遗传距离,并按父子间、母子间、同胞间和不同家系没有血缘关系个体间4种遗传关系进行了分析,提供了这几种不同亲缘关系建鲤个体间的遗传距离范围。试验结果表明,父本、母本与子代间的平均遗传距离分别为0.333 1和0.347 7,同胞子代间的平均遗传距离为0.318 0,三者没有显著差异,说明亲子之间的遗传距离与同胞子代之间遗传距离范围相近。不同家系没有血缘关系个体间的平均遗传距离为0.635 3,要显著大于亲子之间和同胞子代之间的遗传距离,说明没有血缘关系个体间的遗传距离与亲子间、同胞子代间的遗传距离有一定的范围差距。由此,当检测不明遗传背景的建鲤个体时,通过计算遗传距离,再根据不同亲缘关系个体间的遗传距离范围,可以大致推断出它们的亲缘关系远近。家系选择是重要的传统选育手段,家系选育的成功很大程度上取决于家系的构建,即亲本的选择配组。Melchinger等[22]认为,遗传距离与杂种优势呈显著正相关,亲本的遗传距离越远,则交配产生杂种优势就越明显,通过检测所有个体间的遗传距离,可在今后构建建鲤家系时指导亲本的选择和配组,这对加强建鲤的种质遗传改良和培育新品系具有重要意义。
参考文献:
[1]张建森,孙小异.建鲤新品系的选育[J].水产学报,2007,31(3):287-292.
[2]孙小异.建鲤——我国养殖鱼类杂交选育的第一个品种[J].科学养鱼,1988(4):16-17.
[3]赵紫霞,邓海霞,徐鹏,等.鲤45S rDNA的染色体荧光原位杂交定位[J].大连海洋大学学报,2012,27(5):457-463.
[4]O'Connell M,Wright J M.Microsatellite DNA in fishes[J].Reviews in Fish Biology and Fisheries,1997,7:331-363.
[5]于飞,王伟继,孔杰,等.微卫星标记在大菱鲆(Scophthalmus maximus L.)家系系谱印证中的应用研究[J].海洋学报, 2009,31(3):127-136.
[6]Perezenriquez R,Takagi M,Taniguchi N.Genetic variability and pedigree tracing of a hat chery reared stock of red sea bream(Pagrus major)used for stock enhancement,based of microsatel-lite DNA markers[J].Aquaculture,1999,173:413-423.
[7]Jackson T R,Martin-Robichaud D J,Reithm E.Application of DNA markers to the management of Atlantic halibut(Hippoglossus hippoglossus)broodstock[J].Aquaculture,2003,220:245-259.
[8]Sekino M,Sugaya T,Hara M,et al.Relatedness inferred from microsatellite genotypes as a tool for broodstock management of Japanese flounder Paralichthys olivaceus[J].Aquaculture,2004,233: 163-172.
[9]Mcdonai D G J,Danzmann R G,Ferguson M M.Relatedness determination in the absence of pedigree information in three cultured strains of rainbow trout(Oncorhynchus mykiss)[J].Aquaculture, 2004,233:65-78.
[10]杜晓东,高远镇,邓岳文,等.利用微卫星标记进行马氏珠母贝家系遗传结构分析与系谱认证[J].水产学报,2011,35(12):1795-1804.
[11]俞菊华,李红霞,唐永凯,等.建鲤生长抑制素基因MSTN的分离、表达及多态性与体型、平均日增重相关性研究[J].农业生物技术学报,2010,18(6):34-48.
[12]萨姆布鲁克J,拉塞尔D W.分子克隆试验指南[M].3版.黄培堂,王嘉玺,朱厚础,等译.北京:科学出版社,2002:463-471.
[13]孙效文,鲁翠云,匡友谊,等.镜鲤两个繁殖群体的遗传结构和几种性状的基因型分析[J].水产学报,2007,31(3):273-279.
[14]鲁翠云,曹顶臣,孙效文,等.微卫星分子标记辅助镜鲤家系构建[J].中国水产科学,2008,15(6):893-901.
[15]Nei M,Tajima F,Tateno Y.Accuracy of estimated phylogenetic trees from molecular data[J].Journal of Molecular Evolution, 1983,19:153-170.
[16]Nei M.Estimation of average heterozygosity and genetic distance from a small number of individuals[J].Genetics,1978,89:583-590.
[17]Dewoody J A,Avise J C.Microsatellite variation in marine,freshwater and anadromous fishes compared with other animals[J].J Fish Biol,2000,56:461-473.
[18]Botstein D,White R L,Skolnick M,et al.Construction of a genetic linkage map in man using restriction fragment length polymorphism[J].American Journal of Human Genetics,1980,32:314-331.
[19]Weir B S,Cockerham C C.Estimation F-statistics for the analysis of population structure[J].Evolution,1984,38:1358-1370.
[20]赵文,毕进红,韩婷婷,等.西藏拟溞遗传多样性的初步研究[J].大连海洋大学学报,2011,26(2):108-113.
[21]Wright S.Evolution and the genetics of population variability within and among Natural Population Chicago[M].Chicago:University of Chicago Press,1987.
[22]Melchinger A E,Lee M,Lamkey K R,et al.Genetic diversity for restriction fragment length polymorphisms and heterosis for two tiller sets of maize inbreds[J].Theoretical and Applied Genetics, 1990,80:488-496.
The genetic structure and genetic diversity in individuals with different genetic relationship in six families of common carp Cyprinus carpio var.jian
LI Jian-lin,TANG Yong-kai,LI Hong-xia,YU Ju-hua,DONG Zai-jie
(Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization,Ministry of Agriculture,Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences,Wuxi 214081,China)
Abstract:The genetic structure and the genetic distance in the individuals with different genetic relationship in six families of common carp Cyprinus carpio var.jian were evaluated by 12 microsatellite loci.A total of 80 alleles and 172 genotypes were detected in the six families and the alleles had the average number of 6.7 and genotype number of 14.3 at each locus.The average observed(Ho)and expected heterozygosity(He)in the six populations were varied from 0.725 to 0.883 and from 0.533 to 0.656,respectively,and the average polymorphic information content(PIC)from 0.440 to 0.584.The fixation index(FIS)indicated that heterozygote excess existed in all of the six families(FIS<0).In the six families,the average genetic distance between the families was 0.458 7,and the genetic distance differentiation coefficient(Fst)was 0.209 4.There was average genetic distance of 0.333 1 between male parent and offspring,0.347 7 between female parent and offspring and 0.318 0 between siblings,and the average genetic distance between the individuals which did not have consanguinity was 0.635 3,significantly higher than that between the parent-offspring and the siblings(P<0.01).The findings showed that there were rich polymorphism information content and large genetic diversity in the six families,indicating that the six populations have a large selection potential.
Key words:microsatellite marker;Cyprinus carpio var.jian;family;genetic structure;genetic diversity
中图分类号:S917
文献标志码:A
收稿日期:2012-06-04
基金项目:国家 “863”计划项目(2011AA100401);公益性行业(农业)科研专项(200903045);现代农业产业技术体系建设专项(nycytx-49);国家科技基础条件平台水产种质资源平台
作者简介:李建林(1974-),男,副研究员。E-mail:lijl@ffrc.cn
通信作者:俞菊华(1966-),女,研究员。E-mail:yujh@ffrc.cn
文章编号:2095-1388(2013)02-0166-05