复方中草药对大菱鲆非特异性免疫力的影响
李华,张太娥,李强
(大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
摘要:将牛膝、板蓝根、甘草、陈皮、肉桂、麦芽、神曲7味中草药,粉碎后经80目筛网过滤,按一定比例混匀,以2%、4%和6%的质量分数添加于基础饲料中连续投喂体质量为(29.00±1.82)g的大菱鲆Scophthalmus maximus,对照组投喂不添加中草药的基础饲料,试验共进行28 d,试验结束后测定大菱鲆的非特异性免疫指标及抗病力。结果表明:在整个试验周期内,4%浓度组大菱鲆血清溶菌酶活力和抗菌活力均比对照组有显著升高(P<0.05);试验前2周4%和6%浓度组鱼血清抗蛋白酶活力较高,后2周2%浓度组鱼血清抗蛋白酶活力逐渐升高,并显著高于其他组(P<0.05);试验前3周4%浓度组鱼血清补体C3含量与对照组相比显著升高(P<0.05);在整个试验周期内,2%、4%、6%浓度组鱼血清NBT阳性细胞数与对照组相比均显著升高(P<0.05),且4%和6%浓度组升高更为明显;在整个试验周期内,4%和6%浓度组头肾白细胞吞噬活性均呈现先降低后升高的趋势,均在第4周达到峰值,且显著高于对照组和2%浓度组(P<0.05);攻毒试验表明,各组的存活率从大到小依次为4%浓度组>2%浓度组>6%浓度组>对照组。本研究表明,该复方中草药可以显著提高大菱鲆的非特异性免疫力和抗病力,2%浓度组在一定水平上有促进作用,4%浓度组效果更为显著。
关键词:大菱鲆;复方中草药;非特异性免疫力;抗病力
大菱鲆Scophthalmus maximus是中国北方地区的主要海水养殖品种之一,随着养殖业不断向集约化、规模化发展,给鱼类疾病防治提出了新的课题。在养殖生产中由于抗生素等药物长期使用或用药不当,不仅使微生物产生抗药性,耐药菌株不断增加,水产动物免疫功能下降,同时也造成了巨大的经济损失,如 “多宝鱼药残事件”使整个大菱鲆产业受到了沉重打击。因此,如何提高健康养殖水平,为人们提供优质绿色的海产品,成为当前的首要任务。
应用中草药作为免疫增强剂不但可以解决化学药物、抗生素等引发的抗(耐)药性和养殖鱼类药残超标等问题,而且符合发展无公害渔业、生产绿色水产品的需求[1-2]。国内外很多学者研究证明,中草药免疫增强剂可明显增强水产动物的抗病能力,国外学者Rao等[3]、Christybapita等[4]以单方中草药牛膝和旱莲草分别投喂露斯塔野鲮和罗非鱼,结果表明能显著提高机体的免疫力。国内学者用复方中草药投喂罗非鱼[5]、牙鲆[6]、草鱼[7]等,均能有效地提高机体的非特异性免疫力。大菱鲆是近年来推广的养殖品种,有关中草药对它的作用效果及作用水平等尚未见报道。本研究中作者通过在饲料中添加不同质量分数的中草药投喂大菱鲆,测定其非特异性免疫指标以及机体的抗病力,研究其对大菱鲆的免疫效果,进而为在大菱鲆养殖中推广应用中草药免疫增强剂提供科学依据。
1 材料与方法
1.1 材料
试验用大菱鲆购自大连双龙海产品有限公司,规格整齐,体质健壮,体质量为(29.00±1.82)g,体长为10~14 cm,共100尾。试验鱼饲养于农业部北方海水增养殖重点实验室,水族箱体积为120 L,暂养10 d后用于试验。暂养期间水温为16~19℃,盐度为31~33,pH为7.8~8.3,24 h不间断充气,日换水1次,换水量为1/3。每日8:00和17:00投喂饲料,投饲率为鱼体质量的3%~4%。
复方中草药为牛膝、板蓝根、甘草、陈皮、肉桂、麦芽、神曲7味中草药,粉碎后经80目筛网过滤,按一定比例混匀,分别以2%、4%、6%的质量分数添加于大菱鲆基础饲料(山东升索渔用饲料研究中心)中制粒,粒径为2.0~2.5 mm,长度约4 mm,阴干后于低温下保存备用。对照组饲料为不添加中草药的基础饲料。
1.2 方法
1.2.1 试验分组 采用单因子浓度梯度设计方法,将试验鱼随机分为4个试验组,分别投喂基础饲料和添加2%、4%、6%质量分数的中草药饲料,并分别记为对照组和2%、4%、6%浓度组。各组均设3个平行,每个平行放8尾鱼,连续投喂28 d。试验期间环境条件和饲养管理等同暂养期。
1.2.2 样品的制备 于试验开始前和开始后第7、14、21、28天采样,每次从每组采集3尾鱼,用电子秤测量体质量(精确至0.1 g)。用酒精棉将鱼体消毒后,从尾静脉采血,分离血清,并于-80℃下保存备用。解剖鱼腹腔,取头肾,置于180目金属网,用无菌药匙将单细胞挤于盛有RPIM-1640的无菌小烧杯中。收集细胞悬液,以600 r/min离心10 min,洗涤3次,收集细胞并用RPIM-1640调整细胞浓度至1.0×107个/mL,即为头肾吞噬细胞液。
1.2.3 指标的测定
1)溶菌酶活力。参考王雷等[8]的方法进行。用0.1 mol/L的磷酸钾缓冲液(pH 6.4)配制溶壁微球菌悬液(OD570nm=0.3)。取3 mL于试管内并置于冰浴中,加入50 μL待测血清,读取570 nm处的吸光度A0。将试液移入37℃下温育30 min,取出后立即置于冰浴内10 min中止反应,读取570 nm处的吸光度A。溶菌酶活力计算公式为
U=(A0-A)/A。
2)抗菌活力。采用改进的Hultmark等[9]的方法。将大菱鲆血清(10 μL/孔)加至96孔酶标板中,再加入90 μL 0.1 mol/L磷酸钾缓冲液(pH 6.4),读取490 nm处的吸光度 A1n;再加入100 μL磷酸钾缓冲液,读取490 nm处的吸光度A2n。计算系统误差K=∑(A2n/A1n)/N,式中n为样本编号,N为样本总数。将待测血清液移入酶标板相应的孔中(10 μL/孔),加入90 μL 0.1 mol/L磷酸钾缓冲液(pH 6.4),读取630 nm处的吸光度AK;取出96孔板,往相应列的孔内分别加入100 μL大肠杆菌悬液,摇匀后读取630 nm处的吸光度A0;于37℃下温育30 min,读取490 nm处的吸光度A。抗菌活力(Ua)按下列公式计算:
Ua=(A0-A)/(A-AK×K)1/2,
若A0≤A时,Ua均以0作为结果。
3)抗蛋白酶活力。参考王宏田等[10]的方法进行。抗蛋白酶活力通过抑制蛋白酶水解酪蛋白的能力来表示,采用酶标仪读取630 nm处的OD值,以样品每分钟使胰蛋白酶活力降低的数值,表示蛋白酶活性物质的活力。
4)补体C3的含量。采用补体C3检测试剂盒(浙江伊利康生物技术有限公司),按说明书操作。
5)NBT阳性细胞数。参照简纪常等[11]的方法进行。取50 μL血细胞滴于盖玻片上,在室温下用湿盒孵育40 min,在0.067 mol/L磷酸盐缓冲液(pH 6.4)中轻轻洗涤盖玻片以完全去除红细胞,再在盖玻片上滴加50 μL 2 mg/L NBT溶液,湿盒下温育40 min。在显微镜下观察,被染成黑色或棕色的细胞即为NBT阳性细胞。每尾鱼观察10个视野,再计算一组鱼中平均1个视野内的NBT阳性细胞数。
6)头肾白细胞吞噬活性。参照李海平等[12]的方法,稍加改进。制备酵母菌悬液,用1%美蓝染色,洗涤,制成1.2×107个/mL菌悬液于冰箱中保存备用。取分离的头肾白细胞液100 μL注入离心管中,滴加100 μL染色酵母菌液,于37℃下孵育45 min。用滴管吸取上述混合液滴片,加盖玻片后直接用高倍镜观察,计数100个吞噬细胞中参与吞噬的白细胞数,即为细胞吞噬百分比。
7)抗病力。投喂结束后,用迟钝爱德华氏菌Edwardsiella tarda进行攻毒感染试验。从每组取9尾鱼,采用腹腔注射方式,每尾注射250 μL浓度为2.6×108个/mL的菌液,连续观察7 d,记录各组鱼的死亡数。
1.3 数据处理
应用SPSS 16.0统计软件对数据进行单因素方差分析,用Duncan法进行多重比较。
2 结果与分析
2.1 溶菌酶活力
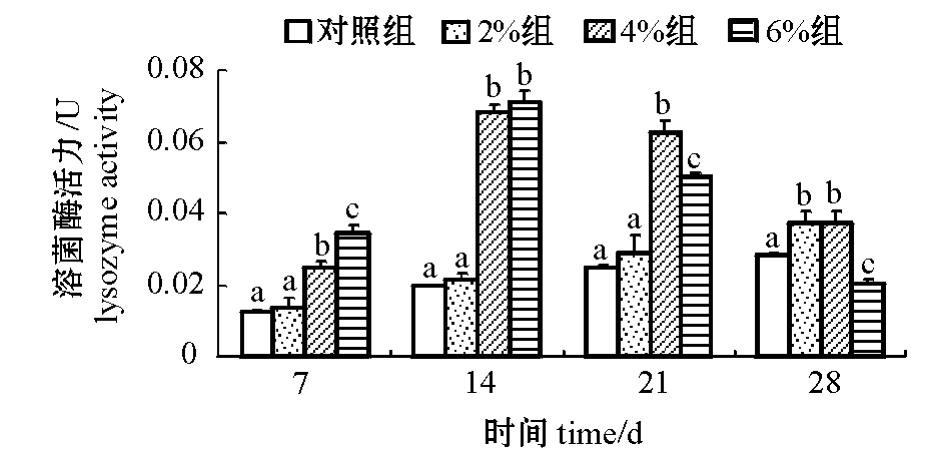
从图1可见:2%浓度组大菱鲆血清溶菌酶活力随试验时间的延长逐渐升高,但始终维持在较低水平;4%和6%浓度组随试验时间的延长均呈先升高后降低的趋势,第14天时达到最高值。多重比较结果表明,除第28天外,4%和6%浓度组鱼血清溶菌酶活力在各采样时间均显著高于对照组和2%浓度组(P<0.05),且4%浓度组酶活力维持时间更长。
2.2 抗菌活力
从图2可见:第7天时,4%和6%浓度组鱼血清抗菌活力显著高于对照组和2%浓度组(P<0.05);第14天时,6%浓度组鱼血清抗菌活力迅速升高,显著高于其他组(P<0.05);之后随试验时间的延长,4%浓度组鱼血清抗菌活力逐渐升高,接近6%浓度组水平,且显著高于对照组和2%浓度组(P<0.05);第28天时,6%浓度组鱼血清抗菌活力迅速降低,显著低于4%浓度组(P<0.05)。
2.3 抗蛋白酶活力
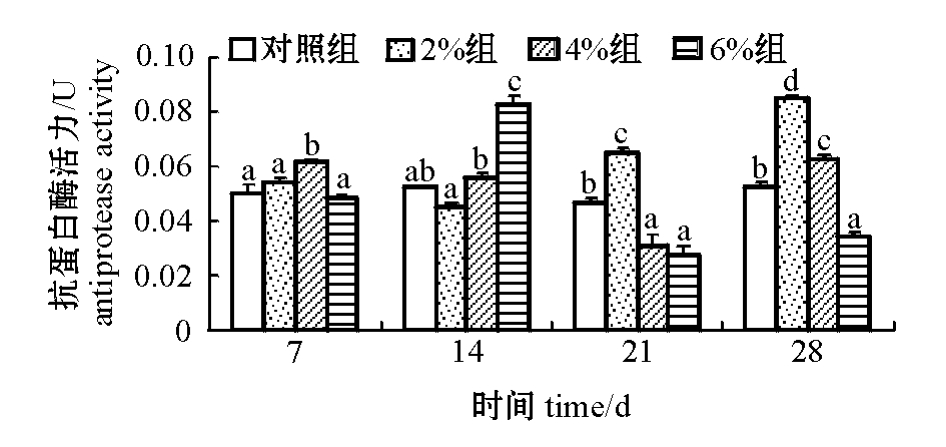
从图3可见:2%和4%浓度组大菱鲆血清抗蛋白酶活力随时间的延长均呈现先降低后升高的趋势,分别在第14天和第21天时达到最低值;6%浓度组鱼血清抗蛋白酶活力则呈现先升高后降低的趋势,在第14天时达到最高值。多重比较结果表明:前2周,4%和6%浓度组鱼血清抗蛋白酶活力保持在较高水平;后2周,2%浓度组鱼血清抗蛋白酶活力逐渐升高,且显著高于其他组(P<0.05),6%浓度组显著低于对照组(P<0.05)。
2.4 补体C3
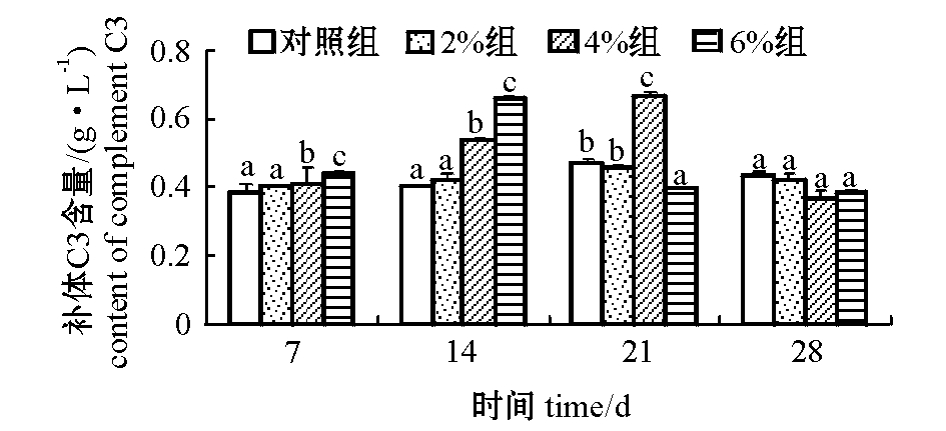
从图4可见:2%浓度组大菱鲆血清补体C3含量在整个试验周期内波动较小,接近对照组;4%和6%浓度组鱼血清C3含量则呈现先升高后降低的趋势,分别在第21天和第14天时达到峰值,第28天时降至接近初始值。多重比较结果表明,第14天时,6%浓度组鱼血清补体C3含量显著高于其他各组(P<0.05),4%浓度组次之;第21天时,4%浓度组血清补体C3含量则显著高于其他各组(P<0.05)。
2.5 NBT阳性细胞数
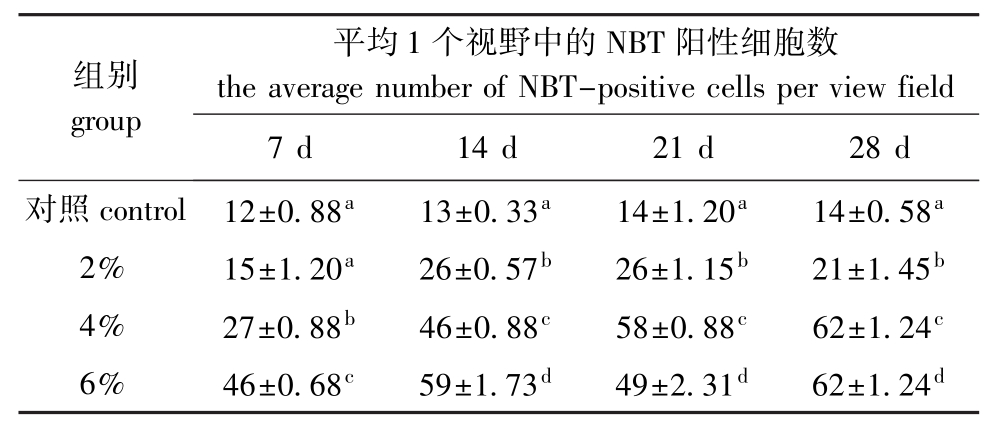
从表1可见:2%浓度组平均1个视野中NBT阳性细胞数在第14天有小幅升高,之后波动较小; 4%浓度组NBT阳性细胞数前3周一直处于升高趋势,3周后维持稳定;6%浓度组第7天时NBT阳性细胞数就明显升高,之后有小幅上下波动,但始终维持高水平;对照组在4周内一直维持相对较低水平,且无明显波动。多重比较结果表明,2%、4%、6%浓度组在各采样时间与对照组相比均有显著升高(P<0.05)(除2%组第7天外),且4%和6%浓度组NBT阳性细胞数升高更为明显。
表1 复方中草药对大菱鲆NBT阳性细胞数的影响
Tab.1 Effect of compound Chinese herbal medicine on NBT-positive cells in turbot S.maximus
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with the different letters within the same column are significant differences at the 0.05 probability level,and the means with the same letters within the same column are not significant differences,et sequentia.
组别group平均1个视野中的NBT阳性细胞数the average number of NBT-positive cells per v iew field 7 d 14 d 21 d 28 d对照control 12±0.88a13±0.33a14±1.20a14±0.58a2% 15±1.20a26±0.57b26±1.15b21±1.45b4% 27±0.88b46±0.88c58±0.88c62±1.24c6% 46±0.68c59±1.73d49±2.31d62±1.24d
2.6 头肾白细胞吞噬活性
头肾白细胞的吞噬活性由细胞的吞噬率来表示,测定结果见表2。从表2可见:4%和6%浓度组大菱鲆头肾白细胞吞噬百分比在试验前2周变化不大,第21天时有小幅上升,第28天时达到峰值,且显著高于对照组和2%浓度组(P<0.05);在整个试验期间,2%浓度组白细胞吞噬百分比与对照组相比无显著性差异(P>0.05)。
表2 复方中草药对大菱鲆白细胞吞噬活性的影响
Tab.2 Effect of compound Chinese herbal medicine on phagocytic activity of leucocytes in turbot S.maximus
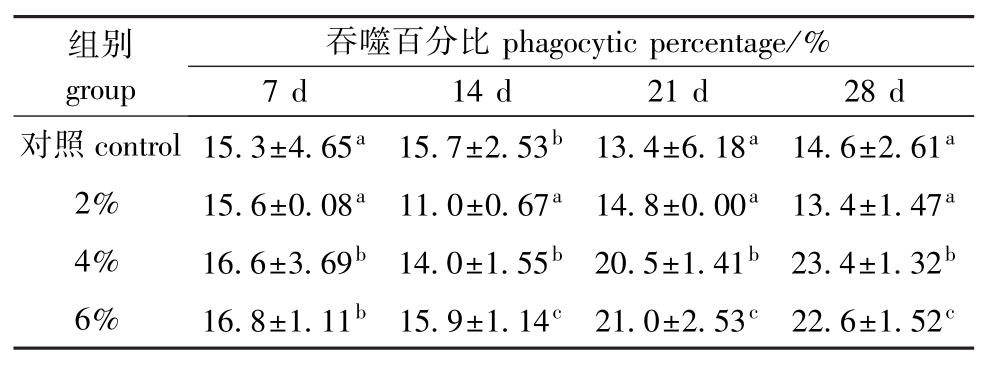
组别group吞噬百分比phagocytic percentage/% 7 d 14 d 21 d 28 d对照control 15.3±4.65a15.7±2.53b13.4±6.18a14.6±2.61a2% 15.6±0.08a11.0±0.67a14.8±0.00a13.4±1.47a4% 16.6±3.69b14.0±1.55b20.5±1.41b23.4±1.32b6% 16.8±1.11b15.9±1.14c21.0±2.53c22.6±1.52c
2.7 抗病力
攻毒试验结果表明,2%、4%、6%组存活率均高于对照组。从表3可见:2%浓度组前3 d存活率均为100%,第4天开始死亡,在第5、6天存活率逐渐降低,第7天时全部死亡;4%浓度组前4 d存活率为100%,第5天时开始死亡;6%浓度组,前2 d存活率为100%,第3天开始死亡,到第6天时全部死亡。各组的存活率从大到小依次为4%浓度组>2%浓度组>6%浓度组>对照组。
表3 攻毒后不同试验组大菱鲆的存活率
Tab.3 Survival rate in turbot S.maximus fed the diet containing compound Chinese herbal medicine after challenged with pathogen Edwardsiella tarda
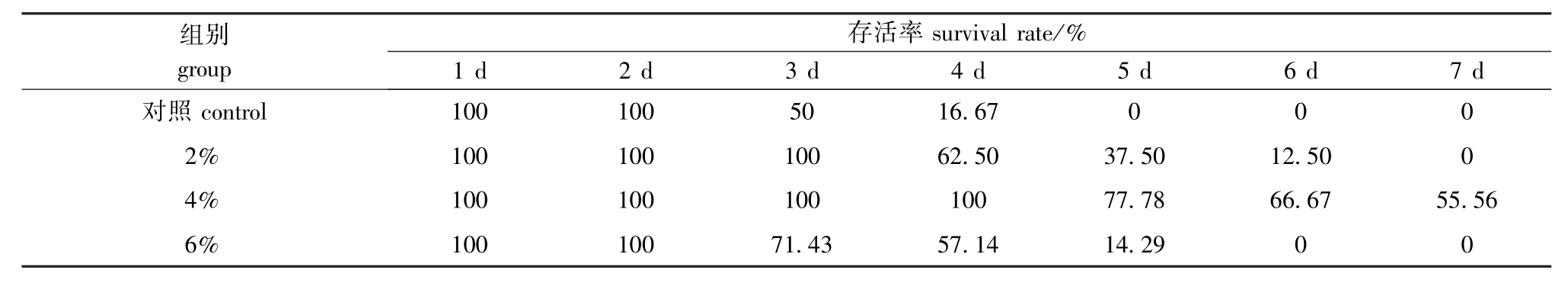
组别group存活率survival rate/% 1 d 2 d 3 d 4 d 5 d 6 d 7 d对照control 100 100 50 16.67 0 0 0 2% 100 100 100 62.50 37.50 12.50 0 4% 100 100 100 100 77.78 66.67 55.56 6% 100 100 71.43 57.14 14.29 0 0
3 讨论
本复方以牛膝为主药,配以常见的板蓝根、甘草等中草药,其药物成分包括生物碱、多糖、皂甙、挥发油、甘草甜素、 多种氨基酸等[13-14]。牛膝含有多种免疫活性多糖,在国内多用于治疗人类疾病,很少应用于水产养殖。本试验结果表明,该复方作为免疫增强剂投喂大菱鲆,可显著提高其溶菌酶活性、抗菌活力、抗蛋白酶活力等非特异性免疫指标。鱼类的特异性免疫机制还很不完善,其非特异性免疫系统仍扮演着重要角色,因此,通过激活抗菌活力、溶菌活力、免疫酶活力以及活化吞噬细胞的吞噬杀菌功能等途径来杀灭入侵的病原物,提高鱼体的非特异免疫活性,增强鱼类的免疫应答水平是非常重要的[15]。
鱼体内溶菌酶的活性和抗菌活力直接关系到鱼类的免疫功能和健康。中草药对鱼类溶菌酶活性调节的报道也很多,董艳珍等[16]、Yin等[17]分别用两种中草药的提取液拌饵投喂金鲫和罗非鱼,结果均显示鱼血清溶菌酶活性明显升高。本研究结果与上述研究结果相似,投喂中草药复方后可显著提高大菱鲆血清溶菌酶活力,尤其是4%浓度组,对溶菌酶活性影响较显著,且持续时间较长。在本试验中,复方中草药能显著提高大菱鲆血清抗菌活力,作用迅速但维持时间较短。陈志款等[18]用添加复方中草药的饲料连续投喂红笛鲷,能显著增强鱼血清的抗菌活力,并呈现先升高后降低的趋势,这与本试验结果基本相似。
补体C3是补体系统的重要成分,主要参与旁路激活途径。旁路途径使机体在初次接触抗原时,即可活化补体发挥其杀灭作用,表明了补体C3在非特异性免疫中的重要性[19]。本试验结果表明, 2%浓度组补体C3含量较对照组无明显变化,4%浓度组则显著升高,6%浓度组虽可以提高补体C3的含量,但持续时间较短,后期迅速降低。李桂峰等[20]分别用添加4种不同酵母多糖含量的饲料投喂赤眼鳟,结果高浓度添加组能显著提高补体C3的水平,这与本试验结果相似。
吞噬细胞在防御外来微生物感染过程中发挥重要作用,鱼类吞噬细胞的吞噬活性不仅受温度的影响,而且还受到饵料、免疫激活剂的影响。本试验结果表明,2%浓度组与对照组无显著性差异;4%和6%浓度组在第1周时,白细胞的吞噬活性比对照组显著升高,之后3周内持续升高。国外学者Rao等[3]用添加牛膝的饲料投喂露斯塔野鲮, 0.5%的添加量使细胞的吞噬活性有显著升高。李超等[7]用中草药投喂草鱼,各试验组吞噬细胞的吞噬活力均显著高于对照组。吞噬细胞包括单核细胞、巨噬细胞和各种粒细胞,统称为NBT阳性细胞,是重要的非特异性免疫因素,这些细胞吞噬了NBT后,胞质中的葡萄糖-6-磷酸氧化所脱下的氢被NBT接受,使淡黄色的NBT还原成棕黑色的颗粒,因而,NBT是研究这3种细胞数量和吞噬能力极好的指示剂[11]。本试验中各试验组NBT阳性细胞数较对照组发生显著变化,4%浓度组和6%浓度组血清中的NBT阳性细胞数均有显著提高。史会来等[21]使用中草药投喂真鲷幼鱼,结果表明,能显著影响血液中NBT阳性细胞数。
鱼体能够预防细菌的侵入,抑制细菌在机体内繁殖的蛋白酶抑制物主要是α1抗胰蛋白酶和α2巨球蛋白,因此,总抗蛋白酶的活性也是反映机体免疫状态的重要免疫指标。本试验中,2%浓度组鱼血清抗蛋白酶活力呈缓慢升高趋势,4%浓度组酶活力上下波动,不够稳定,6%浓度组酶活力缓慢升高,之后降低。Christybapita等[4]研究表明,使用不同浓度的旱莲草提取物投喂罗非鱼,其抗蛋白酶的活性在第2周和第3周比对照组均有显著提高。本试验变化趋势和以上学者的研究略有差异,其原因有待于进一步探讨。
攻毒试验是免疫增强剂效果最直观的反映,对照组及试验组鱼经活菌攻毒后,各组的存活情况均发生了不同的变化,2%、4%、6%浓度组比对照组存活率均有提高,各组存活率从大到小依次为4%浓度组>2%浓度组>6%浓度组>对照组。本试验结果与 Divyagnaneswari[22]的研究结果相似,该学者将茄属草药添加于饲料中,投喂红罗非鱼,结果能显著提高罗非鱼的免疫力和抗病力。由此可以看出,本试验中添加中草药对试验鱼起到了一定的免疫保护作用,以4%浓度组的存活率为最高。
综上所述,本试验中所采用的中草药对大菱鲆具有一定的免疫调节及增强作用,可显著提高大菱鲆的非特异性免疫力,且对抵抗病原菌的感染具有一定的增强作用,说明该中草药复方制剂的多种免疫活性物质对大菱鲆具有较强的免疫调节作用。本试验结果也表明,不同免疫指标达到最高水平所需要的时间和剂量各不相同。添加6%的高浓度组,某些免疫指标虽变化显著,但表现出一定的副作用,其溶菌酶和抗菌活力、抗病力等指标不如4%浓度组,说明添加高浓度中草药抑制了鱼体的免疫力和抗病力。作者认为本试验所采用的中草药复方制剂,完全可以作为免疫增强剂在大菱鲆养殖中使用,以4%添加量为宜,合适的投喂时间和周期有待进一步试验确定。此外,中草药的粒径和添加量具有密不可分的关系,本试验中中草药粉碎后采用80目过滤筛网,在实际生产中可通过缩小中草药粒径减少添加量,不仅可以降低成本而且还可以提高免疫效果。
参考文献:
[1]吕欣荣,肖克宇.中草药在水产养殖病害防治中的应用现状[J].内陆水产,2007,32(9):29-31.
[2]吴亚楠,柳鹏,李强,等.复方中草药对仿刺参免疫力和抗病力的影响[J].大连海洋大学学报,2011,26(4):338-343.
[3]Rao Y V,Chakrabarti R.Stimulation of immunity in Indian major carp Catla catla with herbal feed ingredients[J].Fish&Shellfish Immunol,2005,18(4):327-334.
[4]Christybapita D,Divyagnaneswari M,Michael R D.Oral administration of Eclipta alba leaf aqueous extract enhances the non-specific immune responses and disease resistance of Oreochromis mossambicus[J].Fish&Shellfish Immunol,2007,23(4):840-852.
[5]张照红,林旋.复方中草药对奥尼罗非鱼血液非特异性免疫功能的影响[J].水产科学,2011,30(5):1-5.
[6]李霞,马驰原.中草药对牙鲆免疫力的影响[J].东北农业大学学报,2011,42(3):60-67.
[7]李超,张其中.不同剂量复方中草药免疫增强剂对草鱼生长性能和免疫功能的影响[J].上海海洋大学学报,2011,20(4): 534-540.
[8]王雷,李光友.口服免疫型药物对养殖中国对虾病害防治作用的研究[J].海洋与湖沼,1994,25(5):486-492.
[9]Hultmark D,Steiner H,Rasmuson T,et al.Insect immunity.Purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae of Hylophora ceropia[J].Eur J Biochem,1980,106(1):7-16.
[10]王宏田,张培军.牙鲆不同组织中抗蛋白酶物质活性研究[J].海洋科学,2002,26(2):15,68.
[11]简纪常,吴灶和.中草药对建鲤非特异性免疫功能的影响[J].大连水产学院学报,2002,17(2):114-119.
[12]李海平,谢珍玉,周永灿,等.低氧水体对尖吻鲈Lates calcarifer(Bloch)头肾巨噬细胞(head-kidney macrophage)活性的影响[J].现代渔业信息,2007,22(4):12-14,23.
[13]刘向前.常用中药的配伍运用[M].北京:人民军医出版社, 2007.
[14]《家庭书架》编委会.生活中常用的200种道地药材[M].北京:北京出版社,2007.
[15]Ellis A E.Immunity to bacteria in fish[J].Fish&Shellfish Immunol,1999,9(4):291-308.
[16]董艳珍,刘茂春.两种中草药对金鲫非特异性免疫的影响[J].安徽农学通报,2012(10):53-54.
[17]Yin G J,Jeney G,Racz T,et al.Effect of two Chinese herbs(Astragalus radix and Scutellaria radix)on non-specific immune response of tilapia,Oreochromis niloticus[J].Aquaculture,2006,253(1/4):39-47.
[18]陈志款,简纪常,吴灶和,等.一种复方中草药饲料添加剂在红笛鲷网箱养殖中的应用[J].广东海洋大学学报,2008,28(4):59-64.
[19]王志平,张士璀,王光锋.鱼类补体系统成分及补体特异性和功能的研究进展[J].水生生物学报,2008,32(5):760-769.
[20]李桂峰,康裕财,孙际佳,等.酵母多糖对赤眼鳟非特异性免疫机能的影响[J].中山大学学报:自然科学版,2003,42(4): 55-58.
[21]史会来,楼宝,胡则辉.中草药饲料添加剂对真鲷(Pagrosomus major)幼鱼生长和非特异性免疫的影响[J].现代生物医学进展,2007,7(4):548-551,556.
[22]Divyagnaneswari M.Enhancement of nonspecific immunity and disease resistance in Oreochromis mossambicus by Solanum trilobatum leaf fractions[J].Fish&Shellfish Immunology,2007,23: 249-259.
Influence of compound Chinese herbal medicine on non-specific immunity of turbot Scophthalmus maximus
LI Hua,ZHANG Tai-e,LI Qiang
(Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China)
Abstract:In this paper,turbot(Scophthalmus maximus)juveniles weighing(29.00±1.82)g were fed diets containing 7 Chinese herbal medicines(CHM)immunostimulants including Achyranthes,Isatis tinctoria L.,Glycyrrhiza glabra,Pericarpium citri reticulatae,Cortex cinnamomi,Fructus hordei germinatus,and Massa medicata fermentata,which were grinded and screened with 80 mesh,at a rate of 0,2.0%,4.0%and 6.0%for 4 weeks to evaluate the effect of CHM on non-specific immunity in turbot.The results showed that there was significant influence of CHM on the activities of lysozyme,anti-bacterial and anti-protease,complement C3 content,number of NBT-positive cells and the phagocytic activity of pronephros leukocytes.With the extension of feeding time,most of immunological factors were found to have a tendency of increase first and then decrease,the peak activity on the 2ndor 3rdweek.There were significantly higher lysozyme and anti-bacterial activities in the 4%group than those in the control group during the experiment(P<0.05).The higher anti-protease activity was observed in 4%and 6% groups in the first two weeks.However,the anti-protease activity in 2%group was continued to increase in later two weeks,significantly higher than in other groups(P<0.05).There was significantly higher complement C3 content in 4%group than that in the control group(P<0.05).The juveniles fed the diet containing Chinese herbal medicines had significantly more NBT-positive cells than the fish in the control group did(P<0.05),especially the fish fed the diets containing 4%and 6%Chinese herbal medicines.The phagocytic activity of pronephros leukocyte was found to be decreased first and increased later in 4%and 6%groups throughout the experiment,the peak at the 4th week,and significantly higher than that in 2%group and the control group(P<0.05).Infection test showed that the survival rate in the groups was descendantly arranged as 4%grouP>2%grouP>6%grouP>control group.It is concluded that addition of 2%CHM to the basal food can improve the non-specific immunity and disease resistance in turbot,especially in 4%group.
Key words:Scophthalmus maximus;Chinese herbal medicine;non-specific immunity;disease resistance
中图分类号:S941.42
文献标志码::A
收稿日期:2012-06-20
基金项目:国家 “十二五”科技支撑计划项目(2011BA益性行业科研专项(200905020);辽宁省海洋与渔业厅项目(201005)
作者简介:李华(1958-),女,博士,教授。E-mail:lihua@dlou.edu.cn
文章编号:2095-1388(2013)02-0115-06