摘要:采用静水生物测试法进行急性暴露试验,研究了有机磷类农药——乐斯本(LSB)对体质量为(20.0±1.7)g的克氏原螯虾Procambarus clarkii肝胰脏抗氧化系统的影响。试验设定2、10、20、40、80 μg/L 5个LSB质量浓度梯度,每个浓度设2个平行,另设空白对照组和助溶剂二甲基亚砜(DMSO)对照组,每组投放克氏原螯虾20只,试验在聚乙烯塑料箱(58 cm×35 cm×34 cm)中进行。结果表明:药物浓度升高对克氏原螯虾产生较大毒性,半致死浓度(LC50)随着暴露时间的延长呈显著下降趋势,符合双曲线衰减模型(R=0.9999,P<0.0001),安全浓度为(2.79±0.31)μg/L;低LSB浓度染毒条件下,克氏原螯虾肝胰脏过氧化氢酶(CAT)活性随时间变化较小,在20 μg/L LSB感染96 h时CAT活性达到最大值,之后随药物浓度的升高而降低,CAT活性随时间和药物浓度的变化呈极显著性差异(P<0.001);肝胰脏超氧化物歧化酶(SOD)活性变化与CAT活性变化相似,在时间和LSB浓度的共同作用下,SOD活性表现出显著性差异(P=0.045<0.05);LSB浓度对肝胰脏谷胱甘肽(GSH)含量的影响不大,在20~80 μg/L浓度组,24 h和48 h的GSH含量有所下降,96 h的GSH含量则维持在较高水平,GSH含量变化在时间上出现了极显著性差异(P<0.001)。本研究表明,肝胰脏SOD和CAT活性及GSH含量变化可以反映克氏原螯虾受损伤的程度,并可用作克氏原螯虾安全性风险评价的参考依据。
关键词:乐斯本;克氏原螯虾;肝胰脏;抗氧化酶
克氏原螯虾 Procambarus clarkii也称小龙虾,是近年来最具特色、最具潜力的养殖品种之一[1-3]。随着养殖集约化程度的不断提升,产业的快速发展中也凸显诸多问题,养殖水体的污染即为其中之一。稻虾轮作是目前大量采用的克氏原螯虾养殖模式,即在水稻收割后至翌年播种这段闲置时间,在稻田中放养克氏原螯虾。由于在农作物病虫害防治过程中,喷施的农药量平均只有25% ~50%沉积在作物上[4],大部分进入农田土壤及水体,且部分农药在水中降解速度较慢[5],极易对稻田水中的克氏原螯虾产生毒性,笔者所在课题组已先后多次接到疑因农药污染而导致克氏原螯虾死亡的报告。
乐斯本(Lorsban,LSB)又名毒死蜱(Chlorpyrifos),世界卫生组织(WHO)将其列为二级中度危害杀虫剂,LSB是目前全球应用最广泛的农药之一[6-7]。在中国,2007年甲胺磷等高毒农药被禁用后,乐斯本作为替代产品在水稻等作物上的用量大幅增加,销售额居所有杀虫剂首位[8]。因此,了解LSB对水环境的污染程度以及对克氏原螯虾的养殖风险非常必要。
LSB对水产养殖品种及水环境的危害性是近年来的研究热点之一,但主要集中在对大型溞、轮虫、鱼类及南美白对虾等[7,9-14]的研究上,对克氏原螯虾毒性方面的研究鲜见报道。LSB同其他有机磷类(OP)农药一样,会对生物体造成氧化胁迫,破坏氧自由基的代谢平衡,造成机体损伤[15],而肝脏是机体最重要的解毒器官,对LSB的亲和力较大,药物会通过不断被摄取而迅速积累[16]。本试验中,作者选择克氏原螯虾肝胰脏组织,通过检测肝胰脏内重要的抗氧化酶组分——超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性及谷胱甘肽(GSH)含量的变化[17],研究了急性暴露对克氏原螯虾肝胰脏抗氧化系统的影响,旨在为合理地使用LSB农药、开展克氏原螯虾的生态养殖和水产品质量安全控制提供基础依据。
1.1 材料
克氏原螯虾取自江苏省淡水水产研究所盱眙试验基地,体质量为(20.0±1.7)g,头胸甲长为(42.5±3.7)mm,选取体质健壮、反应灵敏的个体用于试验,驯养7 d,试验前1 d停止投喂。
LSB(100%分析纯,购自美国陶氏益农公司)是一种脂溶性有机磷酸脂类化合物,水溶性很低(<2 mg/L),但在溶媒二甲基亚砜(DMSO)中能够迅速且完全溶解[10],因此,笔者采用DMSO助溶的方式配制体积分数为0.01%的药液。
1.2 方法
1.2.1 试验条件 试验在聚乙烯塑料箱(58 cm× 35 cm×34 cm)中进行,养殖用水为曝气3 d的净化水。试验期间,每天采用便携式多参数水质分析仪(YSI-ADV6600)监测水质,pH为6.5~7.5,总硬度(以CaCO3计)为(10~250)mg/L,试验温度为(20±2)℃,溶解氧(DO)≥7 mg/L,自然光照。为防止摄食的影响,试验期间不投喂饵料,驯养和试验期间虾生长正常。
1.2.2 试验设计 参照静水生物测试法[18],试验期间不更换试验液,根据环境中LSB残留的浓度范围[14],设定2、10、20、40、80 μg/L 5个 LSB质量浓度梯度。每个浓度设2个平行组,另设空白对照组和助溶剂DMSO对照组,每组投放克氏原螯虾20只,试验过程中观察虾的行为和中毒症状。中毒后,经多次刺激无反应则判断为死亡,将其捞出并记录死亡数。
1.2.3 组织匀浆的制备及酶活性的测定 用4℃预冷的生理盐水漂洗样品,再用滤纸吸去表面水分,按质量与体积比为1∶10加入上述生理盐水,冰浴条件下,用超声波进行匀浆。匀浆液用冷冻离心机(Eppendorf 5810R)以4 000 r/min离心10 min,取上清液备用。
酶活性的测定方法及活性单位(U)定义参见文献 [19]。
1.2.4 指标计算 采用半数致死浓度(LC50)来表征LSB对克氏原螯虾的毒性。采用寇氏(Karber) 法[11]计 算 24、 48、 96 h 的 LC50以 及lg(LC50)的95%置信限,并按下式计算安全浓度:
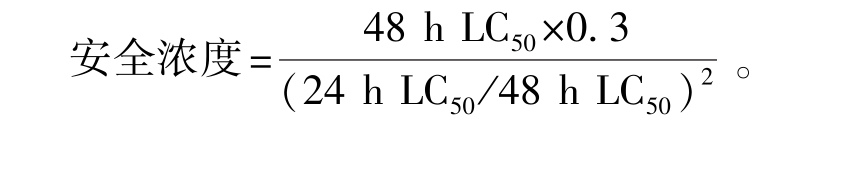
1.3 数据处理
试验数据均以平均数±标准差表示。用 SPSS 16.0软件对试验数据进行重复测量方差分析(Repeated Measures)和双因素方差分析(Two-Way ANOVA),用SigmaPlot 11.0软件作图。
2.1 LSB对克氏原螯虾的急性毒性
试验期间,空白对照组、DMSO对照组均未发现虾中毒或死亡,其他试验组在中毒初期,虾急速爬动,有些表现为腹部朝上,翻身困难,附肢抖动,随着中毒时间的延长,动作变得迟缓,逐步丧失运动能力,翻转后附肢不停抽搐,最后躺卧箱底。
从图1可见:随着LSB质量浓度的增加,其毒性作用不断增强,虾死亡率逐渐上升;随着暴露时间的延长,同一浓度组LSB对克氏原螯虾的毒性作用亦随之增强。相同暴露时间内,LSB浓度越高,虾死亡率越大;相同LSB浓度条件下,染毒时间越长,虾死亡率越高。
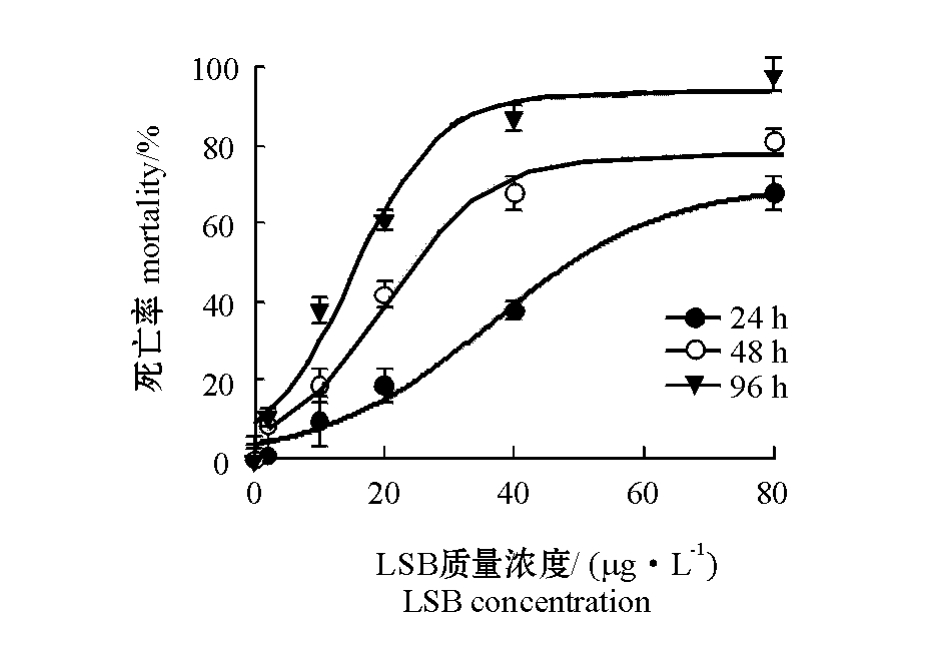
图1 LSB质量浓度和暴露时间对克氏原螯虾死亡率的影响
Fig.1 The effects of LSB concentration and exposure period on the mortality of the crayfish
以Karber方程对试验结果进行统计分析,得出24、48、96 h的 LC50分别为(28.24±2.81)、(19.52±2.03)、(13.13±1.71)μg/L,安全浓度为(2.79±0.31)μg/L,LC50随着暴露时间(t)的延长呈显著下降趋势,符合双曲线衰减模型(图2):

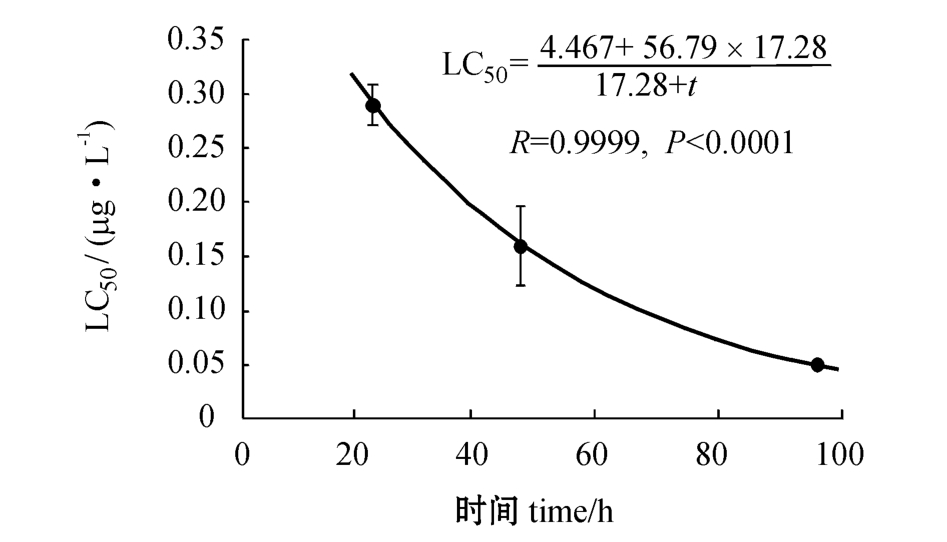
图2 LC50随试验时间变化的双曲线衰减模型拟合
Fig.2 The LC50decreased with period and fitted with the hyperbolic decay model
2.2 LSB对克氏原螯虾肝胰脏抗氧化酶活性的影响
从图3可见:在染毒24 h和48 h时,药物对克氏原螯虾肝胰脏SOD活性的影响均不显著(P>0.05);在染毒96 h时,LSB质量浓度为20 μg/L的条件下,SOD活性被诱导表达到最大值;之后随药物浓度的升高SOD活性又下降。在时间和LSB浓度的共同作用下,SOD活性表现出显著性差异(P=0.045<0.05)(表1)。
表1 时间和LSB浓度对克氏原螯虾肝胰脏抗氧化酶活性的交互影响结果
Tab.1 The two-way ANOVA on the interaction between exposure period and LSB concentration on parameters of the hepatopancreatic oxidative stress response
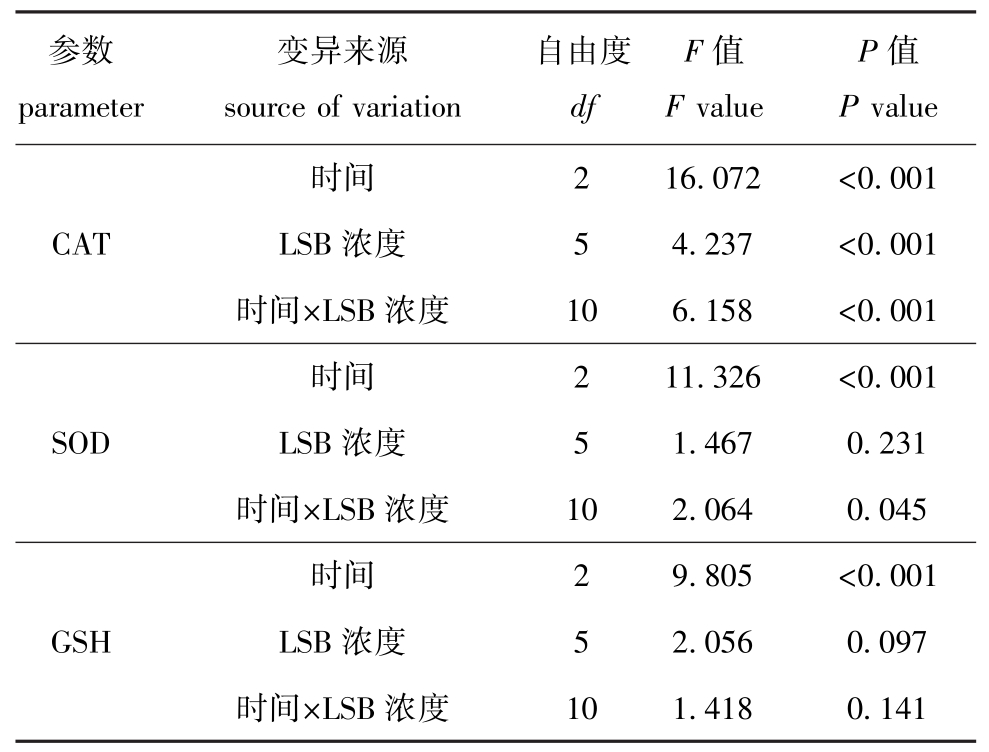
参数parameter变异来源source of variation自由度df F值F value P值P 2 16.072 <0.001 CAT LSB浓度 5 4.237 <0.001时间×LSB浓度 10 6.158 <0.001时间value时间2 9.805 <0.001 GSH LSB浓度 5 2.056 0.097时间×LSB浓度2 11.326 <0.001 SOD LSB浓度 5 1.467 0.231时间×LSB浓度 10 2.064 0.045时间10 1.418 0.141
从图3可见:在低浓度(2 μg/L)染毒条件下,克氏原螯虾肝胰脏CAT活性随时间的变化不大;当LSB的质量浓度为10 μg/L时,对CAT活性具有激活作用,酶活性较对照组和低浓度组高,之后随着药物浓度的升高CAT活性有下降趋势。染毒48 h时的CAT活性变化与染毒24 h时的变化趋势相似,但其活性较24 h低;染毒96 h时, CAT活性变化趋势较大,在LSB质量浓度为20 μg/L时,CAT活性达到了最大值,之后随药物浓度的升高CAT活性降低。CAT活性随时间和药物浓度的变化呈极显著性差异(P<0.001)(表1)。
从图3可见:药物浓度对肝胰脏GSH含量的影响不大,在低浓度组染毒条件下其含量基本没变化,当LSB质量浓度达到20~80 μg/L时,其24 h和48 h时的GSH含量有所下降,96 h的GSH含量则维持在较高水平。GSH含量的变化在时间上出现了极显著性差异(P<0.001)(表1)。
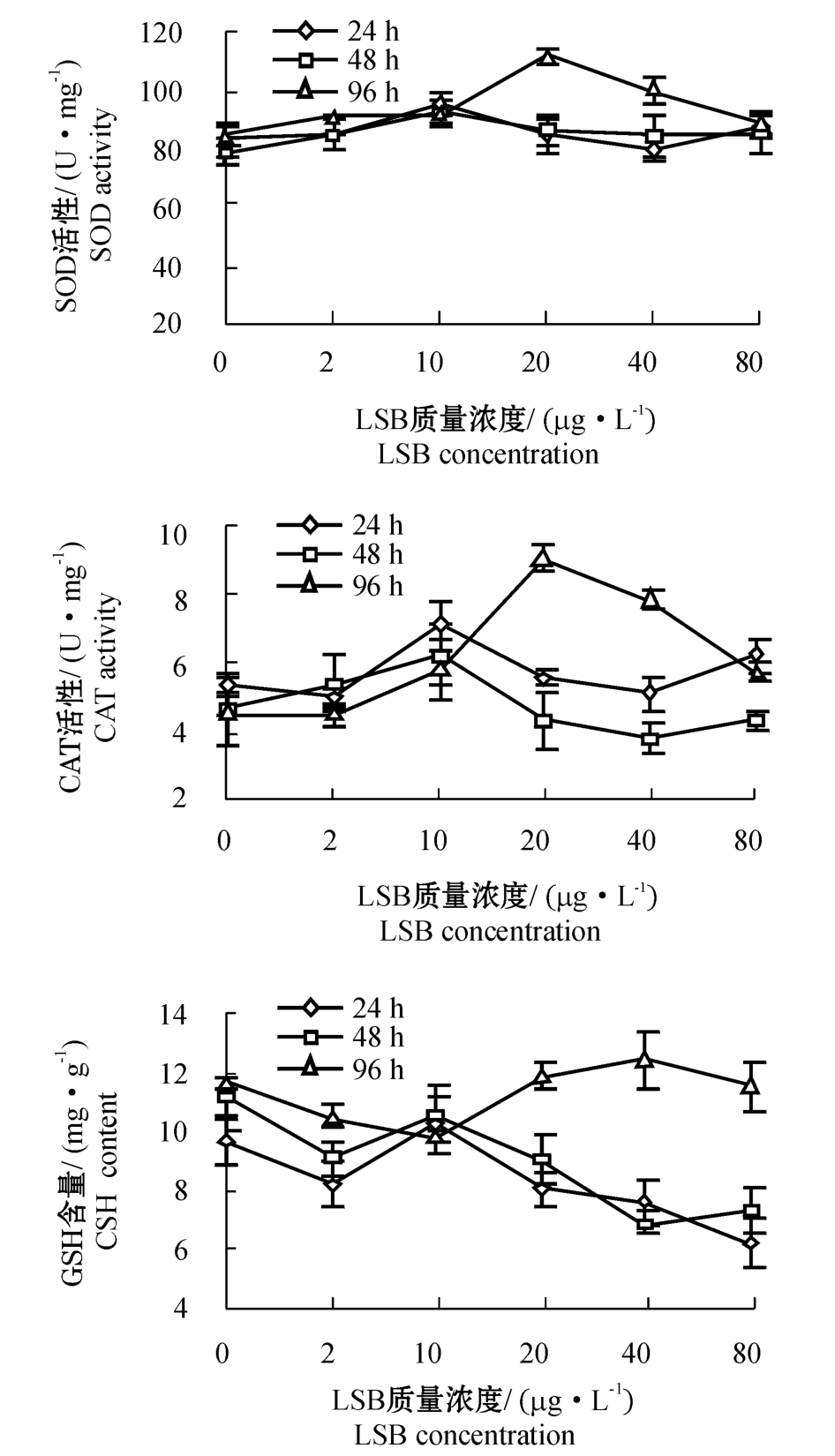
图3 时间、LSB质量浓度对克氏原螯虾肝胰脏SOD、CAT、GSH的影响
Fig.3 The effects of exposure period and LSB concentration on the activities of SOD,and CAT,and GSH levels in the hepatopancreas of the crayfish
3.1 控制LSB对克氏原螯虾毒性影响的措施
进行急性毒性试验对阐明受试动物的毒性作用具有重要意义,是进行药物安全评价的重要手段。LSB对新糠虾 Neomysis integer、隆线溞 Daphnia carinata、南美白对虾Penaeus vannmei、乌鳢Channa punctatus、罗非鱼Oreochromis niloticus等的96 h LC50分 别 为 0.13、 0.24、 0.89、 81.98、 1.57 μg/L[4,9-14],表明其对水生动物均有极高毒性,即使携带极微量LSB的稻田水流入养殖水体,也会对养殖品种产生严重危害。吴长兴等[8]对水稻1个生产季节的LSB使用情况及灌排水进行了跟踪调查,发现在LSB使用高峰期,排水对稻田周边水域造成严重污染,出水中LSB残留量高达26.07 μg/L,远高于本试验中克氏原螯虾(2.79±0.31) μg/L的安全浓度。此外,2008年台湾市场上23%的水产品检测出LSB残留,通过对11家水产养殖场的所有环节进行排查,发现在所投喂的饲料中存在高LSB残留[20],每天投喂这些饲料使得农药在动物体内大量积累,并最终会通过食物链传递给人类,因此,研究并控制LSB在养殖水体中的扩散污染,对实现克氏原螯虾等水产品的健康养殖及水产品质量的安全保障具有重要意义。
水产养殖场应加强水源、器械及饲料等的管理,在养殖区域的田间应尽量避免连续施用LSB,并提前做好预防工作,如在每年7—8月稻田LSB使用的高峰期,可以采用微生物制剂对养殖水体中的有机磷农药进行净化处理[21]。此外,加强光照、提高水温与水体的pH,能够有效地促进LSB的降解[5]。因此,养殖者应加强清塘管理,降低池塘水位后可采用底泥暴晒与生石灰泼洒相结合的方式,促进土壤及水体中LSB的降解。
3.2 LSB对克氏原螯虾肝胰脏抗氧化系统的影响
本试验中发现,克氏原螯虾在20 μg/L的LSB溶液中暴露96 h时,肝胰脏SOD活性被诱导表达到最大值;之后随药物浓度的升高SOD活性又下降,与Beaumont等[17]的研究结果类似,这种现象被称之为 “毒物兴奋效应”[22],当机体受到重度逆境胁迫时,SOD活性通常降低[23-24]。此外,由于在抗氧化系统中,CAT与SOD协同发挥作用[17],因此变化趋势较为相似,这与本试验结果一致,两种酶活性均显示先升后降的波动趋势。GSH量的多少是衡量机体抗氧化能力大小的重要因素,缺乏或耗竭GSH会促使很多化学物质或环境因素产生中毒作用或加重中毒作用[25]。本试验中,刚染毒的24 h,低浓度组(2 μg/L)克氏原螯虾肝胰脏GSH含量明显降低,分析是由于此时机体消耗体内GSH来抵御LSB引起虾体内脂质过氧化物及过氧化氢堆积的原因;随着时间和药物浓度的提高, GSH含量有所升高,表明长时间、高浓度的LSB对克氏原螯虾的抗氧化系统造成了损伤,抑制了GSH的消耗,表现为含量上升。本试验表明,SOD和CAT活性及GSH含量变化可以反映克氏原螯虾受伤害的程度,并可用作克氏原螯虾安全性风险评价的参考依据。
此外,染毒时间越长,机体受损伤程度越严重,如果毒物浓度过小,则可能对水生动物组织不构成损伤[26]。由此可见,染毒时间和药物浓度均决定LSB对克氏原螯虾的毒性效果。此次试验中也观察到低浓度组克氏原螯虾很少死亡,因此,在实际生产中,应控制水体中LSB的质量浓度不高于(2.79±0.31)μg/L这一安全浓度。
参考文献:
[1] 黄羽,戴银根,胡成钰,等.克氏原螯虾产业发展现状及可持续发展对策[J].江苏农业科学,2011,39(1):274-277.
[2] 徐增洪,周鑫,水燕.克氏原螯虾的食物选择性及其摄食节律[J].大连海洋大学学报,2012,27(2):166-170.
[3] 董学兴,吕林兰,黄金田,等.Cu(Ⅱ)和Cd(Ⅱ)对克氏原螯虾代谢酶的影响[J].大连海洋大学学报,2011,26(5):467-470.
[4] 祁力钧,傅泽田,史岩.化学农药施用技术与粮食安全[J].农业工程学报,2002,18(6):203-206.
[5] 石利利,林玉锁,徐亦钢,等.毒死蜱农药环境行为研究[J].土壤与环境,2000,9(1):73-74.
[6] WHO.The WHO Recommended Classification of Pesticides by Hazard and Guidelines to Classification 2009[M].Stuttgart,Germany:Wissenchaftliche Verlagsgesellschaft mbH,2009:24-26.
[7] Pamela D W,Joseph R B.Tadpole size,cholinesterase activity,and swim speed in four frog species after exposure to sub-lethal concentrations of chlorpyrifos[J].Aquatic Toxicology,2008,88(1):9 -18.
[8] 吴长兴,赵学平,吴声敢,等.丘陵地区水稻田使用毒死蜱对水体的污染及其生态风险[J].生态与农村环境学报,2011,27(3):108-112.
[9] 马继华,蒋耀培,刘泉,等.毒死蜱对南美白对虾的急性毒性影响[J].水产科技情报,2009,36(4):192-194.
[10] David S,Nico M,Agna K,et al.Acute toxicity of pesticides to the tropical freshwater shrimp Caridina laevis[J].Ecotoxicology and Environmental Safety,2008,69(3):421-427.
[11] Roast S D,Widdows J,Jones M B.Disruption of swimming in the hyperbenthic mysid Neomysis integer(Peracarida:Mysidacea)by the organophosphate pesticide chlorpyrifos[J].Aquatic Toxicology,2000,47(4):227-241.
[12] Mahmut S,Rabia S,Figen E.Effects of chlorpyrifos on reproductive performances of guppy(Poecilia reticulata)[J].Chemosphere,2005,58(9):1293-1299.
[13] Daoud A,Nagpurea N S,Sudhir K,et al.Genotoxicity assessment of acute exposure of chlorpyrifos to freshwater fish Channa punctatus(Bloch)using micronucleus assay and alkaline single-cell gel electrophoresis[J].Chemosphere,2008,71(10):1823-1831.
[14] Gül A.Investigation of acute toxicity of chlorpyrifos-methyl on Nile tilapia(Oreochromis niloticus L.)larvae[J].Chemosphere, 2005,59(2):163-166.
[15] Filiz D,Fatma G U,Dilek D,et al.Subacute chlorpyrifos-induced oxidative stress in rat erythrocytes and the protective effects of catechin and quercetin[J].Pesticide Biochemistry and Physiology, 2011,99:77-81.
[16] 侯方浩,余向阳,赵于丁,等.毒死蜱对锦鲫性腺的影响及其在鱼组织中的富集[J].江苏农业学报,2009:25(1):188-191.
[17] Beaumont A R,Newman P B.Low levels of tributyhin reduce growth of marine microalgae[J].Marine Pollution Bulletin,1986, 17(10):457-461.
[18] 吴邦灿,费龙.现代环境监测技术[M].北京:中国环境科学出版社,1999:252-254.
[19] 姚志峰,章龙珍,庄平,等.铜对中华鲟幼鱼的急性毒性及对肝脏抗氧化酶活性的影响[J].中国水产科学,2010,17(4): 731-738.
[20] Sun F,Chen H S.Monitoring of pesticide chlorpyrifos residue in farmed fish:Investigation of possible sources[J].Chemosphere, 2008,71(10):1866-1869.
[21] 刘云焕,陈东海.微生物降解有机磷农药的研究进展[J].北方环境,2005,30(1):22-24.
[22] Stebbing A R.Hormesis the stimulation of growth by low levels of inhibitions[J].Science of the Total Environment,1982,22(1): 213-234.
[23] 唐学玺,张培玉.蒽对黑鳕超氧化物歧化酶活性的影响[J].水产学报,2000,24(3):217-220.
[24] Hegazi M M,Attia Z I,Ashour O A.Oxidative stress and antioxidant enzymes in liver and white muscle of Nile tilapia juveniles in chronic ammonia exposure[J].Aquatic Toxicology,2010,99(2): 118-125.
[25] Palacea V P,Brown S B,Baron C I,et al.An evaluation of the relationships among oxidative stress,antioxidant vitamins and early mortality syndrome(EMS)of lake trout(Salvelinus namaycush) from Lake Ontario[J].Aquatic Toxicology,1998,43:259-268.
[26] 汪开毓,耿毅,叶仕根,等.鲤慢性喹乙醇中毒的病理学和组织学残留[J].水产学报,2003,27(1):75-82.
Effects of Lorsban on antioxidant system in hepatopancreas of red swamp crayfish Procambarus clarkii
Abstract:Effects of Lorsban(LSB)on antioxidant system in hepatopancreas of red swamp crayfish Procambarus clarkii with body weight(20.0±1.7)g were studied in an acute exposure experiment by the static test method.The crayfish were stocked into polyethylene plastic tanks of each 58 cm×35 cm×34 cm at a rate of 20 individuals per tank and exposed to the LSB concentrations of 2,10,20,40,and 80 μg/L,and blank and DMSO groups as control with triplication.Results showed that the LSB had great toxicity to the crayfish at increasing concentration with the safe concentration of(2.79±0.31)μg/L.The LC50of LSB was found to be decreased significantly with time and fitted a hyperbolic decay model with high R(R=0.9999,P<0.0001).The activities of superoxide dismutase(SOD),and catalase(CAT)and glutathione(GSH)content in the hepatopancreas as the antioxidant indices revealed that there was little change in CAT activity at low LSB concentrations,the maximum activity in 20 μg/L group with in 96 h.With time procedure and increase in the drug concentration,however,CAT activity was shown to be very significantly lower(P<0.001).SOD activity was shown a similar trend as the CAT,significant differences(P<0.05)in terms of time and concentration.There was no significant effect of the drug on the GSH content in 10 μg/L group,GSH levels being declined in 24 h and 48 h,and GSH levels being significantly higher in 96 h(P<0.001).It is concluded that the damage effect of red swamp crayfish is reflected in hepatopancreatic CAT, and SOD activities and GSH content as toxicological indicators.
Key words:Lorsban(LSB);Procambarus clarkii;hepatopancreas;antioxidant enzyme
中图分类号:S966.1;Q178.1
文献标志码:A
收稿日期:2012-05-01
基金项目:农业部公益性行业(农业)科研专项(201003070);江苏省农业科技支撑计划项目(BE2010378)
文章编号:2095-1388(2013)01-0072-05