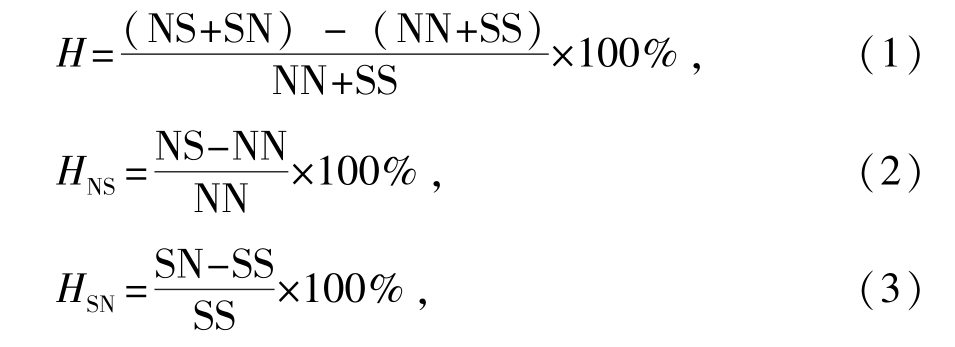
摘要:以蛤仔Ruditapes philippinarum北方大连养殖群体(N)和南方莆田养殖群体(S)为亲本,采用群体内自交和群体间杂交的方法建立了NN(N♀×N♂)、SS(S♀×S♂)、NS(N♀×S♂)和SN(S♀×N♂)4个试验组,比较了自交与杂交F1在幼虫期和稚贝期的生长与存活,研究了蛤仔不同地理群体间的杂交效应。结果表明:正反交组的单亲生长优势具有明显的不对称性,在幼虫期NS组和SN组的单亲生长优势分别为11.23%和-6.05%,双亲生长优势为2.12%,正交组NS表现出杂种优势,而反交组SN表现出杂种劣势;在稚贝期,正反交组都表现出杂种优势,NS组和SN组的单亲生长优势分别为24.89%和15.12%,双亲生长优势为19.93%;在幼虫期和稚贝期,杂交F1的存活性状未表现出明显的杂种优势。本研究结果表明,利用蛤仔南北方群体杂交育种的方法,可有效地改良蛤仔的生长性状,并为蛤仔速生新品种培育提供基础资料。
关键词:蛤仔;种群;杂交;杂种优势
蛤仔Ruditapes philippinarum在中国的分布范围南起香港、广东(海门、汕尾、雷东、洲岛),北至河北(北戴河)、辽宁(庄河、长兴岛、海洋岛)等地。目前,中国蛤仔年产量为320万 t左右,约占海水养殖产量的20%,约占贝类产量的30%,占世界蛤仔总产量的90%以上。缺少高产抗逆品种成为蛤仔养殖业发展的 “瓶颈”。为了改变这种状况以实现蛤仔产业的可持续性发展,开展蛤仔系统的育种工作研究是非常必要的。目前,蛤仔高产抗逆品种培育方面的遗传育种工作已取得一定的进展[1-3]。
杂交作为生物育种的重要方法之一,已在水产生物的品种改良中发挥着重大作用[4]。由于杂种优势的存在,杂交有可能迅速和显著地提高水产生物的产量或生活力[5]。有关贝类的杂交育种研究,国内外已有许多报道。大多数种间杂交由于授精时配子间不亲和以及胚胎发育障碍等问题,未能得到生产应用或只能作为育种的中间材料。然而,贝类亚种间、不同地理群体间的杂交在长牡蛎[6]、海湾扇贝[7-8]、 栉孔扇贝[9]、 贻贝[10]、 马氏珠母贝[11]、杂色鲍[12]等贝类上已取得了可喜的进展,大多都能获得正的杂种优势。张跃环等[2,13]对不同地理群体菲律宾蛤仔的生长发育进行了比较,闫喜武等[1]对蛤仔不同壳色品系间的双列杂交进行了研究,丁鉴峰等[14]对不同壳色品系蛤仔的免疫机能进行了比较。但有关蛤仔不同地理群体间杂交方面的研究目前尚未见报道。为此,作者研究了蛤仔南北方地理群体间的杂交效应,旨在为蛤仔的杂交育种以及杂种优势在生产中的利用提供基础资料。
1.1 亲贝来源
蛤仔亲贝来自于南北方两个不同地理群体,北方大连养殖群体是用北方野生个体经人工繁殖培育的3龄蛤仔;南方莆田养殖群体是用南方野生个体经人工繁殖培育的3龄蛤仔。于2010年6月,在庄河海洋贝类养殖场室外生态池进行亲贝促熟。
1.2 方法
1.2.1 试验设计 于2010年10月选取性腺成熟的蛤仔北方群体(N)与南方群体(S)各500枚进行双列杂交。采用阴干流水刺激法对亲贝进行催产,分别收集4组亲本N♀、N♂、S♀、S♂各30个个体的精子或卵子,将收集好的精、卵分别进行人工授精,采用双列杂交法建立自交组和杂交组,即杂交组为N♀×S♂和S♀×N♂,自交组为N♀× N♂和S♀×S♂,得到4个试验组的F1代,每组设3个重复。
1.2.2 子代培育 按照闫喜武等[15-16]培养其他滩涂贝类的方法,在50 L塑料桶中培育子代幼虫和稚贝。以等鞭金藻Isochrysis galbana和小球藻Chlorella vulgaris为主要饵料,连续充气,每两天全量换水一次。幼虫培育密度为8~10个/mL,稚贝培育密度为2~4个/mL。60 d后将稚贝收集到60目网袋中在室内水泥池中吊养。
1.2.3 指标测定 幼虫和壳长小于3.0 mm的稚贝,使用显微镜目微尺测量大小;壳长大于3.0 mm的稚贝,使用游标卡尺测量大小。每次测量设3个重复,每个重复随机测量30个个体。幼虫存活率为单位体积存活的幼虫数占最初孵化出D形幼虫数的百分比;稚贝存活率为不同日龄存活稚贝的数量占变态稚贝数量的百分比。
1.2.4 杂种优势的计算 按照Cruz等[17]的方法,杂种优势的计算公式为
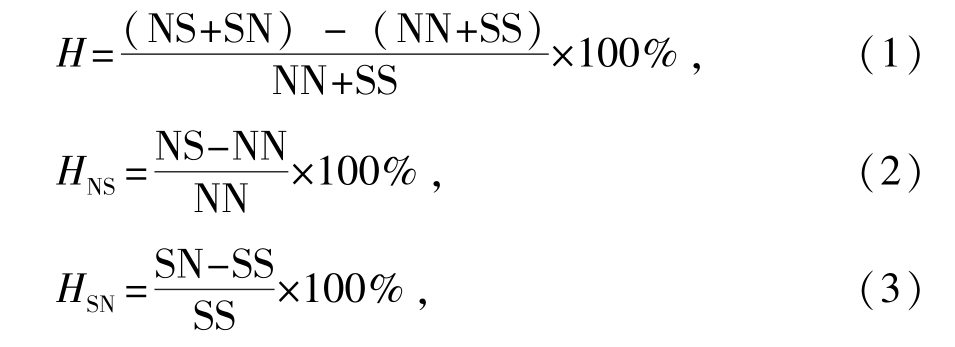
式中:H表示双亲杂种优势;HNS、HSN表示双列杂交中正、反交组的单亲杂种优势;NN、NS、SN、SS分别表示4个试验组的F1在同一日龄时的表型值(生长、存活)。
1.3 数据处理
试验数据用平均值±标准差表示,用 SPSS 17.0进行单因素方差分析,用Duncan法进行多重比较。差异显著性水平设为0.05。
2.1 幼虫的生长、存活及杂种优势
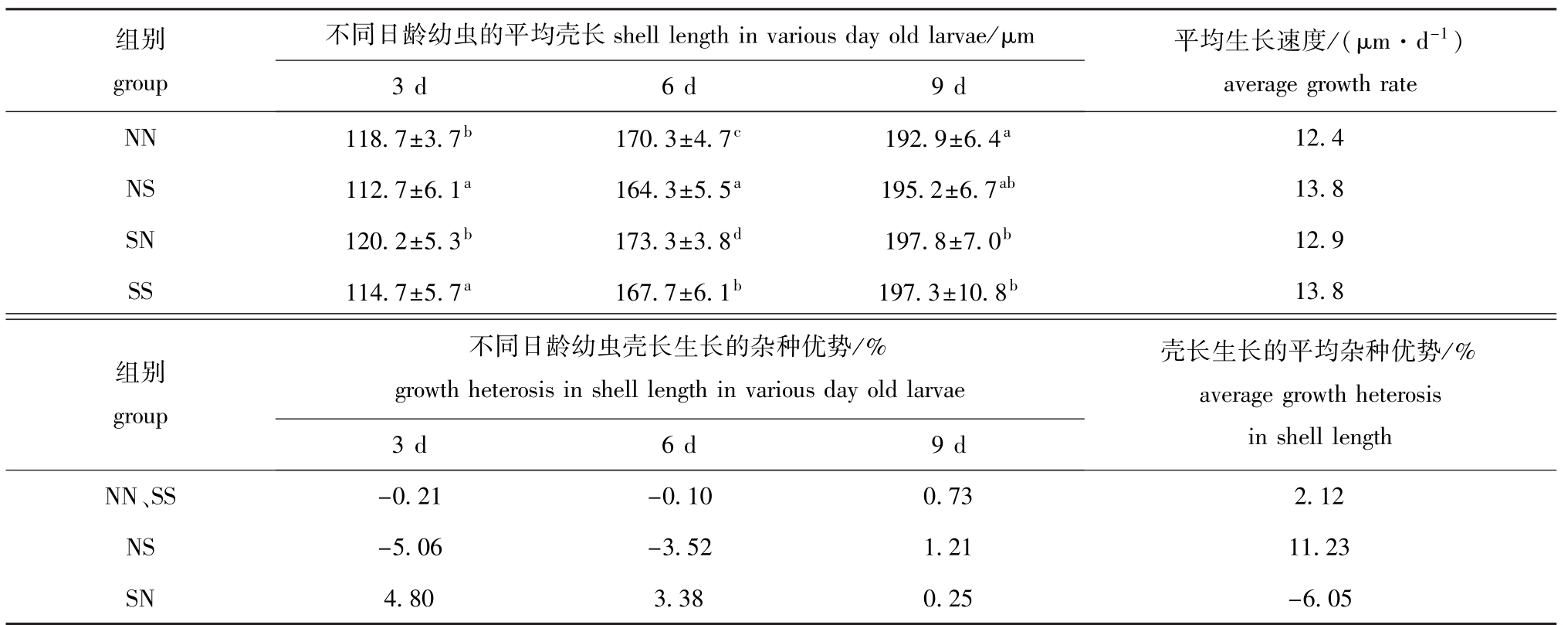
2.1.1 生长和杂种优势 NN、NS、SN、SS组幼虫在3、6、9日龄的平均壳长、生长速度和杂种优势见表1。从表1可见:3日龄时,NN组和SN组幼虫的平均壳长明显大于 NS组和 SS组(P<0.05);6日龄时,4个试验组间幼虫的平均壳长均有显著性差异(P<0.05),大小顺序为SN>NN>SS>NS;9日龄时,SN组和SS组幼虫的平均壳长最大,且两组间无显著性差异(P>0.05),但均与NN组有显著性差异(P<0.05),与NS组无显著性差异(P>0.05)。从生长速度上看,NS组幼虫具有生长优势,其壳长生长杂种优势平均值为11.23%;与此相反,SN组表现出生长劣势,其壳长生长杂种优势平均值为-6.05%;总体上,杂交组较自交组(2.12%)具有生长优势。
表1 试验组各日龄幼虫的平均壳长和杂种优势
Tab.1 The average shell length and growth heterosis in various day old larvae for each experimental group
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with the different letters within the same column are significant differences at the 0.05 probability level,and the means with the same letters within the same column are not significant differences,et sequentia.
组别group不同日龄幼虫的平均壳长shell length in various day old larvae/μm 平均生长速度/(μm·d-1) average growth rate NN 118.7±3.7b170.3±4.7c192.9±6.4a3 d 6 d 9 d 12.4 NS 112.7±6.1a164.3±5.5a195.2±6.7ab13.8 SN 120.2±5.3b173.3±3.8d197.8±7.0b12.9 SS 114.7±5.7a167.7±6.1b197.3±10.8b13.8不同日龄幼虫壳长生长的杂种优势/% growth heterosis in shell length in various day old larvae壳长生长的平均杂种优势/% average growth heterosis组别group in shell length NN、3 d 6 d 9 d SS -0.21 -0.10 0.73 2.12 NS -5.06 -3.52 1.21 11.23 SN 4.80 3.38 0.25 -6.05
2.1.2 存活率和杂种优势 NN、NS、SN、SS组幼虫在3、6、9日龄的平均存活率及存活优势见表2。从表2可见:3日龄时,SN组幼虫的存活率最低(51.66%),明显小于 NN组和 NS组(P<0.05),NN组幼虫的存活率最高(71.33%),明显大于SN组和SS组(P<0.05);6日龄时,4个试验组幼虫的存活率均有显著性差异(P<0.05),且从大到小依次为NN>NS>SS>SN;9日龄时,NN组和NS组幼虫的存活率明显大于SN组和SS组(P<0.05),SS组幼虫的存活率明显大于 SN组(P<0.05)。从存活优势上看,9日龄时NS、SN组未表现出杂种存活优势。但总体而言,NN组和NS组幼虫的存活率大于SN组和SS组。
表2 各试验组幼虫的存活率和杂种优势
Tab.2 Larval survival rate and survival heterosis for each experimental group
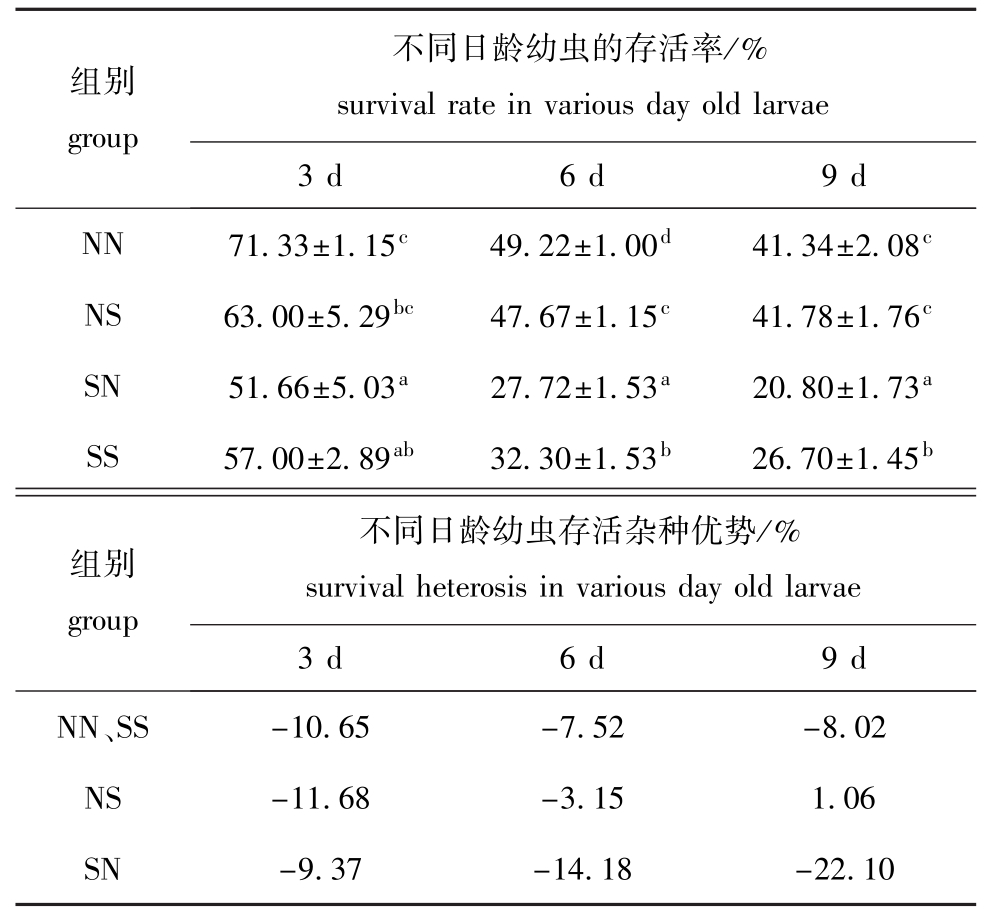
不同日龄幼虫的存活率/%组别group survival rate in various day old larvae 3 d 6 d 9 d NN 71.33±1.15c49.22±1.00d41.34±2.08cNS 63.00±5.29bc47.67±1.15c41.78±1.76cSN 51.66±5.03a27.72±1.53a20.80±1.73aSS 57.00±2.89ab32.30±1.53b26.70±1.45b组别group不同日龄幼虫存活杂种优势/% survival heterosis in various day old larvae 3 d 6 d 9 d NN、SS -10.65 -7.52 -8.02 NS -11.68 -3.15 1.06 SN -9.37 -14.18 -22.10
在幼虫阶段,NS组和SN组的生长和存活优势表现出明显的正负不对称性。
2.2 稚贝的生长、存活及杂种优势
2.2.1 生长和杂种优势 各试验组稚贝的平均壳长、生长速度以及杂种优势见表3。从表3可见: 30日龄时,NN组和NS组稚贝的平均壳长大于SN组和SS组(P<0.05);60日龄时,4个组稚贝的平均壳长均有显著性差异(P<0.05),从大到小依次为NN>NS>SN>SS;90日龄时,NS组稚贝的平均壳长明显大于其他3组(P<0.05),SN组稚贝的壳长明显大于NN组和SS组(P<0.05),NN组和SS组无显著性差异(P>0.05)。从生长速度上看,NS组和SN组均表现出生长优势,其壳长生长杂种优势平均值分别为24.89%、15.12%,自交组壳长生长杂种优势平均值为19.93%。
2.2.2 存活率和杂种优势 各试验组稚贝的存活率及存活优势见表4。从表4可见:30日龄时, NN组和NS组稚贝存活率明显高于SN组和SS组(P<0.05);60、90日龄时,NS组稚贝存活率均明显高于其他3组(P<0.05),NN组稚贝存活率也明显高于SN组和SS组(P<0.05),而SN组和SS组无显著性差异(P>0.05)。从存活优势上看, 90日龄时NS组稚贝表现出单亲存活优势,其杂种优势平均值为5.72%,SN组也表现出微弱的单亲存活优势,其杂种优势平均值为0.24%。总体来看,杂交组较自交组(3.04%)具有存活优势。
在稚贝阶段,NS组和SN组的生长速度和存活率虽然较NN组和SS组具有杂种优势,但杂种优势平均值的大小表现出明显的不对称性。
表3 各试验组稚贝的平均壳长和杂种优势
Tab.3 The average shell length and growth heterosis in the juvenile Manila clam for each experimental group
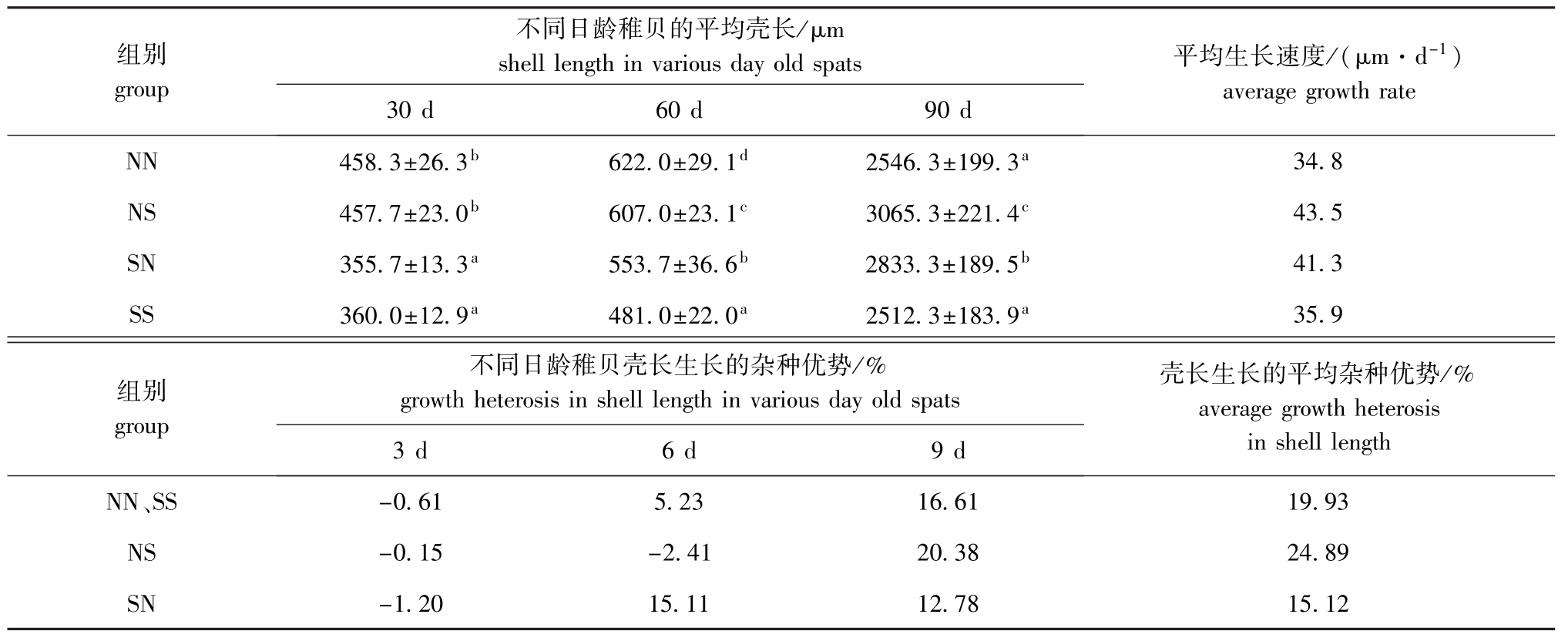
不同日龄稚贝的平均壳长/μm组别group shell length in various day old spats 平均生长速度/(μm·d-1) 30 d 60 d 90 d average growth rate NN 458.3±26.3b622.0±29.1d2546.3±199.3a34.8 NS 457.7±23.0b607.0±23.1c3065.3±221.4c43.5 SN 355.7±13.3a553.7±36.6b2833.3±189.5b41.3 SS 360.0±12.9a481.0±22.0a2512.3±183.9a35.9不同日龄稚贝壳长生长的杂种优势/% growth heterosis in shell length in various day old spats壳长生长的平均杂种优势/% average growth heterosis组别group in shell length NN、3 d 6 d 9 d SS -0.61 5.23 16.61 19.93 NS -0.15 -2.41 20.38 24.89 SN -1.20 15.11 12.78 15.12
表4 各试验组稚贝的存活率和杂种优势
Tab.4 The survival rate and survival heterosis in juvenile clam for each experimental group
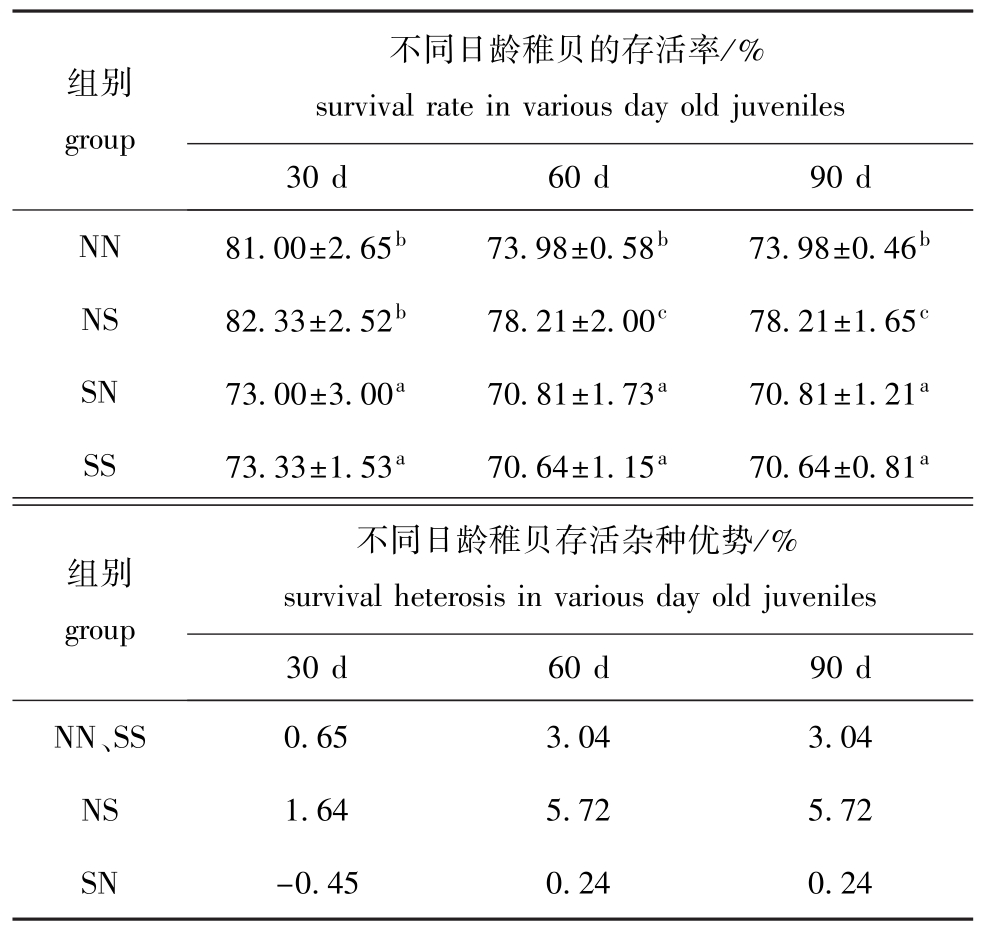
不同日龄稚贝的存活率/%组别groupsurvival rate in various day old juveniles 30 d 60 d 90 d NN 81.00±2.65b73.98±0.58b73.98±0.46bNS 82.33±2.52b78.21±2.00c78.21±1.65cSN 73.00±3.00a70.81±1.73a70.81±1.21aSS 73.33±1.53a70.64±1.15a70.64±0.81a组别group不同日龄稚贝存活杂种优势/% survival heterosis in various day old juveniles 30 d 60 d 90 d NN、SS 0.65 3.04 3.04 NS 1.64 5.72 5.72 SN -0.45 0.24 0.24
杂交是动植物育种的重要方法之一。贝类杂交育种研究在长牡蛎[6]、皱纹盘鲍[18]和栉孔扇贝[19]中开展得较多。相比之下,有关蛤仔杂交的研究较少,起步也较晚,且主要集中在蛤仔不同壳色品系和不同壳型的杂交上,尚未见关于不同地理群体间杂交的报道。蛤仔是世界性分布的双壳贝类,由于长期的地理隔离,造成基因型的分化,形成了不同的地理群体。闫喜武等[20]对蛤仔莆田群体与大连群体的生物学进行了比较,发现两个蛤仔群体在壳型、生物学零度、繁殖期、产卵量、卵径、D型幼虫大小、变态时间、生长速度等方面均存在明显差异。本研究结果显示:无论是在幼虫期、稚贝期还是在养成阶段,S群体自交组壳长均小于N群体自交组,造成这种差异的根本原因是两群体在遗传上的差异;正交组NS的生长性状在幼虫期和稚贝期获得显著杂种优势,反交组SN的生长性状在稚贝期获得显著生长优势。本研究中,自交组和杂交组的受精率都很高,在胚胎发育时间上也基本一致,证明了蛤仔南北方群体杂交并不存在授精时配子间不亲和以及胚胎发育障碍等问题。
按照性状表现类型,杂种优势表现为存活优势与生长优势;按照亲本类型,杂种优势表现为双亲杂种优势与单亲杂种优势。本研究结果与郑怀平等[7]对海湾扇贝和闫喜武等[21]对蛤仔的同类研究结果相似。杂种优势具有明显的正负不对称性或大小不对称性,这种不对称现象在杂交育种中是广泛存在的。本试验中,正交组合NS获得的杂种优势比反交组合SN大(稚贝期尤为明显),笔者认为,出现这种现象的原因可能是多方面的。首先,有研究表明,贝类群体杂合度与其生长和适合度呈正相关[22]。本试验中,蛤仔N群体来自于大连石河镇,由于经过很多代群体内自繁,基因多样性较差,与S群体相比,N群体的杂合度低,杂交使其杂合度得到了更大的提高,因此,N群体获得了更好的杂交改良效果。其次,由于本试验在北方进行,试验水温比南方同期海水温度低,与S群体相比,N群体更为适应较低的水温条件。这可能是造成正交组合NS比反交组合SN生长速度快的原因之一。
参考文献:
[1] 闫喜武,张跃环,霍忠明,等.不同壳色菲律宾蛤仔品系间的双列杂交[J].水产学报,2008,32(6):864-875.
[2] 张跃环,闫喜武,霍忠明,等.不同地理群体菲律宾蛤仔生长发育的比较[J].大连水产学院学报,2009,24(1):34-39.
[3] 闫喜武.菲律宾蛤仔养殖生物学、养殖技术和品种选育[D].青岛:中国科学院海洋研究所,2005.
[4] 吴仲庆.水产生物遗传育种学[M].3版.厦门:厦门大学出版社,2000.
[5] 楼允东.鱼类育种学[M].北京:中国农业出版社,1999.
[6] 孔静,王昭萍,刘剑,等.长牡蛎中国群体和美国群体杂交效应与三倍体的优势[J].水产学报,2011,35(5):676-681.
[7] 郑怀平,张国范,刘晓,等.海湾扇贝杂交家系与自交家系生长和存活的比较[J].水产学报,2004,28(3):267-272.
[8] Wang Chunde,Li Zhaoxia.Improvement in production traits by mass spawning type crossbreeding in bay scallops[J].Aquaculture,2010,299:51-56.
[9] 刘小林,常亚青,相建海,等.栉孔扇贝不同种群杂交效果的初步研究[J].海洋学报,2003,25(1):93-99.
[10] Miguel A,Rio-Portilla D,Andy R B.Larval growth,juvenile size and heterozygosity in laboratory reared mussels,Mytilus edulis[J]. J Exp Marine Biol Ecol,2000,254:1-17.
[11] 王爱民,阎冰,叶力,等.马氏珠母贝不同地理种群内自繁和种群间杂交子一代主要性状的比较[J].水产学报,2003,27(3):201-206.
[12] 游伟伟,柯才焕,蔡明夷,等.杂色鲍日本群体与台湾群体杂交的初步研究[J].厦门大学学报:自然科学版,2005,44(5): 701-705.
[13] 张跃环,闫喜武,姚托,等.菲律宾蛤仔2个壳色品系群体杂交的研究[J].南方水产,2008,4(3):27-32.
[14] 丁鉴锋,杨霏,闫喜武,等.不同壳色菲律宾蛤仔免疫机能的比较研究[J].大连海洋大学学报,2012,27(5):411-416.
[15] 闫喜武,赵生旭,张澎,等.培育密度及饵料种类对大竹蛏幼虫生长、存活及变态的影响[J].大连海洋大学学报,2010,25(5):386-391.
[16] 闫喜武,王琦,赵越,等.中国蛤蜊人工育苗技术的初步研究[J].大连海洋大学学报,2010,25(1):41-44.
[17] Cruz P,Ibarra A M.Larval growth and survival of two catarina scallop(Argopecten circularis,Sowerby,1835)populations and their reciprocal crosses[J].Journal of Experimental Marine Biology and Ecology,1997,212:95-110.
[18] 张国范,王继红,赵洪恩,等.皱纹盘鲍中国群体和日本群体的自交与杂交F1的RAPD标记[J].海洋与湖沼,2002,33(5):484-491.
[19] 李红蕾,宋林生,刘保忠,等.栉孔扇贝不同种群的遗传结构及其杂种优势[J].海洋与湖沼,2002,33(2):188-195.
[20] 闫喜武,张国范,杨凤,等.菲律宾蛤仔莆田群体与大连群体生物学比较[J].生态学报,2005,25(12):3329-3334.
[21] 闫喜武,张跃环,孙焕强,等.菲律宾蛤仔两道红与白斑马品系的三元杂交[J].水产学报,2010,34(8):1190-1197.
[22] English L J,Maguire G B,Ward R D.Genetic variation of wild and hatchery populations of the Pacific oyster,Crassostrea gigas(Thunberg),in Australia[J].Aquaculture,2000,187:283-298.
Early growth and development of hybrid Manila clam Ruditapes philippinarum cultured in north and south China
Abstract:Broodstocks of Manila clam Ruditapes philippinarum were induced to spawn and crossed within and between southern Chinese(S)Putian and northern Chinese Dalian(N)populations to produce four F1hybrids including NN(N♀×N♂),SS(S♀×S♂),NS(N♀×S♂)and SN(S♀×N♂).The growth and survival of the F1hybrids were compared in the larva and juvenile Manila clam to elucidate cross effects.The results showed that the single-parental heterosis was found to be asymmetrical in growth between two reciprocal crosses,the good growth in NS group.The growth heterosis was found to be 2.12%in mid-parental larvae and juveniles,and to be 11.23%in single-parental NS,and to be-6.05%for SN at larvae stage,indicating that the crossbreeding between NS populations led to heterosis while the cross between SN showed hybrid weakness.In the juveniles,however,growth heterosis was observed in both the crossbreeding between NS populations and SN populations,19.93%for the mid-parental heterosis,and 24.89%for NS,and 15.12%for SN in the single-parental heterosis.No heterosis was detected among the 4 groups in survival.It is concluded that the heterosis between population N and population S may lay fundament of genetic improvement.
Key words:Ruditapes philippinarum;population;cross;heterosis
中图分类号:S917.4
文献标志码:A
收稿日期:2012-04-18
基金项目:国家现代农业产业技术体系建设专项经费资助项目(CARS-48)
文章编号:2095-1388(2013)01-0039-05