盐度对刺参碳、氮收支影响的初步研究
孟雷明1、2,王丽丽1,雷艳1、2,姚翔1,李燕2,李莉3
(1.国家海洋环境监测中心,辽宁大连116023;2.大连海洋大学水产与生命学院,辽宁大连116023;3.国家海洋局秦皇岛海洋环境监测中心站,河北秦皇岛066002)
摘要:在温度为(15.0±0.5)℃条件下研究了不同盐度(22.0、27.0、31.5、36.0)对刺参Apostichopus japonicus生长和碳、氮收支的影响,建立了不同盐度下刺参的碳、氮收支方程。试验刺参体质量为(37.53± 1.84)g,将刺参放于品字形循环水槽(40 cm×30 cm×30 cm,水体约为35 L)中饲养,试验共进行28 d。结果表明:盐度为31.5的试验组刺参特定生长率(SGR)显著高于其他各组(P<0.05),达到了1.6%/d;不同盐度下刺参对碳、氮的摄食率分别为72.32~127.85 mg/(g·d)和6.59~11.65 mg/(g·d),盐度为31.5时刺参对碳、氮的摄食率最大,盐度升高或降低均导致刺参对碳、氮的摄食率降低;刺参摄食饲料中的碳后,通过粪便排出的碳达到了61.3% ~74.4%,其次是呼吸消耗碳(21.7%~34.9%),用于生长的碳最少(3.8%~4.7%);刺参摄取的氮主要消耗在粪便中(56.6% ~64.7%),其次是代谢消耗氮(27.0%~32.6%),用于生长的氮最少(7.4%~10.8%)。通过刺参的特定生长率和盐度对其碳、氮收支的影响可以看出,刺参生长的最适宜盐度为27.0~31.5,盐度的升高或降低均会导致刺参的生长减慢。
关键词:盐度;刺参;生长;碳、氮收支
碳、氮是构成细胞的主要元素,而且碳与氮含量的比值也相对较为稳定,因此,用碳、氮描述次级生产者的生长,将生产力建立在碳源和氮源基础上更具有意义。盐度是影响刺参生理生态学最重要的环境因子之一,可以显著影响其碳、氮收支,主要表现为生长、代谢、排粪等各生理过程中碳和氮分配比例的变化[1]。盐度影响刺参碳、氮收支最直接的表观特征就是其生长性状的变化,所以研究盐度对刺参 Apostichopus japonicus碳、氮收支的影响具有重要的理论和实用意义。
适宜的海水盐度是刺参健康、快速生长的重要条件,一般来说,成参的适盐范围为18~39,适宜生长盐度为20~39[2]。作为刺参养殖的主要方式,池塘养殖刺参要经受结冰、化冰、降雨等引起的水环境盐度的剧烈变化。例如,大连地区刺参养殖池塘的盐度在夏季时为25,到春季和冬季则高达36[3]。盐度的变化必然会给刺参带来胁迫反应,引起其碳、氮收支的变化,进而影响其生长,甚至带来严重的病害[3-4]。目前,已有关于刺参对盐度的耐受性以及盐度对刺参呼吸排泄、能量收支影响等方面的研究报道[2-4],但尚未见关于盐度对刺参碳、氮收支影响方面的报道。为此,本研究中作者进行了不同盐度下刺参的生长及碳、氮收支的研究,以期为刺参养殖中的合理管理提供指导。
1 材料与方法
1.1 材料
试验用刺参采捕于大连登沙河围堰养殖区,采捕时水温为12℃,盐度为30。采捕的刺参置于加冰的保温箱中带回实验室。
试验饲料由贝类生物沉积物和海藻粉配制而成,其中贝类生物沉积物采自长海县广鹿岛海域的虾夷扇贝养殖浮筏,采用人工刷洗虾夷扇贝网笼的方法获取,采集的沉积物现场经1 mm的铁网过滤,除去碎贝壳等杂物,带回国家海洋局近岸海域生态环境重点实验室后,于65℃下烘干保存;海藻粉购自辽宁省海洋水产科学研究院,主要成分是海带Laminaria japonica和鼠尾藻Sargassum sp.。将贝类生物沉积物与海藻粉按3∶1混合,加少量蒸馏水混匀,然后用搅肉机搅拌制成直径为3.64 mm、长为5~20 mm的颗粒状,在65℃下烘干至恒重(约36 h),于4℃下贮存。饲料中C含量为9.11%,N含量为0.83%。
1.2 方法
1.2.1 刺参驯化 将采捕的刺参在PVC水槽中驯化7 d,驯化期间,饱足投喂配制饲料。
1.2.2 试验设计 试验设置22.0、27.0、31.5、36.0盐度处理组,每组设3个重复,每个重复放3头刺参。试验海水由盐度为31.5的沙滤海水与充分曝晒逸散余氯后的自来水或海盐调配而成,用光学折射盐度计(成都成华光学仪器厂生产)测定与校对其盐度。在试验开始前,每组每日升高(或降低)盐度为1,分别将刺参驯化至试验盐度并暂养7 d。驯化结束后,刺参禁食48 h,称量体质量为(37.53±1.84)g。将刺参放于品字形循环水槽(40 cm×30 cm×30 cm,水体约为35 L)中饲养,该水槽为循环流水,可保持水温为(15.0± 0.5)℃。试验期间,pH为7.8~8.2,光照周期为13L∶11D,光照强度恒定为342 lx。每天换水1/3,换水时试验海水经100目筛绢过滤。水槽内不间断充气,使溶解氧保持在5.0 mg/L以上。
1.2.3 试验管理及样品的测定 挑选规格相近的刺参用于正式试验,同时随机选取5组刺参样品,每组3头,在65℃条件下烘干至恒重,并计算干湿比。试验过程中,刺参每天投喂一次(16:30), 23~24 h后用虹吸法吸出残饵,刺参粪便也用虹吸法分别于8:00和16:00吸出,残饵和粪便于65℃条件下分别烘干至恒重。试验持续进行28 d,试验结束后将刺参饥饿48 h,称重获得湿质量,然后在65℃条件下烘干至恒重获得干质量。同一个水族箱中的刺参作为一个样品,分析其碳、氮含量。利用Perkin-Elmer 240C元素分析仪(Perkin-Elmer Company,USA)测定饲料、刺参粪便和刺参样品中的碳、氮含量。
1.2.4 指标计算
1)特定生长率(SGR)。
SGR(%/d)=100×(ln Wf-ln W0)/t,
其中:Wf和W0分别为试验终末和初始时刺参的湿体质量(g);t为试验时间(d)。
2)碳、氮收支模型的建立。
试验期间刺参的平均干质量(g)=[初始参体湿质量(g)×干湿比+终末参体干质量(g)]/2。
根据测定的饲料、粪便、刺参体内的碳和氮含量,以及刺参的摄食量、排粪量、刺参干质量分别计算以下参数:
(1)摄食碳、氮(CC、CN)=摄食量(g)×饲料中碳、氮含量(%)/[刺参的平均干质量(g)×试验时间(d)];
(2)生长碳、氮(GC、GN)=[初始参体干质量(g)×初始参体碳、氮含量(%)-终末参体干质量(g)×终末参体碳、氮含量(%)]/[刺参的平均干质量(g)×试验时间(d)];
(3)粪便碳、氮(FC、FN)=粪便量(g)×粪便中碳、氮含量(%)/[刺参的平均干质量(g)×试验时间(d)]。
(4)根据物质的能量收支方程分别计算呼吸代谢碳(RC)和代谢氮(EN),即
RC=CC-FC-GC,EN=CN-FN-GN。
1.3 数据处理
试验数据用平均值±标准误表示。采用 SPSS 17.0软件对试验数据进行单因素方差分析(oneway ANOVA),用Duncan氏法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
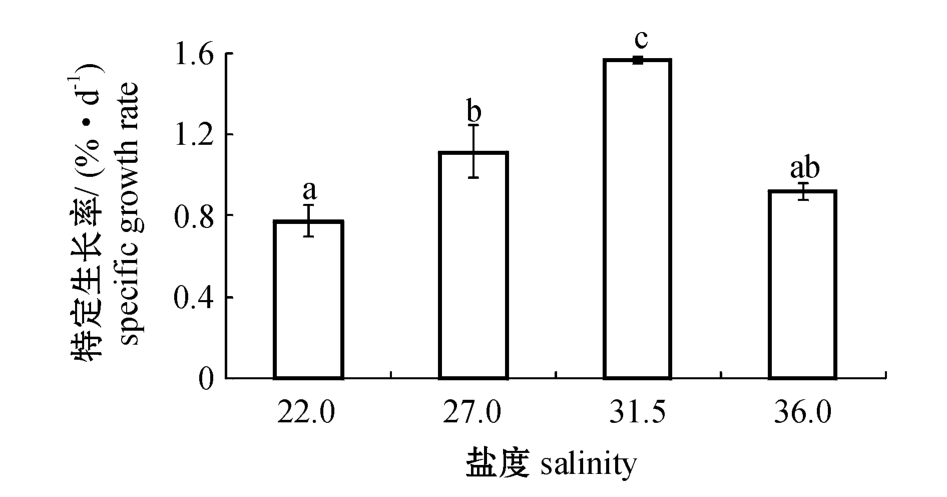
2.1 刺参的生长
试验开始时,各试验组刺参的初始体质量无显著性差异(P>0.05),试验结束时各试验组刺参的特定生长率有显著性差异(P<0.05)。从图1可见:刺参的特定生长率随盐度的升高呈先升高后降低的趋势,其中盐度为31.5的试验组刺参SGR显著高于其他组(P<0.05),达到了1.6%/d;盐度为27.0的试验组显著高于盐度为22.0的试验组(P<0.05),其余组间均无显著性差异(P>0.05)。
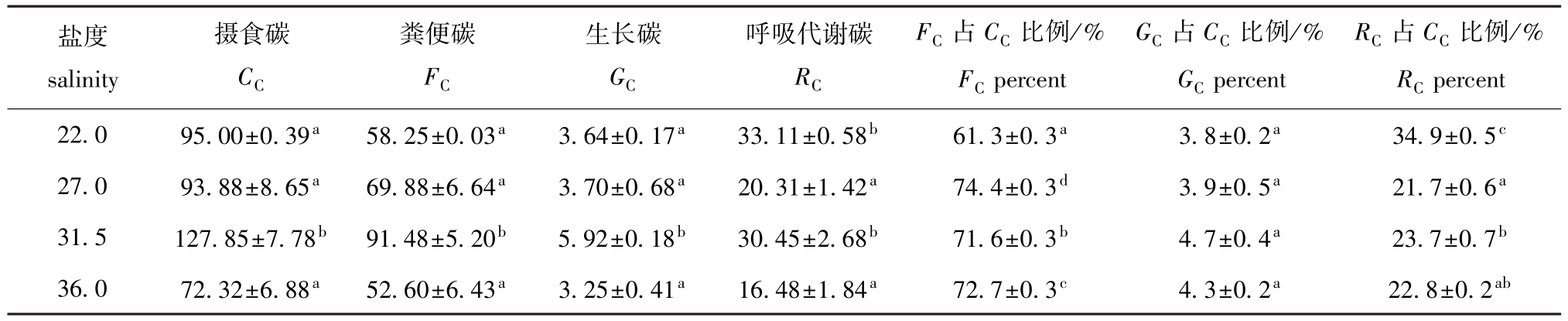
2.2 刺参的碳收支
从表1可见:随着盐度的升高,摄食碳和呼吸代谢碳呈先降低后升高再降低的趋势,粪便碳和生长碳呈先增加后降低的趋势。刺参的摄食碳、粪便碳和生长碳均在盐度为31.5时最高,且显著高于其他各组(P<0.05),呼吸代谢碳在盐度为22.0和31.5时较高,显著高于其他各组(P<0.05),其余组间均无显著性差异(P>0.05);而摄食碳、生长碳、呼吸代谢碳和粪便碳均在盐度为36.0时最低。
从表1可见:不同盐度下刺参摄食饲料中的碳后,粪便碳占摄食碳的比例最高(61.3% ~74.4%),呼吸代谢碳占摄食碳的比例次之(21.7% ~34.9%),而用于生长的碳最少(3.8%~4.7%)。多重比较结果表明:粪便碳占摄食碳的比例在盐度为27.0时最高,且各组间有显著性差异(P<0.05);呼吸代谢碳占摄食碳的比例在盐度为22.0时最高,且显著高于其他各组(P<0.05);生长碳占摄食碳的比例在盐度为31.5时最高,但各组间均无显著性差异(P>0.05)。
各试验盐度下,刺参的碳收支方程分别为
盐度为22.0时,100CC=61.3FC+3.8GC+34.9RC;
盐度为27.0时,100CC=74.4FC+3.9GC+21.7RC;
盐度为31.5时,100CC=71.6FC+4.7GC+23.7RC;
盐度为36.0时,100CC=72.7FC+4.3GC+22.8RC。
表1 各盐度下刺参的碳收支参数以及对碳的转化效率和代谢效率(n=3)
Tab.1 Carbon parameters and carbon allocation into different physio-ecological process in sea cucumber Apostichopus japonicus under four salinities(n=3)
mg/(g·d)
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with the different letters within the same column are significant differences at the 0.05 probability level,and the means with the same letters within the same column are not significant differences,et sequentia.
盐度salinity percent 22.0 95.00±0.39a58.25±0.03a3.64±0.17a33.11±0.58b61.3±0.3a3.8±0.2a34.9±0.5摄食碳CC粪便碳FC生长碳GC呼吸代谢碳RC FC占CC比例/% FCpercent GC占CC比例/% GCpercent RC占CC比例/% RC c 27.0 93.88±8.65a69.88±6.64a3.70±0.68a20.31±1.42a74.4±0.3d3.9±0.5a21.7±0.6a31.5 127.85±7.78b91.48±5.20b5.92±0.18b30.45±2.68b71.6±0.3b4.7±0.4a23.7±0.7b36.0 72.32±6.88a52.60±6.43a3.25±0.41a16.48±1.84a72.7±0.3c4.3±0.2a22.8±0.2ab
2.3 刺参的氮收支
从表2可见:随着盐度的升高,粪便氮和生长氮呈先升高后降低的趋势,摄食氮和代谢氮则呈先降低后升高再降低的趋势。刺参的摄食氮、粪便氮、生长氮和代谢氮均在盐度为31.5时最高,均显著高于其他各组(除盐度为22.0的代谢氮外)(P<0.05);摄食氮、粪便氮和代谢氮均在盐度为36.0时最低,生长氮在盐度为22.0时最低。
从表2可见:刺参摄食饲料中的氮后,大部分(56.6%~64.7%)分配在粪便氮中,代谢氮占摄食氮的比例次之(27.0% ~32.6%),生长氮占摄食氮的比例最少(7.4% ~10.8%)。多重比较结果表明:粪便氮占摄食氮的比例在盐度为27.0时最高,且各组间有显著性差异(P<0.05);代谢氮占摄食氮的比例在盐度为22.0和36.0时较高,显著高于其他各组(P<0.05);生长氮占摄食氮的比例在盐度为36.0时最高,但各组间无显著性差异(P>0.05)。
表2 各盐度下刺参的氮收支参数以及对氮的转化效率和代谢效率(n=3)
Tab.2 Nitrogen parameters and nitrogen allocation into different physio-ecological process in sea cucumber Apostichopus japonicus under four salinities(n=3) mg/(g·d)
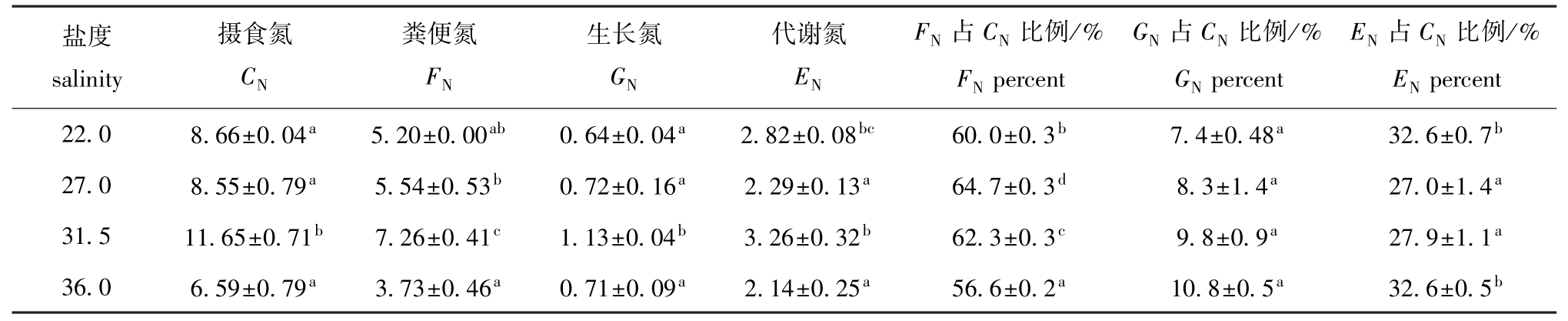
盐度salinity percent 22.0 8.66±0.04a5.20±0.00ab0.64±0.04a2.82±0.08bc60.0±0.3b7.4±0.48a32.6±0.7摄食氮CN粪便氮FN生长氮GN代谢氮EN FN占CN比例/% FNpercent GN占CN比例/% GNpercent EN占CN比例/% EN b 27.0 8.55±0.79a5.54±0.53b0.72±0.16a2.29±0.13a64.7±0.3d8.3±1.4a27.0±1.4a31.5 11.65±0.71b7.26±0.41c1.13±0.04b3.26±0.32b62.3±0.3c9.8±0.9a27.9±1.1a36.0 6.59±0.79a3.73±0.46a0.71±0.09a2.14±0.25a56.6±0.2a10.8±0.5a32.6±0.5b
各试验盐度下,刺参的氮收支方程分别为
盐度为22.0时,100CN=60.0FN+7.4GN+32.6EN;
盐度为27.0时,100CN=64.7FN+8.3GN+27.0EN;
盐度为31.5时,100CN=62.3FN+9.8GN+27.9EN;
盐度为36.0时,100CN=56.6FN+10.8GN+32.6EN。
3 讨论
3.1 盐度对刺参生长的影响
棘皮动物中很多种类可以通过体腔液调节和等渗细胞调节来适应盐度的大幅度变化[5],刺参也具有这种调节机制,其适宜盐度为18~39[2]。本试验中设置的盐度梯度均在刺参的耐受盐度范围内。当水生生物体液和外界水体两者的渗透压相等时,水体的盐度即为等渗点[4,6-7]。刺参摄食量和特定生长率的变化也可以反映刺参对盐度的适宜程度,从本试验结果来看,盐度为31.5的试验组刺参对碳、氮的摄食率最高,刺参的特定生长率也显著高于其他各组,这说明试验期间自然海水(盐度31.5)与其他试验盐度相比最接近刺参的等渗点。刺参通过调节渗透压来适应外界盐度是一个消耗自身物质和能量的生理过程,刺参处于等渗点时用于渗透压调节的物质和能量最少,特定生长率最高,生长则较快[8]。盐度为22.0的试验组刺参的特定生长率最低,而代谢碳、氮相对较高,过高的代谢碳、氮主要用在了调节体液渗透压适应外界盐度上。因此,盐度为22.0的试验组刺参虽然具有较高的碳、氮摄食率,但不能转换为刺参体质量的显著增加[9-10]。
3.2 盐度对刺参碳收支的影响
当刺参处在最适盐度时体内外的渗透压处于平衡状态,不需要过多的物质和能量来保持体内的环境稳定,刺参摄食的物质和能量分配到生长中的比例增大[3,11]。本试验中,盐度为31.5的试验组刺参的生长碳最多(5.92 mg/(g·d)),所占摄食碳的比例也是最大(4.7%),但在其他盐度下刺参的生长碳比例逐渐减小,可见刺参对碳的分配也符合上述规律。由表1可以看出,盐度为22.0的试验组,刺参摄食碳的量大于盐度为27.0的试验组,其呼吸代谢碳的量最大(33.11 mg/(g·d)),占摄食碳的比例也最大(34.9%),粪便碳占摄食碳的比例显著小于其他组,这说明盐度为22.0的试验组刺参为了对抗外界很低的渗透压必须依靠增大摄食碳的量,同时减少粪便碳和生长碳的分配比例来满足呼吸代谢对碳的消耗,以此维持其在低盐度下对物质和能量的需求[9]。中国对虾在盐度适宜时生长碳占摄食碳的比例为25.84%[10],三疣梭子蟹幼蟹在温度适宜时生长碳占摄食碳的比例为34.5%[11],且中国对虾和三疣梭子蟹幼蟹在受到盐度、温度等环境胁迫时会出现摄食碳升高、代谢碳比例升高、生长碳比例下降的现象[1,10-11]。从本试验结果看,刺参亦具有此类调节机制。
3.3 盐度对刺参氮收支的影响
棘皮动物氮的排泄与其渗透压调节过程有着密切的关系,棘皮动物可以通过游离氨基酸的分解或者合成来调节体内的渗透压[12]。低盐度胁迫下,棘皮动物氨氮排泄量的增加可能是其体内游离氨基酸分解引起的[12-13]。刺参也具有类似的调节机制,有研究发现,刺参单位质量排氨率在盐度为30以下时较低,在盐度升高到35以上或降低到23(幼参)、20(1龄)时,其单位质量的排氨率均上升[14]。袁秀堂等[4]在研究盐度对刺参呼吸和排泄的影响时发现,刺参在盐度为28~34之外时,盐度胁迫带来的渗透压调节需要体内较多的游离氨基酸分解,进而导致排氨率上升。结合本试验结果可以看出,刺参在盐度为22.0和36.0时为了适应外界的渗透压,调节了体内游离氨基酸的代谢水平,这是导致盐度为22.0和36.0时刺参代谢氮比例升高、生长氮减少的主要原因。在受到环境因素(盐度、温度等)胁迫时,鱼类和多毛类也具有和刺参相似的调节机制,即加大代谢氮的比例来适应环境胁迫,从而导致了生长氮的比例减小[15-16]。
在中国刺参养殖的主要区域——辽宁省和山东省,冬季刺参养殖池塘结冰,海水盐度会升高;初春化冰,海水盐度急剧降低[3,17]。春季池塘化冰时,对低盐适应能力较弱的刺参仍然需要调整渗透压及碳、氮收支等生理过程来适应盐度的迅速下降[8]。为了尽可能降低结冰、化冰对刺参养殖池塘盐度的影响,在冬季结冰前应大量加注新鲜海水,使池塘保持较高水位;在初春化冰时可以排掉表层低盐海水(排淡)、加注新鲜海水,同时又不会引发池塘水温的降低。有研究表明,刺参养殖池塘 “排淡”前,至少需要保持170 cm的水深[17]。采取以上措施可减轻盐度变化对池塘刺参的胁迫,使其在适宜的盐度下生长。
参考文献:
[1] 张硕,董双林,王芳.温度和体重对中国对虾碳收支的影响[J].应用生态学报,2000,11(4):615-617.
[2] 龚海滨,王耀兵,邓欢,等.仿刺参对盐度的耐受能力研究[J].水产科学,2009,28(5):284-286.
[3] Yuan X T,Yang H S,Wang L L,et al.Effect of salinity on energy budget in pond-cultured sea cucumber Apostichopus japonicus(Selenka)(Echinodermata:Holothuroidea)[J].Aquaculture, 2010,306:348-351.
[4] 袁秀堂,杨红生,周毅,等.盐度对刺参(Apostichopus japonicus)呼吸和排泄的影响[J].海洋与湖沼,2006,37(4):348-354.
[5] Talbot T D,Lawrence J M.The effect of salinity on respiration,excretion,regeneration and production in Ophiophragmus filograneus(Echinodermata:Ophiuroidea)[J].Journal of Experimental Marine Biology and Ecology,2002,275:1-14.
[6] 隋延鸣,高保全,刘萍,等.三疣梭子蟹“黄选1号”盐度耐受性及适宜生长盐度分析[J].大连海洋大学学报,2012,27(5): 398-401.
[7] 刘海映,王冬雪,姜玉声,等.盐度对口虾蛄假溞状幼体存活和摄食的影响[J].大连海洋大学学报,2012,27(4):311-314.
[8] 陈勇,高峰,刘国山,等.温度、盐度和光照周期对刺参生长及其行为的影响[J].水产学报,2007,31(5):687-691.
[9] 王兴强,曹梅.低温和低盐对脊尾白虾生长和能量收支的影响[J].水生态学杂志,2010,3(2):66-71.
[10] 张硕,董双林,王芳.盐度和饵料对中国对虾碳收支的影响[J].水产学报,1999,23(2):144-149.
[11] 王俊,姜祖辉,陈瑞盛,等.三疣梭子蟹幼蟹的摄食和碳收支[J].海洋水产研究,2004,25(6):25-29.
[12] Lawrence J M,Lane J M.The Utilization of Nutrients by Postmetamorphic Echinoderms[M]//Echinoderm Nutrition.Rotterdam: Balkema Publishers,1982:331-371.
[13] Diehl W J.Osmoregulation in echinoderms[J].Comparative Biochemistry and Physiology,1986,84A:199-205.
[14] 薛素燕,方建光,毛玉泽,等.高温下不同盐度对刺参幼参和1龄参呼吸排泄的影响[J].中国水产科学,2006,16(6):975-980.
[15] 刘勇,线薇薇.温度对日本刺沙蚕氮生长和氮收支的影响[J].水产科学,2010,29(6):311-316.
[16] Kang K H,Kwon J Y,Kim Y M.A beneficial coculture:Charm abalone Haliotis discus Hannai and sea cucumber Stichopus japonicus[J].Aquaculture,2003,216:87-93.
[17] 于金海,冷晓飞,李春燕,等.黄海北部仿刺参养殖池塘关键环境因子的周年变化与管理研究[J].大连水产学院学报, 2009,24(6):514-519.
Effects of salinity on carbon and nitrogen budgets in sea cucumber Apostichopus japonicus
MENG Lei-ming1,2,WANG Li-li1,LEI Yan1,2,YAO Xiang1,LI Yan2,LI Li3
(1.National Marine Environmental Monitoring Center,Dalian 116023,China;2.College of Fisheries and Life Science,Dalian Ocean University, Dalian 116023,China;3.Marine Environment Monitoring Central Station of Qinghuangdao,SOA,Qinghuangdao 066002,China)
Abstract:Effects of salinity on growth,and carbon and nitrogen budgets were studied in sea cucumber Apostichopus japonicus juveniles at constant temperature of(15.0±0.5)℃.The sea cucumber with body weight of(37.53± 1.84)g were reared in a circulating aquarium(40 cm×30 cm×30 cm,about 35 L)under different salinities(22.0,27.0,31.5,and 36.0)for 28 days.The specific growth rate(SGR)was shown to be significantly higher in the sea cucumber at a salinity of 31.5(1.6%/d)than at other salinities.The sea cucumber had carbon consumption from 72.32 to 127.85 mg/(g·d)and nitrogen consumption from 6.59 to 11.65 mg/(g·d)at various salinities,the maximal nitrogen and carbon consumption at a salinity of 31.5,and the lower nitrogen and carbon consumption at enhanced or decreased salinity.The established budget showed that the fecal carbon accounted for the major component from 61.3%to 74.4%in the ingested carbon,followed by respiratory carbon(21.7%-34.9%),and(3.8%-4.7%)of carbon for growth.In the nitrogen budget,the maximal nitrogen was allotted to the feces(56.6%-64.7%),followed by the metabolic exhaustion(27.0%-31.5%),and(7.4%-10.8%)of nitrogen for growth.In conclusion,salinity from 27.0 to 32.6 is considered as the optimal salinity for Apostichopus japonicus growth,or poor growth at a salinity of above 31.5 or below 27.0.
Key words:salinity;Apostichopus japonicus;growth;carbon and nitrogen budget
中图分类号:Q178;Q958;S968
文献标志码:A
收稿日期:2012-05-01
基金项目:国家自然科学基金资助项目(30871932);海洋公益性行业科研专项(200805069);农业部暨辽宁省省级高校海洋水产增养殖学与生物技术重点开放实验室开放课题(K2006-02)
作者简介:孟雷明(1983-),男,硕士研究生。E-mail:mengleiming1002@yahoo.cn
通信作者:王丽丽(1981-),女,硕士,助理研究员。E-mail:llwang@nmemc.gov.cn
文章编号:2095-1388(2013)01-0034-05