刺参肠道潜在产酶益生菌的筛选和鉴定
杨志平1,孙飞雪2,刘志明2,张磊2,曹为2,马悦欣2
(1.大连汇新钛设备开发有限公司,辽宁大连116039;2.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
摘要:从健康刺参Apostichopus japonicus(体质量为10~30 g)肠道中分离出50株细菌,以点种法在选择培养基上对菌株产淀粉酶、蛋白酶、脂肪酶和纤维素酶的能力进行测试,筛选出产3种酶以上的细菌13株,并定量测定了其中9株菌的淀粉酶和蛋白酶活力。依据产酶能力选6株细菌进行溶血试验。结果表明: 6株菌均不产生溶血素,不具有潜在的致病性,选3株产酶细菌BC26、BC228、BC232进行毒力测试,经一个月观察证实,无论给刺参腹腔注射细胞浓度为107cfu/mL的菌悬液,还是投喂含细菌浓度为109cfu/g的干饲料,刺参都是安全的;对细菌16S rDNA序列同源性的分析表明,BC26、BC228、BC232菌株分别与芽孢杆菌Bacillus sp.FA132、假交替单胞菌Pseudoalteromonas sp.NBRC102016和塔斯马尼亚弧菌Vibrio tasmaniensis 04102的相似性均为99%。
关键词:刺参;潜在产酶益生菌;筛选;鉴定
刺参Apostichopus japonicus是中国北方地区重要的海珍品之一,具有很高的营养价值和经济价值。随着刺参养殖密度的增加以及海水污染程度的恶化,各种传染性疾病也随之出现,给刺参养殖业造成了巨大的经济损失[1-4]。传统的疾病防治方法以使用抗生素为主,容易使细菌产生抗药性[5],干扰水生动物肠道正常微生物区系[6],还可能造成水产品中药物残留,对人类健康产生不利影响。已有研究表明,从健康动物体内分离具有产酶能力的微生物是筛选益生菌的有效途径[7-8]。潜在益生菌对刺参生长、消化、免疫的影响研究已有报道[9-12]。本研究中,作者从自然海域生长的健康刺参肠道组织筛选出几株产多种水解酶的细菌,并对其进行安全性试验和初步分类鉴定,旨在为刺参益生菌制剂的研发与应用提供科学依据。
1 材料与方法
1.1 材料
试验用刺参样品于2010年5月和2010年11月分别采自大连柏岚子和黑石礁自然海域,体质量为10~30 g,共20头。
1.2 方法
1.2.1 肠道细菌分离 将从海底取回的新鲜刺参以无菌解剖法取出肠道,在低温下将组织匀浆,并与适量的无菌海水充分混匀,稀释,取适宜的稀释液0.1 mL涂布于TSA和MRS培养基上,在20℃下恒温培养2~3 d,选取形态不同的菌落经划线纯化后接种于2216E斜面上,并于4℃下保存。
1.2.2 菌株的产酶能力测定 在淀粉培养基、海水酪素琼脂培养基、脂酶(Tween80)培养基以及产纤维素酶培养基上采用点种法测定菌株的产酶能力,以水解圈直径与菌落直径之比初步判定产酶能力。使用TSB培养基对初筛菌株产酶进行定量测定,将菌株在TSB中培养24 h获得种子培养物,再将液体种子以2%的接种量接种于50 mL液体培养基中,在25℃下摇瓶(150 r/min)培养48 h,以3 000 r/min离心15 min,取上清液测定酶活力。采用淀粉-碘比色法测定淀粉酶活力,采用福林酚试剂法测定蛋白酶活力。
1.2.3 细菌溶血试验 将用TSA培养基过夜培养的待测菌株点种羊血平板,于20℃下培养24 h,根据菌落周围透明圈的形成来判断溶血素的产生。
1.2.4 安全性试验 将刺参(1~2 g)饲养在盛70 L过滤海水的100 L塑料桶中,水温约14℃,暂养2周。将80头健康的刺参随机分为8组,每组10头,其中1组刺参腹腔注射0.1 mL浓度为107cfu/mL的待测菌株菌液,1个对照组注射等量的无菌生理盐水;3组刺参每天投喂含细菌浓度为109cfu/g的干饲料,3个对照组刺参每天投喂基础饲料。饲料配方(干物质,质量分数):豆粕10%,鱼粉8%,马尾藻25%,脱胶海带粉30%,麦饭石10%,石粉16.5%,多维预混料0.5%,其营养成分:粗蛋白质16.32%,粗脂肪5.53%,粗纤维16.13%,粗灰分30.78%。试验期间每天按刺参体质量的5%投喂,每2 d换水1/2并吸底去除残饵及粪便。观察和记录一个月试验中刺参的发病和死亡情况。
1.2.5 菌株的鉴定 细菌DNA的提取方法参考文献 [13],用引物对27f/1492r[14]对提取的DNA进行PCR扩增,50 μL反应体系包含:5 μL 10×PCR Buffer,4 μL dNTPs,4 μL MgCl2(25 mmol/L),上、下游引物(10 mmol/L)各2 μL,1.25 U Taq酶,4 μL DNA模板,28.75 μL ddH2O。反应程序为:94℃下预变性4 min;94℃下变性30 s,56℃下退火30 s,72℃下延伸90 s,共进行30个循环;最后在72℃下再延伸10 min。用10 g/L琼脂糖凝胶电泳检测PCR产物,将PCR产物送天根生化科技有限公司进行测序。
2 结果
2.1 刺参肠道细菌的产酶能力
从表1可见:从取自大连柏岚子海域刺参肠道分离出的13株细菌(BC11~BC113)中,4株无产酶能力,6株产1种酶,3株产2种酶;从黑石礁海域刺参肠道分离的 37株细菌(BC21~BC237)中,8株无产酶能力,6株产1种酶,10株产2种酶,12株产3种酶,1株产4种酶。
依据酶活力定性检测结果选出其中9株菌进行酶活力测定,结果表明:淀粉酶活力为203.0~860.2 U/mL,其中BC28菌株和BC210菌株的淀粉酶活力最高;蛋白酶活力为65.9~148.7 U/mL,其中BC222和BC225菌株的蛋白酶活力最高。
2.2 细菌溶血试验
依据产酶结果选 BC26、BC222、BC225、BC228、BC232和BC234菌株进行溶血试验,结果6株菌均不产生溶血素,但 BC222、BC225和BC234菌株产生α溶血。
表1 刺参肠道菌株的产酶能力
Tab.1 Qualitative extracellular enzyme activity of the bacterial strains isolated from the gut of sea cucumber
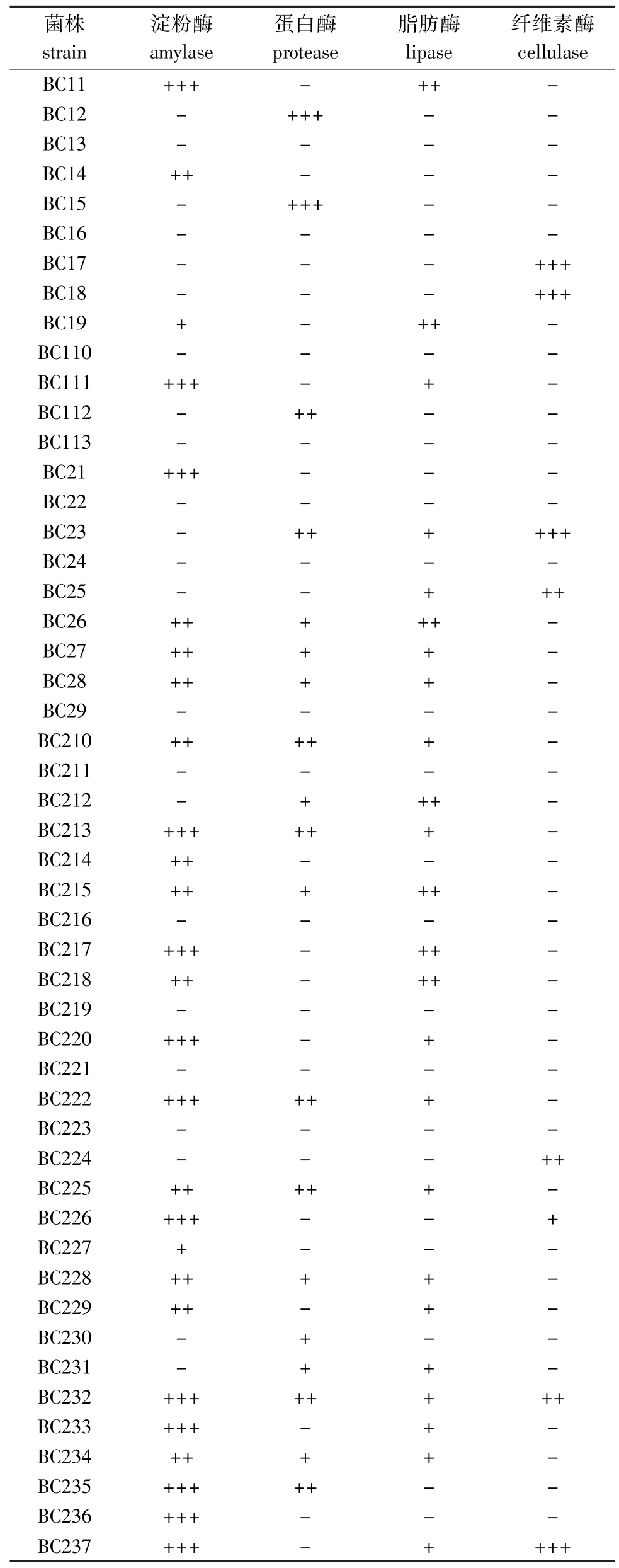
注:+++表示3≤Dh/Dc;++表示2≤Dh/Dc<3;+表示1≤Dh/Dc<2;-表示无活性。Dh为水解圈直径,Dc为菌落直径。
Note:+++indicates 3≤Dh/Dc;++indicates 2≤Dh/Dc<3;+indicates 1≤Dh/Dc<2;-indicates no activity.Dh denotes diameter of hydrolysis zone,Dc denotes colony diameter.
菌株strain淀粉酶amylase蛋白酶protease脂肪酶lipase纤维素酶cellulase BC11 +++ - ++ -BC12 - +++ - -BC13 - - - -BC14 ++ - - -BC15 - +++ - -BC16 - - - -BC17 - - - +++ BC18 - - - +++ BC19 + - ++ -BC110 - - - -BC111 +++ - + -BC112 - ++ - -BC113 - - - -BC21 +++ - - -BC22 - - - -BC23 - ++ + +++ BC24 - - - -BC25 - - + ++ BC26 ++ + ++ -BC27 ++ + + -BC28 ++ + + -BC29 - - - -BC210 ++ ++ + -BC211 - - - -BC212 - + ++ -BC213 +++ ++ + -BC214 ++ - - -BC215 ++ + ++ -BC216 - - - -BC217 +++ - ++ -BC218 ++ - ++ -BC219 - - - -BC220 +++ - + -BC221 - - - -BC222 +++ ++ + -BC223 - - - -BC224 - - - ++ BC225 ++ ++ + -BC226 +++ - - + BC227 + - - -BC228 ++ + + -BC229 ++ - + -BC230 - + - -BC231 - + + -BC232 +++ ++ + ++ BC233 +++ - + -BC234 ++ + + -BC235 +++ ++ - -BC236 +++ - - -BC237 +++ - + +++
2.3 安全性试验
选用细菌BC26、BC228和BC232菌株对刺参进行安全性试验,无论给刺参腹腔注射细胞浓度为107cfu/mL的BC26、BC228、BC232菌悬液,还是投喂含细菌浓度为109cfu/g的干饲料,养殖一个月后,试验组和对照组刺参均无发病和死亡现象。表明3株细菌在试验浓度下对刺参无毒力。
2.4 菌株的鉴定
将BC26、BC228和BC232菌株的16S rDNA序列用Blast软件在 GenBank数据库(www.ncbi. nlm.nih.gov)中进行检索,调取相似性最高的序列。检测结果显示:BC26、BC228和BC232菌株分别与芽孢杆菌Bacillus sp.FA132(JQ083325)、假交替单胞菌 Pseudoalteromonas sp.NBRC102016(AB681663)和塔斯马尼亚弧菌Vibrio tasmaniensis 04102(AM422801)的相似性均为99%。
3 讨论
国内外学者研究证明,鱼类、贝类肠道中普遍存在产酶细菌[15-18]。王瑞旋等[15]对军曹鱼肠道异养细菌进行一周年的监测,分离得到94株优势菌,并检测其产蛋白酶、淀粉酶和脂肪酶的能力,结果显示,有 8株菌能同时分泌这 3种酶。Bairagi等[16]对9种淡水鱼消化道产淀粉酶、纤维素酶、脂肪酶和蛋白酶的细菌进行了研究,结果表明,从不同种鱼的肠道可分离出不同的产酶细菌。祝玲等[17]从近江牡蛎肠道中分离出21株菌,并对其蛋白酶、脂肪酶、淀粉酶、纤维素酶的产酶能力进行测定,结果表明,产3种酶以上的有8株菌。王志等[18]研究发现,在九孔鲍消化道中存在着能分泌蛋白酶、脂肪酶和纤维素酶的微生物。这些研究证明,鱼类、贝类肠道除了内在的消化酶外,还有独特的细菌源消化酶,包括淀粉酶、蛋白酶、脂肪酶和纤维素酶[15-18],这有助于营养学家将产酶细菌作为益生菌,设计出低成本饲料配方。本试验中从刺参肠道分离出50株细菌,其中产3种酶以上的细菌13株,表明由肠道细菌补充刺参消化酶的可能性。Bairagi等[16]对从不同淡水鱼肠道分离出的其中10株产酶细菌进行酶活力测定,其蛋白酶活力为1.6~23.8 U/mL。王福强等[19]从牙鲆肠道分离出25株产蛋白酶的细菌,筛选出4株产酶活力较高的菌株,其酶活力为2.19~4.47 U/mL。本研究中对从刺参肠道分离出的其中9株产酶细菌进行酶活力测定,其蛋白酶活力为65.9~148.7 U/mL,高于从鱼类肠道分离出菌株的酶活力[15,19]。
在筛选潜在益生菌时,一般通过小规模体内试验检测候选菌株对宿主的致病性[20-22]。Kim等[20]从虹鳟肠道分离出 Carnobacterium maltaromaticum B26菌株和广布肉杆菌Carnobacterium divergens B33菌株,经腹腔注射、肌肉注射B26菌株和B33菌株的菌悬液以及投喂含二菌株的饲料对鱼体均无毒力。Aly等[21]给尼罗罗非鱼腹腔注射和肌肉注射从养鱼塘分离的Bacillus pumilus菌株后鱼未出现发病和死亡现象。Abd El-Rhman等[22]通过给鱼体腹腔注射从尼罗罗非鱼的性腺和肠道分离的藤黄微球菌Micrococcus luteus证明该菌株是安全的。本试验中,通过给刺参腹腔注射BC26、BC228和BC232菌株的菌悬液和投喂含3菌株的饲料证明这些菌株是安全的。
Macey等[7]依据蛋白质和淀粉的降解能力从鲍鱼消化道筛选出潜在益生菌,在鲍鱼的养殖过程中投喂含此菌的饲料,结果与投喂不含菌的饲料组比较,试验组鲍鱼的生长率和存活率均有明显提高,其肠道中的蛋白酶活力也有明显增加。Bairagi等[8]在南亚野鲮 Labeo rohita的饲料中添加鱼肠道菌枯草芽孢杆菌 Bacillus subtilis和环状芽孢杆菌B.circulans,结果鱼的生长、食物转化率和蛋白质效率增加,他们将这归因于由细菌产生的胞外纤维素和淀粉水解酶。周慧慧等[10]发现自刺参肠道分离的潜在益生菌Bacillus sp.GSC-1和Enterococcus sp.GSC-3可使稚参成活率、特定生长率和变色率显著提高。用添加外源或内源的枯草芽孢杆菌饲料投喂刺参,其生长和免疫力显著提高[11,23]。本研究中依据产酶能力、溶血试验和对刺参的安全性试验筛选出3株对刺参无害的细菌,在刺参的养殖过程中投喂含菌饲料,可明显促进刺参的生长和抗病力,其结果将另文发表。
参考文献:
[1] 马悦欣,徐高蓉,常亚青,等.大连地区刺参幼参溃烂病细菌性病原的初步研究[J].大连水产学院学报,2006,21(1):13-17.
[2] 马悦欣,徐高蓉,张恩鹏,等.仿刺参幼参急性口围肿胀症的细菌性病原[J].水产学报,2006,30(3):378-382.
[3] 王印庚,荣小军,张春云,等.养殖海参主要疾病及防治技术[J].海洋科学,2005,29(3):1-7.
[4] Deng H,He C B,Zhou Z C,et al.Isolation and pathogenicity of pathogens from skin ulceration disease and viscera ejection syndrome of the sea cucumber Apostichopus japonicus[J].Aquaculture,2009,287:18-27.
[5] Sahul Hameed A S,Rahaman K H,Alagan A,et al.Antibiotic re-sistance in bacteria isolated from hatchery-reared larvae and postlarvae of Macrobrachium rosenbergii[J].Aquaculture,2003,217: 39-48.
[6] Verschuere L,Rombaut G,Sorgeloos P,et al.Probiotic bacteria as biological control agents in aquaculture[J].Microbiology and Molecular Biology Review,2000,64(4):655-671.
[7] Macey B M,Coyne V E.Improved growth rate and disease resistance in farmed Haliotis midae through probiotic treatment[J].Aquaculture,2005,245:249-261.
[8] Bairagi A,Sarkar Ghosh K,Sen S K,et al.Evaluation of the nutritive value of Leucaena leucocephala leaf meal,inoculated with fish intestinal bacteria Bacillus subtilis and Bacillus circulans in formulated diets for rohu,Labeo rohita(Hamilton)fingerlings[J].Aquaculture Research,2004,35:436-446.
[9] 张涛,白岚,李蕾,等.不同添加量的益生菌组合对仿刺参消化和免疫指标的影响[J].大连海洋大学学报,2009,24(S1):64-68.
[10] 周慧慧,马洪明,张文兵,等.仿刺参肠道潜在益生菌对稚参生长、免疫及抗病力的影响[J].水产学报,2010,34(6):775-783.
[11] Zhao Y C,Zhang W B,Xu W,et al.Effects of potential probiotic Bacillus subtilis T13 on growth,immunity and disease resistance against Vibrio splendidus infection in juvenile sea cucumber Apostichopus japonicus[J].Fish&Shellfish Immunology,2012,32: 750-755.
[12] 李明,马悦欣,刘志明,等.刺参机体酵母菌组成及其拮抗活性的研究[J].大连海洋大学学报,2012,27(5):436-440.
[13] Zhou J Z,Bruns M A,Tiedje J M.DNA recovery from soils of diverse composition[J].Microbiology,1996,62(2):316-322.
[14] Lane D J.16S/23S rRNA sequencing[M]//Nucleic acid Techniques in Bacterial Systematics.New York:John Wiley&Sons, 1991.
[15] 王瑞旋,冯娟.军曹鱼肠道细菌及其产酶能力的研究[J].海洋环境科学,2008,27(4):309-312.
[16] Bairagi A,Sakar Ghosh K,Sen S K,et al.Enzyme producing bacterial flora isolated from fish digestive tracts[J].Aquaculture International,2002,10:109-121.
[17] 祝玲,杨吉霞,蔡俊鹏,等.近江牡蛎肠道细菌及其产酶能力[J].湛江海洋大学学报,2005,25(1):10-13.
[18] 王志,蔡俊鹏,徐丽.九孔鲍肠道中产酶菌株的筛选及其与深圳湾菌株的比较[J].粮食与饲料工业,2005(5):34-36.
[19] 王福强,陈营,邵占涛,等.牙鲆肠道内产蛋白酶菌的分离与筛选[J].中国微生态学杂志,2004,16(5):259-262.
[20] Kim D H,Austin B.Innate immune responses in rainbow trout(Oncorhynchus mykiss Walbaum)induced by probiotics[J].Fish &Shellfish Immunology,2006,21:513-524.
[21] Aly S M,Abd-El-Rahman A M,John G,et al.Characterization of some bacteria isolated from Oreochromis niloticus and their potential use as probiotics[J].Aquaculture,2008,277:1-6.
[22] Abd El-Rahman A M,Khattab Y A E,Shalaby A M E.Micrococcus luteus and Pseudomonas species as probiotics for promoting the growth performance and health of Nile tilapia,Oreochromis niloticus [J].Fish&Shellfish Immunology,2009,27:175-180.
[23] Zhang Q,Ma H M,Mai K S,et al.Interaction of dietary Bacillus subtilis and fructooligosaccharide on the growth performance,nonspecific immunity of sea cucumber,Apostichopus japonicus[J].Fish &Shellfish Immunology,2010,29(2):204-211.
Screening and identification of potential enzyme producing probiotics from gut of sea cucumber Apostichopus japonicus
YANG Zhi-ping1,SUN Fei-xue2,LIU Zhi-ming2,ZHANG Lei2,CAO Wei2,MA Yue-xin2
(1.Dalian Huixin Titanium Equipment Dev.Co.Ltd.,Dalian 116039,China;2.Key Laboratory of Mariculture&Stock Enhancement in North China's Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China)
Abstract:Fifty bacterial strains were isolated from gut of healthy sea cucumber Apostichopus japonicus with body weight of 10-30 g,whose extracellular amylase,protease,lipase and cellulase activities were detected using selective media by point inoculation method.Thirteen bacterial strains producing 3 enzymes were screened,nine strains of which were further quantitatively assayed for amylase and protease activities.Hemolysis was tested in six bacterial strains selected depending on the extracellular enzyme producing ability.The results showed that the six bacterial strains did not secreted hemolysin,without potential pathogenicity.The toxicity test revealed that three enzyme producing bacterial strains,BC26,BC228 and BC232,were found to be safe for the sea cucumber which were challenged by intra-peritoneal injection of 0.1 mL cell suspension of the three bacterial strains at concentration of 107cfu/mL,and which were fed the diet containing the three bacterial cells at 109cfu/g once daily for one month. Similarity analysis of 16S rDNA sequences indicated that the bacterial strain BC26 had 99%similarity to Bacillus sp.FA132,BC228 had similarity to Pseudoalteromonas sp.NBRC 102016 and BC232 had similarity to Vibrio tasmaniensis 04102.
Key words:Apostichopus japonicus;potential enzyme producing probiotics;screening;identification
中图分类号:S968.9;Q939.1
文献标志码:A
收稿日期:2012-05-25
基金项目:辽宁省教育厅创新团队项目(2009T019)
作者简介:杨志平(1962-),男,工程师。E-mail:zpyang@163.com
通信作者:马悦欣(1963-),女,教授。E-mail:mayuexin@dlou.edu.cn
文章编号:2095-1388(2013)01-0017-04
