奥尼罗非鱼免疫球蛋白单克隆抗体的制备及其初步应用
郝贵杰,潘晓艺,徐洋,姚嘉赟,尹文林,沈锦玉
(浙江省淡水水产研究所,浙江湖州313001)
摘要:采用饱和硫酸铵盐析和Sephadex G-200柱层析方法制备奥尼罗非鱼Oreochromis niloticus×O.aureus(体质量为500~1 000 g)免疫球蛋白(IgM),以其为抗原免疫8周龄的BALB/c小鼠,免疫3~4次后,取小鼠脾细胞与SP2/0骨髓瘤细胞融合,用ELISA方法对杂交瘤进行筛选。结果表明:阳性克隆经3次亚克隆后,共获得6株针对罗非鱼IgM的单克隆抗体(mAb),分别命名为1C10、1C2、1G11、2C2、2F9和4B3,所有单抗均为IgG类,各株杂交瘤的细胞上清ELISA效价为1∶800~1∶3 200;制备4B3和1G11的腹水单抗,ELISA效价分别为1∶102 400和1∶6 400。免疫印迹试验结果表明,mAb 4B3能在变性条件下识别罗非鱼IgM的重链,约在相对分子质量85 000左右。用ELISA检测4B3对罗非鱼IgM的敏感性,IgM灵敏度为10 μg/L。利用所制备的单抗4B3建立了评价无乳链球菌Streptococcus agalactiae灭活疫苗免疫罗非鱼血清抗体水平的三抗体夹心ELISA(TAS-ELISA)方法,结果表明:腹腔注射和浸泡免疫无乳链球菌灭活疫苗14 d后,两种免疫方式的罗非鱼血清抗无乳链球菌的抗体比对照组稍有增加;免疫21 d后,两种免疫方式的罗非鱼血清抗体均有明显增加;免疫35 d后增加更为显著,达到最高峰,注射组效价达1∶2 560,浸泡组达1∶640;免疫56 d后抗体开始下降,直到第98天还维持在明显高于对照组的抗体水平。本研究表明,所制备的罗非鱼IgM mAb可用于评价罗非鱼疫苗免疫效果及抗体产生规律等,具有广阔的应用前景。
关键词:奥尼罗非鱼;免疫球蛋白;间接ELISA;单克隆抗体;BALB/c小鼠
奥尼罗非鱼Oreochromis niloticus×O.aureus是养殖罗非鱼的主要品种之一[1-2]。随着罗非鱼养殖业的发展,罗非鱼病害有逐渐增多的趋势,特别是近年来两广地区及海南省罗非鱼养殖中出现了严重疾病,其病原主要有海豚链球菌Streptococcus iniae和无乳链球菌 Streptococcus agalactiae[3-7]。另外,多种水生动物病原性链球菌已被证明可在高等动物或/和人类间传播[8-9]。对罗非鱼链球菌病害的控制目前仍以抗生素为主,长期使用抗生素可诱导耐药菌产生,破坏养殖水体微生态环境,同时抗菌药物残留也是影响水产品质量的重要因素。因此,研制疫苗进行预防显得尤为重要,通过免疫手段有效增强鱼体的主动防御能力,减少疾病发生的机率[10-12]。研究证实,鱼类在受到微生物感染或人工免疫后,均能产生由免疫球蛋白(Immunoglobulin,Ig)介导的特异性免疫反应[13]。目前,国内外对罗非鱼的菌苗免疫已进行了大量研究[14-17],但能够直接反映罗非鱼免疫球蛋白提高从而判断免疫效果的试剂还很缺乏,而针对免疫球蛋白的单抗研究能够弥补这一缺失。有关罗非鱼免疫球蛋白(IgM)的相关研究已有一些报道[18-19],但有关罗非鱼IgM单克隆抗体(mAb)研制和应用的研究尚未见报道。为此,本研究中作者开展了罗非鱼IgM mAb的制备及其初步应用研究,以期为评价罗非鱼链球菌灭活疫苗免疫应答水平及规律提供必要的试剂。
1 材料与方法
1.1 材料
试验用奥尼罗非鱼体质量为500~1 000 g,购自湖州某农贸市场。ICR小鼠和8周龄雌性BALB/ c小鼠购自浙江大学医学院实验动物中心。
罗非鱼无乳链球菌L4由中国水产科学研究院鱼病研究室保存,BHI(脑心浸液培养基)购于杭州天和公司,小牛血清购自杭州四季青生物工程材料有限公司,高糖型DMEM及HT、HAT购自Sigma公司,HRP羊抗鼠-IgG、邻苯二胺(OPD)均购自华美公司,融合用PEG4000购自Sigma公司,其他生化试剂均为国产分析纯。
1.2 方法
1.2.1 免疫原的制备及动物免疫 罗非鱼血清IgM的制备参照文献 [20],采用饱和硫酸铵沉淀及柱层析方法。用纯化的罗非鱼血清IgM免疫小鼠的方法及途径参照文献 [21-22]。
1.2.2 细胞融合及阳性杂交瘤细胞株的筛选 按常规方法[20-21]进行细胞融合,阳性杂交瘤细胞株的筛选参照文献 [20]中的间接ELISA方法,不同的是包被抗原用提纯的罗非鱼血清IgM,用免疫小鼠阳性血清做方阵试验决定包被抗原浓度为10 mg/L。
1.2.3 阳性杂交瘤细胞株的建立及腹水的制备将鉴定为阳性的细胞孔中的细胞扩大培养,并及时冻存,同时根据有限稀释法进行亚克隆2~3次,至每孔为单细胞克隆及克隆孔阳性率为100%时,即可定株。然后,按照Golding等[23]的方法进行小鼠腹水的制备。
1.2.4 mAb特性的鉴定
1)mAb细胞上清及腹水效价。以10 mg/L纯化的罗非鱼IgM包被酶标板,于4℃下过夜,封闭后分别加细胞上清和腹水抗体,其中细胞上清的稀释梯度为1∶200~1∶12 800,腹水的稀释梯度为1∶1 000~1∶1.024×106,每孔加100 μL,其余步骤同文献 [20]中的间接ELISA方法。
2)mAb灵敏度的测定。用包被液将提纯的罗非鱼IgM稀释成不同浓度的悬液。IgM含量从10 mg/L倍比稀释到2.25 μg/L,分别取100 μL加至酶标板各孔,一抗为1 000倍稀释的腹水单抗,其余步骤同文献 [20]中的间接ELISA方法。
1.2.5 Werstern-blot分析 SDS-PAGE电泳采用垂直电泳系统,浓缩胶为50 g/L,分离胶为120 g/L。电泳及免疫印迹参考 《蛋白质技术手册》[24]中的方法进行。一抗为1∶500稀释的单抗腹水,二抗为1∶500的羊抗鼠HRP-IgG。
1.2.6 受免罗非鱼体液的免疫效果评价
1)菌苗的制备及罗非鱼的免疫。罗非鱼无乳链球菌L4灭活疫苗的制备参照文献 [25]中的方法,由中国水产科学研究院鱼病研究室制备。于试验前两周,选取同一批健康的奥尼罗非鱼,体质量为40~60 g(购自衢州某奥尼罗非鱼种苗场)。在过滤的池塘水中充氧饲育,水温为20~22℃。试验共分3组,每组放45尾鱼,每组均设3个重复。3组分别为腹腔注射免疫组(1×108cfu/mL,0.1 mL/尾)、浸泡免疫组(5×108cfu/mL,用5 L浸泡5 min)和磷酸盐缓冲液(PBS,0.01 mol/L,pH 7.2)注射对照组,免疫两周后加强免疫一次,方法同前。于首次免疫后的不同时间进行尾静脉采血,每组分别取3尾,血液于4℃冰箱中过夜,以1 500 r/min离心10 min分离血清,每组血清混合后于-20℃下保存,用于抗体的检测。
2)建立评价疫苗效果的TAS-ELISA方法。建立步骤参照文献 [26-27]中的方法,该方法可简化为链球菌包被→不同稀释度的免疫鱼血清→单抗4B3→HRP酶标抗鼠二抗→显色→终止→读数。
3)受免罗非鱼血清中抗体的测定。每组罗非鱼在免疫后 14、21、28、35、42、56、70、84、98 d分别按照上述方法制备血清,用TAS-ELISA方法进行抗体水平以及最高抗体效价的测定。
2 结果
2.1 蛋白质纯化结果
采用饱和硫酸铵沉淀及柱层析方法制备奥尼罗非鱼IgM,最终收集洗脱峰处的第4~8管蛋白洗脱液,200 μL/管,合并后采用考马斯亮蓝G-250比色法进行蛋白定量。结果表明,纯化的罗非鱼IgM的质量浓度为4.2 g/L。
2.2 mAb的筛选及杂交瘤细胞系的建立
采用罗非鱼IgM免疫小鼠以及细胞融合方法,用间接ELISA方法检测细胞培养上清,共获得6株抗奥尼罗非鱼IgM的细胞株,分别命名为1C10、1C2、1G11、2C2、2F9和4B3,杂交瘤细胞分别经3次亚克隆,100%的细胞孔经检测保持了分泌抗罗非鱼IgM的能力,经连续细胞传代培养后,各细胞株依然能够稳定分泌针对罗非鱼IgM的抗体。
2.3 mAb的生物学特性
6株mAb的细胞培养上清及1G11和4B3腹水的ELISA效价结果见表1。
表1 6株mAb的生物学特性
Tab.1 Biological properties of the six monoclonal antibodies
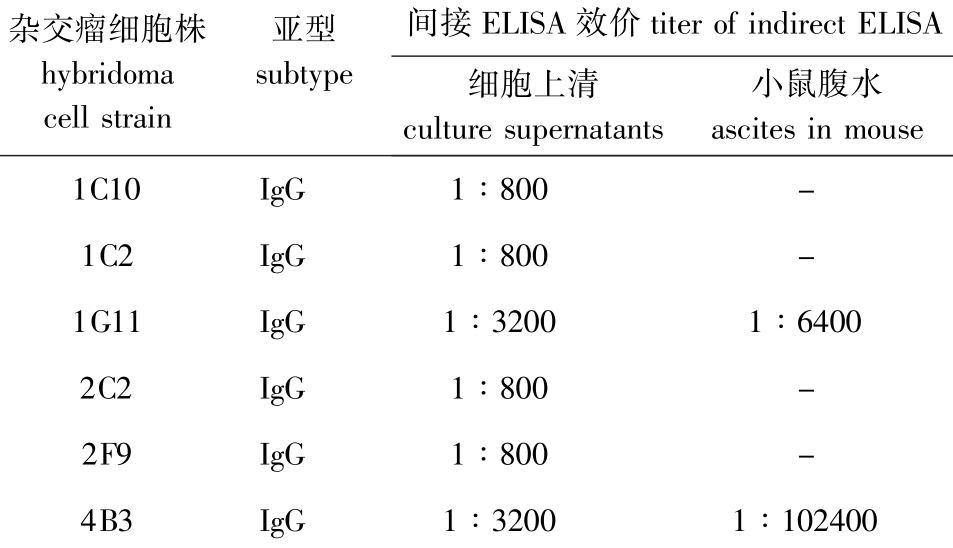
注:-表示该细胞株未制备腹水。
Note:-means the cell strain without preparation with ascites.
杂交瘤细胞株 亚型 间接ELISA效价titer of indirect ELISA hybridomasubtype细胞上清 小鼠腹水cell strainculture supernatantsascites in mouse 1C10 IgG 1∶800 -1C2 IgG 1∶800 -1G11 IgG 1∶3200 1∶6400 2C2 IgG 1∶800 -2F9 IgG 1∶800 -4B3 IgG 1∶3200 1∶102400
2.4 mAb敏感性试验
用不同浓度的罗非鱼IgM抗原包被ELISA板,用间接ELISA法测定单抗4B3的敏感性。结果表明,该腹水单抗间接ELISA法检测罗非鱼IgM的灵敏度为10 μg/L。
2.5 Western-blot结果
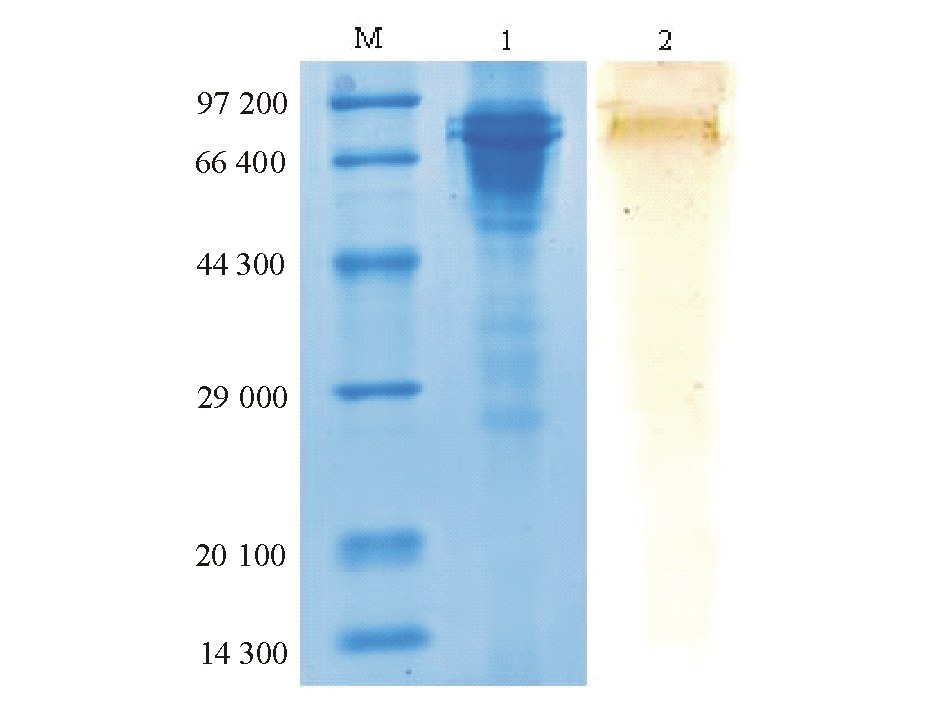
采用SDS-PAGE和Western-blot方法测定单抗4B3的特异性,结果见图1。
2.6 免疫奥尼罗非鱼的抗体水平
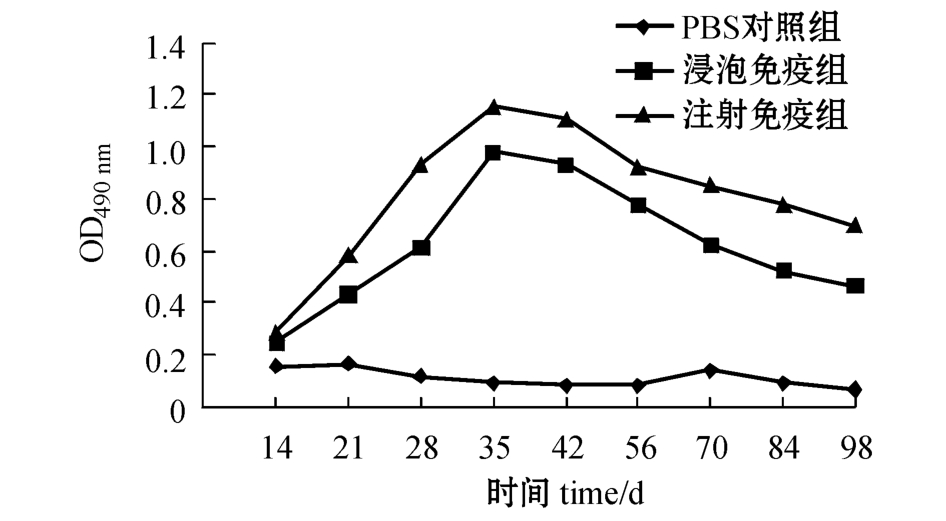
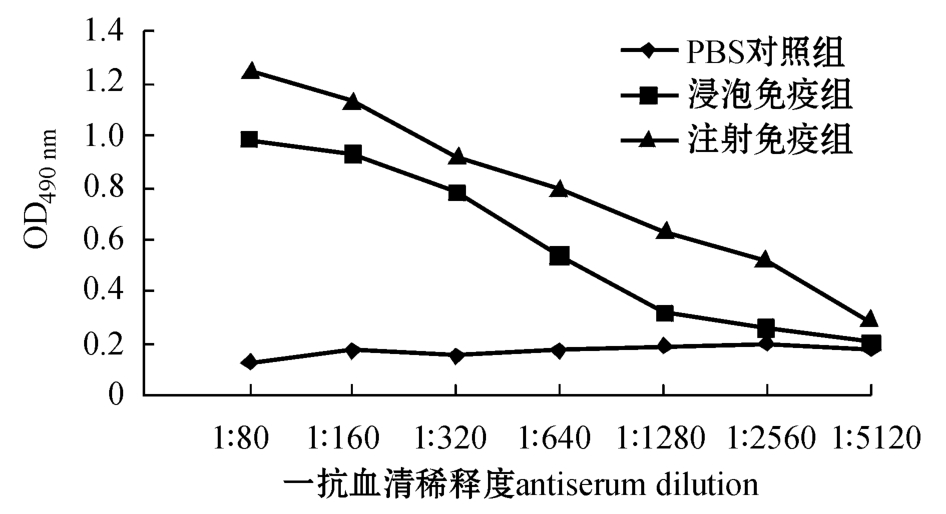
无乳链球菌L4灭活疫苗以不同途径免疫罗非鱼后,每组罗非鱼混合血清中抗L4抗体随时间的变化如图2所示,免疫罗非鱼最高抗体水平的效价如图3所示。
3 分析与讨论
罗非鱼养殖过程中发生的链球菌病害,严重影响了该产业的发展。而抗生素治疗具有较多的负面作用,疫苗的研制及开发已成为控制该病的一个重要手段。Pasnik等[14]研究了无乳链球菌特异性抗体对尼罗罗非鱼的被动免疫作用,证实无乳链球菌的特异性抗体在罗非鱼对无乳链球菌的免疫中发挥主要作用。Shoemaker等[15]研究了利用 OraljectTM技术运送海豚链球菌冻干口服疫苗免疫罗非鱼的效果,结果表明该疫苗对链球菌病可提供保护,但较腹腔注射疫苗组效果差些。目前,鱼类疫苗的免疫效果多采用传统的免疫保护力和血清抗体凝集效价进行评估,因为不同鱼的免疫球蛋白差异较大,目前也没有商品化的二抗产品,所以研究罗非鱼链球菌疫苗免疫效果,阐明罗非鱼受免后保护性抗体产生的规律及水平,制备针对其免疫球蛋白的单抗成为关键。本试验中制备了这一必要的试剂,并做了初步应用。
关于鱼类的免疫球蛋白,近年来已开展了较多的研究,一般认为硬骨鱼类的免疫球蛋白为IgM,通常鱼类的免疫球蛋白是由4个Ig分子组成的四聚体,每个Ig分子由2个重链(H链)和2个轻链(L链)组成,H链相对分子质量一般为60 000~81 000,L链相对分子质量一般为 20 000~30 000[28-30]。不同鱼类的IgM分子存在一定差异,本研究中采用饱和硫酸铵粗提和凝胶分子筛层析方法提纯罗非鱼免疫球蛋白,经SDS-PAGE电泳分析表明,纯化的Ig的H链、L链分子量大小与报道类似。取适当纯化的IgM免疫小鼠,通过细胞融合以及多次的克隆和筛选,共获得了稳定分泌抗罗非鱼IgM mAb的杂交瘤细胞6株:1C10、1C2、1G11、2C2、2F9和4B3。Western-blot试验结果表明,mAb 4B3是针对罗非鱼Ig分子重链的。这与作者之前制备的草鱼免疫球蛋白单抗针对其重链的结果相似[20],这是因为鱼的血清Ig分子与脊椎动物的IgM分子相似,重链的恒定区氨基酸序列多,结构复杂,可提供多个抗原结合表位;而轻链就相对简单,其上免疫表位少,所以强阳性的单抗细胞株绝大多数是抗IgM重链的,在单抗筛选过程中针对轻链的杂交瘤细胞很容易丢失和放弃。已报道的抗鱼类Ig的单抗也是多数只可以识别鱼的Ig重链,仅有少量针对轻链[31]。用不同浓度的罗非鱼IgM抗原包被ELISA板,用间接ELISA法测定4B3的敏感性,结果表明,该单抗间接ELISA法检测罗非鱼IgM的灵敏度为10 μg/L,这种高灵敏性的mAb为罗非鱼传染性疾病的免疫学研究和血清学调查提供了可靠的试剂。
本研究中利用所制备的单抗,建立了以单抗4B3为核心的三抗体ELISA方法(TAS-ELISA),并用该方法评价了在实验室开展的无乳链球菌L4灭活疫苗免疫罗非鱼的免疫效果,实验室免疫罗非鱼选择腹腔注射和浸泡免疫方式。结果表明,罗非鱼免疫14 d后,受免鱼血清抗L4的抗体比对照组稍有增加,进行加强免疫后,也就是在首次免疫21 d后,两种免疫方式的鱼血清抗L4的抗体均有明显增加,免疫35 d后增加更为显著,达到最高峰,但免疫56 d后抗体开始下降,直到第98天还维持在明显高于对照组的抗体水平。罗非鱼免疫35 d时,注射免疫产生的抗体效价达1∶2 560,浸泡免疫产生的抗体效价达1∶640,可见罗非鱼注射免疫效果要优于浸泡免疫,但浸泡免疫具有操作方便、对鱼体损伤小的优势,这些结果为罗非鱼无乳链球菌灭活疫苗的中试及示范奠定了基础。
参考文献:
[1] 贺艳辉,张红燕,龚赟翀,等.我国罗非鱼养殖品种及养殖发展分析[J].水产养殖,2009,30(2):12-14.
[2] 陈德寿.罗非鱼品种与养殖模式选择效果分析[J].科学养鱼, 2007(9):45-46.
[3] 张新艳,樊海平,钟全福,等.罗非鱼无乳链球菌的分离、鉴定及致病性研究[J].水产学报,2008,32(5):772-779.
[4] 甘西,陈明,余晓丽,等.罗非鱼海豚链球菌16S rRNA基因的序列测定和系统进化分析[J].水产学报,2007,31(5):618-623.
[5] 甘西,陈明,余晓丽,等.罗非鱼海豚链球菌PCR检测方法的建立[J].上海水产大学学报,2008,17(1):40-45.
[6] 卢迈新,黎炯,叶星,等.广东与海南养殖罗非鱼无乳链球菌的分离、鉴定与特性分析[J].微生物学通报,2010,37(5):766-774.
[7] 柯剑,赵飞,罗理,等.广东省罗非鱼主养区无乳链球菌的分离、鉴定与致病性[J].广东海洋大学学报,2010,30(3):23-27.
[8] Agnewa W,Barnes A C.Streptococcus iniae:an aquatic pathogen of global veterinary significance and a challenging candidate for reliable vaccination[J].Veterinary Microbiology,2007,122:1-15.
[9] 余晓丽,陈明,李超,等.斑点叉尾鮰暴发性海豚链球菌病的研究[J].大连水产学院学报,2008,23(3):185-191.
[10] 陈红燕,林天龙,陈日升,等.抗嗜水气单胞菌单克隆抗体的制备及特性分析[J].中国水产科学,2003,10(2):122-124.
[11] 余晓丽,陈明,李莉萍,等.罗非鱼海豚链球菌疫苗及其免疫效果的研究[J].淡水渔业,2008,38(6):31-37.
[12] 吴亚楠,柳鹏,李强,等.复方中草药对仿刺参免疫力和抗病力的影响[J].大连海洋大学学报,2011,26(4):338-343.
[13] 吴金英,林浩然.斜带石斑鱼淋巴器官个体发育的组织学[J].动物学报,2003,49(6):819-828.
[14] Pasnik D J,Evans J J,Klesius P H.Passive immunization of Nile tilapia(Oreochromis niloticus)provides significant protection against Streptococcus agalactiae[J].Fish&Shellfish Immunology, 2006,21:365-371.
[15] Shoemaker C A,Vandenberg G W,Desormeaus A,et al.Efficacy ofa Streptococcus iniae modified bacterin delivered using OraljectTMtechnology in Nile tilapia(Oreochromis niloticus)[J]. Aquaculture,2006,255:151-156.
[16] Ra C H,Kim Y J,Park S J,et al.Evaluation of optimal culture conditions for recombinant ghost bacteria vaccine production with the antigen of Streptococcus iniae GAPDH[J].Microbiol Biotechnol,2009,19:982-986.
[17] Sun Y,Hu Y H,Liu C S,et al.Construction and analysis of an experimental Streptococcus iniae DNA vaccine[J].Vaccine,2010, 28(23):3905-3912.
[18] 吴铁军,梁万文.罗非鱼免疫球蛋白(IgM)重链基因全长cDNA序列分析[J].广西农业科学,2009,40(8):1084-1087.
[19] 徐增辉,陈汉忠,李晓栩,等.奥尼罗非鱼血清免疫球蛋白的纯化及分子量的初步分析[J].水产科学,2008,27(12):625-628.
[20] 郝贵杰,沈锦玉,徐洋,等.草鱼免疫球蛋白单克隆抗体的制备及其特性鉴定[J].细胞与分子免疫学杂志,2009,25(9): 808-810.
[21] 刘秀梵.单克隆抗体在农业上的应用[M].合肥:安徽科学技术出版社,1994.
[22] 钱超,姜平,卢春,等.抗SARS冠状病毒M蛋白片段单克隆抗体的制备与初步鉴定[J].细胞与分子免疫学杂志,2006,22(2):213-215.
[23] Golding J W.Monoclonal antibodies:Principle and practice[M]. New York:Academic Press,1983:53-54.
[24] 汪家政,范明.蛋白质技术手册[M].北京:科学出版社, 2000.
[25] 郝贵杰,潘晓艺,姚嘉赟,等.中华鳖细菌疫苗免疫佐剂的筛选及其初步应用[J].大连水产学院学报,2010,25(1):19-23.
[26] 朱正美,刘辉.简明免疫学技术[M].北京:科学出版社, 2002:163-165.
[27] 郝贵杰,沈锦玉,徐洋,等.大黄鱼病原哈维氏弧菌单克隆抗体的制备及其应用[J].水生生物学报,2009,33(3):51-55.
[28] 鄢庆枇,韩一凡,高天翔,等.大黄鱼血清IgM纯化及其兔抗血清的制备[J].中国水产科学,2006,13(3):475-479.
[29] 陈垚,王石泉,韩晓冬,等.鲫鱼血清和皮肤粘液IgM的分离纯化及部分性质的鉴定[J].动物学研究,2003,24(2):111-115.
[30] 黄艳青,王桂堂,孙军,等.黄颡鱼血清免疫球蛋白的纯化及分子量的初步测定[J].水生生物学报,2003,27(6):654-656.
[31] Van Der Hejden M H T,Rooijakkers J B M A,Booms G H R,et al.Production,characterization and applicability of monoclonal antibodies to European eel(Anguilla anguilla L.)immunoglobulin [J].Vet Immunol Immunopathol,1995,45(8):151-164.
Preparation and application of immunoglobulin monoclonal antibodies in tilapia Oreochromis niloticus×O.aureus
HAO Gui-jie,PAN Xiao-yi,XU Yang,YAO Jia-yun,YIN Wen-lin,SHEN Jin-yu
(Zhejiang Institute of Freshwater Fisheries,Huzhou 313001,China)
Abstract:Serum immunoglobulin(IgM)of healty tilapia Oreochromis niloticus×O.aureus(body weight 500-1 000 g)was purified by saturation ammonium sulfate precipitation and followed by Sephadex G-200 gel column chromatography.The 8-week-old female BALB/c mice were immunized with the purified IgM,and the spleen cells collected from the immunized mice were fused with SP2/0 myeloma cells after the third or fourth immunization.Positive hybridoma cells were screened by indirect ELISA and subcloned by limited dilution method.Through three times of subcloning,six mAb against the IgM were selected,designated as 1C10,1C2,1G11,2C2,2F9 and 4B3, respectively,were found to be IgG and to have high ELISA titers between 1∶800-1∶3 200.The 4B3 and 1G11 were chosen to prepare ascites mAb with the ELISA titers of 1∶102 400 and 1∶6 400,respectively.The mAb 4B3 was recognized as the heavy chain of IgM by Western blotting,with sensitivity of at least 10 μg/L of IgM by ELISA.A triple antibody sandwich enzyme-linked immunosorbent assay(TAS-ELISA)was developed with the plates pre-coated with Streptococcus agalactiae isolated from tilapia for IgM capturing followed by samples incubation,mAb(4B3)and goat-anti-mouse-IgG antibody labeled with HRP to value the antibody in the sera of the tilapia immunized with inactive vaccine of S.agalactiae.The results showed that there were slightly higher antibody levels in sera of tilapia vaccinated with inactive vaccine of S.agalactiae than those in the control 14 days after immunization via intraperitoneal injection and bath.The antibody against S.agalactiae was found to be significantly increase than that in the control 21 days after vaccination by two immune ways,with the peak in 35 days.The TAS-ELISA titer was found to be 1∶2 560 in the injection group and 1∶640 in the bath group.The antibody levels were detected to be significantly higher than those in the control in 98 days,even though the antibody level was found to begin to drop in 56 days.The findings show that the McAbs of tilapia immunoglobulin have a great potential and wide application for monitoring the immunity levels and for pathogen diagnosis.
Key words:Oreochromis niloticus×O.aureus;immunoglobulin;indirect ELISA;monoclonal antibody;BALB/c mice
中图分类号:S965.125
文献标志码:A
收稿日期:2012-05-01
基金项目:浙江省湖州市科技攻关计划项目(2010C21107)
作者简介:郝贵杰(1979-),助理研究员。E-mail:melissa511@sina.com
通信作者:沈锦玉(1963-),女,研究员。E-mail:sjinyu@126.com
文章编号:2095-1388(2013)01-0007-05