刘伟1,曾真2,战培荣1
(1.中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070;2.哈尔滨工业大学理学院,黑龙江哈尔滨150001)
摘要:采用两种硫酸铵饱和梯度盐析方法对怀头鲇Silurus soldatovi胃黏膜蛋白酶激活液进行粗提,用6种组合层析条件对胃蛋白酶粗提液进行Sephadex G-75凝胶过滤层析,获得初步纯化的蛋白酶,并通过蛋白质浓度、蛋白酶活力及SDS-PAGE凝胶电泳对其分析鉴定。结果表明:在28%、56%、83%(NH4)2SO4饱和度条件下分级盐析效果比较理想;不同层析条件下层析峰分离液的蛋白酶活力测定均显示出酶活性,层析峰蛋白酶比活力较粗提液提高5~9倍,60 cm柱 (层析柱高52 cm、直径1.6 cm)层析峰分离效果较好。从盐析粗提液电泳结果,以及在60 cm层析柱、pH为3.3的0.01 mol/L β-丙氨酸-甲酸缓冲液、0.8 mL/min流速条件下的层析峰蛋白分管收集液酶活力峰值和层析峰峰顶形状判断,怀头鲇胃蛋白酶可能有两种蛋白组分存在,并测得相对分子质量为26 000~47 000。
关键词:怀头鲇;胃蛋白酶;盐析;凝胶过滤层析
怀头鲇Silurus soldatovi隶属于鲇科 Siluridae、鲇属Silurus,是黑龙江流域特产的大型肉食性鱼类,目前已被列入易濒危鱼类。怀头鲇栖息于较宽敞水体中,营底栖生活,多夜间捕食,冬季亦有摄食;自然水域中,主要捕食鱼类,亦食水生昆虫、蛙、鼠等活动物及其尸体,能吞食相当于自身长度2/3的鱼类;其胃容量大,消化能力极强,生长快。怀头鲇具有很高的营养价值[1-2],其胃还具有消肿补气等药用价值[3]。因此,探讨其酶性质与消化机能有重要意义。
有关鱼类消化酶的研究主要集中在鱼类食性、饲料、季节变化与消化酶的关系,酶促反应与酶动力学,胚后发育阶段消化酶的发生与演变,消化酶在体内消化组织的分布等[4-9]。对太湖沿岸地区几种常见肉食性鱼类的胃蛋白酶和胰蛋白酶活性进行比较研究表明,肉食性鱼类 (特别是胃发达的)食物的消化主要在胃中,胃蛋白酶活性明显高于肠蛋白酶[10]。怀头鲇在摄食后3 h胃蛋白酶活性达到高峰,比肠蛋白酶活性高近1倍,并持续2~3 h[11]。Diaz等[12]用SDS-PAGE凝胶电泳研究了鲷科鱼类幼体消化道中出现的蛋白酶类。而有关鱼类消化酶的分离提纯及应用研究较少。
蛋白酶的分离提纯研究始于20世纪50年代,对几种常见的酶类如胃蛋白酶、糜蛋白酶、胰蛋白酶等研究发现,各物种同源蛋白酶间存在不同程度的差异。1979年Becker等[13]用DEAE离子交换层析和亲和层析先后提纯了人胃蛋白酶Ⅰ、Ⅱ,并对其性质作了研究。中国学者相继用DEAF-52阴离子交换层析、高压液相凝胶过滤层析从人胃黏膜中分离纯化到相对分子质量为67 000的胃蛋白酶原[14-15];用底物亲和法分离纯化了蕲蛇胃蛋白酶[16];用硫酸铵分级沉淀、DEAE-Sepharose离子交换层析、Phenythl-Sepharose疏水层析纯化了嗜热真菌热稳定蛋白酶[17]。近年来研究者以提高鱼类消化酶的利用,或增加水产副产品为目的,对鱼类蛋白酶研究逐步深入。张继平等[18]提取了暗纹东方鲀的胃蛋白酶,黄丽洋等[19]提取了斑点叉尾鮰的肠蛋白酶,Ulitina等[20]从欧洲鲇Silirus glanis L.胃黏膜中分离出3种蛋白酶 (P1、P2和P3)。而对欧洲鲇的地理相近种——怀头鲇胃蛋白酶的分离纯化目前国内外尚未见报道。本研究中,作者采用硫酸铵饱和梯度盐析和Sephadex G-75凝胶过滤层析技术,初步建立了分离纯化怀头鲇胃黏膜蛋白酶的方法,旨在为进一步探讨怀头鲇消化生理机能与食性的关系,以及鱼类胃蛋白酶的应用提供科学依据。
1.1 材料
试验用怀头鲇取自黑龙江水产研究所名优鱼类繁殖基地同批人工孵化鱼苗,饲养于室内控温水族箱 (80 cm×60 cm×50 cm),仔稚鱼阶段投喂水蚤、水蚯蚓等活饵料,幼鱼至2龄阶段投喂冰冻海泥鳅Plotosus liaeatus Thunberg,试验时平均体质量约800 g。水族箱设有水循环过滤装置,以充分曝气的地下水为水源,水温为20~22℃。
1.2 方法
1.2.1 胃蛋白酶的粗提 (粗分级)
1)采样时间。怀头鲇胃黏膜蛋白酶活性在摄食后3 h达到高峰,故在喂食后3~4 h进行采样[5]。
2)酶原抽提。在冰盘上解剖怀头鲇并剪下整个胃部,用蒸馏水清洗,再剪去胃外壁肌肉,保留内壁黏膜组织。将黏膜组织剪碎,加入4倍质量的双蒸水,用高速匀浆器以10 000~13 000 r/min低温匀浆2 h(每5 min间歇匀浆1 min)。若匀浆中有较多组织碎块,应尽可能剪碎黏膜组织。再将匀浆液以8 000 r/min冷冻离心15 min,上清即为胃蛋白酶原抽提液,蛋白酶活力为0.516 IU/mg。
3)酶原激活。用1 mol/L的盐酸将胃蛋白酶原抽提液pH调至2.8,静置2 h,酶原被激活为有活性的蛋白酶,即胃蛋白酶激活液,蛋白酶活力为61.95 IU/mg。将胃蛋白激活液用1 mol/L的氢氧化钠溶液调节pH至4.2,并于4℃下保存。
4)盐析与等电点沉淀。用硫酸铵进行梯度分级盐析。盐析条件一:将胃蛋白酶激活液分装在3只管中,加入4℃预冷的饱和硫酸铵溶液,分别至30%、50%和70%饱和度盐析,静置30 min,以8 000 r/min离心20 min,收集沉淀与上清。盐析条件二:称取1 g固体硫酸铵加入5 mL激活液中,静置30 min,以8 000 r/min离心20 min,收集沉淀溶解于层析缓冲液;再重复上述 (盐析条件二)步骤两次,至硫酸铵饱和度分别为28%、56%和83%,收集沉淀和上清,盐析沉淀分别用层析缓冲液溶解(盐析液)。由于蛋白酶活性对温度和pH敏感,操作均在低温 (4℃)和低pH(pH 4.2)下进行。
5)透析、浓缩。将胃蛋白酶盐析液装入透析袋内,在低温中用层析缓冲液进行透析除盐,并不断更换缓冲液。再将透析袋浸入体积分数为30%的蔗糖溶液中继续透析,浓缩2 h,溶液体积缩小约三分之一,即获得胃蛋白酶粗提液。
1.2.2 胃蛋白酶凝胶过滤层析 (细分级)
1)凝胶材料与样品。选用琼葡糖凝胶G-75 FF,制成凝胶悬浮液。将胃蛋白酶粗提液,加入灌装好凝胶的层析柱内进行细分级提纯。
2)层析条件的设定。由两种规格的层析柱Φ1.6 cm×40 cm(A1)和Φ1.6 cm×60 cm(A2),两种层析缓冲液pH分别为3.3和4.2(B1、B2), 4种洗脱速度0.3、0.6、0.8、1.0 mL/min(C1、C2、 C3、 C4), 组 合 成 A1B1C4、 A1B1C3、A1B2C2、A2B2C1、A2B2C3、A2B1C3 6种层析条件。
3)装柱、上样。装柱时柱内先注满缓冲液,缓慢连续加入凝胶悬浮液,让其自然沉降,使层析柱凝胶均匀,无裂缝,无气泡产生。40 cm层析柱凝胶的高度为35 cm,60 cm层析柱凝胶的高度为52 cm。用缓冲液平衡层析柱至紫外检测仪示数稳定,待缓冲液流至与柱床表面相切时,加入样品(上样前样品经10 000 r/min离心5 min,以除去部分干扰层析的杂质),用缓冲液轻轻冲洗层析柱内壁,密封层析柱。40 cm柱的上样量为1 mL,60 cm柱的上样量为1.5 mL。
4)洗脱、收集。按设定洗脱速度和层析缓冲液进行平衡和洗脱。缓冲液均用体积分数为0.02%的叠氮钠抑制微生物。紫外检测仪灵敏度为2 A,采用自动或人工方法检测蛋白质浓度,分管收集各组合的层析峰蛋白2.5 mL。
1.2.3 盐析和层析提纯的检测方法
1)用SDS-PAGE电泳检测。制作凝胶时,将4.0 mL 30%(体积分数,下同)的丙烯酰胺、2.5 mL分离胶缓冲液 (2 mol/L Tris-HCl、10%SDS, pH 8.8)和3.5 mL双蒸水混合后,加入10%APS溶液和TEMED原液配制12%的分离胶 (分离的相对分子质量为15 000~60 000)。取灌制分离胶3.5 mL,并加入双蒸水使凝胶表面平整,约30 min完全凝固。将0.67 mL 30%丙烯酰胺、1.0 mL浓缩胶缓冲液 (pH 6.8)和2.3 mL双蒸水混合后,加入10%APS溶液和TEMED原液灌制5%的浓缩胶,高度约为1 cm。在冰箱 (4℃)中保存备用。
胃蛋白酶粗提液样品上样前以10 000 r/min离心5 min,取10 μL离心后的样品加入2.5 μL样品缓冲液,与蛋白Marker同时沸水浴5 min,即为电泳样品。每孔上样12.5 μL,未加样品的孔加入12.5 μL缓冲液。在冰箱 (4℃)内电泳73 min。
用体积分数为0.1%的考马斯亮蓝染色10 min。加入脱色液,至底色澄清为止。
2)蛋白质浓度的测定。蛋白浓度标准采用0.615 g/L BSA(牛血清白蛋白,-20℃冷冻保存)。将蛋白酶原抽提液、激活液、粗提液稀释10~20倍后测试,层析峰蛋白液直接测试。将样品混匀,用考马斯亮蓝显色10 min,于595 nm处测定各管的吸光度。
蛋白质浓度计算公式:
式中:P为蛋白质浓度 (mg/mL),A为测定管吸光度;A1为标准管吸光度;A2为空白管吸光度;C为标准管蛋白质浓度 (mg/mL)。
3)蛋白酶活力的测定 (Folin酚法)。将蛋白酶抽提液、激活液、粗提液稀释2倍后的样品和层析峰蛋白液均以3 000 r/min离心10 min,取上清进行测试。样品及试剂在测试前均平衡至室温 (约25℃)。在37℃水浴中反应20 min,于660 nm处测定各管的吸光度。以样品空白作为对照。
根据酪氨酸标准曲线回归方程 y=0.0098x (R2=0.9999)计算酶活力。
绝对酶活力定义:每毫升酶液在37℃下每分钟分解蛋白生成1 μg酪氨酸为一个酶活力单位(U)。
相对酶活力 (比活力)定义:每毫克蛋白在37℃下每分钟分解蛋白生成1 μg酪氨酸为一个酶活力单位 (U),即为绝对酶活力与蛋白质浓度的比值。
2.1 胃蛋白酶粗提条件
2.1.1 盐析方法一 胃蛋白酶激活液用30%、50%和70%饱和度硫酸铵梯度盐析的上清和沉淀,经SDS-PAGE检测,结果如图1所示,3个梯度的上清液 (图1-A)及其沉淀 (图1-B)中的蛋白组成均无明显区别,没有达到分级分离效果。在其沉淀的电泳图谱中有预测的蛋白条带 (图1-B,箭头所示),相对分子质量为31 000~43 000。
2.1.2 盐析方法二 从图2可见,用28%、56%和83%饱和度硫酸铵梯度分级盐析获得的沉淀和上清,即胃蛋白酶粗提液,经SDS-PAGE电泳检测其沉淀组分差异明显,沉淀回收率高,得到较理想的分离效果。其中28%和56%饱和度盐析沉淀电泳在蛋白相对分子质量为26 000~47 000处条带浓密,与图1-B蛋白组成分布相近。饱和度为28%的沉淀中酶活力为69.59 IU/mg,约为56%饱和度中 (35.63 IU/mg)的两倍,但饱和度为28%的沉淀中蛋白质浓度 (1.995/2.611 mg/mL)较低;饱和度为83%的沉淀中酶比活力和蛋白质浓度均很低,而上清中则几乎没有酶活力,电泳中亦无条带显示。
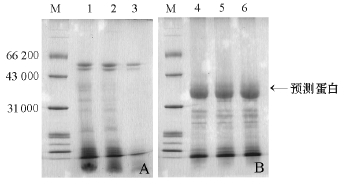
图1 盐析方法一的粗提液电泳结果
Fig.1 The electrophoresis of the crude extract by the first salting out method
注:M为DL 2000 Marker;1、2、3泳道依次为30%、50%、70%饱和度硫酸铵盐析的上清;4、5、6泳道为30%、50%、70%饱和度硫酸铵盐析的沉淀。
Note:M,DL 2000 marker;1,2,3 lanes represent 30%,50% and 70%saturation(NH4)2SO4salting out supernatant,respectively;4,5,6 lanes represent sediments supernatant,respectively.

图2 盐析方法二的粗提液电泳结果
Fig.2 The electrophoresis of the crude extract by the second salting out method
注:1、2、3泳道依次为28%、56%、83%饱和度硫酸铵盐析的沉淀;4泳道为83%饱和度硫酸铵盐析的上清。
Note:1,2,3,lanes represent 28%,56%and 83%sediments with(NH4)2SO4,respectively;4,lane represents the supernatant.
2.2 凝胶过滤层析条件的确定及提纯效果
2.2.1 40 cm层析柱组合条件 从图3可见:pH为3.3的缓冲液、1.0 mL/min洗脱速度条件下(A1B1C4),层析峰在洗脱60 min时出现,收集层析峰测定蛋白酶活性为308.79 IU/mg,酶活力比盐析粗提液提高5~9倍;pH为3.3的缓冲液、0.8 mL/min洗脱速度条件下 (A1B1C3),层析峰在洗脱 70 min时出现;pH 为 4.2的缓冲液、0.6 mL/min洗脱速度条件下 (A1B2C2),层析峰在洗脱110 min时出现。用40 cm层析柱,无论使用pH 3.3还是pH 4.2的缓冲液,流速从0.6 mL/min到1.0 mL/min,层析峰形均只有一个主峰。
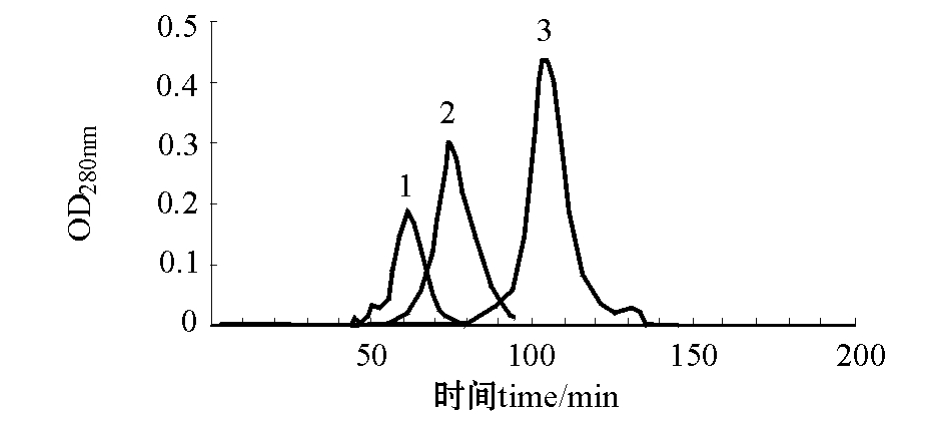
图3 3种层析条件下的洗脱层析图 (1.6 cm×40 cm)
Fig.3 The chromatographic peak in a chromatographic column(1.6 cm×40 cm)
Note:1,A1B1C4;2,A1B1C3;3,A1B2C2.
2.2.2 60 cm层析柱组合条件 pH 4.2的缓冲液、0.3 mL/min洗脱速度条件下 (A2B2C1),层析峰在洗脱400 min时出现一主峰,十几个小峰(图4)。

图4 A2B2C1洗脱层析图 (1.6 cm×60 cm)
Fig.4 The components isolated by gel filtration chromatography in A2B2C1(1.6 cm×60 cm)
3.1 胃蛋白酶提纯条件的选择
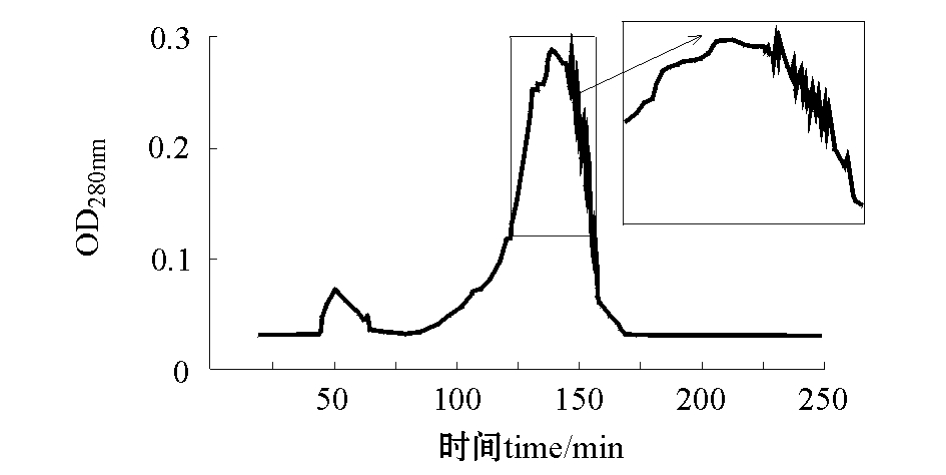
图5 A2B1C3洗脱层析图 (1.6 cm×60 cm)
Fig.5 The components isolated by gel filtration chromatography in A2B1C3(1.6 cm×60 cm)
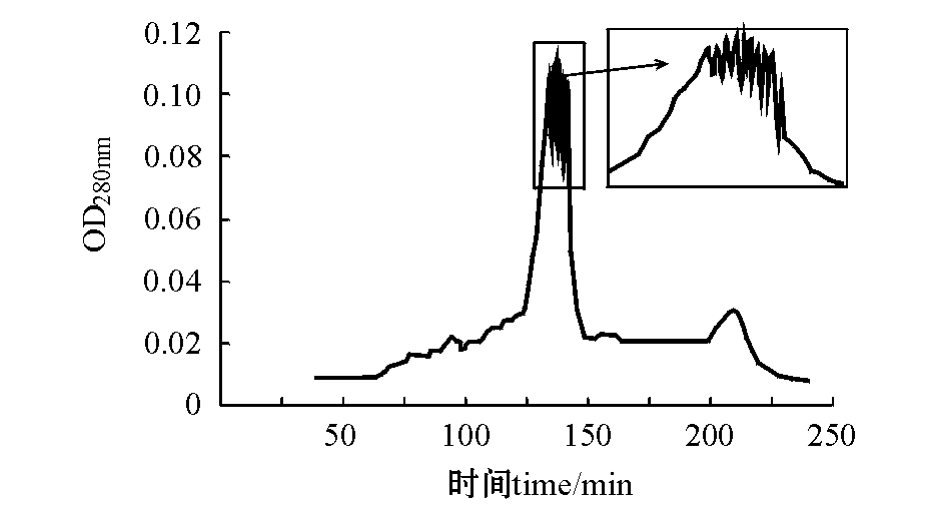
图6 A2B2C3洗脱层析图(1.6 cm×60 cm)
Fig.6 The components isolated by gel filtration chromatography in A2B2C3(1.6 cm×60 cm)
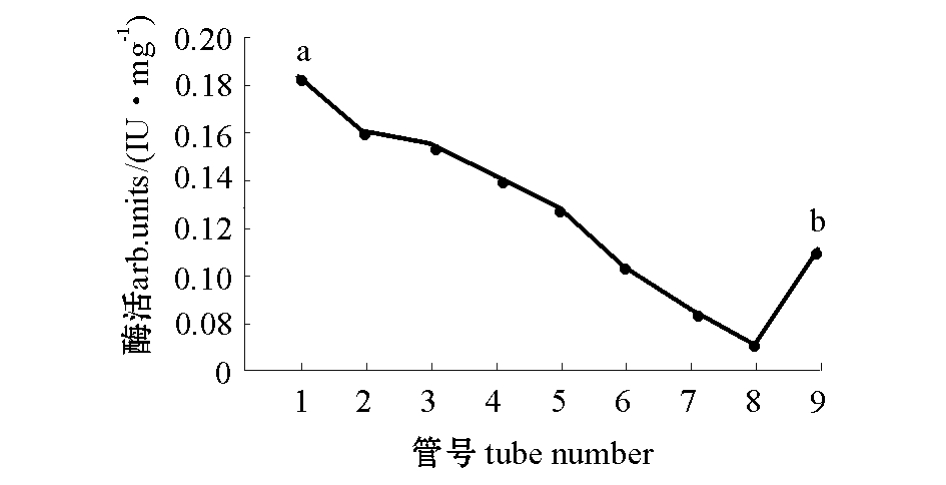
图7 层析峰分管收集液蛋白酶活力
Fig.7 The activity of proteases from fraction liquid of chromatographic peak
注:a为1号管;b为9号管。
Note:a,the tube of number one;b,the tube of number nine.
在胃蛋白酶分离纯化过程中,尤其是粗分级分离时,为得到浓度足够高的粗提液需经过反复试验优化粗提方法。如黏膜组织前处理、匀浆转速、匀浆介质、操作温度等因素都会影响匀浆效果。提取酸性蛋白酶时匀浆介质可用生理盐水、柠檬酸缓冲液或蒸馏水[20-21],本试验中用4倍质量的双蒸水提取效果较好。实际应用中,还需摸索一次处理大量样品的最佳取样时间、酶原激活时间以及可保持酶活力的合适缓冲液等。有真胃的生物胃蛋白酶原在胃酸 (H+)作用下 (pH<5),酶原自动激活,转变为高度酸性的、有活性的胃蛋白酶。本试验在pH为2.8、激活2 h条件下[16]获得的激活液蛋白酶活力比匀浆抽提液提高120倍,激活效果明显。有学者认为,较高的硫酸铵饱和度有助于提高盐析回收率,而较低的饱和度硫酸铵可保持较高比活力[17-18]。根据本试验在28%、56%、83%饱和度分级盐析检测结果综合分析,建议选择40%~70%饱和度硫酸铵盐析为宜[20]。但83%硫酸铵分级沉淀中有两条很深的相对分子质量约为47 000的蛋白条带,是否为胃蛋白酶原,若适当延长酶原激活时间,是否有可能激活更多酶原,有待试验探讨。
本试验结果显示,用Sephadex G-75 FF凝胶效果较好,层析峰出现明显,纯化后蛋白酶比活力显著增加。凝胶过滤层析上样量理论上为柱体积的1%~5%,经本试验验证,60 cm层析柱最合适的上样量为1.5%。通常以高柱长、低流速下凝胶过滤层析效果为佳,并要充分浓缩样品,保证样品浓度。本试验在60 cm层析柱、pH为3.3的0.01 mol/L β-丙氨酸-甲酸缓冲液、0.8 mL/min洗脱速度条件下,层析分离效果较好,并在峰顶下落处出现带锯齿状的峰形 (图5),推测若增加柱长 (至75 cm),同时减小流速 (至0.3 mL/min),可以达到更高分辨率[22]。与欧洲鲇胃蛋白酶不同[20],本试验中在60 cm层析柱、pH为4.2的0.01 mol/L β-丙氨酸-乙酸缓冲液、0.3 mL/min洗脱速度条件下没有达到预期效果 (图4)。凝胶过滤层析只能根据表观相对分子质量分离蛋白,不能保证将所有的蛋白酶都分开,因为有可能存在表观相对分子质量很相近而组成却不同的胃蛋白酶。若增加DEAE -纤维素阴离子交换层析[13,18,20],可以将有相同表观相对分子质量但所带电荷不同的蛋白酶分离,提纯效果会更好。有待进一步分离试验并确定其组分和性质。
3.2 鱼类蛋白酶的应用
蛋白酶在许多领域有广泛的用途。如蛋白水解酶在食品工业中用于肉的软化及生产氨基酸制品[16-17];医学上用于酶诊断和酶治疗 (尤其是在外科手术中)[15];农业上用于饲料蛋白酶添加剂和生物肥中,以增加效率[18,23]。此外,蛋白水解酶作为工具酶广泛用于蛋白质和多肽的一级结构、酶活性位点等研究,以及解决其它酶学和分子生物学等重要问题[11,22]。因此,寻找高活性蛋白酶的新来源仍十分重要而迫切。
由于胃黏膜蛋白酶组成较复杂,本试验中只对怀头鲇胃黏膜蛋白酶进行了初步纯化。试验用SDS -PAGE检测的怀头鲇胃黏膜蛋白酶相对分子质量为26 000~47 000,根据电泳图谱、层析图和层析峰酶活力测定结果推测,可能至少有两种胃蛋白酶存在。Ulitina等[20]对欧洲鲇胃黏膜蛋白酶用凝胶过滤层析和离子交换层析分离出两种相对分子质量(30 200、39 800)的3种蛋白酶。怀头鲇胃蛋白酶相对分子质量范围与欧洲鲇相近,二者与胃蛋白酶Ⅰ、Ⅱ的相对分子质量亦相近[14-15],说明怀头鲇极强的消化能力是在长期进化与自然适应中获得的生化遗传性状,消化机能相对较完善,对鱼类消化酶在系统进化方面的研究具有重要价值。不同鱼类的消化道构造,消化酶种类、特性及活性分布均有不同。消化酶的特征可反映鱼类的消化能力及种的属性,鱼类消化酶学研究将成为水产养殖及分子育种中的基础工作。
提纯胃蛋白酶可以从酶本身的结构性质来探讨鱼类消化酶的稳定性和动力学问题。叶元土等[24]、王立波等[25]分别研究了南方鲇S.meridionalis和怀头鲇两种同属鱼的胃蛋白酶活力,结果发现胃蛋白酶最适pH值为2.6,均低于胃腔内的pH值,而最适温度分别为33℃和35℃,均高于其生活水体环境温度。本试验中对怀头鲇胃蛋白酶分离纯化组分的活性检测结果说明,可以在离体条件下对酶活性质进行深入研究。消化酶分析研究为揭示和评定鱼类早期发育健康状况、食性、添加外源酶效果和自然水域饵料基础等情况可提供生理生化依据[10],如Diaz等[12]通过研究评价鲷科鱼类幼体消化道蛋白酶类,确定了其幼体对外源酶的依赖性,从而进一步了解酶类与食物的相互作用及酶的适应性。消化酶研究还可从消化生理和酶学角度解释或解决鱼类生长和食物转换利用等问题,在减少鱼类氮、磷的排泄量,处理氮、磷超标排放水体,保护生态环境等方面亦有重要意义。
参考文献:
[1] 胡国宏,于铁梅,刘英,等.怀头鲇的含肉率和肌肉营养成分分析[J].大连水产学院学报,2001,15(4):310-312.
[2] 潘伟志,尹洪滨,刘伟,等.怀头鲶♀×鲶鱼♂远缘杂交规模化繁育技术研究[J].水产学杂志,2000,13(2):74-79.
[3] 伍汉霖,金鑫波,倪勇.中国有毒鱼类和药用鱼类[M].上海:上海科学技术出版社,1977.
[4] Kuzmina V V.Effect of temperature on the level of total proteolytic activity of the digestive tract in some freshwater teleosts[J].Journal of Ichthyology,USSR,1990,30(4):667-677.
[5] 刘伟,潘萍芝.饲料成分对幼鲤肝胰脏、肠道蛋白酶活性的影响[C]//全国水产学术会议论文集,1997.
[6] 林仕梅,王友慧,叶元土,等.大鳍鳠蛋白酶活力的研究[J].中国水产科学,2003,10(2):169-171.
[7] 李卫芬,沈涛,陈南南,等.饲料中添加枯草芽孢杆菌对草鱼消化酶活性和肠道菌群的影响[J].大连海洋大学学报,2012,27 (3):221-225.
[8] 唐玲,徐奇友,许红,等.饲料中添加女贞子对镜鲤生长性能、消化酶活性以及肌肉品质的影响[J].大连海洋大学学报,2011, 26(6):560-564.
[9] 牛纪锋,吴锐全,谢骏,等.饲料中添加植酸酶对大口黑鲈生长和消化酶活性的影响[J].大连水产学院学报,2010,25(2): 132-136.
[10] 谭北平.太湖沿岸区几种肉食性鱼类蛋白酶活性的研究[J].湖北农学院学报,1995,15(2):96-98.
[11] 王立波,刘伟,支兵杰.怀头鲇幼鱼摄食前后消化酶活性的变化[J].水产学杂志,2007,20(1):36-41.
[12] Diaz M,Moyano F J,Garcia-Carreno F L,et al.Substrate-SDSPAGE determination of protease activity through larval development in sea bream[J].Aquacult Int,1997,5:461-471.
[13] Becker T,Rapp W.Characterization of human pepsin I obtained from purified gastric pepsinogen I[J].Klin Wochenschr,1979,57: 711-718.
[14] 肖志坚,杨希震,蒋孟军,等.67 ku胃蛋白酶原的分离纯化及性质研究[J].生物化学与生物物理学进展,1996,23(4):342-345.
[15] 于成国,刁尧,赵恂,等.人胃蛋白酶原Ⅰ、Ⅱ的分离纯化[J].中国医科大学学报,2000,29(6):410-411.
[16] 陈躬瑞,柯李晶,赵恒裕,等.底物亲和法分离纯化蕲蛇胃蛋白酶[J].中国食品学报,2001,1(1):50-54.
[17] 朱俊华,李多川,陈静.嗜热真菌Thermomyces lanuginosus热稳定蛋白酶的纯化及特性[J].山东农业大学学报,2002,33(1): 19-22.
[18] 张继平,郭照良,唐冬生,等.暗纹东方鲀胃蛋白酶的分离纯化及部分性质研究[J].湖南农业大学学报:自然科学版,2004,30 (6):526-529.
[19] 黄丽洋,丁建君,姜山,等.斑点叉尾鮰鱼肠蛋白酶的分离纯化及其酶学性质[J].大连海洋大学学报,2012,27(1):83-85.
[20] Ulitina N N,Proskuryakov M T.Proteinases from gastric mucosa of European sheatfish,Silirus glanis L.[J].Applied Biochemistry and Microbiology,2004,40(1):30-34.
[21] Lillehoj E P,Malik V S.Protein purification.Advances in biochemical engineering[J].Biotechnology,1989,40:22-28,33,39-41.
[22] Engelhardt H,Schon U M.Optimal conditions for size exclusion chromatography of proteins[J].Chromatographia,1986,22(7):388 -390.
[23] Tang J,Wolf S,Caputto A.Isolation and crystallization of gastricsin from human gastric juice[J].The Journal of Biological Chemistry, 1959,234(5):1174-1178.
[24] 叶元土,林仕梅,罗莉,等.温度、pH值对南方大口鲶、长吻鮠蛋白酶和淀粉酶活力的影响[J].大连水产学院学报,1998,13 (2):17-23.
[25] 王立波,刘伟,陈军,等.温度、pH对怀头鲇幼鱼胃肠道蛋白酶、淀粉酶活力影响[J].大连水产学院学报,2007,22(4):311 -314.
The screening of proteinase isolation and purification condition in gastric mucosaof northern sheatfish Silirus soldatovi
LIU Wei1,ZENG Zhen2,ZHAN Pei-rong1
(1.Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China;2.College of Sciences, Harbin Institute of Technology,Harbin 150001,China)
Abstract:The crude protease activated fluid(pH 2.8,2 h)was extracted from gastric mucosa of northern sheatfish Silirus soldatovi by two methods of(NH4)2SO4saturated salt gradient.Pepsin crude extracts were dealt with six kinds of combination chromatography conditions,and analyzed by gel filtration chromatography on Sephadex G-75 to produce preliminary purification proteases,and to be identified by protein concentration,protease activity and SDS-polyacrylamide gel electrophoresis analysis.The results showed that good isolation and purification were observed at 28%,56%,and 83%(NH4)2SO4saturated salt gradient.The chromatographic-peak separation solutions under different chromatographic conditions revealed that the specific activity of chromatography-peak protease was increased by about five to nine times compared with that of crude extracts,and the effect of 60 cm(Φ1.6 cm× 52 cm)column chromatography peak separation was quite good.From the crude extract electrophoresis and chromatography-peak shapes under the condition of 0.8 mL/min flowing chromatography peak and the 60 cm chromatography column,and 0.01 mol/L β-alanine-formate buffer(pH 3.3),there were two protein components with molecular weight from 26 000 to 47 000 in stomach proteases of northern sheatfish.
Key words:Silurus soldatovi;pepsin;salting out;gel filtration chromatography
中图分类号:Q494
文献标志码:A
文章编号:2095-1388(2012)06-0558-06
收稿日期:2012-06-04
基金项目:科技部农业科技基金资助项目 (02EFN216900727);哈尔滨市科技局优秀学科带头人项目 (2010RFXYNO47)
作者简介:刘伟 (1960-),女,研究员。E-mail:liuwei_1020@yahoo.com.cn