建鲤急性肝损伤模型的建立及当归提取物的保肝和抗氧化作用研究
曹丽萍,贾睿,丁炜东,杜金梁,殷国俊
(中国水产科学研究院淡水渔业研究中心农业部水生动物遗传育种和养殖生物学重点开放实验室,江苏无锡214081)
摘要:通过四氯化碳 (CCl4)诱导建鲤Cyprinus carpio var.Jian肝损伤并建立急性肝损伤模型,以研究当归提取物 (Extract from Angelica sinennsis,EAS)对肝脏组织的保护和抗氧化作用。采用CCl4腹腔注射法造模,分别测定不同时间和剂量下建鲤血清中谷丙转氨酶 (GPT)、谷草转氨酶 (GOT)、乳酸脱氢酶(LDH)的活性及丙二醛 (MDA)的含量,确定出建模的合适注射浓度和作用时间;用添加0.5%和1.0% (质量分数,下同)的EAS饲料,预防性喂养建鲤60 d后,通过测定鲤血清和肝脏组织中相关生化指标来观察EAS的保肝和抗氧化作用。结果表明:用体积分数为15.00%的CCl4-橄榄油一次性腹腔注射 (剂量为0.1 mL/10 g体质量)建鲤72 h后,能诱导鲤血清中GPT、GOT和LDH活性显著性升高 (P<0.05), MDA大量生成;投喂含0.5%和1.0%的EAS饲料均能显著抑制CCl4致建鲤血清中GOT、GPT和LDH活性的升高 (P<0.05),提高血清中总蛋白 (TP)、白蛋白 (Alb)含量及肝组织总抗氧化能力 (T-AOC),抑制肝组织匀浆中超氧化物歧化酶 (SOD)水平下降;同时,0.5%的EAS还能显著恢复血清中SOD水平和肝组织中谷胱甘肽 (GSH)水平,抑制MDA生成。本研究结果表明,EAS对CCl4诱导的建鲤肝组织损伤具有保护作用,该作用与EAS的清除自由基和抗氧化能力有关。
关键词:四氯化碳;建鲤;当归;抗氧化;模型
肝脏是鱼体内最大的实质性器官,参与消化、代谢、排泄、解毒及免疫等多种生命活动,特别是胃肠吸收的物质几乎全部进入肝脏,在肝脏内进行合成、分解、转化和贮存,因此,鱼类肝脏最易受多种病原体、毒物及免疫病理所累及[1-2];同时环境污染,高蛋白、高脂肪或霉变饲料的使用,以及抗生素和杀虫剂的滥用均可导致鱼类肝胆疾病频繁发生[3]。大量研究证实,在多种肝病的肝细胞损伤中,多种酶、自由基以及脂质过氧化反应均发生较大的变化,氧化应激是它们共同的损伤机制[4]。因此,利用具有生物学活性的肝损伤模型,快速而高通量地筛选护肝药物并探索其作用原理具有重要意义。在人类及其他动物医药的研制与开发中,药理模型的建立和应用发挥着积极的作用,但是在水产领域,鱼类保肝药物筛选模型的研究鲜有报道。
应用中草药防治肝脏疾病有着悠久的历史,很多研究表明,一些中草药提取物及其化学成分对哺乳动物的肝脏具有保护作用[5-6]。近几年来,水产领域有关保肝药物方面的研究也证实,中草药在抗鱼类肝损伤时具有良好的效果和独特的优势,且与其抗氧化和自由基活性有关[7-10]。具抗氧化活性的中草药有望在不久的将来成为广为利用的治疗鱼肝病的高效药。
当归Angelica sinesis(Oliv.)Diels.为伞形科、当归属植物的干燥根,主要活性成分为阿魏酸、当归多糖和藁本内酯等[11],其具有镇痛、抗损伤、增强免疫以及抗氧化和清除自由基等作用[12],是中国常用中药[13]。当归提取物对哺乳动物有较好的抗氧化作用,阿魏酸能通过直接消除自由基、抑制超氧自由基引起的膜脂质过氧化反应以及与生物膜磷脂结合,保护膜脂质等多种机理拮抗自由基对组织的损害[14];当归多糖则通过抑制丙二醛、一氧化氮的生成,减少谷胱甘肽的清除作用,拮抗四氯化碳 (CCl4)诱导的氧化性肝脏损伤,表现出抗氧化作用[15]。然而在水产领域关于当归提取物的保肝和抗氧化作用研究却少有报道。
本研究中,主要以 CCl4诱导建鲤 Cyprinus carpio var.Jian肝损伤,并建立急性肝损伤模型,通过检测鲤血清和肝脏组织匀浆中相关生化指标的变化来评价当归提取物对建鲤急性肝损伤的保护和抗氧化作用,旨在为进一步高通量筛选保肝中药,开发鱼类免疫调节和保肝中草药配方奠定基础。
1 材料与方法
1.1 材料
1.1.1 试剂和仪器 CCl4(分析纯)购于国药集团化学试剂有限公司;谷丙转氨酶 (GPT)、谷草转氨酶 (GOT)、乳酸脱氢酶 (LDH)、丙二醛(MDA)、谷胱甘肽 (GSH)、超氧化物歧化酶(SOD)、总蛋白 (TP)、白蛋白 (Alb)和总抗氧化能力 (T-AOC)等测定试剂盒均购自于南京建成生物工程研究所科技有限公司;723分光光度计购自上海欣茂仪器有限公司。
1.1.2 试验鱼 建鲤采自中国水产科学院淡水渔业研究中心渔场,体质健康无伤,6月龄,体质量为150 g左右,饲养于循环水系统中,水温为25℃,每天投喂商品饲料2次。
1.1.3 中草药 当归提取物 (Extract from Angelica sinennsis,EAS)购自南通四海植物提取有限公司。
1.2 方法
1.2.1 CCl4致建鲤肝损伤模型的建立 将健康建鲤随机分为6组,每组20尾,投喂12 h后,称重,按0.1 mL/10 g(体质量)剂量分别一次性腹腔注射 6.25%、12.50%、15.00%、18.75% 和25.00%(体积分数,下同)的CCl4-橄榄油溶液,对照组注射等体积橄榄油溶液。观察动物的存活情况,于造模后24~144 h取血,测定建鲤血清中GPT、GOT、LDH活性及MDA含量。如动物在试验中死亡,则不进行测定。
1.2.2 CCl4致建鲤肝组织损伤及当归提取物的保护试验 将健康建鲤随机分为4组,每组20尾,试验设4组:空白对照组、模型对照组、低剂量EAS组和高剂量EAS组,其中两对照组均饲喂基础饲料,低剂量EAS组和高剂量EAS组分别饲喂含0.5%和1.0%EAS的饲料,各组均定时定量(投饲量为鱼体质量的2%)投喂商品饲料,共饲养60 d。饲养结束后,除空白对照组腹腔注射橄榄油0.1 mL/10 g(体质量)外,其余各组均腹腔注射15.00%的CCl4-橄榄油溶液0.1 mL/10 g(体质量),禁食,以诱导肝损伤。72 h后采血分离血清,测定各组血清中GPT、GOT、LDH活性及TP和Alb等含量;同时采集各组肝脏组织,制备匀浆,测定匀浆中SOD、MDA、T-AOC和GSH等生化指标。
1.2.3 肝组织匀浆的制备 将抽完血的鱼进行解剖,在肝脏右中叶相同部位取肝脏组织,用预冷的生理盐水漂洗血液,剪去肝脏表面附着的结缔组织,再用滤纸吸去表面水分,称重,用眼科剪刀剪碎,移入匀浆管中,加入9倍体积的生理盐水(体积分数为0.86%)进行匀浆。该匀浆以2 000 r/min离心15 min,收集上清,备用。
1.3 指标的测定及数据分析
按照试剂盒说明书操作测定 GOT、GPT、LDH、MDA、SOD、GSH、T-AOC、Alb和Tb等生化指标,试验数据用平均值±标准误差表示。采用SPSS 15软件包中的单因素方差分析 (one-way-ANOVA)进行显著性分析,用t检验对样本之间进行比较。以P<0.05和P<0.01分别表示有显著性和极显著性差异。
2 结果
2.1 CCl4致建鲤肝损伤模型的建立
试验组按0.1 mL/10 g(体质量)分别一次性腹腔注射6.25%、12.50%、15.00%、18.75%和25.00%的CCl4-橄榄油溶液,对照组注射等量橄榄油,24 h后,18.75%和25.00%的CCl4溶液造模组建鲤的死亡率分别为20%和50%,其它浓度的造模组和对照组均无死亡现象。6.25%、12.50%和15.00%的CCl4溶液造模组及对照组建鲤血清中GPT、GOT、LDH活性及MDA含量的测定结果见图1~图4。
2.1.1 注射不同浓度CCl4对建鲤血清GPT活性的影响 从图1可见:与对照组相比,用12.50%和15.00%的CCl4溶液造模24 h均能引起建鲤血清中GPT活性极显著性升高 (P<0.01);两造模组GPT活性在造模48 h最高,72 h次之,随后迅速降低,第96 h后,GPT值恢复到接近正常水平。
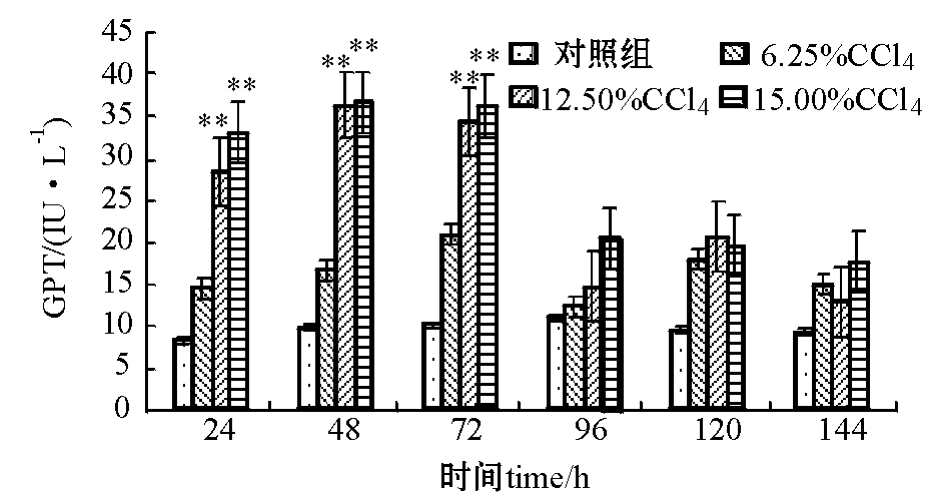
图1 CCl4浓度对建鲤血清中GPT活性的影响
Fig.1 Effects of CCl4concentration on serum GPT ac
tivity in Jian common carp
注:*表示与对照组有显著性差异 (P<0.05);**表示与对照组有极显著性差异 (P<0.01),下同。
Note:*means significant difference compared with the control(P<0.05);**means very significant difference compared with the control(P<0.01),et sequentia.
2.1.2 注射不同浓度CCl4对建鲤血清GOT活性的影响 从图2可见:与对照组相比,用12.50%和15.00%的CCl4溶液造模24 h均能引起建鲤血清中GOT活性显著性升高 (P<0.05),均维持到造模后72 h,随后迅速降低,第96 h后,GOT值恢复到接近正常水平。
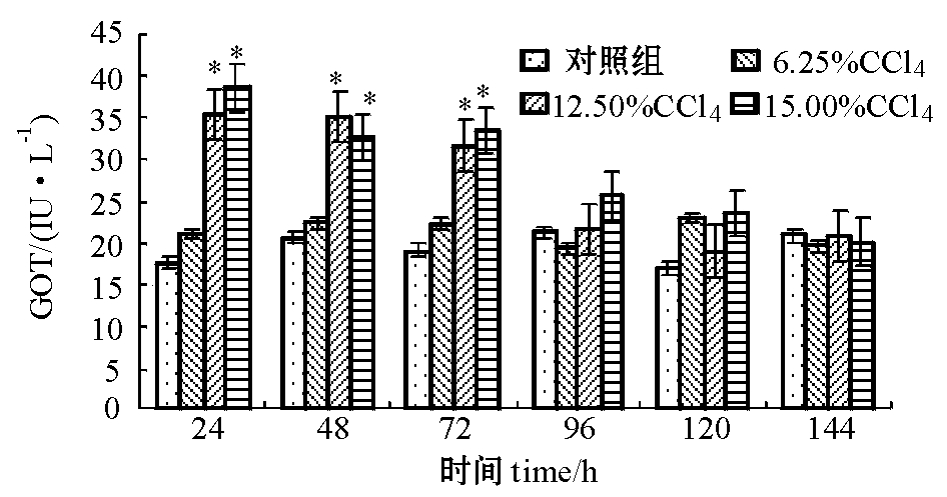
图2 CCl4浓度对建鲤血清中GOT活性的影响
Fig.2 Effects of CCl4concentration on serum GOT activity in Jian common carp
2.1.3 注射不同浓度CCl4对建鲤血清LDH活性的影响 从图 3可见:与对照组相比,仅用15.00%的CCl4溶液造模48 h能引起建鲤血清中LDH活性显著性升高 (P<0.05),维持到造模后72 h,随后迅速降低,第96 h后,LDH值恢复到接近正常水平。
2.1.4 注射不同浓度CCl4对建鲤血清MDA含量的影响 从图4可见:与对照组相比,用12.50%和15.00%的CCl4溶液造模24 h均能引起血清中MDA含量极显著性升高 (P<0.01);12.50%CCl4溶液造模组中MDA水平在造模第72 h恢复,而15.00%CCl4溶液造模组中MDA水平维持到第96 h,MDA值恢复到接近正常水平。
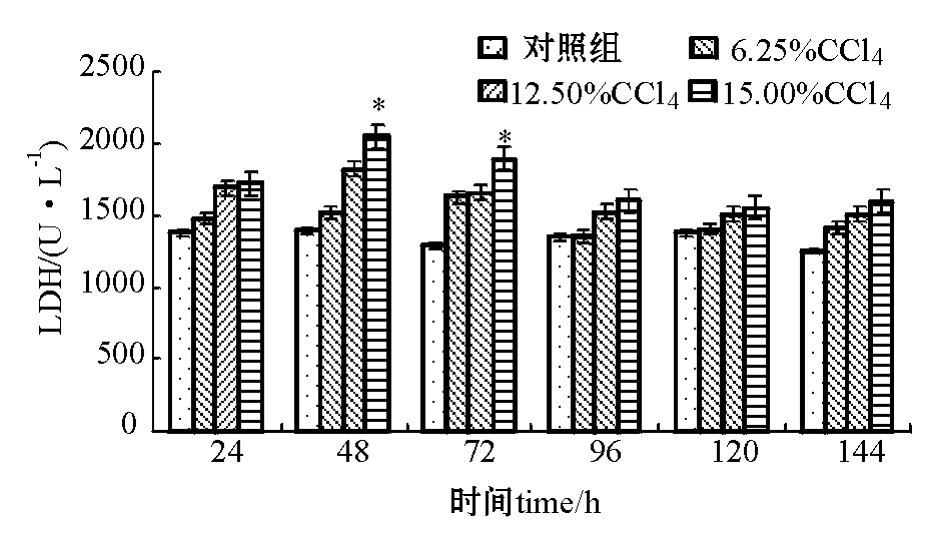
图3 CCl4浓度对建鲤血清中LDH活性的影响
Fig.3 Effects of CCl4concentration on serum LDH activity in Jian common carp
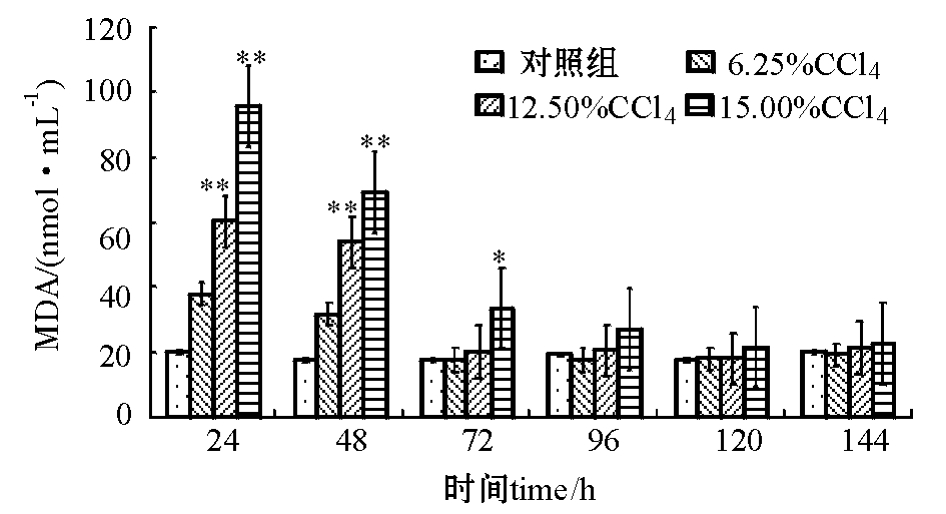
图4 CCl4浓度对建鲤血清中MDA含量的影响
Fig.4 Effects of CCl4concentration on serum MDA levels in Jian common carp
综上所述,按0.1 mL/10 g(体质量)一次性腹腔注射15.00%的CCl4-橄榄油溶液作用72 h,比较合适构建建鲤的肝损伤模型。
2.2 当归提取物的保护作用
2.2.1 EAS对CCl4致肝损伤的建鲤血清中GOT、GPT、LDH和SOD的影响 从图5可见:与空白对照组相比,用15.00%的CCl4-橄榄油腹腔注射建鲤72 h后,鲤血清中的GOT、GPT和LDH活性极显著性升高 (P<0.01),而SOD活性极显著性下降 (P<0.01);与模型对照组相比,0.5%和1.0%的EAS均能显著抑制CCl4诱导的鲤血清中GOT、GPT和 LDH活性升高 (P<0.01或 P<0.05);同时0.5%的EAS对恢复血清中的SOD活性有显著作用 (P<0.05)。
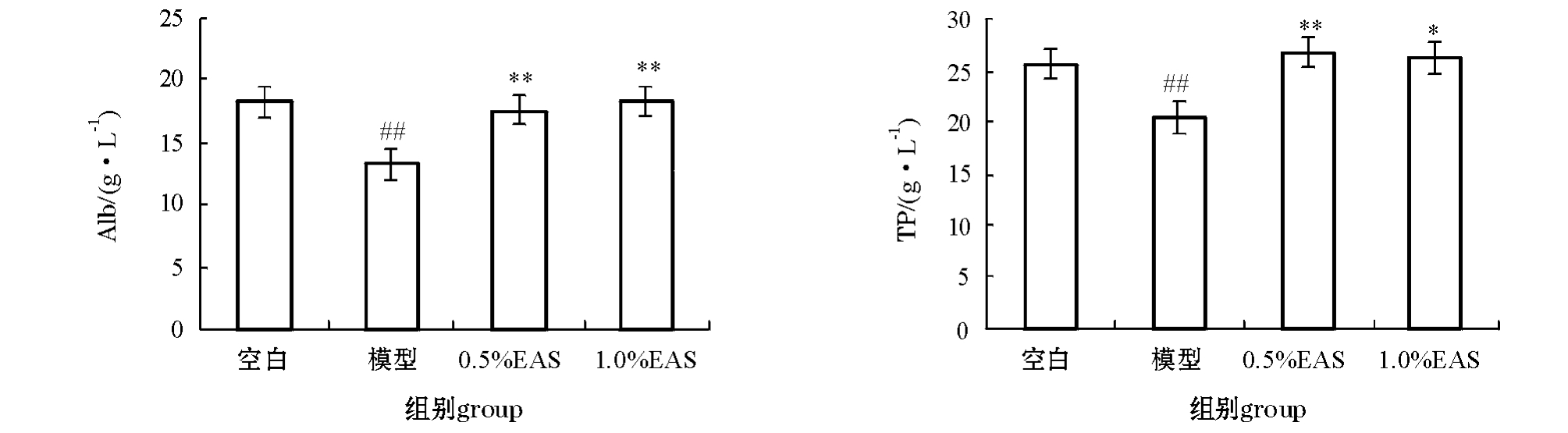
2.2.2 EAS对CCl4肝损伤的建鲤血清中TP和Alb的影响 从图6可见:与空白对照组相比,用15.00%的CCl4-橄榄油腹腔注射建鲤72 h后,鲤血清中的TP和Alb含量极显著性下降 (P<0.01);与模型组相比,0.5%和1.0%的EAS均可以显著恢复鲤血清中的TP和Alb含量 (P<0.01或P<0.05)。
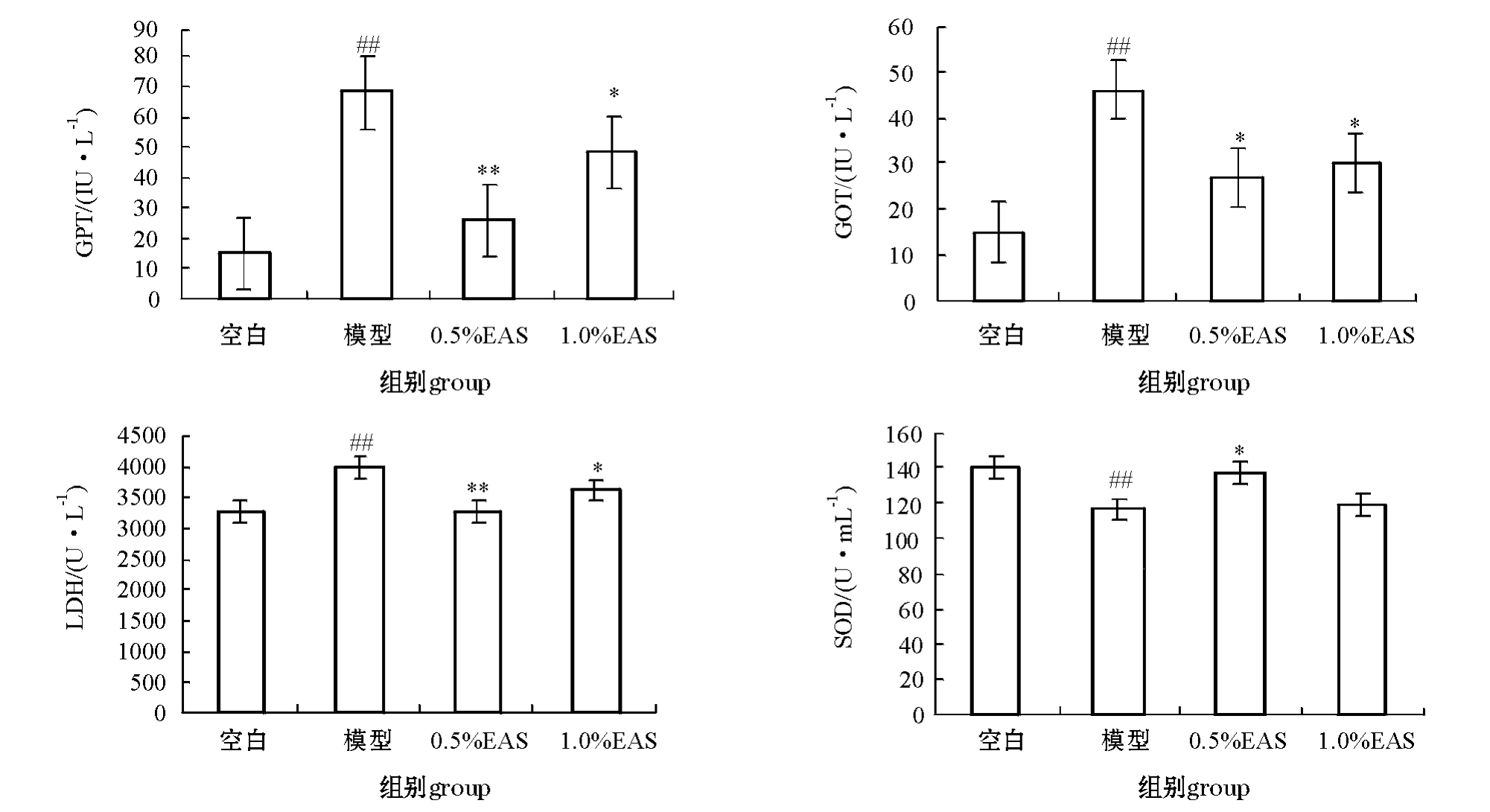
图5 当归提取物对CCl4致肝损伤的建鲤血清中GPT、GOT、LDH和SOD活性的影响
Fig.5 Effects of extract from Angelica sinennsis on the activities of GPT,GOT,LDH and SOD in hepatic-damaged Jian common carp
注:1)#表示与空白对照组相比有显著性差异 (P<0.05);##表示与空白对照组相比有极显著性差异 (P<0.01)。2)*表示与模型对照组相比有显著性差异 (P<0.05);**表示与模型对照组有极显著性差异 (P<0.01),下同。
Note:1)#means P<0.05;##means P<0.01,compared with cells treated with control group only.2)*means P<0.05;**means P<0.01, compared with cells treated with CCl4only,et sequentia.
2.2.3 EAS对CCl4肝损伤的建鲤肝组织匀浆中T -AOC、GSH、SOD和MDA的影响 从图7可见:与空白对照组相比,用15.00%的CCl4-橄榄油腹腔注射建鲤72 h后,肝组织匀浆中的GSH、SOD活性及 T-AOC水平极显著性下降 (P<0.01), MDA含量显著性升高 (P<0.05);与模型对照组相比,0.5%的EAS能显著促进组织中GSH、SOD活性及T-AOC水平恢复 (P<0.01或P<0.05),同时显著抑制MDA合成 (P<0.05);1.0%的EAS可以显著提高匀浆中T-AOC水平和 SOD活性(P<0.05),但对GSH活性和MDA含量没有明显影响 (P>0.05)。
3 讨论
3.1 CCl4致建鲤肝损伤模型的建立
CCl4是一种经典的肝脏毒物,被广泛用于构建肝 (细胞)损伤模型以筛选保肝药物[16]。CCl4可通过细胞色素P450作用分解为三氯甲烷自由基(CCl3·)[17],CCl3·既能选择性地损伤肝小叶中央区的细胞,又能迅速与O2结合转化为过氧化三氯甲烷自由基(CCl3O2·)[18],这些自由基通过攻击肝细胞膜上磷脂分子引起脂质过氧化,损伤肝细胞;同时CCl4能抑制内源性抗氧化酶(如SOD)活性,致使大量自由基无法清除,加重脂质过氧化[19],而MDA是脂质过氧化的主要降解产物[20],可严重损伤肝细胞结构,导致肝细胞坏死,进一步加重肝细胞的损伤,并阻断膜蛋白的合成,使胞浆内的可溶性酶渗出,导致血清中 GOT、GPT和LDH活性上升[21-22]。据此,本研究中选择血清中GOT、GPT、LDH、SOD、MDA及相关辅助性生化指标等来确定CCl4致建鲤肝损伤模型所需浓度及时间,并以此评价当归提取物的保肝和抗氧化作用。
构建急性肝损伤模型来筛选保肝药物,关键是造模浓度的选择,既要求肝损伤指标明显,又要求高存活率。浓度过小,损伤轻,指标变化不明显,不利于分析保肝药药效;浓度过大,容易引起肝功能衰竭,导致死亡率增加,造成药品和动物的浪费且不利于统计分析[23]。本试验在造模过程中,不仅要探索CCl4造模的剂量,还要考虑到最终的注射剂量,依据鱼体质量决定的注射剂量一次性给予太多会导致溶液泄漏,造成剂量不精准;另外,本研究中还发现,采用腹腔注射法来造模,能有效减少由于操作失误导致的鱼体死亡。通过测定血清中GOT、GPT、LDH和MDA等生化指标,确定CCl4致建鲤肝损伤模型的最佳浓度及时间:15.00% CCl4溶液,0.1 mL/10 g(体质量),腹腔注射作用72 h。该急性肝损伤模型具有以下特点:一次性给药,剂量精准,操作简单;肝损伤指标明确;周期短,建鲤全部存活。
3.2 当归提取物的保护作用
CCl4在体内形成的自由基 (CCl3·)可促使细胞膜上不饱和脂肪酸分解,最终导致细胞膜破坏,GOT、GPT和LDH逸出,使其在血液中的含量升高[24]。GOT和GPT是反映线粒体膜损伤和肝细胞损伤的重要指标。本试验结果显示,0.5%和1.0%的中药均能显著抑制 CCl4诱导的血清中GOT、GPT和LDH升高,说明EAS能抵抗磷脂氧化,保护生物膜。当归提取物的两种主要活性成分——当归多糖和阿魏酸钠对大鼠和小鼠保肝作用的研究也表明,EAS有保护细胞膜完整性的作用[25-26]。
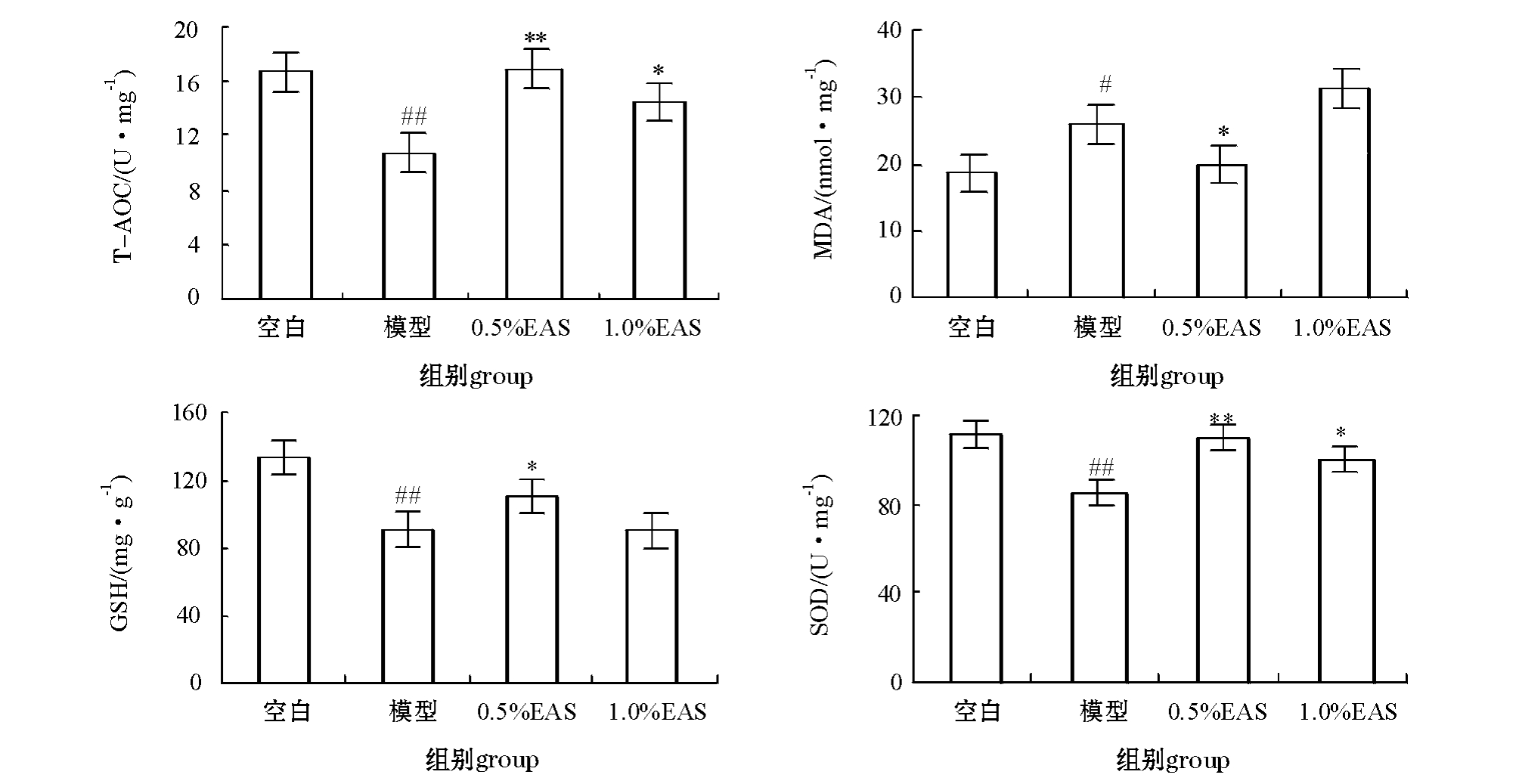
图7 当归提取物对CCl4致肝损伤建鲤组织匀浆中T-AOC、MDA含量及GSH、SOD活性的影响
Fig.7 Effects of extract from Angelica sinennsis on homogenous T-AOC,and MDA levels,and GSH,and SOD activities in the hepatic-damaged Jian common carp
SOD是动物机体内的抗氧化酶,能清除自由基,防止自由基对细胞结构的损伤,其活力的大小反映了机体抗氧化、 清除自由基的能力[17,27-28]。GSH是一种生物体内最丰富的三肽非酶类抗氧化剂[29-31],可直接消除活性氧自由基,同时作为谷胱甘肽过氧化物酶的底物,在清除细胞内过氧化氢及脂过氧化物中发挥作用,GSH的多少是衡量机体抗氧化能力大小的重要因素[32]。MDA是细胞膜脂质过氧化反应的终产物,细胞中MDA含量多少可反映细胞脂质过氧化的损伤程度[20]。当归的清除自由基和抗脂质过氧化作用已在哺乳动物上做过大量的试验研究。曾国华等[33]在研究用阿魏酸钠预处理对大鼠心肌细胞缺氧/复氧损伤的延迟保护作用时发现,其有强大的抗自由基损伤的作用,主要表现为增加SOD、GSH-Px活性,减少MDA含量。袁新初等[34]的报道也证实,当归注射液的清除自由基和抗脂质过氧化作用能有效保护更年期大鼠。本研究中也得出了一致的结论,0.5%、1.0%的EAS对恢复肝损伤建鲤血清和肝脏组织中SOD、GSH含量有显著效果;0.5%的EAS能显著抑制MDA合成。由此可推测,EAS对CCl4诱导的建鲤肝组织损伤的保护作用应与其清除自由基能力和还原能力有关,EAS能较好地恢复SOD酶活性,减少MDA的生成及还原性GSH的消耗,从而增强机体的抗氧化能力。
本研究中以CCl4为损伤剂成功建立了建鲤肝损伤模型,并研究了EAS对急性肝损伤的保护作用,结果显示,EAS能通过提高GSH和SOD酶活力以及抑制脂质过氧化产物MDA的生成来减轻CCl4对肝的损伤,减少GPT、GOT和LDH的释放,对CCl4造成的肝急性损伤具有一定的保护作用,且该保护作用可能与其抗氧化、清除自由基能力有关,这将为进一步了解EAS对损伤肝细胞保护的药理作用机制及筛选更多的中草药提供了基础资料。
参考文献:
[1] Arnold H,Pluta H J,Braunbeck T.Sublethal effects of prolonged exposure to disulfoton in rainbow trout(Oncorhynchus mykiss): cytological alterations in the liver by a potent acetylcholine esterase inhibitor[J].Ecotoxicology and Environmental Safety,1996,34 (1):43-55.
[2] Moutouk K,Braunbeck T,Houlihan D.Quantitative analysis of alterations in liver ultrastructure of rainbow trout Oncorhynchus mykiss after administration of the aquaculture antibacterials oxolinic acid and flumequine[J].Diseases of Aquatic Organisms,1997, 29:21-34.
[3] Cabello F C.Heavy use of prophylactic antibiotics in aquaculture: a growing problem for human and animal health and for the environment[J].Environmental Microbiology,2006,8(7):1137-1144.
[4] 王小莺,胡国良,张彩英,等.保肝护脾液对四氯化碳所致小鼠急性肝损伤的保护作用[J].中兽医学杂志,2006(2):10-11.
[5] Wu Y,Wang F,Zheng Q,et al.Hepatoprotective effect of total flavonoids from Laggera alata against carbon tetrachloride-induced injury in primary cultured neonatal rat hepatocytes and in rats with hepatic damage[J].Journal of Biomedical Science,2006,13(4): 569-578.
[6] Rudnicki M,Silveira M,Pereira T,et al.Protective effects of Passiflora alata extract pretreatment on carbon tetrachloride induced oxidative damage in rats[J].Food and Chemical Toxicology,2007, 45(4):656-661.
[7] Yin G,Cao L,Xu P,et al.Hepatoprotective and antioxidant effects of Hibiscus sabdariffa extract against carbon tetrachloride-induced hepatocyte damage in Cyprinus carpio[J].In Vitro Cellular&Developmental Biology-Animal,2011,47(1):10-15.
[8] Malekinejad H,Alizadeh A,Cheraghi H,et al.The protective effect of liquorice plant extract on CCl4-induced hepatotoxicity in common carp(Cyprinus carpio)[J].Veterinary Research Forum, 2010,1(3):158-164.
[9] 吴亚楠,柳鹏,李强,等.复方中草药对仿刺参免疫力和抗病力的影响[J].大连海洋大学学报,2011,26(4):338-343.
[10] 李华,李强,付雷,等.几种中草药对海水养殖中常见病原菌的抗菌作用[J].大连海洋大学学报,2011,26(1):6-11.
[11] 王芳,李东.当归的化学及药理研究进展[J].中国药房, 2003,14(10):630-631.
[12] 康军.当归化学成分及其药理作用研究进展[J].医药产业资讯,2005(23):120.
[13] Lao S C,Li S P,Kan K K W,et al.Identification and quantification of 13 components in Angelica sinensis(Danggui)by gas chromatography-mass spectrometry coupled with pressurized liquid extraction[J].Analytica Chimica Acta,2004,526(2):131-137.
[14] 马清均,王淑玲.常用中药现代研究与临床[M].天津:天津科技翻译出版公司,1995:622.
[15] 王燕,单体中.当归多糖的生物学功能研究进展[J].中国饲料,2006(9):18-21.
[16] Koneri R,Balaraman R,Firdous K M V.Hepatoprotective effects of Momordica Cymbalaria Fenzl.against carbon tetrachloride induced hepatic injury in rats[J].Pharmacology Online,2008,1: 365-374.
[17] Recknagel R O,Glende J R E,Dolak J,et al.Mechanisms of carbon tetrachloride toxicity[J].Pharmacology&Therapeutics,1989, 43(1):139-154.
[18] Mitra S,Venkataranganna M,Sundaram R,et al.Effect of HD-03,a herbal formulation,on the antioxidant defence system in rats [J].Phytotherapy Research,1998,12(2):114-117.
[19] Zhou J F,Cai D,Zhu Y G,et al.A study on relationship of nitric oxide,oxidation,peroxidation,lipoperoxidation with chronic cholecystitis[J].World J Gastroenterol,2000,6(4):501-507.
[20] Ohta Y,Sasaki E,Nishida K,et al.Contribution of the antilipid peroxidative action of Dai-saiko-to extract to its preventive effect on carbon tetrachloride-induced acute liver injury in rats[J].Phytotherapy Research,1998,12:5-8.
[21] Berry M N,Halls H J,Grivell M B.Techniques for pharmacological and toxicological studies with isolated hepatocyte suspensions [J].Life Sciences,1992,51(1):1-16.
[22] Romero F J,Bosch-Morell F,Romero M J,et al.Lipid peroxidation products and antioxidants in human disease[J].Environmental Health Perspectives,1998,106(Suppl 5):1229-1234.
[23] 刘霞,王泰龄,赵静波,等.D-半乳糖胺致大鼠急性肝损伤模型制作的改进[J].中日友好医院学报,1996,10(4):305-308.
[24] Halliwell B,Gutteridge J.Role of free radicals and catalytic metal ions in human disease:An overview[J].Methods in Enzymology, 1990,186:1-85.
[25] Ye Y N,Liu E S L,Li Y,et al.Protective effect of polysaccharides -enriched fraction from Angelica sinensis on hepatic injury[J].Life Sciences,2001,69(6):637-646.
[26] 计一平,胡晋红,刘涛,等.阿魏酸钠对小鼠急性肝损伤的保护作用[J].第二军医大学学报,2000,10:999-1001.
[27] 许治冲,刘晖,徐奇友,等.温度和饲料脂肪水平对松浦镜鲤免疫及抗氧化能力的影响[J].大连海洋大学学报,2012,27 (5):429-435.
[28] 唐玲,徐奇友,许红,等.饲料中添加女贞子对镜鲤生长性能、消化酶活性以及肌肉品质的影响[J].大连海洋大学学报, 2011,26(6):560-564.
[29] Meister A.New aspects of glutathione biochemistry and transport selective alterations of glutathione metabolism[J].Nutr Rev,1984, 42:397-400.
[30] 孙向军,罗琳,姜志强,等.饲料脂肪水平对锦鲤体色和几项免疫指标的影响[J].大连海洋大学学报,2011,26(5):397-401.
[31] 唐玲,徐奇友,王常安,等.不同水温和饲料蛋白质水平对镜鲤血清生化指标的影响[J].大连海洋大学学报,2011,26(1): 41-46.
[32] Iwamoto A,Egashira T,Takayama F,et al.Changes in free radical -related substances in plasma folling is chemia-reperfution in rat liver[J].Pathophysiology,2002(8):167-174.
[33] 曾国华,何明,陈和平,等.阿魏酸钠预处理对大鼠心肌细胞缺氧/复氧损伤的延迟保护作用[J].中药药理与临床,2007, 23(5):57-60.
[34] 袁新初,张瑞莲.当归注射液对更年期大鼠超氧化物歧化酶和脂质过氧化物的影响[J].中草药,2001,32(9):822-823.
Establishment of the acute hepatic injury model and antioxidant effects of extract from Angelica sinennsis in common carp Cyprinus carpio var.Jian
CAO Li-ping,JIA Rui,DING Wei-dong,DU Jin-liang,YIN Guo-jun
(Key Open Laboratory for Genetic Breeding of Aquatic Animals and Aquaculture Biology,Ministry of Agriculture,Freshwater Fisheries Research Center,Chinese Academy of Fishery Sciences,Wuxi 214081,China)
Abstract:The present study aimed to develop a vivo model of acute hepatotoxicity using carbon tetrachloride (CCl4)as hepatotoxicant and to evaluate the antioxidant effects of an extract from Angelica sinennsis(EAS)against CCl4induced hepatotoxicity in Jian common carp(Cyprinus carpio var.Jian).The Jian common carp model of acute hepatic injury was induced by intraperitoneal injection of CCl4.To define the most optimal CCl4action concentration and time,the serum glutamate oxalate transaminase(GOT),glutamate pyruvate transaminase(GPT),lactate dehydrogenase(LDH)and malondialdehyde(MDA)were detected at different time and doses.The Jian common carp was fed the diet containing EAS at a dose of 0.5 and 1 g/100 g for 60 days prior to CCl4intoxication,and the changes in hepatic function markers in serum and hepatic tissue were analyzed to evaluate the antioxidant effects of EAS on the hepatopancrease.Results showed that the serum level of MDA and GOT,GPT,and LDH activities were found to be significantly elevated in the group injected with 15.00%(in volume)of CCl4in olive oil at a volume of 0.1 mL/10 g of body weight for 72 h.In vivo,administration of EAS at the doses of 0.5 and 1 g/100 g in the diet for 6 0 days led to significant reduce in the activities of GPT,GOT and LDH and increase in the reduced levels of total protein(TP)and albumin(Alb)in the serum.Meanwhile,the reduced levels of superoxide dismutase (SOD),glutathione(GSH)and total antioxidant capacity(T-AOC)were markedly increased and the MDA formation was significantly inhibited in the hepatopancrease.Fish
received:0.5 g/100 g of EAS in the diets showed significant restoration of SOD activities in blood serum and glutathione(GSH)in liver homogenate,and reduction of MDA.The findings proved the hepatoprotective action of EAS,which is likely related to antioxidative activity,and support the use of EAS as a hepatoprotective and antioxidant agent in fish.
Key words:carbon tetrachloride;Cyprinus carpio var.Jian;Angelica sinennsis;antioxidation;model
中图分类号:S965.116
文献标志码:A
文章编号:2095-1388(2012)06-0551-07
收稿日期:2012-03-25
基金项目:科技部国际科技合作项目 (2009DFA32620);无锡市科技计划 (国际科技合作)项目 (CZE00906);中央级公益性科研院所基本科研业务费专项资金资助项目 (2011JBFC05)
作者简介:曹丽萍(1977-),女,助理研究员。E-mail:dingwd@126.com
通信作者:殷国俊 (1967-),男,研究员。E-mail:yingj@ffrc.cn