鳜胰岛素样生长因子-ⅡcDNA基因的克隆与表达特征
刘俊,赵金良,张敏,代威
(上海海洋大学农业部淡水水产种质资源重点实验室,上海201306)
摘要:为全面获得鳜Siniperca chuatsi GH-IGFs生长发育轴的调控因子特征,采用RT-PCR、cDNA末端快速扩增 (RACE)技术成功克隆了肝组织胰岛素样生长因子-Ⅱ (IGF-Ⅱ)cDNA序列。结果表明:鳜IGF -ⅡcDNA全长为1 643 bp,包括5′端非翻译区103 bp、3′端非翻译区892 bp和开放阅读框648 bp,开放阅读框编码215个氨基酸;鳜IGF-Ⅱ前肽由信号肽、成熟肽和E肽3部分组成,其中信号肽为47个氨基酸,成熟肽为70个氨基酸,E肽为98个氨基酸;鳜IGF-Ⅱ氨基酸序列与其他脊椎动物的相似度为81%~98%,与鳜IGF-Ⅰ的相似度为62.5%。运用实时荧光定量PCR技术检测了鳜成鱼不同组织以及孵化后0~22 d仔稚鱼中IGF-ⅡmRNA的表达情况,结果表明:IGF-ⅡmRNA在鳜脑中表达量最高,在肌肉、心脏、胃、鳃、肾脏中表达量次之,在脾、前肠、后肠、性腺、肝脏中表达量较低;在孵化后早期发育阶段均检测到有IGF-ⅡmRNA表达,孵化当天 (0 d)表达量最高,之后表达量有所降低。本研究结果可为鳜IGF-Ⅱ对生长发育的调控作用研究提供科学依据。
关键词:鳜;胰岛素样生长因子-Ⅱ;基因表达
鱼类具有特殊的生长模式,即成年期后仍继续生长[1]。由于GH-IGFs轴是脊椎动物生长发育的主要内分泌调控轴[2-3],因此,鱼类成为脊椎动物GH-IGFs轴生长调控作用研究的重要模式动物。胰岛素样生长因子 (Insulin-like growth factors,IGFs)是一类在结构上与胰岛素原具有高度同源性的多肽,IGF系统包括2个配体(IGF-Ⅰ、IGF-Ⅱ), 2个受体 (IGF-Ⅰreceptor、IGF-Ⅱreceptor),6个结合蛋白 (IGF binding proteins,IGFBPs)[4]。其中,IGF-Ⅱ与胰岛素、IGF-Ⅰ有67~70个同源氨基酸,通过IGF系统介导的信号通路,参与调节动物生长、繁殖、细胞增殖与分化、抑制细胞凋亡等多种生理作用[5]。
鳜Siniperca chuatsi是中国特有的名贵淡水经济鱼类之一,也是鳜类中生长速度最快的种类。对其GH[6]和IGF-Ⅰ[7]基因特征的研究已有报道。为全面掌握鳜IGF的基因特征,本研究中,作者通过RACE技术克隆了鳜IGF-Ⅱ cDNA全长序列,对其结构特征进行了初步分析,并采用实时荧光定量PCR技术对成体不同组织以及个体发育早期阶段IGF-ⅡmRNA的表达特征进行了分析,旨在为进一步开展鳜IGF-Ⅱ对生长发育的调控作用研究提供科学依据。
1 材料与方法
1.1 材料
鳜成鱼、仔稚鱼样品均取自上海市浦东新区孙农水产养殖场,仔稚鱼分别于孵化后0、2、4、6、8、10、12、14、16、19、22 d采集,由于早期鱼苗太小,孵化后0~12 d的样品20尾为一组,孵化后13~22 d的样品10尾为一组,每次采样3组。鱼苗先用无菌水冲洗,再用无菌吸水纸擦干,装入无 RNase的 Eppendorf管中液氮速冻,并于-80℃下保存备用。
总RNA抽提试剂RNAisoTMPlus、RNA PCR Kit(AMV)Ver.3.0、SMARTerTMRACE cDNA Amplification Kit、DNA Fragment Purification Kit、SYBRRPrimeScriptTMRT-PCR Kit、pMD19-T载体均购自宝生物工程 (大连)有限公司;DNA Ladder、Loading Buffer、普通琼脂糖凝胶DNA回收试剂盒、大肠杆菌DH5α均购自天根生化科技 (北京)有限公司;其余试剂均为国产分析纯。
1.2 方法
1.2.1 总RNA的提取与cDNA的合成 将鳜成鱼活体解剖,取其肝组织,于液氮中冷冻并研磨,按照RNAisoTMPlus试剂盒说明书抽提总RNA。按照DNaseⅠ (RNase Free)试剂盒说明书去除基因组DNA的污染。使用SMARTerTMRACE cDNA Amplification Kit试剂盒合成3′RACE-Ready-cDNA和5′RACE-Ready-cDNA,于冰箱 (-20℃)中保存备用。
1.2.2 引物设计与合成 所用引物见表1,均由上海生工生物工程技术服务有限公司合成。
表1 引物序列及退火温度
Tab.1 Nucleotide sequences and annealing temperature of oligonucleotide primers
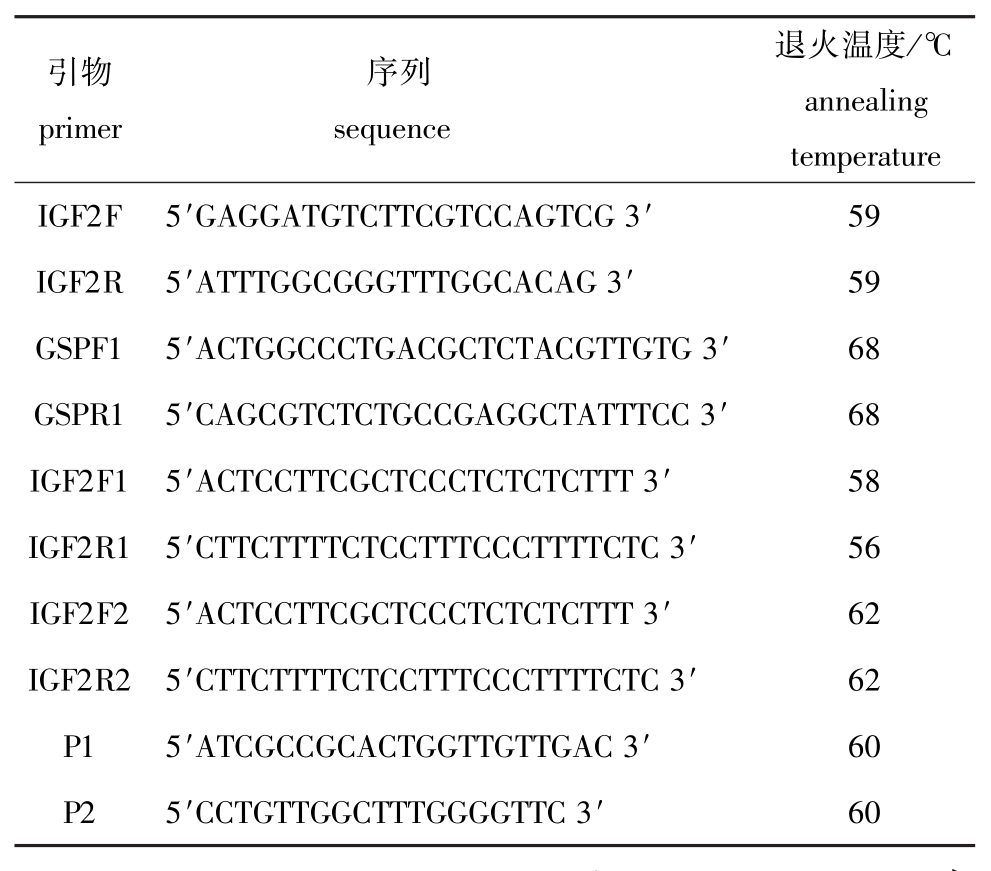
引物primer序列sequence退火温度/℃annealing temperature IGF2F 5′GAGGATGTCTTCGTCCAGTCG 3′ 59 IGF2R 5′ATTTGGCGGGTTTGGCACAG 3′ 59 GSPF1 5′ACTGGCCCTGACGCTCTACGTTGTG 3′ 68 GSPR1 5′CAGCGTCTCTGCCGAGGCTATTTCC 3′ 68 IGF2F1 5′ACTCCTTCGCTCCCTCTCTCTTT 3′ 58 IGF2R1 5′CTTCTTTTCTCCTTTCCCTTTTCTC 3′ 56 IGF2F2 5′ACTCCTTCGCTCCCTCTCTCTTT 3′ 62 IGF2R2 5′CTTCTTTTCTCCTTTCCCTTTTCTC 3′ 62 P1 5′ATCGCCGCACTGGTTGTTGAC 3′ 60 P2 5′CCTGTTGGCTTTGGGGTTC 3′ 60
1.2.3 RT-PCR和RACE扩增 IGF-ⅡcDNA小片段的RT-PCR扩增按照TaKaRa RNA PCR Kit (AMV)Ver.3.0说明书进行操作。RACE扩增按照SMARTerTMRACE cDNA Amplification Kit试剂盒说明书进行操作。主要步骤如下:以3′-RACEReady cDNA为模板,用通用引物UPM和GSPF1进行3′-RACE扩增,扩增程序为94℃下变性30 s, 68℃下退火30 s,72℃下延伸3 min,共进行30个循环,于4℃下保存;以5′-RACE-Ready cDNA为模板,用通用引物UPM和GSPR1进行5′-RACE扩增,扩增程序为94℃下变性30 s,66℃下退火30 s,72℃下延伸2 min,共进行35个循环,于4℃下保存。同时,以IGF2F1和 IGF2R1为引物,扩增含阅读框的cDNA序列用于验证。
1.2.4 产物纯化、克隆与测序 RT-PCR和RACE产物经12 g/L琼脂糖凝胶电泳检测,用普通琼脂糖凝胶DNA回收试剂盒进行回收纯化。纯化产物分别与pMD19-T载体连接构建重组质粒,转化至大肠杆菌DH5α感受态细胞中,经LB平板(含Amp+、IPTG和X-gal)培养后,筛选重组子进行插入片段检测。序列测定由上海生工生物工程技术服务有限公司完成。
1.2.5 生物信息学分析 应用BioEdit和Edit Seq软件进行开放阅读框 (ORF)分析并推导相应的氨基酸序列;用Signal P 3.0 server软件进行信号肽分析,用Scratch预测二硫键;用Blast软件进行序列同源性分析,用Clustal W进行多序列比对,用EmbossMBOSS进行序列相似度分析;用Mega 4.1软件构建NJ系统进化树。
1.2.6 实时荧光定量PCR分析 以脑组织总RNA (质量浓度为500 ng/μL)为模板,按照 SYBRRPrimeScriptTMRT-PCR Kit试剂盒说明书进行反转录。反转录产物用EASY Dilution进行10倍梯度稀释,共设5个梯度,每个梯度设3个重复,分别以IGF-Ⅱ基因引物 (IGF2F2、IGF2R2)和内参基因β-actin引物 (P1、P2)配制实时定量PCR反应液,在BioRad IQ5实时荧光定量 PCR仪上进行Real Time PCR反应。根据各扩增曲线的Ct值及对应各稀释梯度的对数值,制作标准曲线。
分别提取3尾鳜成鱼的胃、肾脏、脾、脑、前肠、后肠、鳃、心脏、性腺、肌肉、肝脏11个组织,以及孵化后 0、2、4、6、 8、 10、 12、14、16、19、22 d仔稚鱼总RNA,将起始浓度调到合适浓度后进行反转录,再以反转录产物为模板,按照上述步骤分别进行IGF-Ⅱ和β-actin基因的Real Time PCR反应。
2 结果
2.1 鳜IGF-ⅡcDNA全长序列与结构特征
小片段扩增产物经克隆、测序后获得长266 bp片段,再用 Blastn检索 NCBI核酸数据库,用Blastx检索NCBI蛋白质库,发现该序列与其他鱼类IGF-Ⅱ有较高的同源性,初步确定此片段为鳜IGF-ⅡcDNA部分序列;3′RACE产物经测序得到长度为1 425 bp的序列(图1-A),5′RACE产物经测序得到长度为320 bp的序列(图1-B)。将3′RACE、5′RACE和小片段序列进行比对、拼接后得到长度为1 643 bp cDNA全长序列 (GenBank序列号为HM164111.1)。以IGF2F1和IGF2R1为引物扩增包含编码区的cDNA序列,进行验证(图1-C)。
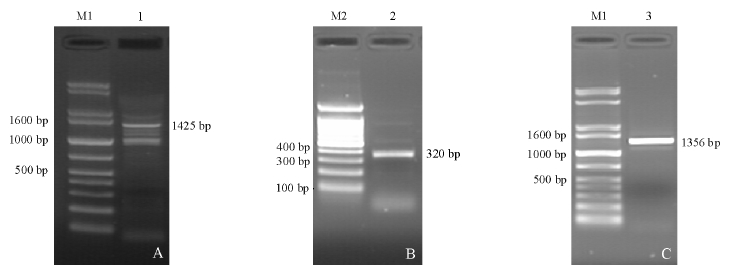
图1 鳜IGF-Ⅱ3′RACE、5′RACE和编码区扩增结果
Fig.1 Amplification of 3忆RACE,5忆RACE and coding region products in S.chuatsi IGF-Ⅱ
IGF-ⅡcDNA包括103 bp的5′端非翻译区、648 bp的开放阅读框 (ORF)、892 bp的3′端非翻译区以及一个非典型的多聚腺苷酸 (attaaa)信号序列,开放阅读框编码215个氨基酸残基 (图2),相对分子质量为24 700,等电点为9.96。其中,前47个氨基酸为信号肽,中间70个氨基酸为成熟肽,后98个氨基酸序列为E肽。氨基酸序列中,第56、68、96、97、101、110位的6个半胱氨酸可形成3个二硫键。
IGF-Ⅱ成熟肽由B、C、A、D 4个区域组成,其中B区域有32个氨基酸,C区域有11个氨基酸,A区域有21个氨基酸,D区域有6个氨基酸(图3)。鳜IGF-Ⅱ成熟肽氨基酸序列与其他脊椎动物的相似度达到81%~98%,其中,B、A和D区域较为保守,C区域变异较大。
根据IGF-Ⅱ氨基酸序列构建了脊椎动物NJ系统进化树 (图4),鳜和其他硬骨鱼类聚为一支,哺乳类、鸟类和两栖类聚为另一支,物种间的亲缘关系与其传统分类地位一致。
2.2 鳜各组织、幼体发育早期IGF-Ⅱ的表达
2.2.1 成体不同组织中IGF-ⅡmRNA的表达 利用实时荧光定量PCR法分析IGF-Ⅱ基因在不同组织中的表达情况,以内参基因β-actin对各组织起始RNA进行校正,以肾组织作为对照因子,因目的基因 IGF-Ⅱ和内参基因 β-actin扩增效率兼容[8],故采用2-ΔΔCt法对不同组织IGF-ⅡmRNA的表达量进行比较。从图5可见:各组织中均有IGF-ⅡmRNA表达,其中IGF-ⅡmRNA在脑中表达量较高,在肾、胃、鳃、心脏、肌肉中表达量次之,在脾、前肠、后肠、性腺、肝脏中表达量较低。
2.2.2 幼体发育早期阶段IGF-ⅡmRNA的表达以内参基因β-actin对各发育期起始RNA量进行校正,以孵化当天 (0 d)作为对照因子,比较孵化后2、4、6、8、10、12、14、16、19、22 d幼鱼IGF-ⅡmRNA的表达水平。从图6可见:各发育时期均有IGF-ⅡmRNA表达,但表达量有微小差异,孵化当天表达量最高,之后表达量有所降低。
3 讨论
本研究中运用RACE技术首次克隆获得了鳜IGF-ⅡcDNA全长序列,推导的IGF-Ⅱ前体蛋白编码为215个氨基酸,前肽由信号肽、成熟肽和E肽3部分组成,成熟肽由B、C、A、D 4个区域组成[9]。成熟肽中含有6个半胱氨酸残基,2个位于B区域,4个位于A区域,可形成3个链内二硫键,对维持IGF-Ⅱ的空间结构有重要作用。

图2 鳜IGF-ⅡcDNA全长和氨基酸序列
Fig.2 The full length cDNA and deduced amino acid sequence in S.chuatsi IGF-Ⅱ
注:小写字母代表3′、5′端非翻译区;大写字母部分为编码区,大写字母对应下面部分为氨基酸序列;浅灰色底黑字表示信号肽;深灰色底黑字表示成熟肽;黑底白字表示E肽;*表示终止密码子;方框表示多聚腺苷酸加尾信号 (attaaa)和形成3个二硫键的6个半胱氨酸残基 (C56、C68、C96、C97、C101、C110)。
Note:Letters denote 3′-,5′-untranslated regions;Capital letters represent coding region,and the opposites of the capitial letters show the amino acids;Light gray background and black letters indicate the signal peptide;Dark gray background and black letters indicate the mature peptide; Black background and white letters indicate the E peptide;Asterisk indicates stop codon;Boxes indicate putative polyadenylation signals(attaaa)and the forming of three disulfide bonds of the six cysteine residues(C56,C68,C96,C97,C101,C110)are boxed.
与鳜IGF-Ⅰ成熟肽相比[7],鳜IGF-Ⅱ的B和 A区较为保守,D区保守性最高。鳜IGF-Ⅱ的B和A区中也含有与IGFBPs和IGFR作用所必需的一些保守氨基酸残基,如A区Phe51、Ser53和B区Glu6、Thr7、Glu12、Gln18、Phe19参与IGFBP结合, A区 Tyr62和 B区 Arg24、Phe26-Tyr27-Phe28参与IGFR结合[9]。

图3 脊椎动物IGF-Ⅱ氨基酸序列比对Fig.3 Comparison of amino acid sequences of IGF-Ⅱamong vertebrates
注:为了最大限度的比对,引入间隙,并用 “-”表示,具有相同的氨基酸位点用 “.”标出。
Note:To maximize the alignment,gaps are introduced and indicated as dashes,and dots indicate the identity.
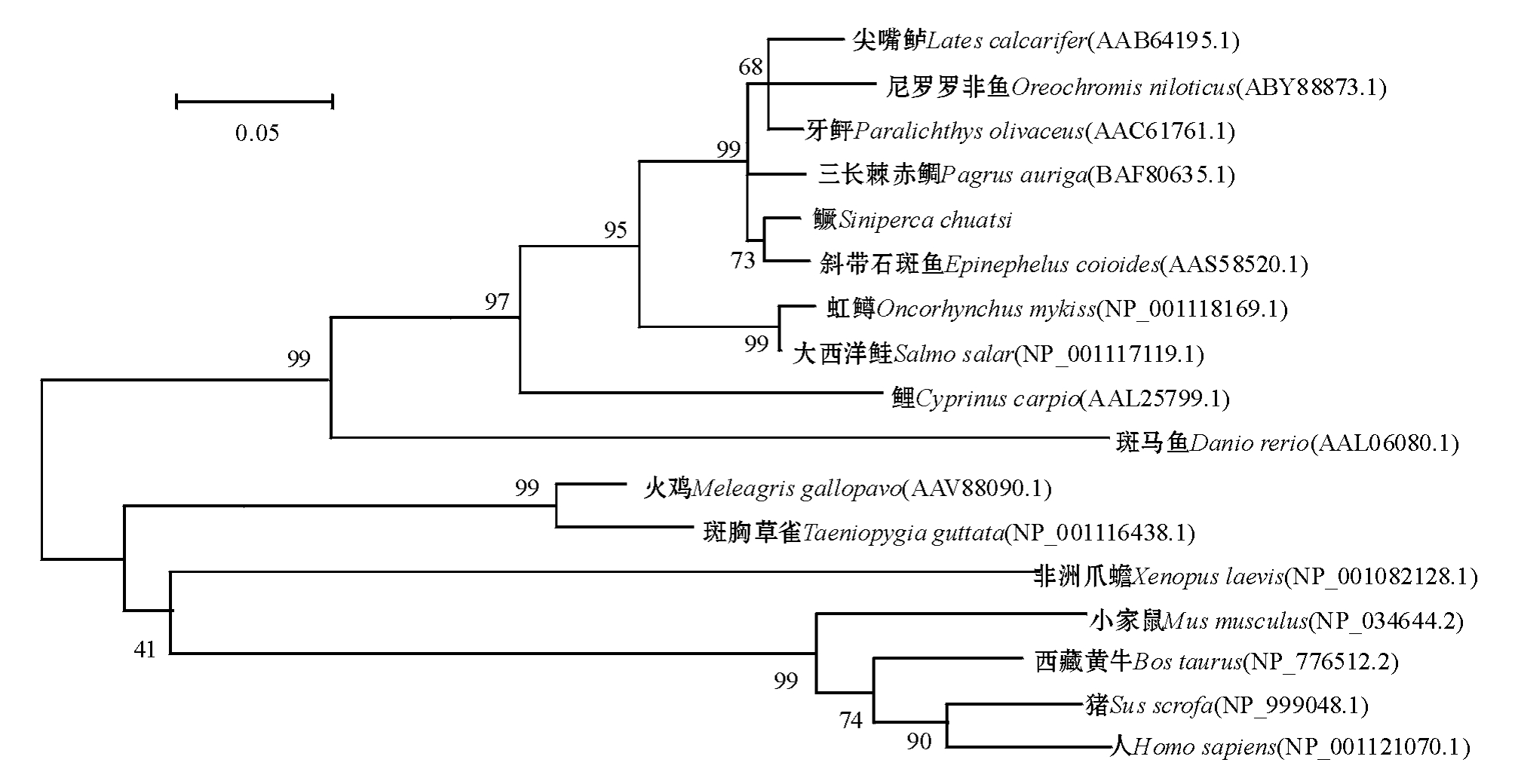
图4 脊椎动物IGF-Ⅱ的NJ系统进化树
Fig.4 The NJ phylogenetic tree of IGF-Ⅱamong vertebrates
不同鱼类IGF-Ⅱ基因的组织表达存在一定的差异。研究表明,鲤Cyprinus carpio IGF-Ⅱ mRNA在肝胰脏、心脏等组织中表达量较高,与IGF-Ⅰ的组织表达量相似 (鳃、精巢除外)[10];半滑舌鳎Solea senegalensis IGF-Ⅱ与IGF-ⅠmRNA均在肝脏、鳃中表达水平较高[11];金头鲷Sparusaurata IGF-Ⅱ mRNA在肝脏、心脏、鳃中表达水平较高[12];而三长棘赤鲷Pagrus auriga IGF-Ⅱ mRNA在鳃、心脏中表达水平较高,在肝脏中表达水平相对较低,IGF-Ⅰ主要在肝脏中表达[13]。本研究表明,鳜IGF-ⅡmRNA在所检测成体的不同组织中均有表达,在脑中表达量最高,在肌肉和心脏中表达量较高,在肝脏中表达量较低,而IGF-Ⅰ在鳜成鱼肝脏中表达量最高[7],这一结果与三长棘赤鲷IGF-Ⅱ的组织表达特征[13]较为相似,表明IGF-Ⅱ与IGF-Ⅰ在不同器官组织中的生理功能存在一定差异。在鳜脑中IGF-ⅡmRNA表达量最高,可能与IGF-Ⅱ是脑中担负重要调节作用的主效应因子有关。研究表明,用不同剂量的猪生长激素处理,能显著提高鲤肝脏和脑中IGF mRNA的表达水平,且具有剂量依赖效应,肝脏中IGF-Ⅰ诱导表达量高于IGF-Ⅱ,而脑中IGF-Ⅱ表达水平对生长激素反应更为灵敏[10,14]。
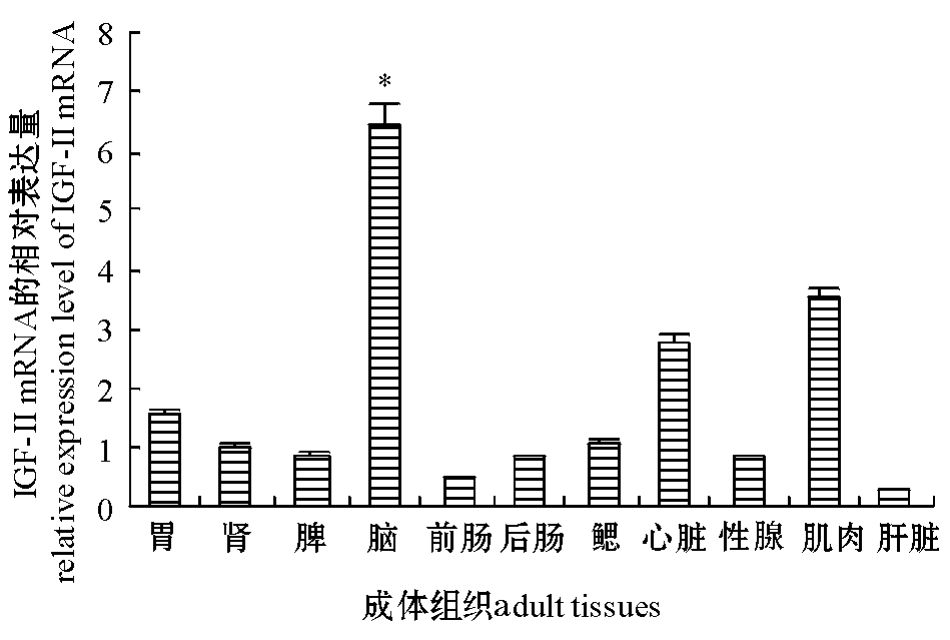
图5 鳜各组织IGF-ⅡmRNA的相对表达量
Fig.5 Relative expression levels of IGF-Ⅱ mRNA in tissues of S.chuatsi
注:1)表达值以内参基因β-actin加以校正,数值表示为相对于对照因子 (肾)的倍数变化 (平均值±标准差,n=3);2) *表示该组织与肾组织有显著性差异 (P<0.05)。
Note:1)Expression values are normalized to those of internal reference gene β-actin.Data are expressed as the mean fold(mean± S.D.,n=3)from the calibrator group(kidney);2)Expression values in tissues with*are significantly from that in kidney(P<0.05).
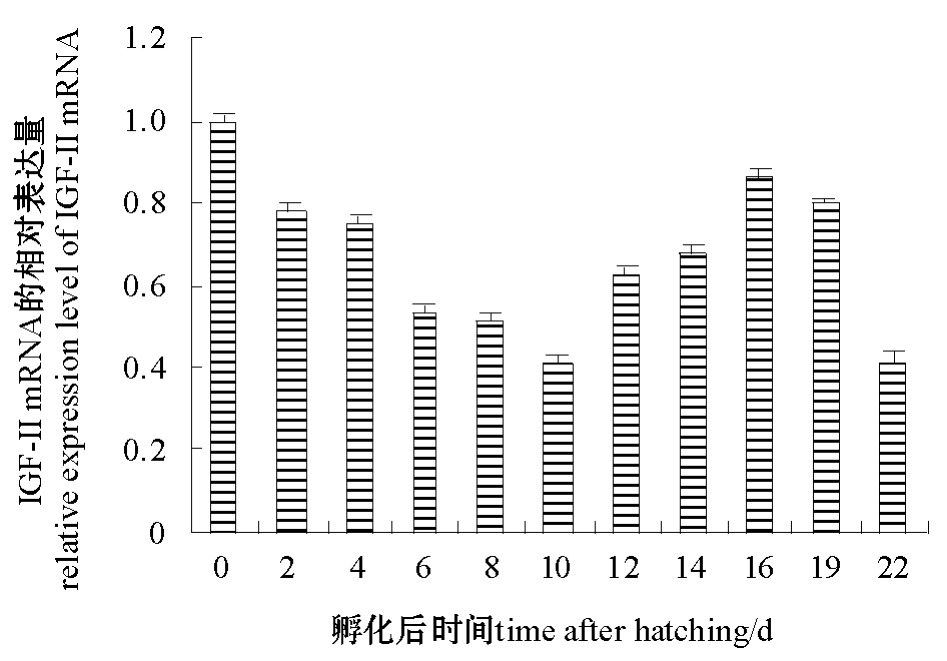
图6 鳜幼体发育早期IGF-ⅡmRNA的相对表达量
Fig.6 Relative expression of IGF-Ⅱ mRNA during larval development in S.chuatsi
注:表达值以内参基因β-actin加以校正,数值表示为相对于对照因子 (卵化当天)的倍数变化 (平均值±标准差,n=3)。Note:Expression values are normalized to those of internal reference gene β-actin.Data are expressed as the mean fold(mean±S.D.,n =3)from the calibrator group(0 d).
鱼类IGF-Ⅱ基因的发育表达特征与哺乳动物间存在明显差异。哺乳动物胚胎发育早期IGF-Ⅱ基因表达量较高,之后表达量逐渐降低[2],而鱼类IGF-Ⅱ基因从胚胎发育早期到成体阶段都有较高水平的表达。虹鳟 Onchorynchus mykiss胚胎期(卵裂、原肠、器官形成)以及孵化后、卵黄吸收、开口摄食期间均观察到IGF-Ⅰ 和IGF-Ⅱ mRNA的表达[15]。金头鲷 IGF-Ⅰ、IGF-Ⅱ mRNA的表达贯穿未受精卵、胚胎和仔鱼整个发育期,IGF-ⅡmRNA在孵化后1 d的表达水平最高,随后表达水平下降;IGF-ⅠmRNA在孵化后1 d开始表达,孵化后12~16 d表达水平显著上升[16]。进一步研究表明,虹鳟IGF-Ⅱ基因还参与胚胎发育中温度对生长作用的调节[17-18],半滑舌鳎胚胎的生长速率与IGF-Ⅱ基因的表达水平呈正相关性[11]。本研究结果表明,鳜IGF-ⅡmRNA在孵化后0、2、4、6、8、10、12、14、16、19、22 d各期均有较高表达,孵化当天 (0 d)表达量最高,孵化后第10 d表达量最低,之后表达水平又有缓慢上升,这表明IGF-Ⅱ是鳜早期生长发育的重要调节因子。前期研究表明,鳜仔鱼在孵化后5 d开口摄食,12 d胃腺发育成熟[19]。因此,孵化后5~12 d是鳜消化系统发育成熟及营养方式由内源性营养向外源性营养转换的关键期。鳜早期发育阶段IGF-ⅡmRNA的表达特征变化,可能还与其参与仔鱼的消化系统发育和营养方式转变等调节活动有关。在半滑舌鳎胚胎孵化前和仔鱼变态前观察到IGF-ⅡmRNA表达水平较高,而在眼移位变态前表达水平显著下降,推测IGF-Ⅱ 还参与变态发育调节[11]。
参考文献:
[1] Thomas P M.Paradigms of growth in fish[J].Comp Biochem Physiol Part B,2001,129(2-3):207-219.
[2] 顾志良,王慧娟,郁建锋.动物GH/IGF-Ⅰ轴调控机制的研究进展[J].中国畜牧兽医,2011,38(10):50-54.
[3] Moriyama S,Ayson F G,Kawauchi H.Growth regulation by insulin -like growth factor-I in fish[J].Biosci,Biotech and Biochem, 2000,64(8):1553-1562.
[4] Duan C,Ding J,Schlueter P J,et al.A zebrafish view of the insulin -like growth factor(IGF)signaling pathway[J].Acta Zoolo Sin, 2003,49(4):421-431.
[5] Duan C.The insulin-like growth factor system and its biological actions in fish[J].Am Zool,1997,37(6):491-503.
[6] 鲁双庆,刘峰,刘臻,等.三种鳜鱼生长激素基因的克隆及序列比较[J].海洋与湖沼,2008,39(4):354-361.
[7] 刘俊,赵金良,张敏,等.鳜胰岛素样生长因子-ⅠcDNA全长克隆及组织表达分析[J].动物学杂志,2011,46(2):121-129.
[8] Johnson M R,Wang K,Smith J B,et al.Quantitation of dihydropyrimidine dehydrogenase expression by real-time reverse transcription polymerase chain reaction[J].Anal Biochem,2000,278 (2):175-184.
[9] Duval H,Rousseau K,Elies G,et al.Cloning,characterization,and comparative activity of turbot IGF-Ⅰand IGF-Ⅱ[J].Gen Comp Endocr,2002,126(3):269-278.
[10] Tse M C,Vong Q P,Cheng C H,et al.PCR-cloning and gene expression studies in common carp(Cyprinus carpio)insulin-likegrowth factor-II[J].Biochim Biophys Acta,2002,1575(1-3):63 -74.
[11] Funes V,Asensio E,Ponce M,et al.Insulin-like growth factors I and II in the sole Solea senegalensis:cDNA cloning and quantitation of gene expression in tissues and during larval development [J].Gen Comp Endocri,2006,149(2):72-166.
[12] Duguay S J,Lai-Zhang J,Steiner D F,et al.Developmental and tissue-regulated expression of IGF-Ⅰand IGF-Ⅱ mRNAs in Sparus aurata[J].J Mol Endocrin,1996,16(2):123-132.
[13] Ponce M,Infante C,Funes V,et al.Molecular characterization and gene expression analysis of insulin-like growth factors I and II in the red banded seabream,Pagrus auriga:transcriptional regulation by growth hormone[J].Comp Biochem Physiol Part B,2008,150 (4):418-426.
[14] Vong Q P,Chan K M,Cheng C H.Quantification of common carp (Cyprinus carpio)IGF-Ⅰ and IGF-Ⅱ mRNA by real-time PCR:differential regulation of expression by GH[J].J Endocrinol,2003,178(3):513-521.
[15] Greene M W,Chen T T.Temporal expression pattern of insulinlike growth factor mRNA during embryonic development in a teleost,rainbow trout(Oncorhynchus mykiss)[J].Mol Mar Biol Biotech,1997,6(2):144-151.
[16] Perrot V,Moiseeva E B,Gozes Y,et al.Ontogeny of the insulinlike growth factor system(IGF-Ⅰ,IGF-Ⅱ,and IGF-1R)in gilthead seabream(Sparus aurata):expression and cellular localization[J].Gen Comp Endocrin,1999,116(3):445-460.
[17] Gabillard J C,Weil C,Rescan P Y,et al.Effects of environmental temperature on IGF-Ⅰ,IGF-Ⅱ and IGF type I receptor expression in rainbow trout(Oncorhynchus mykiss)[J].Gen Comp Endocrin,2003,133(2):233-242.
[18] Gabillard J C,Rescan P Y,Fauconneau B,et al.Effect of temperature on gene expression of the GH/IGF system during embryonic development in rainbow trout(Oncorhynchus mykiss)[J].J Exp Zool Part A,2003,298(2):134-142.
[19] 吴雪峰,赵金良,钱叶洲,等.鳜消化系统器官发生的组织学[J].动物学研究,2007,28(5):511-518.
Cloning and expression of full-length cDNA of insulin-like growth factor-Ⅱ in mandarin fish Siniperca chuatsi
LIU Jun,ZHAO Jin-liang,ZHANG Min,DAI Wei
(Key Laboratory of Freshwater Aquatic Genetic Resources,Ministry of Agriculture,Shanghai Ocean University,Shanghai 201306,China)
Abstract:The complete cDNA sequence of insulin-like growth factor-Ⅱ(IGF-Ⅱ)was cloned from liver of mandarin fish Siniperca chuatsi by RT-PCR and rapid amplification of cDNA ends(RACE)to evaluate the regulating characteristics of HG-IGF-Ⅱ axis.A total of 1 643 bp IGF-ⅡcDNA sequence was found to be comprised of a 103 bp 5′-untranslated region,892 bp 3′-untranslated region and 648 bp open reading frame(ORF)encoding 215 amino acids with a signal peptides of 47 amino acids,a mature peptides of 70 amino acids and a E peptides of 98 amino acids.The mandarin fish IGF-Ⅱamino acid sequence showed similarity of 81%-98%with other vertebrate IGF-Ⅱs,but only similarity of 62.5%with the mandarin fish IGF-Ⅰ.The IGF-ⅡmRNA expression was detected in different adult tissues and larval development stages(0,2,4,6,8,10,12,14,16,19,and 22 days posthatching)using real-time quantitative PCR technique.The maximal expression was observed in the brain,followed by the in muscle,heart,stomach,gill,and kidney,and the lower expression in the spleen,foregut,hindgut,gonad,and liver.The IGF-Ⅱ mRNA was expressed during larval various development stages,the maximal expression in the newly hatched,and then reduced slightly.These findings may provide a molecular base for further knowledge of growth regulation.
Key words:Siniperca chuatsi;insulin-like growth factor-Ⅱ;gene expression
中图分类号:Q786
文献标志码:A
文章编号:2095-1388(2012)06-0495-07
收稿日期:2012-03-20
基金项目:上海市科委重点基础项目 (09jc1406900);上海市重点学科建设项目 (Y1101)
作者简介:刘俊 (1983-),男,硕士研究生。E-mail:junliu1983@163.com
通信作者:赵金良 (1969-),男,教授。E-mail:jlzhao@shou.edu.cn






