表1 脊尾白虾二倍体染色体数目的统计
Tab.1 Chromosome counts in ridgetail white prawn Exopalaemon carinicauda
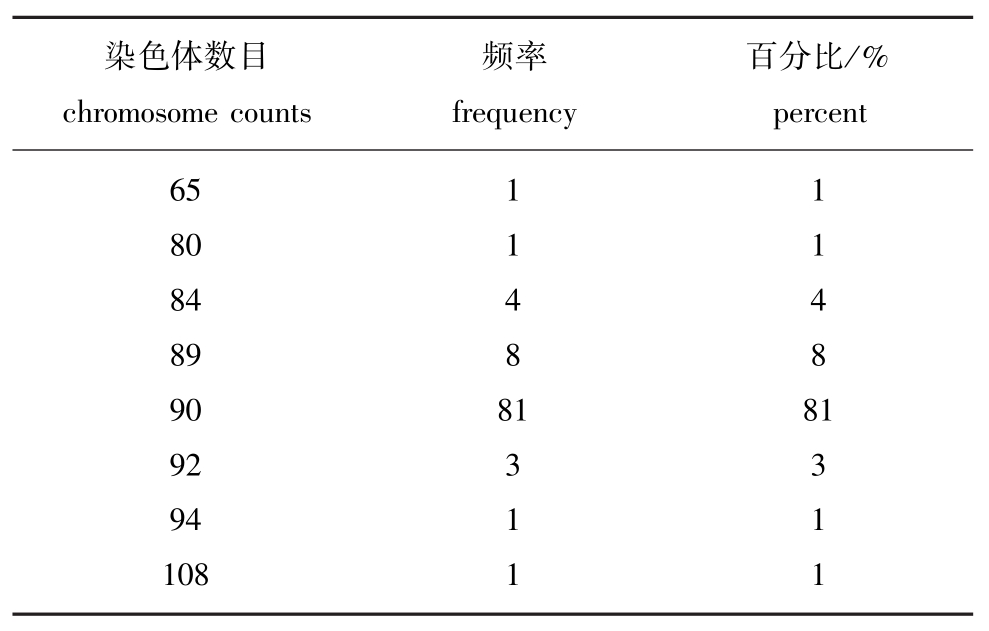
染色体数目chromosome counts频率frequency百分比/% percent 65 80 84 89 90 92 94 108 11488 1311 11488 1311
李洋1、2,刘萍2,李健2,李吉涛2,高保全2
(1.大连海洋大学水产与生命学院,辽宁大连116023;2.中国水产科学院黄海水产研究所,山东青岛266071)
摘要:以脊尾白虾Exopalaemon carinicauda原肠胚时期受精卵为材料,采用低渗法和热滴片法制备染色体,对脊尾白虾进行细胞遗传学研究。核型分析结果显示,对50尾脊尾白虾雌虾受精卵中100个良好的中期分裂相进行染色体计数,染色体数目为90的出现频率最高,达到了81%,由此确定脊尾白虾二倍体染色体数目为90,即2n=90;通过对中期分裂相染色体臂长进行测量与分析发现,中部着丝粒染色体 (m)共计56条,亚中部着丝粒染色体 (sm)共计8条,亚端部着丝粒染色体 (st)共计12条,端部着丝粒染色体(t)共计14条,核型组成公式为2n=56m+8sm+12st+14t,没有发现异性性染色体的存在。
关键词:脊尾白虾;染色体;核型
脊尾白虾Exopalaemon carinicauda又名白虾、小白虾、五须虾、青虾、绒虾、迎春虾等,隶属于节肢动物门Arthropoda、甲壳纲Curstacea、十足目Decapoda、游泳亚目Natantia、长臂虾科Palaemonidae、长臂虾属Palaemon、白虾亚属Exopalaemon,系热温带海区底栖虾类,以黄渤海产量最高,是中国特有的3种经济虾类之一,其产量仅次于中国对虾Fenneropenaeus chinensis和中国毛虾Acetes chinensis[1]。脊尾白虾具有肉质细嫩、味道鲜美、繁殖能力强、生长速度快、生长季节长和环境适应性广等优点。近年来,随着沿海滩涂的开发,养殖面积迅速扩大,已成为池塘单养、鱼虾贝类混养和虾池秋冬季养殖的重要品种[2]。
目前,国内对脊尾白虾的研究主要集中在混养技术、急性毒性试验以及盐度和中草药等对其存活、生长的影响研究,王李宝等[3]对脊尾白虾养殖过程中使用药物剂量进行了急性致毒试验;曹梅等[4]研究了盐度波动和中草药制剂对脊尾白虾存活、生长和免疫的影响;张兴国[5]对脊尾白虾的混养技术进行了报道。但对于脊尾白虾细胞遗传学方面的研究尚未见报道。随着脊尾白虾产量和市场需求的日益增长,为了更好地进行人工养殖、育种、选种等研究工作,对脊尾白虾的种质资源等基础研究显得极为迫切。王青等[6]先后对十足目甲壳动物共计27科96种进行了染色体数目的研究,其中对3科20种进行了核型分析;姜叶琴等[7]对太湖秀丽白虾Exopalaemon modestus进行了染色体及核型的研究。本研究中,作者对同为白虾属的脊尾白虾染色体进行研究,旨在为脊尾白虾的遗传育种、人工养殖提供参考资料。
1.1 材料
于2010年7—8月从莱州湾捕捞野生脊尾白虾活体,于实验室暂养24 h后,在解剖镜下挑选亲虾抱卵已发育到原肠胚时期的受精卵,以备用。
1.2 方法
1.2.1 染色体的制备 将受精卵从亲虾游泳肢上剥离,放入用50%的海水 [φ(海水) ∶φ(蒸馏水)=1∶1]配制的体积分数为0.04%的秋水仙素中处理3 h,并用50%的海水冲洗干净秋水仙素,使用0.075 mol/L的 KCl溶液低渗处理50 min,加入预冷到4℃的卡诺氏 (Carnoy)固定液[φ(甲醇)∶φ(冰乙酸)=3∶1),15 min更换一次固定液,更换3次后置于4℃下保存。制片时使用50%的冰醋酸溶液进行解离,用热滴片法制片,用吉姆萨染液染色20 min,慢慢冲去染液,晾干后镜检。
1.2.2 染色体臂长的计算 染色体臂长的计算公式为
相对长度=(实测染色体长度/全部染色体长度总和)×100,
臂比=长臂长度/短臂长度。
2.1 脊尾白虾染色体数目的确定
对50尾雌虾受精卵进行滴片,从中挑选100个中期分裂相清晰的滴片进行染色体计数,染色体条数在90时的出现频率最高,达到81%,结果列于表1,由此确定脊尾白虾染色体数目为2n=90。
表1 脊尾白虾二倍体染色体数目的统计
Tab.1 Chromosome counts in ridgetail white prawn Exopalaemon carinicauda

染色体数目chromosome counts频率frequency百分比/% percent 65 80 84 89 90 92 94 108 11488 1311 11488 1311
2.2 脊尾白虾染色体的相对长度和臂比值分析
将所拍照片输入计算机经放大处理后利用投影仪描绘轮廓,并对清晰的中期分裂相染色体的长臂长、短臂长进行测量与分析。脊尾白虾染色体相对长度和臂比值列于表2。根据Levan等[8]提供的染色体核型分类依据,将脊尾白虾染色体分为4类,其中中部着丝粒染色体 (m)共计56条,亚中部着丝粒染色体 (sm)共计8条,亚端部着丝粒染色体 (st)共计12条,端部着丝粒染色体 (t)共计14条,故核型公式为2n=56m+8sm+12st+14t= 90。图1为依据染色体相对长度排列后的核型图,图2为染色体中期分裂相。
细胞遗传学是研究细胞中染色体遗传规律的学科,同时也是在细胞层次上进行遗传学研究的遗传学分支学科,主要研究细胞中染色体的起源、组成、变化、行为和传递等机制及其生物学效应。核型是细胞有丝分裂中期的全套染色体图像按大小、形态成对排列的总和。染色体的核型分析是细胞遗传学研究的基本方法,是研究物种演化、分类以及染色体结构、型态与功能之间的关系所不可缺少的重要手段。同时核型分析还是开展杂交育种、多倍体诱导等遗传育种操作的基础。对于脊尾白虾人工养殖、育种、选种等研究工作也具有重要意义。
表2 脊尾白虾染色体的相对长度、臂比及核型
Tab.2 Relative length and arm ratio of metaphase chromosomes in ridgetail white prawn Exopalaemon carinicauda

注:m为中部着丝粒染色体;m为亚中部着丝粒染色体;st为亚端部着丝粒染色体;t为端部着丝粒染色体。
Note:m,metacentric chromosomes;sm,submetacentric chromosome; st,acroentric chromosome;t,telocentric chromosome.
染色体序号No.相对长度relative length臂比arm ratio着丝点位置chromosome site 14.2±0.89 1.12±0.37 m 2 13.5±1.47 1.52±0.73 m 3 12.75±0.92 1.47±1.14 m 4 11.77±1.12 1.26±0.22 m 5 11.65±1.03 1.01±0.08 m 6 8.54±0.65 1.15±0.36 m 7 7.89±0.77 1.04±0.18 m 8 7.62±0.54 1.18±0.71 m 9 7.36±0.81 1.02±0.40 m 10 7.14±0.35 1.03±0.55 m 11 7.12±0.22 1.13±0.56 m 12 7.03±0.26 1.21±0.87 m 13 6.87±0.39 1.09±0.42 m 14 6.52±0.61 1.15±0.82 m 15 6.47±0.58 1.30±1.14 m 16 6.11±0.92 1.27±0.92 m 17 6.08±0.88 1.08±1.11 m 18 5.62±1.09 1.37±0.37 m 19 5.47±0.78 1.19±1.14 m 20 5.34±0.90 1.10±0.74 m 21 5.14±0.69 1.09±1.18 m 22 4.82±0.58 1.23±0.77 m 23 4.73±0.46 1.41±0.08 m 24 4.68±0.49 1.44±0.13 m 25 4.33±0.63 1.36±0.96 m 26 4.01±0.54 1.01±1.25 m 27 3.92±0.44 1.14±0.04 m 28 3.86±0.48 1.07±0.28 m 29 10.27±0.95 2.17±0.32 sm 30 9.01±0.85 2.07±0.09 sm 31 8.63±0.35 2.09±0.08 sm 32 7.24±0.63 2.63±0.33 sm 33 4.42±0.67 4.21±0.71 st 34 4.38±0.59 3.35±0.08 st 35 4.17±0.80 5.04±0.12 st 36 4.09±0.77 5.28±0.32 st 37 4.02±0.53 4.74±0.21 st 38 3.85±0.29 4.49±0.09 st 39 4.07±0.48 ∞ t 40 3.92±0.52 ∞ t 41 3.71±0.47 ∞ t 42 3.67±0.26 ∞ t 43 3.08±0.27 ∞ t 44 2.85±0.48 ∞ t 45 2.77±0.18 ∞1 t
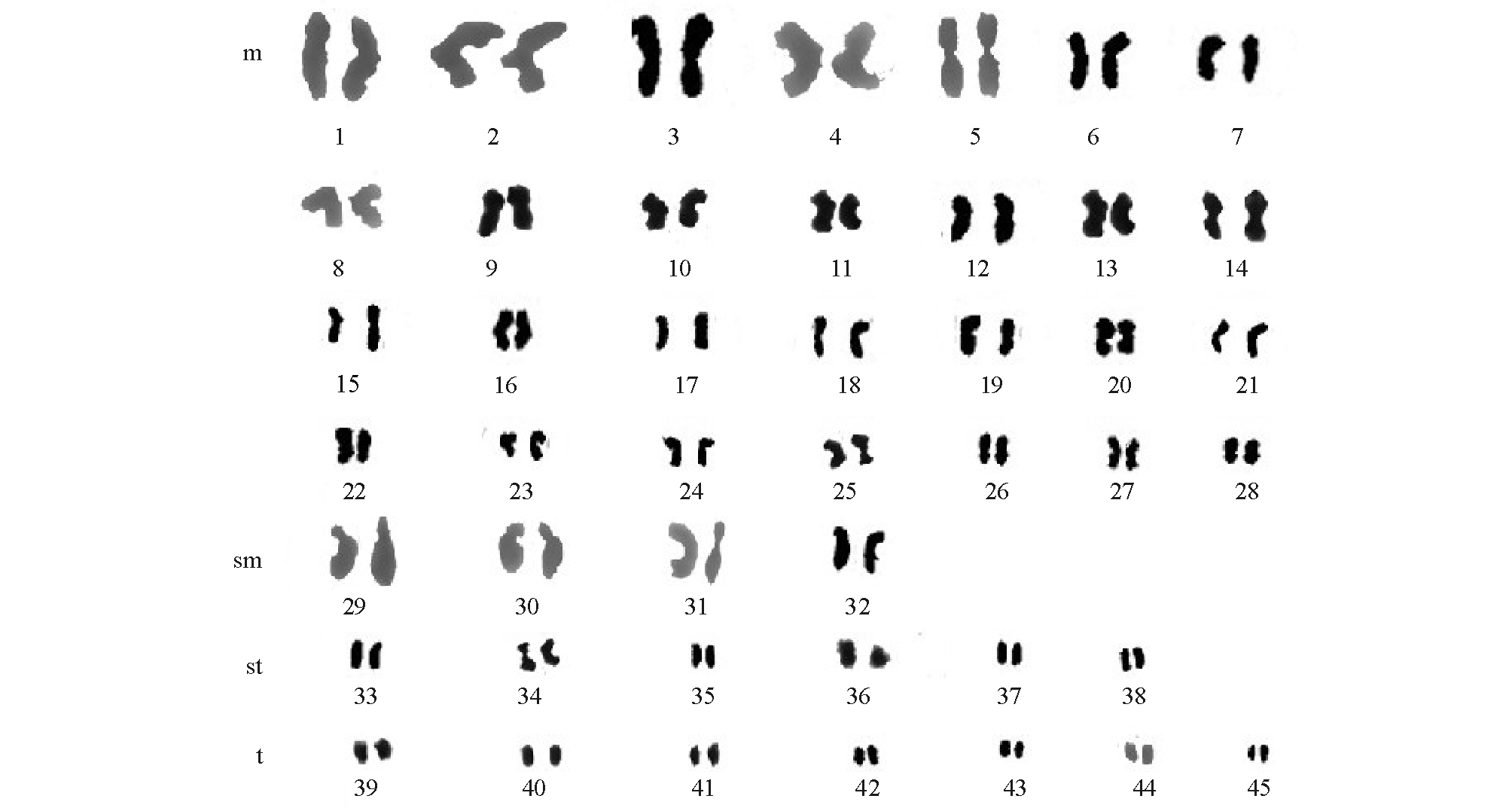
图1 脊尾白虾原肠胚染色体核型图
Fig.1 Karyotype of the ridgetail white prawn Exopalaemon cariniauda
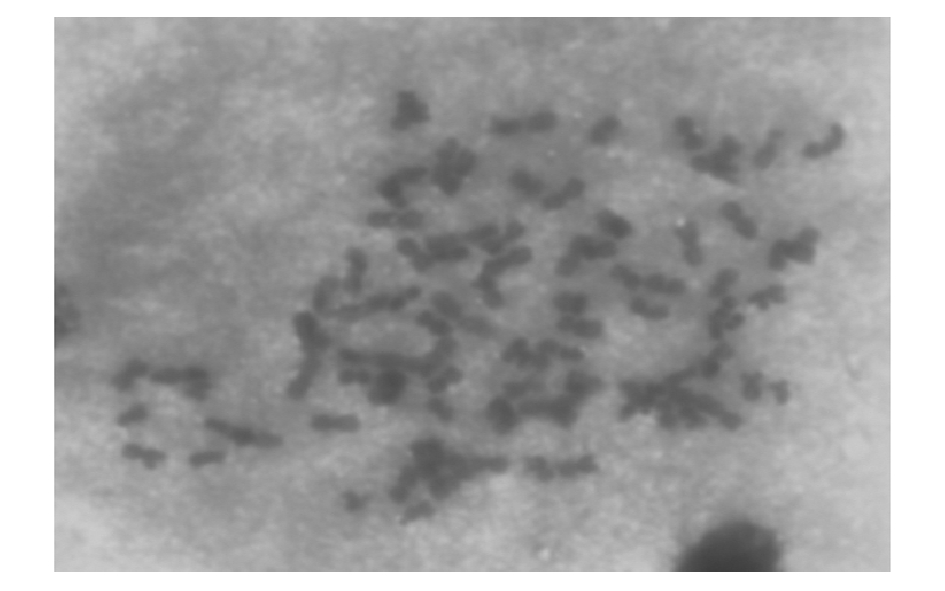
图2 脊尾白虾染色体的中期分裂相
Fig.2 Metaphase chromosomes of the ridgetail white prawn Exopalaemon carinicauda
在甲壳纲十足目动物中因其染色体数目众多,而且其有丝分裂中期染色体大多呈点状,给核型分析带来了很大的难度。李雅娟等[9]针对不同倍性泥鳅杂交后代的染色体数目采用低渗法进行了研究并取得了较好的效果;刘萍等[10]和钱国英等[11]分别在中国对虾和日本沼虾Macrobrachium nipponense的染色体制备过程中就低渗法和管渗法进行了比较分析,认为整体上低渗法比管渗法效果要好;张天澍等[12]和周丽青等[13]分别在罗氏沼虾Macrobrachium rosenbergii和波纹唇鱼Cheilinus undulatus的染色体制备过程中采用了研磨离心和热滴片的方法进行制片,在染色体数目众多且不易分散的种类中采用热滴片法进行制片技术已经非常成熟;Ojima等[14]首次提出低渗法制片以来经过试验检验制片效果非常完善。因此,本研究中在参考前人方法的基础上通过实际操作,采用低渗法和热滴片法获得了脊尾白虾原肠胚时期受精卵染色体的清晰分裂相,在操作过程中,为使染色体更好地分散开,可适当提高滴片温度和高度;为使染色体停滞在分裂中期,使用秋水仙素的处理时间和浓度要通过梯度试验来确定,通过低渗可以使细胞膨胀染色体间距拉大,经过解离对获得清晰分裂相有很大作用。
脊尾白虾染色体数目为90条,与姜叶琴等[7]对同为白虾属的秀丽白虾的染色体研究结果一致,根据Ahmed[15]提出的核型稳定性观点分析,脊尾白虾具有较多的m型核型,由此认为其具有较为稳定的染色体组型。根据Murofuehi等[16]的十足类染色体倍数性进化观点,认为染色体数目少的十足类核型则更为原始。根据邱高峰等[17-18]的研究表明,脊尾白虾染色体数目与沼虾属和长臂虾属的染色体数目及核型组成方面相近。综合比较后作者认为,脊尾白虾的进化地位要比同为长臂虾科的长臂虾属和沼虾属更为原始。
在已研究的十足目中只有铠甲虾科、方蟹科和异尾类中发现了性染色体[6]。Nakamura等[19]也曾在十足目物种中发现了性染色体,而本研究中虽未发现性染色体,但也不能确定性染色体不存在,因为脊尾白虾染色体性状多为点状,而且数目庞大,制片过程中分散不均匀不清晰导致对其常染色体和性染色体的区分非常困难。因此,对脊尾白虾性染色体还需采用其他方法进行深入地研究,进一步对其进行补充与完善。
参考文献:
[1] Xu W,Xie J,Shi H,et al.Hematodinium infections in cultured ridgetail white prawns,Exopalaemon carinicauda,in eastern China [J].Aquaculture,2010,300:25-31.
[2] 王兴强,阎斌伦,马甡,等.脊尾白虾生物学及养殖生态学研究进展[J].齐鲁渔业,2005,22(8):21-23.
[3] 王李宝,万夕和,朱彬,等.二硫氰基甲烷对脊尾白虾的急性致毒实验[J].海洋水产研究,2008,29(5):120-123.
[4] 曹梅,王兴强,阎斌伦,等.盐度波动和中草药制剂对脊尾白虾存活、生长和免疫的影响[J].安徽农业科学,2010,38(7): 3512-3515.
[5] 张兴国.脊尾白虾与梭子蟹、贝类混养技术[J].齐鲁渔业, 2008,25(4):35-36.
[6] 王青,孔晓瑜,于珊珊,等.十足目染色体研究进展[J].海洋科学,2005,29(6):60-65.
[7] 姜叶琴,谢书海,周琴,等.秀丽白虾染色体核型的初步分析[J].水产科学,2008,27(9):470-472.
[8] Levan A,Fredga K,Aandberg A A.Noenelature for centromeric position on chromosomes[J].Hereditas,1964,52(2):201-220.
[9] 李雅娟,钱聪,印杰,等.不同倍性泥鳅杂交后代染色体数目组成的研究[J].大连海洋大学学报,2012,27(4):326-332.
[10] 刘萍,麦明,孔杰,等.中国对虾染色体制备及染色体形态的研究[J].海洋科学,1994,23(1):33-37.
[11] 钱国英,汪财生,伊尚军.日本沼虾染色体制备的比较研究[J].实验生物学报,2005,38(5):456-460.
[12] 张天澍,王玉凤.罗氏沼虾的染色体研究[J].华中师范大学学报,2003,37(2):231-232.
[13] 周丽青,杨爱国,吴彪,等.波纹唇鱼染色体制备及核型的初步研究[J].渔业科学进展,2010,31(1):54-58.
[14] Ojima Y S,Hitotsumachi S.Cytogenetic studies in lower vertebrates[J].Proc Jap Acad,1966,42(1):62-66.
[15] Ahmed M.Chromosome cytology of marine pelecypod molluscs [J].Sci Karachi,1976(4):77-94.
[16] Murofuehi M,Deguehi Y.Karyotype evolution in Decapoda Crustacea[C]//Hirano R,Hanyu I.Proc Second Asian Fisheries Forum.Tokyo:Japan Asian Fisheries,1990:549-553.
[17] 邱高峰,堵南山,赖伟.日本沼虾染色体及其核型的研究[J].海洋与湖沼,1994,25(5):493-498.
[18] 邱高峰.罗氏沼虾核型及长臂虾亚科演化关系的探讨[J].水产学报,1996,20(4):294-300.
[19] Nakamura H K,Machii A,Wada T,et al.A check list of decapod chromosomes(Crustacea)[J].Bull Natl Inst Aquac,1988,13:1-9.
The chromosome preparation and karyotype in ridgetail white prawn Exopalaemon carinicauda
LI Yang1,2,LIU Ping2,LI Jian2,LI Ji-tao2,GAO Bao-quan2
(1.College of Fisheries and Life Science,Dalian Ocean University,Dalian 116023,China;2.Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences,Qingdao 266071,China)
Abstract:The cytogenetic study was conducted in ridgetail white prawnExopalaemon carinicaudaby preparation of chromosome spreads from some embryo cells at gastrula stage using hot film drops.The microphotography showed that there were 90 chromosomes in diploid(2n=90)based on the maximal frequency of 90 in chromosome number,that is,accounting for 81%in 100 metaphase chromosomes.The karyotype formula was found to be expressed as 2n=56m+8sm+12st+14t in the prawn.There were 28 pairs of metacentric chromosomes(m),4 pairs of submetacentric chromosomes(sm),6 pairs of acroentric chromosomes(st)and 7 pairs of telocentric chromosomes (t),and no sex-chromosome of heteromorphism was observed in the complements.
Key words:Exopalaemon carinicauda;chromosome;karyotype
中图分类号:S917.4
文献标志码:A
文章编号:2095-1388(2012)05-0453-04
收稿日期:2011-12-21
基金项目:国家 “863”高技术研究发展计划项目 (2012AA10A409);中国水产科学研究院黄海水产研究所基本科研业务费资助项目(2012-ts-11)
作者简介:李洋 (1985-),男,硕士研究生。E-mail:liyang_able@163.com
通信作者:刘萍 (1962-),女,研究员。E-mail:liuping@ysfri.ac.cn