温度和饲料脂肪水平对松浦镜鲤免疫及抗氧化能力的影响
许治冲1、3,刘晖2,徐奇友3,王常安3,许红3
(1.上海海洋大学水产与生命学院,上海201306;2.辽宁宽甸满族自治县水产苗种管理站,辽宁宽甸118200;3.中国水产科学研究院黑龙江水产研究所动物营养实验室,黑龙江哈尔滨150070)
摘要:在实验室条件下,进行了不同温度 (16、23、30℃)与不同饲料脂肪水平 (5%、8%、11%、15%)对松浦镜鲤Cyprinus carpioSongpu mirror幼鱼 (体质量为5.51 g±0.05 g)免疫和抗氧化能力的影响试验。试验在36个盛水150 L的循环水族箱中进行,共饲养70 d。结果表明:1)16℃时,肝胰脏超氧化物歧化酶 (SOD)和过氧化氢酶 (CAT)活性均随饲料脂肪水平的增加而降低,低脂组 (5%、8%)显著高于高脂组 (11%、15%)(P<0.05);15%脂肪组肝胰脏丙二醛 (MDA)含量显著高于8%脂肪组 (P<0.05),低脂组 (5%、8%)脾脏MDA含量显著高于15%脂肪组 (P<0.05)。2)23℃时,肝胰脏溶菌酶(LYZ)活性随着饲料脂肪水平的增加先升高后降低,15%脂肪组肝胰脏LYZ活性显著低于8%脂肪组(P<0.05),5%和15%脂肪组肝胰脏SOD活性显著低于8%和11%脂肪组 (P<0.05);肝胰脏MDA和脾脏SOD、MDA均随饲料脂肪水平的增加显著升高 (P<0.05)。3)30℃时,15%脂肪组肝胰脏LYZ活性显著低于其他组 (P<0.05),5%脂肪组血清IgM质量浓度显著低于11%脂肪组 (P<0.05)。4)各温度下,饲料脂肪水平对松浦镜鲤幼鱼脾脏LYZ、血清ALP、C3、C4以及脾脏CAT活性均无显著影响 (P>0.05); 5)各饲料脂肪水平下,温度都对松浦镜鲤幼鱼免疫和抗氧化指标均产生了显著影响 (P<0.05)。综合以上结果,从鱼体免疫角度推测松浦镜鲤幼鱼在16℃和23℃时饲料脂肪添加量分别不宜超过8%和11%。
关键词:松浦镜鲤;温度;脂肪;免疫;抗氧化
鱼类是变温动物,其体温直接依赖于周围环境的温度,各种生理机能受水温的影响极大[1]。鱼类的免疫活性受到包括水温、性成熟等一系列因素的影响,季节的变化特别是环境温度的改变对鱼体免疫系统的影响尤为显著[2-4]。关于鱼类体液免疫应答与水温的关系,国外对大马哈鱼Oncorhynchus keta、鲳Stromateoides argenteus曾有一些报道[5-6]。Lemorvan等[7]研究表明,鲤Cyprinus carpio在低温条件下,抗体产量明显下降;Avtalion等[8]用牛血清蛋白免疫鲤时发现,初次应答在低温时受到抑制,而若在高温时建立了免疫记忆则再次应答时不受低温影响。
饲料中脂肪尤其是必需脂肪酸是水产动物免疫反应的重要调节因子,但当饲料中脂肪水平超过需求量时,会导致鱼体的脂肪沉积增加,从而影响鱼体的免疫功能,严重时甚至会造成大量脂肪在鱼肝细胞内堆积,导致肝功能下降甚至衰竭。如果体内的脂肪含量升高,会增加鱼体的氧化反应,但鱼类具有抗氧化机制,可抵抗氧化损伤而维持健康,如摄食高脂饲料的塞内加尔鳎Cynoglossus cynoglossus肝脏中的过氧化氢酶 (CAT)和超氧化物歧化酶(SOD)活性均升高[9],但是脂肪过高时就会氧化产生活性氧 (ROS),ROS可以氧化DNA、蛋白和脂质[10],破坏分子的交联作用,并导致酶活性降低,最终破坏细胞的完整性[11],从而影响鱼体的抗病力,给鱼体健康带来负面影响。
松浦镜鲤Cyprinus carpioSongpu mirror是黑龙江水产研究所在德国镜鲤选育系F4基础上,采用混合选择方法,从1998年开始连续选育3代后获得的体型完好、背部较高而厚、生长快、抗寒力强、繁殖力高、体表基本无鳞的新品种。该品种经第四届全国水产原种和良种审定委员会第一次会议审定为适宜推广养殖的选育种。目前,虽然已对镜鲤相关高密度驯化养殖技术、无公害养殖技术、蛋白质需求[12-14]等进行了系统的研究,但有关镜鲤脂肪营养素需求方面的研究尚未见报道。为此,本研究中作者在不同水温条件下,用不同脂肪水平的饲料饲喂镜鲤,通过测定松浦镜鲤幼鱼的免疫和抗氧化能力,观察其对免疫性能的影响,以期为不同水温条件下松浦镜鲤幼鱼最适脂肪需求的研究提供参考。
1 材料与方法
1.1 材料
1.1.1 试验鱼 试验用鱼为黑龙江水产研究所松浦实验站当年培育的松浦镜鲤鱼种,经体积分数为3%的NaCl溶液消毒后暂养一周,选取体质健壮、规格整齐、体质量为 (5.51±0.05)g的松浦镜鲤幼鱼756尾用于试验。
1.1.2 试验饲料 以秘鲁进口蒸汽鱼粉、豆粕为主要蛋白源,以进口优质鱼油为脂肪源,依据鲤基本营养需求,在基础饲料中通过调节鱼油、α-纤维素的添加比例配制成4种脂肪含量 (均为质量分数,下同) 分别为 5.55%、8.43%、11.78%、15.60%(实测值)的等氮饲料 (粗蛋白质平均为43.22%)。试验饲料组成及营养水平见表1。饲料原料粉碎后过40目筛,称重后用鼓型混合机混合10 min,待充分混匀后再用小型制粒机加工成直径为1.0 mm和2.0 mm两种规格的颗粒饲料,自然风干后保存在冰箱 (-20℃)中备用。
1.2 方法
1.2.1 试验设计与饲养管理 将试验鱼随机分成12组,每组设3个平行,每个平行放21尾鱼。试验在室内循环水族箱 (每个水族箱盛水150 L)中进行,24 h不间断充气供氧,每周换水2/3。试验设16、23、30℃ 3个温度梯度,在每个温度下设4组,分别投喂含4种脂肪水平 (5%、8%、11%、15%)的饲料。试验共进行 70 d,每天 08:00、11:00、14:00和17:00饱食投喂4次,每两周称量1次鱼体质量,根据实际生长情况调整饲料粒径和投饲量。定时测量水温、pH值、溶解氧及水中氨氮含量,确保水温恒定,水中溶氧>6.00 mg/L,总氨氮为0.020~0.025 mg/L,pH值为7.0~8.0。
表1 试验饲料组成及营养水平(风干基础)
Tab.1 Composition and nutrient levels in the experimental diets(air-dry basis)w/%
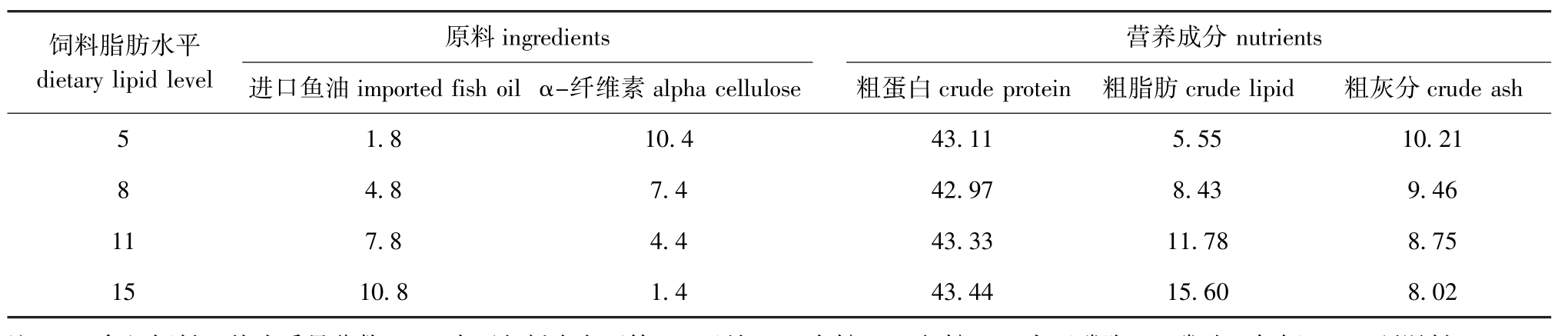
注:1)各组饲料 (均为质量分数,%)中还包括小麦面筋5,豆粕18,次粉20,鱼粉40,大豆磷脂1,磷酸二氢钙0.5,预混料0.9;2)预混料0.90%包括复合维生素0.3%,复合微量元素0.2%,硫酸镁0.2%,胆碱0.2%;3)复合维生素和微量元素 (mg/kg或IU/kg饲料)包括VA 15 000 IU,VD33 000 IU,VE 60 mg,VK 5 mg,VB115 mg,VB230 mg,VB615 mg,VB120.5 mg,烟酸175 mg,叶酸5 mg,肌醇1 000 mg,生物素2.5 mg,泛酸钙50 mg,VC 1 000 mg,Zn 60 mg,Fe 25 mg,Cu 3 mg,Mn 15 mg,I 0.6 mg,Mg 0.7 g。
Note:1)Ingredients(%)including white protein 5,soy bean meal 18,wheat flour 20,fish meal 40,soybean lecithin 1,Ca(H2PO4)20.5, premix 0.9;2)0.90%premix in diet including vitamin premix 0.3%,mineral premix 0.2%,MgSO40.2%,choline chloride 0.2%;3)Vitamin premix and mineral element premix(mg/kg or IU/kg diet)including VA 15 000 IU,VD33 000 IU,VE 60 mg,VK 5 mg,VB115 mg,VB230 mg, VB615 mg,VB120.5 mg,niacin 175 mg,folic acid 5 mg,inositol 1 000 mg,biotin 2.5 mg,calcium 50 mg,VC 1 000 mg,Zn 60 mg,Fe 25 mg,Cu 3 mg,Mn 15 mg,I 0.6 mg,and Mg 0.7 g.
饲料脂肪水平dietary lipid level原料ingredients进口鱼油imported fish oil α-纤维素alpha cellulose营养成分 nutrients粗蛋白crude protein 粗脂肪crude lipid 粗灰分crude ash 581 1 10.21 9.46 8.75 8.02 15 1.8 4.8 7.8 10.8 10.4 7.4 4.4 1.4 43.11 42.97 43.33 43.44 5.55 8.43 11.78 15.60
1.2.2 样品的采集与分析
1)血清的制备 试验结束后停食24 h,从每个水族箱随机取3尾鱼经麻醉处理后,用注射器(2.5 mL)从尾静脉取血,血样在冰箱 (4℃)静置1~2 h后,于4℃下以3 500 r/min离心30 min,取上层血清备用。
2)组织匀浆液的制备 从每个处理组随机取9尾鱼置于冰盘上,解剖取其肝胰脏、脾脏,称重后保存于冰箱 (-40℃)中。测定时将冷冻保存的肝胰脏和脾脏样品于4℃下解冻,在冰水浴中剪碎,然后按质量与体积比为1∶9加入预冷的体积分数为0.86%的生理盐水,冰浴匀浆,将匀浆液以6 000 r/min离心30 min,取上清液备用。
3)样品的分析 将制备好的血清样品保存于冰盒中,送黑龙江省电力医院采用全自动生化分析仪 (贝克曼ProCX4,美国)进行血清碱性磷酸酶(ALP)、免疫球蛋白M(IgM)和补体C3、C4的活性分析。按照南京建成生物工程研究所试剂盒说明书中的方法测定组织提取液中溶菌酶 (LYZ)、超氧化物歧化酶 (SOD)和过氧化氢酶 (CAT)的活性及丙二醛 (MDA)的含量;采用考马斯亮兰试剂盒测定组织提取液中蛋白质的含量。
1.3 数据处理
试验数据用平均值±标准差表示,使用 SPSS 12.0软件对数据进行单因素方差分析,如果差异显著再进行 Duncan多重比较;用一般线性模型(GLM)进行双因素方差分析。
2 结果
2.1 不同温度下饲料脂肪水平对松浦镜鲤免疫指标的影响
从表2可见:16℃时,各饲料脂肪水平对松浦镜鲤LYZ活性和血清免疫指标影响均不显著(P>0.05);23℃时,8%脂肪组肝胰脏LYZ活性显著高于15%脂肪组 (P<0.05);30℃时,肝胰脏LYZ活性随饲料脂肪水平的增加呈降低趋势, 5%脂肪组肝胰脏LYZ活性最高且显著高于8%和15%脂肪组 (P<0.05),血清IgM含量随饲料脂肪水平的增加呈上升趋势,5%脂肪组显著低于11%脂肪组 (P<0.05);其他各项指标在各饲料脂肪水平间均无显著差异 (P>0.05);温度和饲料脂肪水平的交互作用仅对肝胰脏LYZ活性影响显著 (P<0.05)。
表2 不同温度下饲料脂肪水平对松浦镜鲤免疫指标的影响
Tab.2 Effects of different dietary lipid levels on immune parameters in Songpu mirror carp at different temperatures
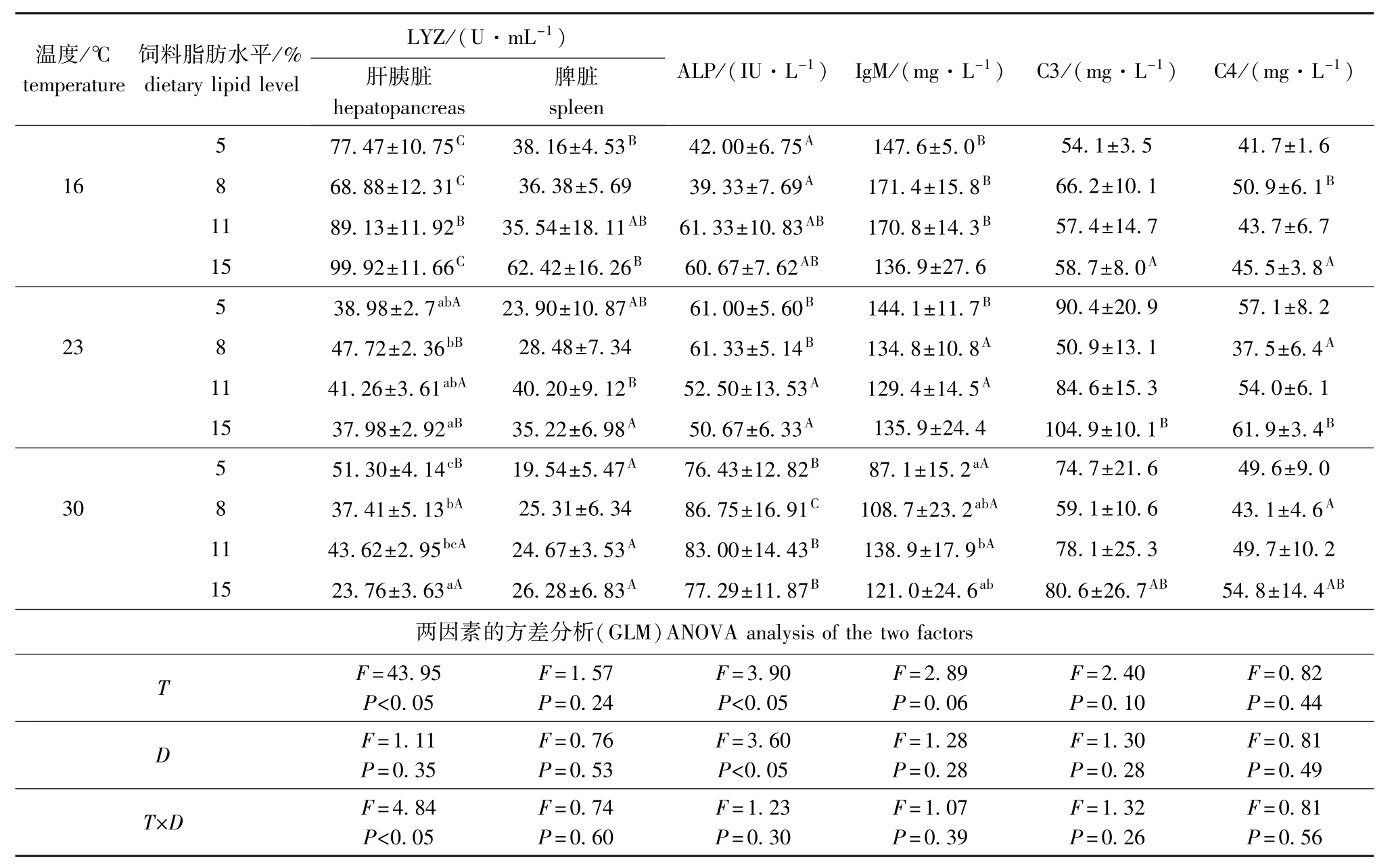
注:1)相同温度下,不同饲料脂肪水平间标有不同小写字母者表示组间差异显著 (P<0.05),标有相同小写字母者表示组间差异不显著(P>0.05);2)同一饲料脂肪水平下,不同温度间标有不同大写字母者表示组间差异显著 (P<0.05),标有相同大写字母者表示组间差异不显著 (P>0.05);3)T表示温度,D表示饲料脂肪水平,T×D表示温度与饲料脂肪水平的交互作用,下同。
Note:1)The means followed by different letters denot significant difference at various ldietary lipid levels within the same temperature(P>0.05).the means followed by the same letters denot no significant difference(P>0.05);2)The means followed by different capital letters denot significant difference at various temperature within the same ldietary lipid levels(P>0.05),the means followed by the same capital letters denot no significant difference (P>0.05);3)Tmeans temperature,Dmeans the diets containing different levels of fat,T×Dmeans interaction between temperature factor and dietary lipid factor.et sequentia.
温度/℃temperature饲料脂肪水平/% dietary lipid level LYZ/(U·mL-1)肝胰脏hepatopancreas脾脏ALP/(IU·L-1) IgM/(mg·L-1) C3/(mg·L-1) C4/(mg·L-1) spleen 54.1±3.5 41.7±1.6 16 8 68.88±12.31C36.38±5.69 39.33±7.69A171.4±15.8B66.2±10.1 50.9±6.1B11 89.13±11.92B35.54±18.11AB61.33±10.83AB170.8±14.3B57.4±14.7 43.7±6.7 15 99.92±11.66C62.42±16.26B60.67±7.62AB136.9±27.6 58.7±8.0A45.5±3.8A5 38.98±2.7abA23.90±10.87AB61.00±5.60B144.1±11.7B5 77.47±10.75C38.16±4.53B42.00±6.75A147.6±5.0B90.4±20.9 57.1±8.2 23 8 47.72±2.36bB28.48±7.34 61.33±5.14B134.8±10.8A50.9±13.1 37.5±6.4A11 41.26±3.61abA40.20±9.12B52.50±13.53A129.4±14.5A84.6±15.3 54.0±6.1 15 37.98±2.92aB35.22±6.98A50.67±6.33A135.9±24.4 104.9±10.1B61.9±3.4B5 51.30±4.14cB19.54±5.47A76.43±12.82B87.1±15.2aA74.7±21.6 49.6±9.0 30 8 37.41±5.13bA25.31±6.34 86.75±16.91C108.7±23.2abA59.1±10.6 43.1±4.6A11 43.62±2.95bcA24.67±3.53A83.00±14.43B138.9±17.9bA78.1±25.3 49.7±10.2 15 23.76±3.63aA26.28±6.83A77.29±11.87B121.0±24.6ab80.6±26.7AB54.8±14.4AB两因素的方差分析(GLM)ANOVA analysis of the two factorsTF=43.95P<0.05F=1.57P=0.24F=3.90P<0.05F=2.89P=0.06F=2.40P=0.10F=0.82P=0.56 =0.49T×DF=4.84P<0.05 =0.44DF=1.11P=0.35F=0.76P=0.53F=3.60P<0.05F=1.28P=0.28F=1.30P=0.28F=0.81P F=0.74P=0.60F=1.23P=0.30F=1.07P=0.39F=1.32P=0.26F=0.81P
2.2 不同饲料脂肪水平下温度对松浦镜鲤免疫指标的影响
从表2可见:肝胰脏LYZ活性随温度的升高除5%脂肪组先降低后升高外其余各脂肪组均显著降低 (P<0.05);脾脏LYZ活性随温度的升高除了8%脂肪组无显著变化外其余各脂肪组均显著降低 (P<0.05);血清ALP活性随温度上升5%和8%脂肪组显著升高,11%和15%脂肪组30℃时血清ALP活性显著高于23℃时 (P<0.05);血清IgM活性随温度的升高除15%脂肪组无显著变化外其余各脂肪组均显著降低 (P<0.05);血清C3含量除了15%脂肪组23℃时显著高于16℃时,血清C4含量除了8%脂肪组23、30℃时显著低于16℃时 (P<0.05)外,其他各脂肪组温度对C3、C4含量影响均不显著 (P>0.05)。
2.3 不同温度下饲料脂肪水平对松浦镜鲤肝胰脏和脾脏抗氧化能力的影响
从表3可见:16℃时,松浦镜鲤肝胰脏SOD和CAT均随着饲料脂肪水平的增加而降低,而肝胰脏MDA含量则随饲料脂肪水平的增加而升高,其中5%和8%脂肪组肝胰脏SOD和CAT活性显著高于11%和15%脂肪组 (P<0.05);8%脂肪组肝胰脏MDA含量显著低于15%脂肪组 (P<0.05);脾脏MDA含量随饲料脂肪水平的增加而降低, 15%脂肪组含量显著低于5%和8%脂肪组 (P<0.05)。23℃时,8%和11%脂肪组肝胰脏SOD活性显著高于5%和15%脂肪组 (P<0.05),脾脏SOD活性8%和15%脂肪组显著高于5%脂肪组(P<0.05);肝胰脏和脾脏CAT活性各脂肪组差异均不显著 (P>0.05);肝胰脏和脾脏MDA含量随饲料脂肪水平的上升均显著升高 (P<0.05)。30℃时,各脂肪组抗氧化指标差异均不显著 (P>0.05)。温度和饲料脂肪水平的交互作用对脾脏SOD和CAT活性影响不显著 (P>0.05),但对其他指标均有显著影响 (P<0.05)。
表3 不同温度下饲料脂肪水平对松浦镜鲤肝胰脏和脾脏抗氧化能力的影响
Tab.3 Effects of different dietary lipid levels on antioxidation in hepatopancreas and spleen of songpu mirror carp at different temperature
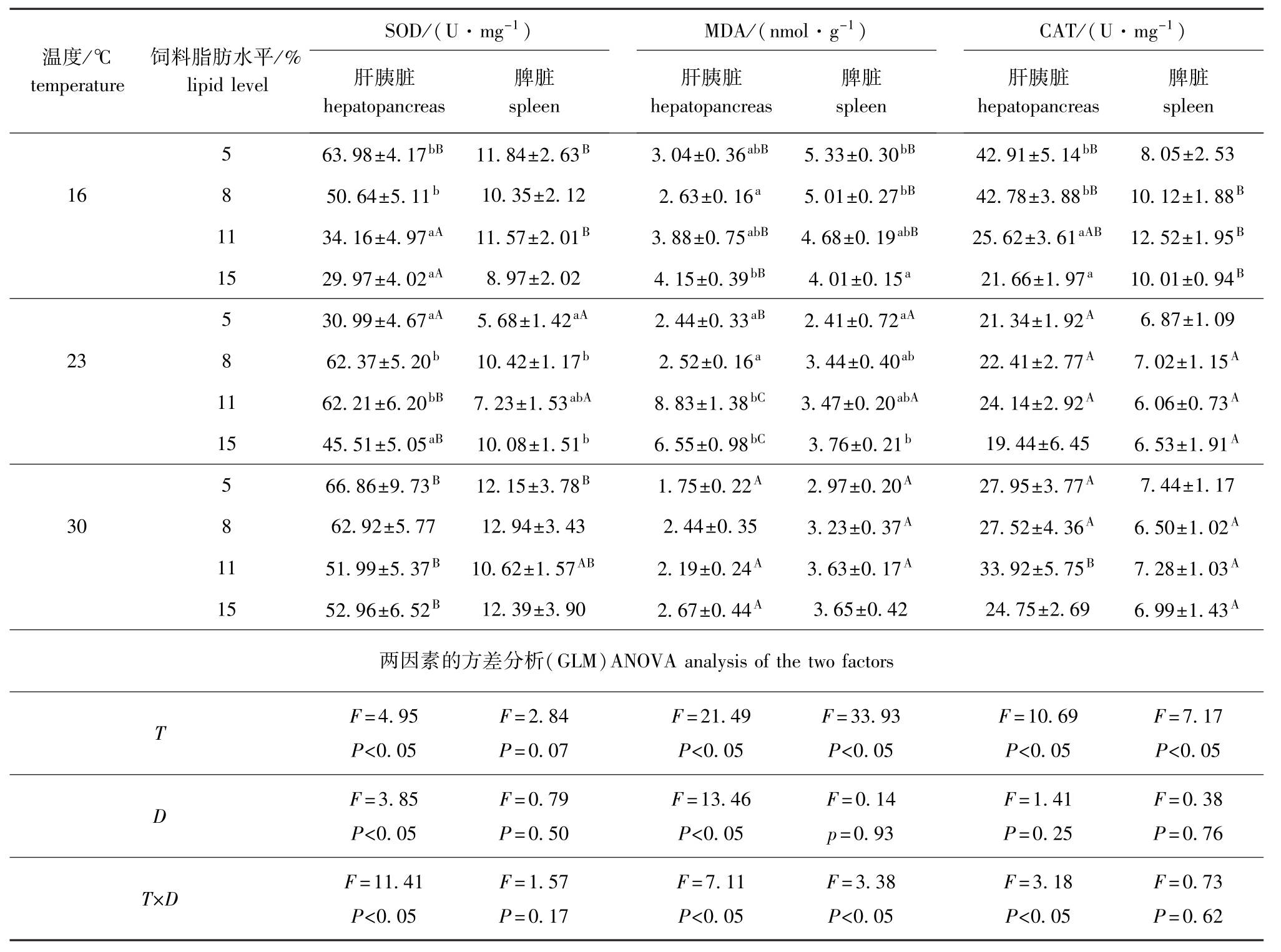
温度/℃temperature饲料脂肪水平/% lipid level SOD/(U·mg-1)肝胰脏hepatopancreas脾脏spleen MDA/(nmol·g-1)肝胰脏hepatopancreas脾脏spleen CAT/(U·mg-1)肝胰脏hepatopancreas脾脏spleen 5 63.98±4.17bB11.84±2.63B3.04±0.36abB5.33±0.30bB42.91±5.14bB8.05±2.53 16 8 50.64±5.11b10.35±2.12 2.63±0.16a5.01±0.27bB42.78±3.88bB10.12±1.88B11 34.16±4.97aA11.57±2.01B3.88±0.75abB4.68±0.19abB25.62±3.61aAB12.52±1.95B15 29.97±4.02aA8.97±2.02 4.15±0.39bB4.01±0.15a21.66±1.97a10.01±0.94B5 30.99±4.67aA5.68±1.42aA2.44±0.33aB2.41±0.72aA21.34±1.92A6.87±1.09 23 8 62.37±5.20b10.42±1.17b2.52±0.16a3.44±0.40ab22.41±2.77A7.02±1.15A11 62.21±6.20bB7.23±1.53abA8.83±1.38bC3.47±0.20abA24.14±2.92A6.06±0.73A15 45.51±5.05aB10.08±1.51b6.55±0.98bC3.76±0.21b19.44±6.45 6.53±1.91A5 66.86±9.73B12.15±3.78B1.75±0.22A2.97±0.20A27.95±3.77A7.44±1.17 30 8 62.92±5.77 12.94±3.43 2.44±0.35 3.23±0.37A27.52±4.36A6.50±1.02A11 51.99±5.37B10.62±1.57AB2.19±0.24A3.63±0.17A33.92±5.75B7.28±1.03A15 52.96±6.52B12.39±3.90 2.67±0.44A3.65±0.42 24.75±2.69 6.99±1.43A两因素的方差分析(GLM)ANOVA analysis of the two factors T F=4.95 P<0.05 F=2.84 P=0.07 F=21.49 P<0.05 F=33.93 P<0.05 F=10.69 P<0.05 F=7.17 P<0.05 D F=3.85 P<0.05 F=0.79 P=0.50 F=13.46 P<0.05 F=0.14 p=0.93 F=1.41 P=0.25 F=0.38 P =0.76 T×D F=11.41 P<0.05 F=1.57 P=0.17 F=7.11 P<0.05 F=3.38 P<0.05 F=3.18 P<0.05 F=0.73 P=0.62
2.4 不同饲料脂肪水平下温度对松浦镜鲤肝胰脏和脾脏抗氧化能力的影响
从表3可见:肝胰脏SOD活性除5%脂肪组外都随温度的上升而升高,其中11%和15%脂肪组显著升高 (P<0.05);脾脏SOD活性5%脂肪组23℃时显著低于其他温度组 (P<0.05);肝胰脏CAT活性随温度的升高先降低后升高,脾脏CAT活性随温度的升高除了5%脂肪组无显著变化外其余各脂肪组均显著下降 (P<0.05);各饲料脂肪水平下,肝胰脏和脾脏MDA含量随温度的升高总体有降低趋势,其中只有11%和15%脂肪组23℃时反而显著升高 (P<0.05)。
3 讨论
3.1 温度和饲料脂肪水平对松浦镜鲤免疫指标的影响
溶菌酶是广泛存在于鱼类各种体液、血清和巨噬细胞中的一种水解酶,不仅具有溶解病原菌、活化补体途径的作用,而且还有发挥趋化和调理素的功能[15]。目前对罗非鱼[16]、大比目鱼[17]和大西洋鲷[18]的研究中发现,水温升高能显著增加其血清溶菌酶活性。但本试验结果显示,肝胰脏和脾脏溶菌酶活性随温度的升高显著下降,这与楠田等[19]研究发现日本鳗鲡Anguilla JaponicaTemminck et Schlegel各种器官和组织中溶菌酶活性在15℃饲养水温条件下比在25℃和30℃饲养水温条件下高的结果相一致。笔者认为,这可能是由鱼类的免疫反应随温度变化受鱼类种类的影响较多造成的[20]。本研究中,水温为23℃和30℃时,低脂肪组比高脂肪组更能维持肝胰脏溶菌酶活性。
鱼类补体系统与哺乳动物补体系统具有相似的功能,目前在鱼类中已发现有经典激活途径、旁路途径[21]。前人研究发现,升高水温能增强罗非鱼Oreochromis niloticus旁路途径活化[16],大马哈鱼补体的活化与温度呈负相关[22]。本试验中仅在15%饲料脂肪水平时,23℃组显著高于16℃组,这可能与鱼类补体系统的活化具有种属特异性和不同鱼类生活的最适水温不同有关,还需更深入地研究分析才能确定。各温度下饲料脂肪水平对血清C3、C4质量浓度的影响不显著,产生这种结果的原因可能由于脂肪营养素的代谢还没有影响到补体激活系统,从而没有对镜鲤血清C3、C4质量浓度产生影响。
IgM是鱼类的一种免疫球蛋白,在适宜的温度范围内多种鱼类血清中免疫球蛋白的活性随温度的升高而增强,如红大马哈鱼[22]和鲤[7]等。本研究中鲤血清IgM质量浓度随温度的升高而显著降低,这也与江育林[23]、侯亚义等[24]对其他鱼类的研究结果不同,可能是鱼的种类和最适生长温度不同所致。关于饲料脂肪水平对鱼类血清IgM的影响还鲜有报道,有待进一步研究。
ALP是生物体内的一种重要的代谢调控酶,直接参与磷酸基团的转移和钙磷代谢,其活性在一定程度上可以反映动物体的免疫情况。目前温度对鱼类ALP的影响研究甚少,影响机制尚不清楚,有关这方面的研究还需进一步深入。各温度条件下不同脂肪组血清ALP活性无显著差异,表明饲料脂肪水平对松浦镜鲤血清ALP活性影响不显著。
3.2 温度和饲料脂肪水平对松浦镜鲤肝胰脏和脾脏抗氧化能力的影响
动物细胞生存要求适当的氧化与抗氧化平衡[25]。MDA被认为是脂质过氧化的主要分解产物,其含量的高低不仅可以间接反映活性氧自由基含量的多少,而且还可以反映组织细胞脂质过氧化的强度或速率[26]。鱼体内都存在一套有效的抗氧化防御系统来清除氧自由基及其代谢产物,这种抗氧化系统主要包括SOD、CAT等抗氧化酶。测定这两种酶的活性常用于评估体内自由基反应的动态变化及组织损伤情况。关于饲料脂肪水平对鱼类抗氧化能力的影响已有一些报道,王朝明等[27]研究表明,胭脂鱼Myxocyprinus asiaticus肝胰脏SOD活性随着饲料脂肪水平的增加先升高后降低,而MDA含量则先降低后升高;林仕梅等[28]研究表明,罗非鱼肝胰脏CAT活性和MDA含量随饲料脂肪水平的增加而升高,SOD活性则在8.5%脂肪组显著降低。本试验中,各温度下随饲料脂肪含量的增加,镜鲤肝胰脏MDA含量有升高趋势,其中在23℃时表现尤为明显,在此温度下11%脂肪组肝胰脏MDA含量较5%和8%脂肪组增加1倍多,这表明此时镜鲤肝胰脏脂肪酸开始发生过氧化并导致过氧化产物增加。16℃时,SOD和CAT活性均随饲料脂肪水平的升高而降低,表明在16℃下高饲料脂肪水平可以引起镜鲤抗氧化能力减弱;23℃时,11%脂肪组肝胰脏SOD和CAT活性明显高于其他组,可能在此饲料脂肪水平下MDA含量显著增加,从而引起鱼体开始出现氧化应激有关;30℃时,饲料脂肪水平对松浦镜鲤抗氧化能力无显著影响,可能是高温下松浦镜鲤代谢加快,抗氧化酶活性增加,从而减弱了饲料脂肪水平的影响。
研究表明,水温的变化能直接影响鱼体内的抗氧化酶活性[29],水温的升高可以使鱼体代谢加快及耗氧量增加,加快氧自由基的产生,从而引起抗氧化酶活性的升高。杨建等[30]研究指出,军曹鱼血清SOD和CAT活性随水温 (26~32℃)的升高而升高;刘松岩等[31]研究发现,中华鲟血清SOD活性随水温的升高变化显著,而CAT活性变化则不显著。本试验结果显示,SOD活性随水温的升高而升高,而CAT活性则先升高后降低,说明随温度的升高松浦镜鲤幼鱼出现了一定的氧化应激,为了维持平衡抗氧化酶活性也随之增加。CAT活性在16℃时比在23℃时高,可能是16℃时产生了低温应激造成的。MDA含量随温度的升高有降低趋势,这正好与抗氧化酶活性升高相吻合。
综合分析温度和饲料脂肪水平对松浦镜鲤幼鱼免疫和抗氧化能力的影响,从鱼体免疫角度推测松浦镜鲤幼鱼在16℃和23℃时饲料脂肪添加量分别不宜超过8%和11%。
参考文献:
[1] 李亚南,王翼平,邵健忠,等.鱼类免疫应答中温度效应研究[J].浙江大学学报,1999,26(3):82-85.
[2] Saha N R,Usami T,Suzuki Y.Seasonal changes in the immune activities of common carp(Cyprinus carpio)[J].Fish Physiology and Biochemistry,2002,26:379-387.
[3] Hoare R,Hovland H,Langston A L,et al.Susceptibility of three different strains of juvenile Atlantic halibut(Hippoglossus hippoglossusL.)cultured at two different temperatures toVibrio anguillarumand temperature effect on antibody response[J].Fish& Shellfish Immunol,2003,13(2):111-123.
[4] Enqelsma M Y,Houqee S,Nap D,et al.Multiple acute temperature stress affects leucocyte populations and antibody responses in common carp,Cyprinus carpioL.[J].Fish&Shellfish Immunol, 2003,15(5):397-410.
[5] Jurd R D.Specilization in the teleost and anuran respnose,a comparative critique in fish immunology[M].London:Academic Press INC,1985:9-28.
[6] Avtalion R R,Milgrom L.Regulatory effect of temperature and amtigen upon immunity[J].Immunology,1976,31(4):589.
[7] Lemorvan C,Deschaux P,Troutaud D.Effects and mechanisms of environmental temperature on carp(Cyprinus carpio)anti-DNP antibody response and non-specific cytotoxic cell activity:A kinetic study[J].Developmental and Comparative Immunology, 1996,20(5):331-340.
[8] Avtalion R R,Malik Z,Lefler E,et al.Temperature effect on immune resistance of fish to pathogens[J].Bamidge Bull Fish Cult Isr,1970,22:33-38.
[9] Rueda-Jasso R,Conceicão L E C,Dias J.Effect of dietary nonprotein energy levels on condition and oxidative status of Senegalese sole(Solea senegalensis)juveniles[J].Aquaculture,2004, 231:417-433.
[10] Janssens B J,Childress J J,Baguet F,et al.Reduced enzymatic antioxidative defence in deep-sea fish[J].J Exp Biol,2000,203: 3717-3725.
[11] Winston G W,Di Giulio R T.Prooxidant and antioxidant mechanism in aquatic organisms[J].Aquat Toxicol,1991,19:137-161.
[12] 韩娜,金峰.德国镜鲤高密度驯化养殖技术[J].黑龙江水产, 2009(3):28.
[13] 韩玉国,姜晓琴.德国镜鲤无公害养殖技术[J].黑龙江水产, 2009(3):10-11.
[14] 张桐,徐奇友,许红,等.不同温度下不同蛋白水平对镜鲤非特异性免疫的影响[J].东北农业大学学报,2010,41(12):80 -85.
[15] Ellis A E.Immunity to bacteria in fish[J].Fish&Shellfish Immunology,1999,9:291-308.
[16] Ndong D,Chen YY,Lin YH,et al.The immune response of tilapiaOreochromis mossambicusand its susceptibility toStreptococcus iniaeunder stress in low and high temperatures[J].Fish&Shellfish Immunology,2007,22:686-694.
[17] Bowden T J,Butler R,Bricknell I R.Seasonal variation of serum lysozyme levels in Atlantic halibut(Hippoglossus hippoglossusL.) [J].Fish&Shellfish Immunology,2004,17:129-135.
[18] Tort L,Rotllant J,Rovira L.Immunological suppression in gilthead sea breamSparus aurataof the North-West Mediterranean at low temperatures[J].Comparative Biochemistry and Physiology, 1998,120:175-179.
[19] 楠田理一,北代典幸.ウナギのリゾチム活性に及ばす饲育水温の影响[J].水产增殖,1992,40(4):453-456.
[20] Watts M,Munday B L,Burke C M.Immune responses of teleost fish[J].Aust Vet J,2001,79(8):570-574.
[21] 覃川杰,杨川,陈昌福.水温对鱼类免疫活动的影响[J].河南师范大学学报:自然科学版,2011,39(5):129-133.
[22] Alcorn S W,Murray A L.Effects of rearing temperature on immune functions in sockeye salmon(Oncorhynchus nerka)[J].Fish &Shellfish Immunology,2002,12:303-334.
[23] 江育林.草鱼免疫应答的初步研究[J].水生生物学报,1991, 15(4):321-326.
[24] 侯亚义,韩晓冬.温度和类固醇激素对虹鳟免疫球蛋白IgM的影响[J].南京大学学报:自然科学版,2001,37(5):563-568.
[25] 刘丽,赵会宏,张国良,等.肌肽对奥尼罗非鱼生长性能的影响[J].水生生物学报,2008,32(5):643-648.
[26] Slatert F,Mickle P L.Oxygen free radicals and tissue damage [M].Amsterdam:Excerpta Medica,1979:143.
[27] 王朝明,罗莉,张桂众,等.饲料脂肪水平对胭脂鱼幼鱼生长、体组成和抗氧化能力的影响[J].淡水渔业,2010,40(5):47-53.
[28] 林仕梅,萝莉.饲料脂肪水平和复合降脂因子对罗非鱼生长性能和肝胰脏代谢、抗氧化指标的影响[J].动物营养学报, 2010,22(6):1585-1591.
[29] Martínez-Ávarez R M,Morales A E,Sanz A.Antioxidant defenses in fish:Biotic and abiotic factors[J].Rev Fish Biol Fisher,2005, 15:75-88.
[30] 杨健,陈刚,黄建盛,等.温度和盐度对军曹鱼幼鱼生长与抗氧化酶活性的影响[J].广东海洋大学学报,2007,27(4):25-29.
[31] 刘松岩,王明学.环境胁迫对中华鲟体内自由基水平和抗氧化酶活力的影响[D].武汉:华中农业大学,2006.
Effects of dietary lipid levels on immunity and antioxidant function in Songpu mirror carp at different temperatures
XU Zhi-chong1,3,LIU Hui2,XU Qi-you3,WANG Chang-an3,XU Hong3
(1.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China;2.Management Station of Aquatic Animal Larvae and Juveniles in Kuandian Manzhu Autonomous County,Liaoning province,Kuandian 118200,China;3.Laboratory for Animal Nutrition,Heilongjiang River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Haerbin 150070,China)
Abstract:A feeding trial was conducted to study the effects of dietary lipid levels(5%,8%,11%,and 15%)on immunity and antioxidant function in Songpu mirror carp(Cyprinus carpioL.)juveniles with body weght of 5.51 g± 0.05 g stocked into 36 tanks of each 150 Liters with recirculating water and reared for 70 d.at different temperatures(16,23,and 30℃).The results showed that:(1)At 16℃,the superoxide dismutase(SOD)and catalase (CAT)activities in the hepatopancreas were found to be significantly increased with the decrease in dietary lipid level(P<0.05),in 5%and 8%lipid groups significantly higher than that in the 11%and 15%groups(P<0.05).There was significantly higher hepatopancreas malondialdehyde(MDA)concentration in the 15%lipid group than that in the 8%group(P<0.05).In the spleen,however,the fish had significantly higher MDA concentration in the 5%and 8%lipid groups than that in the 15%group(P<0.05).(2)At 23℃,the lysozyme(LYZ) activity in the hepatopancreas was found to be increased first and then decreased with the decrease in dietary lipid level.The SOD activity in the hepatopancreas was shown to be higher in 5%and 15%dietary lipid groups than that in 8%and 11%dietary lipid groups(P<0.05).There was significantly lower hepatopancreas LYZ activity in the 15%lipid group than that in the 8%group(P<0.05).The hepatopancreas MDA concentration and the spleen SOD,and MDA concentration were significantly increased with the increase in dietary lipid level(P<0.05).(3) At 30℃,the hepatopancreatic LYZ activity in the 15%lipid group were significantly lower than thatin other groups,and the serum IgM concentration significantly lower in the 5%lipid group than that in the 15%group(P<0.05).(4)Immunity and antioxidant function were more affected by temperature at different dietary lipid levels (P<0.05).(5)It was concluded that in terms of immunity,the optimum dietary lipid requirement of Songup mirror carp was 8%at 16℃ and 11%at 23℃.
Key words:Songup mirror carp;temperature;lipid level;immunity;antioxidation
中图分类号:S963.7
文献标志码:A
文章编号:2095-1388(2012)05-0429-07
收稿日期:2011-11-21
基金项目:现代农业产业技术体系建设专项资金资助项目 (CARS-46)
作者简介:许治冲 (1986-),男,硕士研究生。E-mail:xu_zhichong@163.com
通信作者:徐奇友 (1969-),男,研究员。E-mail:xuqiyou@sina.com


