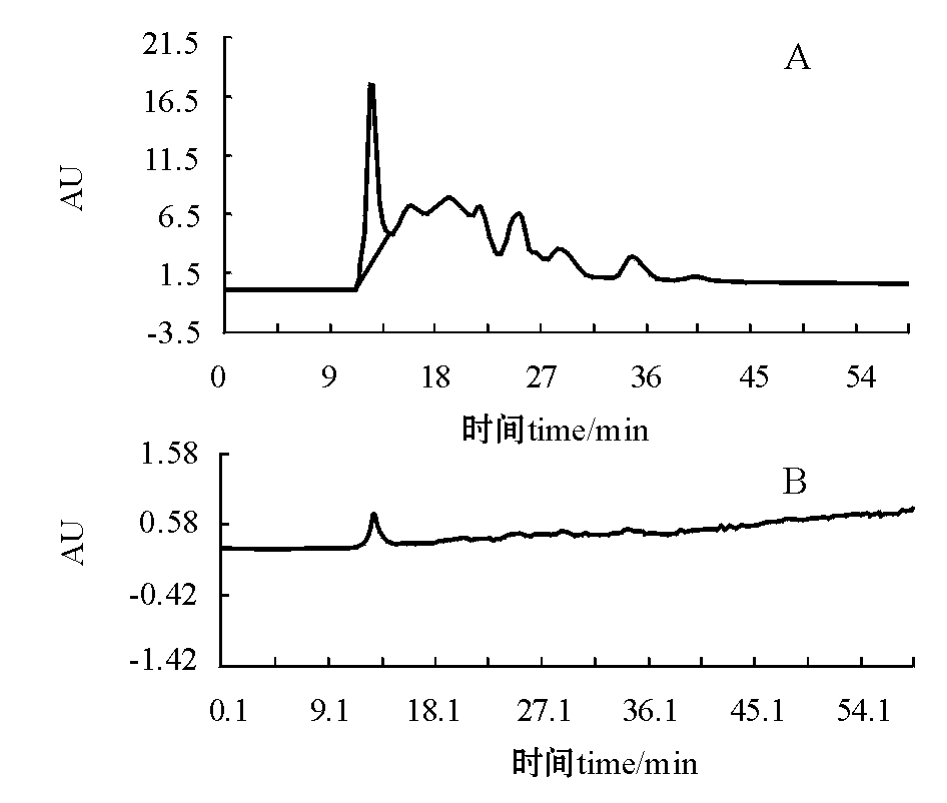
图1 MCL-T的HPLC色谱图
Fig.1 HPLC of MCL-T
注:A第一次HPLC;B第二次HPLC。Note:A HPLC;B Rechromatograph.
李伟1,陈文1,佟长青1、2,孔亮3,曲敏1,谭成玉3,金桥1,李丹彤4
(1.大连海洋大学食品科学与工程学院,辽宁大连116023;2.东北林业大学盐碱地生物资源环境研究中心,东北油田盐碱植被恢复与重建教育部重点实验室,黑龙江哈尔滨150040;3.大连海洋大学海洋环境工程学院,辽宁大连116023;4.大连海洋大学水产与生命学院,辽宁大连116023)
摘要:采用Cellulose DE52离子交换层析、Sephadex G-100分子筛层析及TSK G3000PWXL凝胶色谱柱HPLC从菲律宾蛤仔Ruditapesphilippinarum中分离纯化出具有N-乙酰半乳糖酰胺 (N-acetyl-D-galactosamine,GalNAc)和猪胃黏蛋白 (Mucin from porcine stomach,PSM)特异性的菲律宾蛤仔凝集素 (简称为MCL-T)。SDS-PAGE分析结果表明,MCL-T的相对分子量为148 000,含有62 000和36 000的亚基。抑菌试验结果表明,MCL-T对金黄色葡萄球菌Staphylococcusaureus和枯草芽孢杆菌Bacillussubtilis有较高的抑菌活性。对MCL-T中Trp残基、-S-S-、-SH以及Tyr残基进行化学修饰后,MCL-T对金黄色葡萄球菌的抑菌活性丧失;对其-S-S-进行化学修饰后,MCL-T对枯草芽孢杆菌的抑菌活性影响不大,而对其-SH、Trp残基和Tyr残基进行化学修饰后,MCL-T对枯草芽孢杆菌的抑菌活性丧失。研究表明,MCL-T肽链上的氨基酸残基状态与其抑菌活性有关。
关键词:菲律宾蛤仔;凝集素;抗菌活性;化学修饰
凝集素是非酶及非免疫的蛋白质或糖蛋白,广泛存在于海洋动物、植物和微生物中,在生物机体中起着防御作用[1]。同时,凝集素还具有抗菌、促有丝分裂及抗病毒等多种生物学活性。有关海洋生物凝集素的抗菌活性已有很多报道,Gowda等[2]研究了从海参Holothuriascabra中分离的T-抗原特异性凝集素对一系列革兰氏阳性菌和阴性菌的抗菌活性,并详细研究了细菌表面杂多糖链的变化对凝集素凝集细菌活性的影响;Liao等[3]报道了从红藻中分离的凝集素具有抗海洋弧菌活性;Tasumi等[4]报道了日本鳗鱼Anguillajaponica皮肤黏液中的凝集素具有抑制大肠杆菌Escherichiacoli(K12)的活性。这些研究结果表明,海洋生物凝集素可以成为潜在的生物抗菌剂。
本研究中,作者分离纯化了菲律宾蛤仔Ruditapesphilippinarum凝集素,对其抑菌活性进行了初步研究,并对其氨基酸残基经化学修饰后凝集素抑菌活性的变化进行了研究,旨在探索凝集素结构与抗菌活性之间的关系,为实现其在抗菌方面的应用提供参考。
1.1 材料与仪器
菲律宾蛤仔购于大连兴工街农贸市场;大肠杆菌Escherichiacoli、产气荚膜梭菌Clostridiumperfringens、金黄色葡萄球菌Staphylococcusaureus、枯草芽孢杆菌Bacillussubtilis均取自辽宁出入境检验检疫局。
高效液相色谱 (HPLC):色谱柱为 TSK G3000PWXL(4.6mm×300 mm),柱温为室温,流动相为0.01 mol/L磷酸盐 (pH 7.4)缓冲液。
1.2 方法
1.2.1 凝集素的分离纯化 将菲律宾蛤仔研磨粉碎,用PBS(0.1 mol/L磷酸盐,pH 7.8,含0.15 mol/LNaCl)在4℃下抽提过夜。将匀浆液离心20 min(5 000g),取上清液,加入(NH4)2SO4,使其饱和浓度达到80%,静置过夜后,离心20 min (5 000g),收集沉淀。将沉淀溶于0.1 mol/L Tris -HCl(pH 7.8,含0.15 mol/L NaCl)缓冲液中,将溶液装入透析袋中,透析除去 (NH4)2SO4后,冷冻干燥,得到凝集素粗品。
用TB(0.01 mol/L Tris-HCl,pH 7.8)缓冲液冲洗Cellulose DE52柱 (0.5 cm×10 cm)至吸光值 (A280nm)稳定后,将粗品用少量TB缓冲液溶解后,加入到Cellulose DE52离子交换层析柱中,用含有0~1 mol/L NaCl的TB缓冲液进行梯度洗脱,测定血凝活性,收集具有血凝活性的组分,透析,冷冻干燥。将冻干样品用少量TB缓冲液溶解,加入到Sephadex G-100分子筛层析柱 (2.5 cm×100 cm)中,用TB缓冲液进行洗脱,收集具有血凝活性的组分,透析,冷冻干燥。再将冻干样品溶于PBS中,离心 (4℃,10 000g)20 min,用0.45μm的微孔滤膜过滤,取20μL上清液,使用HPLC进行纯化,测定A280nm。
1.2.2 分子量的测定 采用SDS-PAGE电泳[5]方法测定分子量。
1.2.3 血凝活力的测定 在96孔U型微量血凝板中的每孔中加入25μL Tris-HCl缓冲液,往第1孔中加入25μL凝集素,混匀后,进行倍比稀释,最后在每孔中加入25μL含体积分数为2%人B型红细胞的Tris-HCl缓冲液,振荡摇匀,在室温下放置1 h后进行观察。以红细胞凝集活力最大的稀释度为该凝集素样品的凝集活力 (凝集效价),记为2n[6]。
1.2.4 血凝抑制的测试 在96孔U型板中分别将各种抑制剂25μL连续倍比稀释于等体积含0.15 mol/L NaCl的TB缓冲液中。然后在每个孔中分别加入25μL凝集素 (4倍血凝集活性),再加入25 μL体积分数为2%的人B型红细胞悬浮液。1 h后,测定每种抑制剂的最小抑制浓度。
1.2.5 抑菌活性的测定 将供试菌种用斜面培养基活化,以无菌生理盐水制成106~107cfu/mL的菌悬液。采用滤纸片法测定凝集素的抑菌作用[7]。将厚约4 mm的滤纸打成直径为6 mm的圆片,高压灭菌。吸取0.1 mL各供试菌悬液,分别均匀涂布于平板培养基上。将滤纸片浸于凝集素溶液中,取出后晾干,再贴至平板上,以浸入无菌水中的滤纸片作为对照。于37℃培养箱中培养24 h后测定抑菌圈的直径。
1.2.6 菲律宾蛤仔凝集素氨基酸残基的化学修饰1)对凝集素中色氨酸残基 (Trp)的修饰。N -溴代丁二酰亚胺 (NBS)可以与蛋白质中的色氨酸 (Trp)发生反应[8]。将凝集素溶于0.1 mol/L NaAc-HAc缓冲液 (pH 4.0)中,使其浓度为1.5 mg/mL。每次加入10μL 10 mmol/L NBS溶液 (用pH为4.0的0.1 mol/L NaAc-HAc缓冲液配制),间隔5 min测定A280nm。再次加入NBS,直至A280nm值不再下降为止,透析除去过量的NBS,冷冻干燥,测定其抑菌活性。
2)对凝集素氨基酸残基中二硫键 (-S-S-)及巯基 (-SH)的修饰。1,4-二硫代苏糖醇(DTT)可以还原蛋白质中的-S-S-。用 PB (0.015 mol/L磷酸盐,pH 7.2)缓冲液配制浓度为1.5 mg/mL的凝集素溶液,使DTT终浓度为20 mmol/L,室温下反应3 h后,透析除去过量的DTT,加入0.1 mol/L碘乙酸 (IA,用PB缓冲液配制),使凝集素终浓度为1.5 mg/mL,40℃下反应10 min,透析,冷冻干燥,测定其抑菌活性。
N-乙基顺丁烯二酰亚胺 (NEM)可以与-SH发生反应[9]。用10μL 10 mmol/L NEM(用PB缓冲液配制)与凝集素进行反应,反应5 min后测定A300nm,之后每隔5 min加入NEM 10μL,反应后测定A300nm,直到吸光值不再下降为止,透析,收集样品浓缩,测定其抑菌活性。
3)对凝集素中酪氨酸残基 (Tyr)的修饰。乙酰咪唑 (NAI)可以与乙酰化凝集素中的Tyr发生反应[10]。用含0.15 mol/L NaCl的PB缓冲液溶解NAI,使NAI终浓度为135 mmol/L,凝集素终浓度为1.5 mg/mL,在30℃下反应30 min后,透析,冷冻干燥,测定其抑菌活性。
2.1 菲律宾蛤仔凝集素 (MCL-T)的分离纯化
将菲律宾蛤仔匀浆后,取其上清液中的蛋白质,用饱和浓度为80%的 (NH4)2SO4沉淀,得到的蛋白质具有80%的总血凝活性 (即回收率为80%)。将获得的蛋白质沉淀透析后进行Cellulose DE52离子交换层析,将收集到的具有血凝活性的组分经Sephadex G-100分子筛层析后,再收集具有血凝活性的蛋白峰组分,透析、冷冻干燥。将冻干样品溶于 Tris-HCl缓冲液 (含 0.15 mol/L NaCl)中,经过HPLC纯化,发现第一个色谱峰具有血凝活性 (图1-A),收集具有血凝活性的组分,再次经过HPLC后,得到一个对称的单一色谱峰,这表明该蛋白已经达到色谱纯 (图1-B)。MCL-T经过4步分离纯化,得到MCL-T纯化样品,最终回收率为14%(表1)。

图1 MCL-T的HPLC色谱图
Fig.1 HPLC of MCL-T
注:A第一次HPLC;B第二次HPLC。Note:A HPLC;B Rechromatograph.
经SDS-PAGE电泳检测,没有加入β-巯基乙醇的MCL-T出现相对分子量为148 000的蛋白质,而加入β-巯基乙醇的MCL-T则出现相对分子量为62 000和36 000的蛋白质 (图2)。β-巯基乙醇可以还原蛋白质中的二硫桥。这表明,MCL-T中含有不均一亚基,亚基间由二硫桥连接。
类似的研究有:2004年,Bulgakov等 发现的相对分子量为138 000的菲律宾蛤仔凝集素(MCL),含有相对分子量为74 000、34 000和30 000的亚基;2008年,Takahashi等[12]发现的相对分子量为70 000的菲律宾蛤仔凝集素 (MCL4),由相对分子量为58 000和43 000的亚基组成。
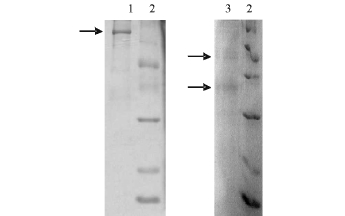
图2 MCL-T的SDS-PAGE电泳
Fig.2 SDS-PAGE electrophoresis of MCL-T
注:1非还原状态下的MCL-T;2标准蛋白质样品;3还原状态下的MCL-T。
Note:1 MCL-T in non-reducingand reducing;2 marker proteins; 3 MCL-T in reducing conditions.
表1 菲律宾蛤仔凝集素的分离纯化
Tab.1 Isolation and purification of MCL-T from M anila clam
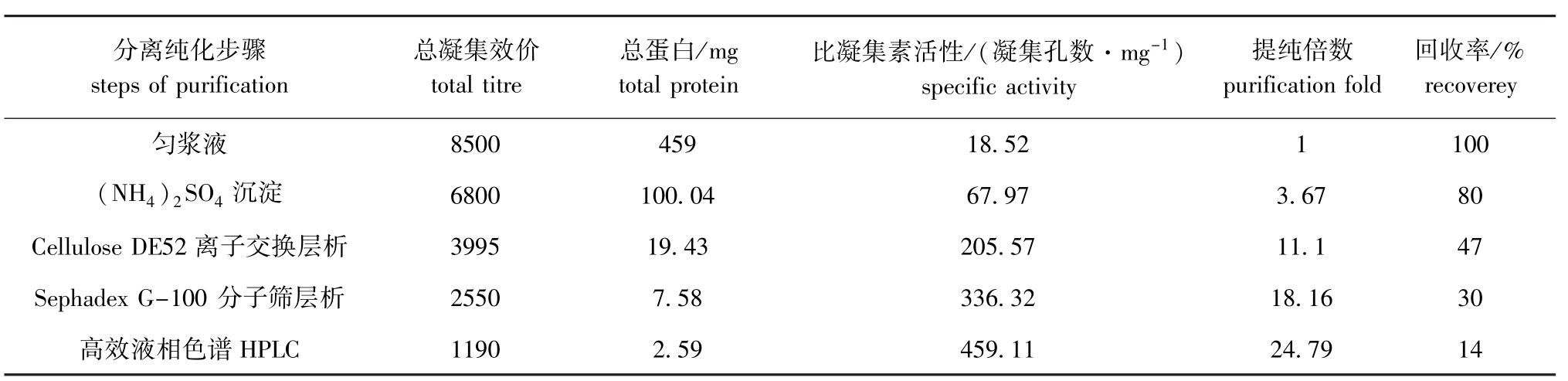
分离纯化步骤steps of purification回收率/% 8500 459 18.52 1 100 (NH4)2SO4沉淀 6800 100.04 67.97 3.67 80 Cellulose DE52离子交换层析 3995 19.43 205.57 11.1 47 Sephadex G-100分子筛层析 2550 7.58 336.32 18.16 30高效液相色谱recoverey匀浆液总凝集效价total titre总蛋白/mg total protein比凝集素活性/(凝集孔数·mg-1) specific activity提纯倍数purification fold HPLC 1190 2.59 459.11 24.79 14
2.2 MCL-T的糖结合特性
血凝抑制试验结果表明:D-葡萄糖 (DGlc)、D-半乳糖 (D-Gal)、D-甘露糖 (D-Man)、N-乙酰-D-葡萄糖酰胺在浓度为100 mmol/L时,对MCL-T血凝活性没有抑制作用;而N-乙酰半乳糖酰胺 (N-acetyl-D-galactosamine,GalNAc)和猪胃黏蛋白 (Mucin from porcine stomach,PSM)对其血凝活性有抑制作用,最小抑制浓度分别为0.0057 mmol/L、0.032μg/mL。
已有报道,菲律宾蛤仔凝集素有 MCL、MCL1、MCL3、MCL4、唾液酸结合凝集素 (sialic acid-binding lectin)、rMCGal和 GST fused rMCGal[11-16]等 (表2)。MCL的糖特异性为末端非还原状态的β-连接的GalNAc和末端非还原状态的β -连接的半乳糖[11];MCL3的糖特异性为GalNAc、D-甘露糖、乳糖 (Lactose) 和棉子糖 (Raffinose)[13];MCL4的糖特异性为GalNAc、N-乙酰葡萄糖酰胺 (GlcNAc)、N-乙酰神经氨酸 (NeuAc)、D-甘露糖、D-岩藻糖 (D-Fucose)和猪胃黏蛋白(PSM)[12];唾液酸结合凝集素的糖特异性为唾液酸[14];rMCGal和GST fused rMCGal的糖特异性均为D-Gal[15];MCL1[16]与MCL-T的糖特异性均为GalNAc、PSM,但二者分子量及亚基组成均不相同。从血凝抑制试验结果及分子量测定来看,MCL -T是一种新的菲律宾蛤仔凝集素。
表2 文献报道的菲律宾蛤仔凝集素
Tab.2 The lectins from M anila clam Ruditapes philippinarum in references
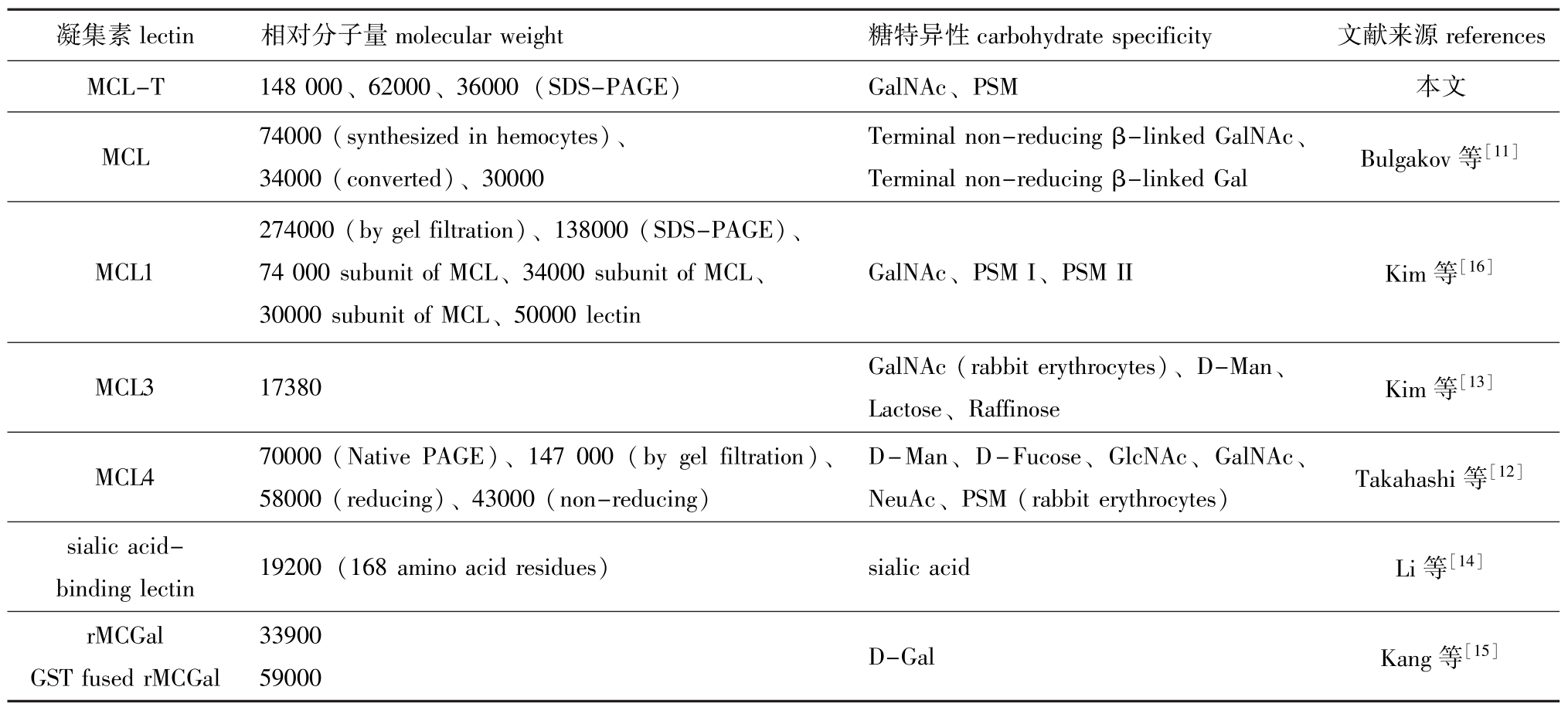
凝集素lectin 相对分子量molecular weight 糖特异性carbohydrate specificity 文献来源references MCL-T 148 000、62000、36000(SDS-PAGE) GalNAc、PSM 本文MCL 74000(synthesized in hemocytes)、34000(converted)、30000 Terminal non-reducingβ-linked GalNAc、Terminal non-reducingβ-linked Gal Bulgakov等[11]MCL1 274000(by gel filtration)、138000(SDS-PAGE)、74 000 subunit of MCL、34000 subunit of MCL、30000 subunit of MCL、50000 lectin GalNAc、PSM I、PSM II Kim等[16]MCL3 17380 GalNAc(rabbit erythrocytes)、D-Man、Lactose、Raffinose Kim等[13]MCL4 70000(Native PAGE)、147 000(by gel filtration)、58000(reducing)、43000(non-reducing) D-Man、D-Fucose、GlcNAc、GalNAc、NeuAc、PSM(rabbit erythrocytes) Takahashi等[12]sialic acidbinding lectin 19200(168 amino acid residues) sialic acid Li等[14]rMCGal GST fused rMCGal 33900 59000 D-Gal Kang等[15]
2.3 MCL-T的抑菌活性
从表3可见:MCL-T对金黄色葡萄球菌和枯草芽孢杆菌表现出较高的抑菌活性;除DTT+IA修饰的MCL-T对枯草芽孢杆菌保留抑菌活性外,经过其它化学修饰的MCL-T均失去抑菌活性。对MCL-T的Trp残基、-S-S-、-SH以及Tyr残基进行修饰后,MCL-T对金黄色葡萄球菌的抑菌活性丧失;对其-S-S-进行修饰后,MCL-T对枯草芽孢杆菌的抑菌活性影响不大,而对其-SH、Trp残基和Tyr残基进行修饰后,MCL-T对枯草芽孢杆菌的抑菌活性丧失。这些结果表明,MCL-T中Trp、-S-S-、-SH和Tyr残基与对金黄色葡萄球菌抑菌活性有关,-SH、Trp残基和Tyr残基与对枯草芽孢杆菌抑菌活性有关。凝集素结构的改变对其抑菌活性具有较大的影响。
表3 MCL-T的抑菌活性
Tab.3 Antibacterial activity of MCL-T
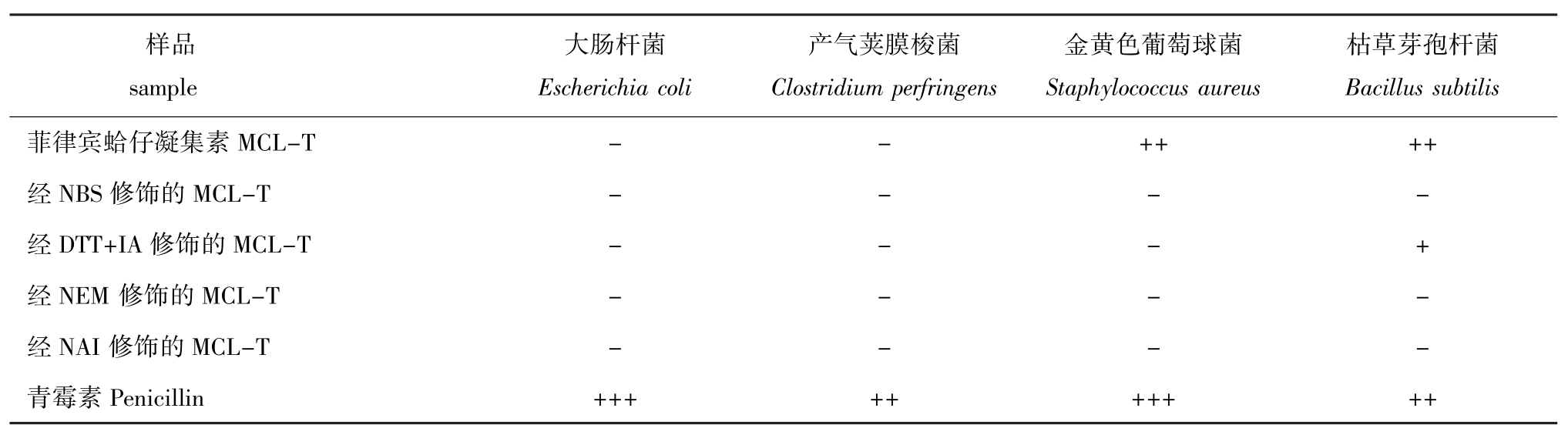
注:-表示没有抑菌活性,抑菌圈直径<7 mm;+表示弱抑菌活性,抑菌圈直径为7~11 mm;++表示中度抑菌活性;抑菌圈直径为11~16 mm;+++表示高抑菌活性,抑菌圈直径>16 mm。
Note:-No antibacterial activity is<7 mm in inhibition diameter;+Weak antibacterial activity is7-11 mm;++Moderate antibacterial activity is11-16 mm;+++High antibacterial activity is>16 mm.
枯草芽孢杆菌Bacillussubtilis菲律宾蛤仔凝集素样品sample大肠杆菌Escherichiacoli产气荚膜梭菌Clostridiumperfringens金黄色葡萄球菌StaphylococcusaureusPenicillin +++ ++ +++ ++ MCL-T - - ++ ++经NBS修饰的MCL-T - - - -经DTT+IA修饰的MCL-T - - - +经NEM修饰的MCL-T - - - -经NAI修饰的MCL-T - - - -青霉素
参考文献:
[1] Belogortseva N I,Molchanova V I,Kurika A V,et al.Isolation and characterization of new GalNAc/Gal-specific lectin from the sea musselCrenomytilusgrayanus[J].Comparative Biochemistry and Physiology,1998,119C:45-50.
[2] Gowda N M,Goswami U,Khan M I.T-antigen binding lectin with antibacterial activity from marine invertebrate,sea cucumber(Holothuriascabra):Possible involvement in differential recognition of bacteria[J].Journal of Invertebrate Pathology,2008,99:141-145.
[3] LiaoW-R,Lin J-Y,Shieh W-Y,et al.Antibiotic activity of lectins from marine algae againstmarineVibrios[J].Journal of Industrial Microbiology and Biotechnology,2003,30:433-439.
[4] Tasumi S,Ohiras T,Kawazoe I,etal.Primary structure and characteristics of a lectin from skin mucus of the Japanese eelAnguillajaponica[J].Journal of Biological Chemistry,2002,277:27305-27311.
[5] LaemmliU K.Cleavage of structure proteins during assembly of the head of acteriophage T4[J].Nature,1970,227:680-685.
[6] Bulgakov A A,Nazarenko E L,Petrova I Y,et al.Isolation and properties of a mannan-binding lectin from the coelomic fluid of the holothurianCucumariajaponica[J].Biochemistry(Moscow), 2000,65:933-939.
[7] 程永宝.微生物学实验与指导[M].北京:中国医药科技出版社,1994.
[8] Lindahl P,Alriksson E,Jornall H,et al.Interaction of the cysteine proteinase inhibitor chicken cystatin with papain[J].Biochemistry,1988,27:5074-5082.
[9] Alexander N M.Spectrophotometric assay for sulfhydryl groups using N-Ethylmaleimide[J].Analatical Chemistry,1958,30(7): 1292-1294.
[10] Selman-Reimer S,Duhe R J,Selman B R.N-ethylmaleimide inhibition of the catalytic activities of theDunaliellasalinacoupling factor 1(CF1)and the restoration of the inhibition of the CF1ATPase activity by N-ethylmaleimide[J].Biochimica Biophysica Acta,1985,810(3):325-331.
[11] Bulgakov A A,Park K I,Choi K S,et al.Purification and characterization ofa lectin isolated from the Manila clamRuditapesphilip-pinarumin Korea[J].Fish&Shellfish Immunology,2004,16:487 -499.
[12] Takahashi K G,Kuroda T,Muroga K.Purification and antibacterial characterization of a novel isoform of the Manila clam lectin (MCL 4)from the plasma of the Manila clam,Ruditapesphilippinarum[J].Comparative Biochemistry and Physiology,2008,150B: 45-52.
[13] Kim JY,Adhyya M,Cho S K,et al.Characterization,tissue expression,and immunoshichemical localization of MCL3,a C-type lectin produced byPerkinsusolseni-infected Manila clam(Ruditapesphilippinarum)[J].Fish&Shellfish Immunology,2008,25: 598-603.
[14] Li C,Yu S,Zhao J,et al.Cloning and characterization of a sialic acid binding lectins(SABL)from Manila clamVenerupisphilippinarum[J].Fish&Shellfish Immunology,2011,30:1202-1206.
[15] Kang Y S,Kim Y M,Park K I,et al.Analysis of EST and lectin expressions in hemocytes of Manila clams(Ruditapesphilippinarum)(Bivalvia:Mollusca)infected withPerkinsusolseni[J].Developmental and Comparative Immunology,2006,30:1119-1131.
[16] Kim Y M,Park K I,Choi K S,et al.Lectin from the Manila clamRuditapesphilippinarumis induced upon infection with the protozoan ParasitePerkinsusolseni[J].Journal of Biological Chemistry, 2006,281:26854-26864.
Isolation,purification and antibacterial activity of lectin from M anila clam Ruditapes philippinarum
LIWei1,CHENWen1,TONG Chang-qing1,2,KONG Liang3, QU Min1,TAN Cheng-yu3,JIN Qiao1,LIDan-tong4
(1.College of Food Science and Engineering,Dalian Ocean University,Dalian 116023,China;2.Alkali Soil Natural Environmental Science Center, Northeast Forestry University/Key Laboratory of Saline-alkali Vegetation Ecology Restoration in Oil Field,Ministry of Education,Harbin 150040,China;3.College of Marine Science and Environment,Dalian Ocean University,Dalian 116023,China;4.College of Fisheries and Life Science, Dalian Ocean University,Dalian 116023,China)
Abstract:A N-acetyl-D-galactosamine(GalNAc)-/mucin from porcine stomach(PSM)-specific lectin(MCL -T)was purified from Manila clamRuditapesphilippinarumusing a combination of ion exchange on Cellulose DE52 and gel filtration on Sephadex G-100 and HPLC on TSK-GEL G3000PWXL.Molecular weight of the MCL-T was determined by SDS-PAGE to be 148 000,containing two kinds of subunits,62 000 and 36 000.The MCL-Twas found to show the antibacterial activities againstStaphylococcusaureusandBacillussubtilis.The antibacterial activities toStaphylococcusaureuswas found to be disappeared in the MCL-T in which tryptophan residues,-S-S-, -SH and tyrosine residueswere chemically modified.The chemicalmodification of-S-S-in the MCL-T led to less effects on the antibacterial activities againstBacillussubtilis,but the chemicalmodification of its-SH,tryptophan residues and tyrosine residues resulted in losing antibacterial activities againstBacillussubtilis.The findings indicate that the patterns of the MCL-T amino acid residues is involved in the antibacterial activities.
Keywords:Ruditapesphilippinarum;lectin;antibacterial activity;chemicalmodification
中图分类号:Q532
文献标志码:A
收稿日期:2012-05-14
基金项目:国家自然科学基金资助项目 (31071612,21075012)
作者简介:李伟 (1964-),男,教授,博士生导师。E-mail:aisingioro@hotmail.com
文章编号:2095-1388(2012)04-0333-05