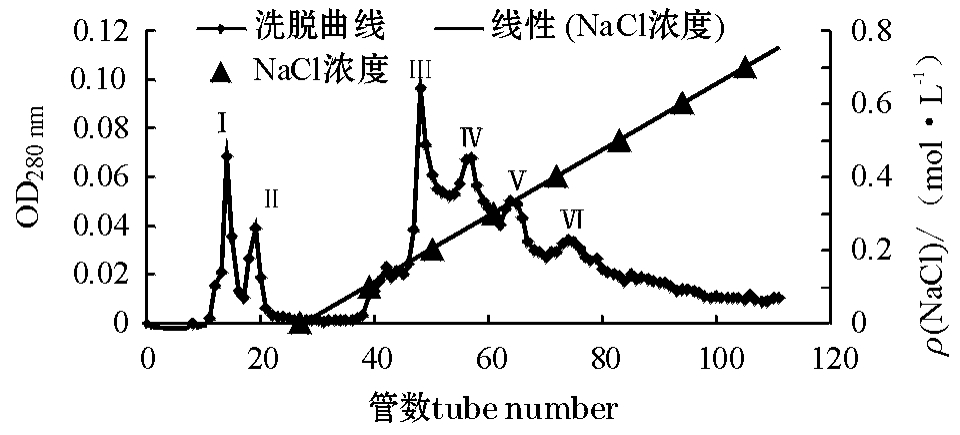
图1 经70%硫酸铵沉淀粗酶液的DEAE650-M阴离子交换层析图谱
Fig.1 Chromatogram of crude enzyme solution with 70%(NH4)2SO4by DEAE650-M exchange chromatography
黄丽洋,丁建君,姜山,杨杰,陈炜,胡建恩
(大连海洋大学食品科学与工程学院,辽宁大连116023)
摘要:以斑点叉尾鮰Ictalurus punctatus鱼肠道为原料提取蛋白酶,对分离条件进行了优化,并对部分酶学性质进行了研究。结果表明:鱼肠内的蛋白酶在硫酸铵饱和度为70%时,所得沉淀中酶活力最高。经过阴离子交换层析分离后,蛋白酶的纯化倍数达到了218倍。该蛋白酶的最适温度为55℃,最适pH为7.5,具有良好的低温稳定性和酸碱稳定性,米氏常数为5.4 g/L。K+和Ca2+离子对该蛋白酶活性有较弱的激活作用,Mg2+则能显著激活蛋白酶活性;Na+和Zn2+对蛋白酶的活性有较弱抑制作用,而Cu2+和EDTA能显著抑制蛋白酶活性。
关键词:斑点叉尾鮰;鱼肠;蛋白酶;分离纯化
斑点叉尾鮰Ictalurus punctatus原产于美国密西西比河,其肉质鲜美,现已成为中国淡水养殖种类之一[1]和大宗出口加工鱼类之一。而加工过程中产生的鱼肚是高档食材,却作为废弃物处理,造成了环境的污染。动物性蛋白酶由于受原料限制,一直产量低、价格高。为此,本研究中,作者以斑点叉尾鮰的肠道为原料提取蛋白酶,对分离条件进行了优化,并对部分酶学性质进行了研究,旨在将废弃的鱼加工副产物作为生物制剂的原料。
1.1 材料
新鲜的斑点叉尾鮰鱼肠由江苏盐城海天水产品有限公司提供,预处理前在-20℃下保存备用。主要试剂有酪蛋白、牛血清蛋白、L-酪氨酸等,均为分析纯。主要仪器有Toyopearl DEAE650-M阴离子交换树脂、高速冷冻离心机、冷冻干燥机、紫外检测仪、自动收集器、蠕动泵等。
1.2 方法
1.2.1 粗酶液的制备 取斑点叉尾鮰鱼肠道,除去污物后用去离子水洗净,称重,按质量与体积比为1∶2加入Tris-HCl(4℃,pH为7.5、0.05 mol/ L)缓冲液,用高速组织捣碎机捣碎,在4℃下离心(14 000×g)20 min,取上清液,按体积比为1∶4加入正丙醇(4℃),搅拌均匀后于4℃下静置4 h,离心(14 000×g)20 min,收集上清液即为粗酶液。
1.2.2 硫酸铵的分级沉淀 取粗酶液,加入硫酸铵使其饱和度分别为20%、30%、40%、50%、60%、70%和80%,搅拌均匀后在4℃下静置30 min,离心(14 000×g)20 min,去上清液得沉淀,溶解后测定不同饱和度下的蛋白酶活性,透析24 h后保存备用[2]。
1.2.3 蛋白酶的分离纯化 经70%硫酸铵沉淀以及透析后的粗酶液,用DEAE650-M阴离子交换柱分离,以去离子水和NaCl溶液(1 mol/L)进行连续梯度洗脱,流速为0.5 mL/min,5 mL/管,紫外检测波长为280 nm,透析脱盐后测定蛋白酶活性,收集活性峰溶液。
1.2.4 蛋白酶活性的测定 用Folin-酚法测定蛋白酶的活性,标准曲线制作用L-酪氨酸法进行。在40℃下,酶每分钟水解酪蛋白产生1 μg酪氨酸定义为1个酶活力单位(U)。
1.2.5 蛋白质含量的测定 采用Lowry法和分光光度法进行测定,以牛血清白蛋白为标准样品。
1.2.6 酶学性质[3-6]1)酶的最适作用温度。将粗酶液分别于30、40、50、55、60、70℃下反应,测定蛋白酶活力。
2)酶的热稳定性。将粗酶液分别于30、40、50、55、60℃恒温条件下保温15、30、45、60、90 min,测定蛋白酶活性。
3)酶的最适pH。用pH值分别为6、7、7.5、8、9、10的缓冲液配制酪蛋白溶液,测定不同pH条件下的蛋白酶活性。
4)酶的酸碱稳定性。用pH值分别为3、4、5、6、7、7.5、8、9、10的缓冲液处理粗酶液,4℃条件下静置4 h后,测定其蛋白酶活性。
5)酶的米氏常数。取粗酶液5份,分别与质量分数为0.1%、0.2%、0.3%、0.4%、0.5%的酪蛋白溶液于55℃、pH为7.5条件下反应,测其吸光度,由底物浓度、酶活力对应吸光值,用Lineweaver-Burk双倒数法作图。
6)金属离子和EDTA对酶活性的影响。在粗酶液中分别加入K+、Na+、Mg2+、Ca2+、Zn2+、Cu2+和EDTA,使其终浓度为10 mmol/L,4℃下静置4 h后,测定在金属离子及EDTA存在下的蛋白酶活性。以未添加金属离子和EDTA的粗酶液的酶活力为100%计算。
2.1 硫酸铵的分级沉淀
斑点叉尾鮰鱼肠蛋白酶的硫酸铵分级沉淀中,硫酸铵饱和度为20%、30%时测不到蛋白酶的活性;饱和度为40%、50%、60%、70%、80%时蛋白酶的活性分别为257、370、428、1 773、624 U/mg。表明硫酸铵饱和度大于60%时,沉淀中的蛋白酶活性显著,其中以饱和度为70%时活性最高;而硫酸铵饱和度低于30%时,蛋白酶活性不显著。
2.2 蛋白酶的分离纯化
鱼肠蛋白酶经硫酸铵沉淀后的样品再经DEAE650-M阴离子交换层析纯化(图1),出现6个280 nm吸收峰,分别测定其蛋白酶活性和蛋白质含量。酶比活力测定结果显示:峰Ⅲ和峰Ⅳ所含蛋白酶的比活力比较高,分别为374、257 U/mg。

图1 经70%硫酸铵沉淀粗酶液的DEAE650-M阴离子交换层析图谱
Fig.1 Chromatogram of crude enzyme solution with 70%(NH4)2SO4by DEAE650-M exchange chromatography
如表1所示,鮰鱼肠蛋白酶经硫酸铵盐析、DEAE650-M阴离子交换层析、冷冻干燥等处理后,其比活力由粗酶液中的350 U/mg提高到3 920 U/mg,纯化倍数达到218。
表1 鱼肠蛋白酶的分离纯化步骤与酶活力
Tab.1 The data on purification of fish intestine protease and its activity
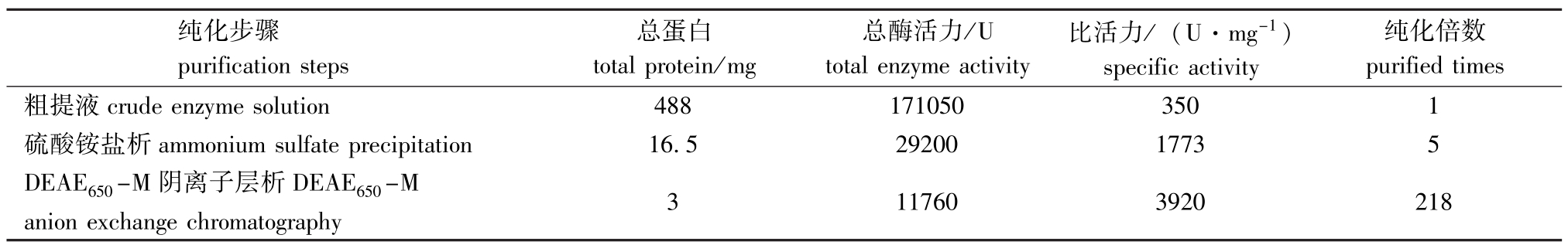
purified times粗提液纯化步骤purification steps总蛋白total protein/mg总酶活力/U total enzyme activity比活力/(U·mg-1) specific activity纯化倍数crude enzyme solution4881710503501硫酸铵盐析ammonium sulfate precipitation16.52920017735 DEAE650-M阴离子层析DEAE650-M anion exchange chromatography 3117603920218
2.3 蛋白酶的酶学性质
2.3.1 酶的最适作用温度 从图2可见,在所测定的温度范围内,酶的最适作用温度为55℃。
2.3.2 酶的热稳定性 从图3可见,低温下蛋白酶的稳定性较好。在55℃下,保温60 min后,酶活力仍保留50%左右;而在30、40℃下,保温90 min后,酶活力仍可保留60%以上。
2.3.3 酶的最适pH 由图4可见:pH为7.5时酶活力达到最高,其后随着pH的增大而逐渐降低,pH小于7时酶活力急剧下降。
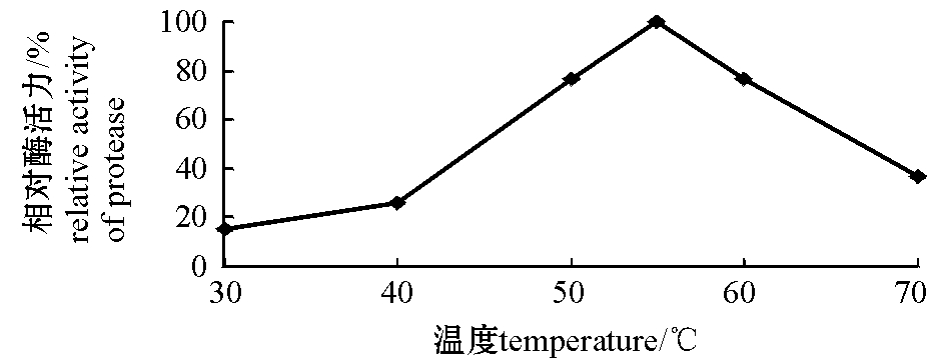
图2 温度对酶活力的影响
Fig.2 Effect of temperature on activity of protease
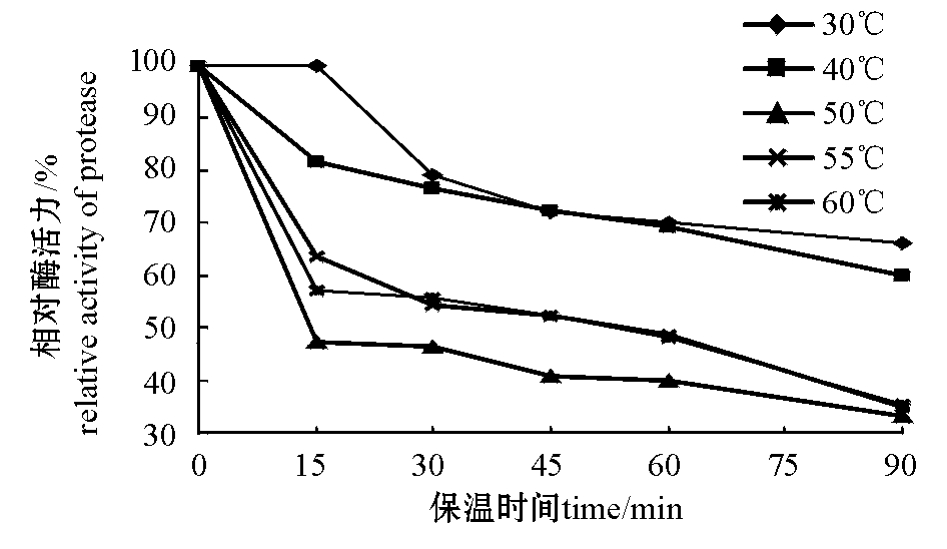
图3 蛋白酶的热稳定性
Fig.3 Effect of temperature on stability of protease activity
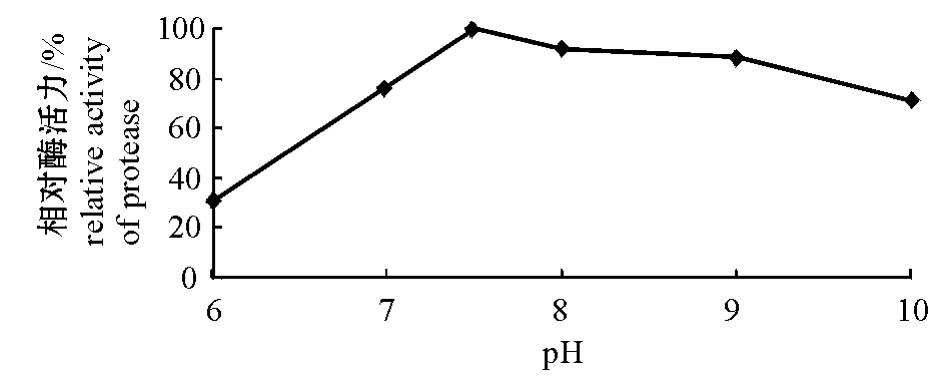
图4 pH对酶活力的影响
Fig.4 Effect of pH value on activity of protease
2.3.4 酶的酸碱稳定性和酶的米氏常数Km 从图5可见:在pH为7.5~10时,酶活力可以保持在60%以上,酶的稳定性良好。
从图6可见:当酶以酪蛋白为底物时,Km值为5.4 g/L。表明该蛋白酶与酪蛋白的亲和力较强。2.3.5 金属离子和EDTA对蛋白酶活性的影响不添加任何物质的粗酶液以及添加金属离子K+、Mg2+、Ca2+、Na+、Zn2+、Cu2+和EDTA的粗酶液中,蛋白酶的相对酶活力分别为100%、107%、151%、119%、87%、65%、18%、26%。表明K+和Ca2+对蛋白酶活性有较弱的激活作用,而Mg2+则可以显著激活蛋白酶活性;Na+和Zn2+对蛋白酶活性有较弱抑制作用,而Cu2+和EDTA则可以明显抑制蛋白酶的活性。
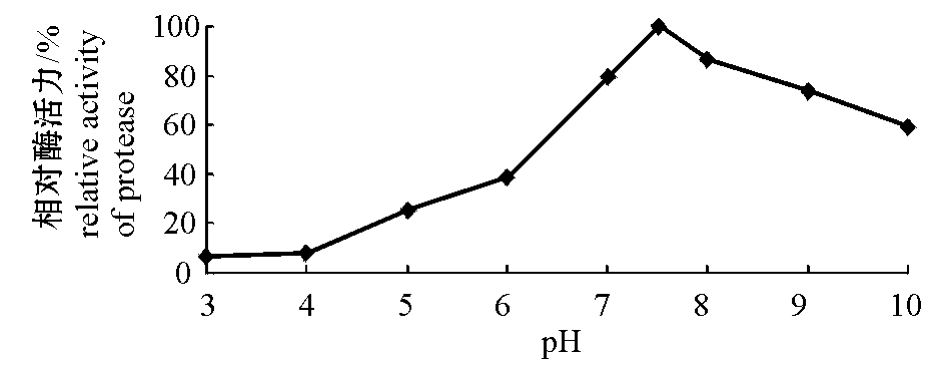
图5 酶的酸碱稳定性
Fig.5 Effect of pH on stability of protease activity
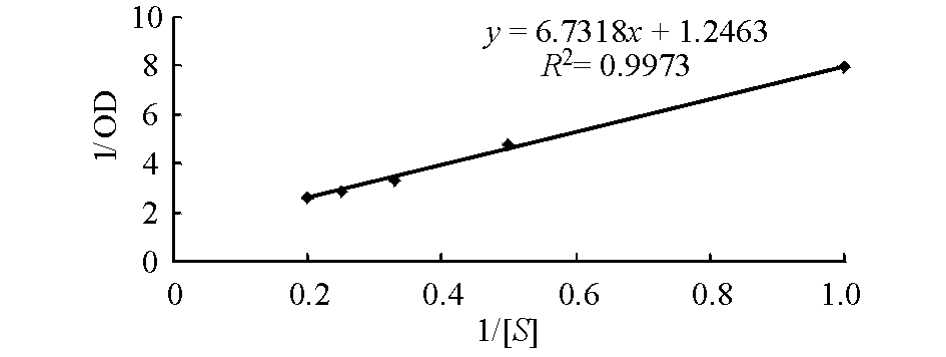
图6 酶催化酪蛋白水解的Lineweaver-Burk双倒数关系图
Fig.6 The Lineweaver-Burk plot of protease hydrolyzation catalysed
参考文献:
[1] 伍莉,陈鹏飞,石志敏,等.添加剂对斑点叉尾鮰肠道蛋白酶活力的影响[J].四川畜牧兽医学院学报,2001,15(3):23-27.
[2] 康平,汪秋宽,宋琳琳,等.皱纹盘鲍内脏酶的酶学性质及褐藻胶裂解酶的分离纯化[J].水产学报,2007,31(1):15-22
[3] 李英辉,丛丽娜,朱蓓薇,等.海参肠中溶菌酶的分离纯化及其酶学性质[J].大连工业大学学报,2008,27(3):193-196.
[4] 江信红,唐云明.黄鳝肠道蛋白酶的分离纯化及其性质[J].中国水产科学,2005,12(3):329-335.
[5] 于国英,朱莉,韩志武.鲐鱼蛋白水解酶的提取纯化及其活性研究[J].中国生化药物杂志,2005,26(1):39-40.
[6] 陈清西,陈祥仁,颜青,等.鲨鱼肠道蛋白酶的分离纯化及性质的初步研究[J].厦门大学学报:自然科学版,1994,33(6):843 -847.
Purification and characterization of protease from intestines of Ictalurus punctatus
HUANG Li-yang,DING Jian-jun,JIANG Shan,YANG Jie,CHEN Wei,HU Jian-en
(College of Food Science and Engineering,Dalian Ocean University,Dalian 116023,China)
Abstract:The paper studies purification and characterization of protease from intestines of Ictalurus punctatus.The result demonstrates that protease has the maximum activity with 70%saturation(NH4)2SO4in crude extraction solution.By using ion exchange chromatography,protease is purified 218-fold.It further shows that the optimal temperature and pH is 55℃and 7.5 respectively for protease with optimal stability,and that Michaelis constant is 5.4 g/L.K+,Mg2+and Ca2+may enhance protease activity.Na+,Zn2+,Cu2+and EDTA may reduce protease activity.
Key words:Ictalurus punctatus;intestine;protease;purification
中图分类号:Q959.482
文献标志码:A
文章编号:2095-1388(2012)01-0083-03
收稿日期:2011-03-14
作者简介:黄丽洋(1985-),女,硕士研究生。E-mail:hly-824@163.com
通信作者:胡建恩(1962-),男,教授。E-mail:hujianen@yahoo.cn