用饲料酵母替代鱼粉对大菱鲆幼鱼生长及免疫机能的影响
崔敏,郭冉,夏辉
(河北农业大学海洋学院,河北秦皇岛066000)
摘要:分别用质量分数为0、15%、30%、45%、60%的饲料酵母替代饲料中0、17%、34%、51%、68%的鱼粉,配制成5种等氮、等能的试验饲料,分别记为Ⅰ(对照组)、Ⅱ、Ⅲ、Ⅳ和Ⅴ组。将195尾大菱鲆Scophthatmus maximus(9.02 g±0.15 g)随机分为5组,每组设3个重复,每个重复组放养13尾鱼。将试验鱼饲养于设有循环流水系统的水族箱(60 cm×40 cm×50 cm)中,用5种饲料投喂,每天投喂3次,投饲率为鱼体质量的3%~4%,以生长及免疫指标来评价饲料酵母替代鱼粉对大菱鲆幼鱼生长的影响。经过56 d的饲养,结果表明:Ⅱ组的增重率(275.30%)和特定生长率(1.91%/d)最高,但与对照组(235.66%、1.82%/d)无显著差异(P>0.05);Ⅱ组的饲料系数(1.34)最低,但与对照组(1.53)无显著差异(P>0.05);Ⅱ组(97.44%)和Ⅳ组(94.87%)的成活率均显著高于对照组(84.62%)(P<0.05),而Ⅴ组的成活率(74.36%)则显著低于对照组(P<0.05);鱼体的粗蛋白含量随着饲料酵母替代比例的增加而逐渐降低(P<0.05),粗灰分则逐渐升高(P<0.05);溶菌酶、超氧化物歧化酶和血浆中蛋白的含量随着替代比例的增加而减少,且当饲料酵母替代比例超过51%时,与对照组差异显著(P<0.05)。综合考虑大菱鲆的生长指标、形体指标、鱼体成分和免疫机能等因素,要获得最佳的养殖效益,大菱鲆幼鱼饲料中用饲料酵母替代鱼粉的比例以17%为宜。
关键词:大菱鲆;饲料酵母;生长性能;免疫机能
大菱鲆Scophthatmus maximus俗称多宝鱼,其生长速度快、肉质细嫩、口感独特,是中国重要的海水养殖种类之一。据统计,2009年中国鲆鲽类总产量为7.9~8.9万t,其中总产量的92%来自山东、河北、天津、辽宁4个环渤海湾主产区,大菱鲆产量占到总产量的55%,2010年大菱鲆的产量达到5万t[1]。
大菱鲆对饲料中蛋白质的需求量较高,尤其是幼鱼。当饲料中蛋白的质量分数低于39%时,幼鱼生长缓慢;只有当蛋白的质量分数高于42%时,大菱鲆幼鱼才会快速生长[2]。众所周知,在水产动物的饲料原料中,最紧缺的就是饲料蛋白源,积极开发饲料蛋白源具有较高的经济效益和社会效益。目前,对渔用蛋白源的研究主要集中在动物性蛋白源、植物性蛋白源、单细胞蛋白源等几个方面。本试验中所使用的饲料酵母属单细胞蛋白,它是以淀粉企业生产淀粉和葡萄糖的废弃物为底物,以产朊假丝酵母Candida utilis为菌种,经过一系列的发酵、蒸干、喷雾干燥等工艺加工而成。该饲料酵母中蛋白质的质量分数可达46.36%,粗脂肪、粗纤维的质量分数分别为1.71%和0.04%,总氨基酸的质量分数为36.04%,赖氨酸含量较高,蛋氨酸含量较少,营养十分丰富。如能充分利用该饲料酵母作为蛋白来源最大限度地替代鱼粉,不仅可以减少鱼粉的使用量,降低生产成本,还能充分利用中国的糟渣资源,解决环境污染问题。
目前关于饲料酵母对鱼类生长影响的研究较多,大多集中在用饲料酵母替代鱼粉后对鱼类的增重率、饲料系数等指标的影响,研究对象多为鲤Cyprinus carpio[3]、建鲤Cyprinus carpiovar jian[4]、罗非鱼Oreochromis mossambicus[5]和淡水白鯧Ephippus orbis[6]等。免疫学指标是鱼类生理学、营
养与饲料的主要研究内容之一。酶活力是反映鱼类免疫机能的重要指标。目前,对水产动物免疫学指标的探索主要集中在酵母培养物、酵母细胞壁和酵母膏上[7-10],但饲料酵母对大菱鲆免疫机能的影响还未见系统的报道。本研究中,作者采用营养学和免疫学方法,探索饲料酵母替代鱼粉的可行性及其在大菱鲆饲料中适宜的添加比例,以期为饲料酵母的应用提供参考资料。
1 材料与方法
1.1 材料
大菱鲆幼鱼购于秦皇岛天合水产良种有限公司,体质量为(9.02 g±0.15 g),共195尾。
1.2 方法
1.2.1 试验饲料的配制 试验中所用鱼粉为秘鲁鱼粉,粗蛋白质量分数为68%。饲料酵母由秦皇岛骊骅淀粉股份有限公司生产和提供,粗蛋白质量分数为46.36%。试验中分别用质量分数为0、15%、30%、45%、60%的饲料酵母替代饲料中0、17%、34%、51%、68%的鱼粉,配制成5种等氮、等能的试验饲料,分别记为Ⅰ(对照组)、Ⅱ、Ⅲ、Ⅳ和Ⅴ组。饲料配方及饲料的营养成分见表1。根据饲料配方将所有饲料原料用粉碎机进行粉碎,过80目筛,混匀,挤压成直径为1.5 mm的硬颗粒饲料,干燥后密封于冰箱(-20℃)中保存,备用。
表1 饲料组成及营养成分
Tab.1 The ingredients and composition of the experimental dietsw/%

注:1)饲料(均为质量分数,%)中还包括磷虾粉krill meal 2,玉米淀粉corn starch 5,复合矿物盐Mineral mixture 0.5,复合维生素Vitamin mixture 2,胆碱choline 0.5(纯度为50%),VC磷酸酯ascorbic phosphate ester 0.4,羧甲基纤维素钠sodium salt of caboxy methyl cellulose 1;
2)复合矿物盐(g/kg)中包括氯化钴CoCl2·6H2O 0.04,硫酸锰MnSO4·H2O 6.5,硫酸铜CuSO4·5H2O 2.5,硫酸亚铁FeSO4·7H2O 40,硫酸镁MgSO4·7H2O 283.98,亚硒酸钠NaSeO30.1,碘化钾KIO40.67,硫酸锌ZnSO4131.93,填充物filler 534.28;
3)复合维生素(g/kg)中包括盐酸硫氨素thiamine hydrochloride 0.5,VB6pyridoxine 1,烟酸niacin 5,核黄素riboflavin 3,肌醇inositol 5,泛酸钙Ca-pantothenate 5,生物素biotin 0.05,叶酸folic acid 0.18,VK3menadione 2,VB12cyanocobal-amine 0.002,VA醋酸盐vitamin A acetate(20 000 IU/g)5,VD3vitamin D3(400 000 IU/g)0.002,VE vitamin E(250 IU/g)8,纤维素cellulose 865.266。
组别group raw materials鱼粉fish meal原料饲料酵母feed yeast纤维素cellulose鳕鱼油cod-fish oil nutritional composition水分moisture营养成分粗蛋白crude protein粗脂肪crude fat总糖total sugar粗灰分crude ash总能/(MJ·kg-1) total energy 18.44 17.69 16.91 16.21 0 15.39ⅠⅡⅢⅣⅤ65 54 43 32 21 15 30 45 60 23.1 18.3 13.6 8.6 4.1 0.5 1.3 2.0 3.0 3.5 10.39 11.26 10.46 11.17 11.49 45.40 45.17 44.93 44.70 44.46 7.30 7.30 7.20 7.40 7.10 5.00 5.75 6.50 7.25 8.00 7.96 9.39 10.45 11.58 12.81
1.2.2 试验设计及饲养管理
将大菱鲆幼鱼随机分为5组,每组设3个重复,每个重复组放养13尾鱼。试验在室内循环流水的水族箱(60 cm×40 cm×50 cm)中进行,内盛水120 L,用试验饲料驯化10 d后开始试验。试验期间,水温为(18.0±1.0)℃,pH为(7.6±0.4),溶氧大于8 mg/L,盐度为(30.60±0.02)。每天饲喂3次(7:00、12:00和18:00),投饲率为体质量的3%~4%。每14 d调整一次投喂量,试验持续56 d。
1.2.3 样品的采集 试验结束后,禁食1 d,每箱随机取3尾鱼称重,置于105℃下烘干[11],然后用微型粉碎机粉碎、称重,装入密封袋中并置于冰箱(-20℃)中冷冻保存,用于测定其粗蛋白、粗灰分和粗脂肪含量[12-13]。另从每箱中随机取3尾鱼,麻醉处理后,测其体长和体质量,然后用2.5 mL一次性无菌注射器(含肝素钠)从心脏采血,并置于冰箱(4℃)中过夜,以3 000 r/min于4℃下离心10 min,分离血浆,将收集的血浆保存于冰箱(-80℃)中,待测。
1.2.4 体成分的测定 饲料及鱼体成分均采用国标中的方法测定。采用105℃烘箱干燥法测定干物质的质量,采用马弗炉灼烧法(550℃)测定粗灰分含量,采用凯氏定氮法测定粗蛋白质含量,采用索氏抽提法(以石油醚为溶剂)测定粗脂肪含量[14]。
1.2.5 生化指标的测定 采用考马斯亮蓝染色法测定血浆中的总蛋白,采用黄嘌呤氧化酶法测定超氧化物歧化酶(super oxide dismutase,SOD)的活力,采用磷酸苯二钠比色法测定碱性磷酸酶(alka-
line phosphatase,AKP)的活力,参照Yin等[15]的方法测定溶菌酶(lysozyme)的活力,以上指标均用南京建成生物工程研究所生产的试剂盒测定。测定杀菌活性(bactericidal activity)时,以大肠杆菌为底物,在普通培养基中培养24 h后,用0.067 mol/L的PBS(pH 6.4)洗涤成菌悬液,使其OD570nm≈0.3。取2 mL配制好的大肠杆菌菌悬液放入试管中,加入20 μL血浆,混匀,测其吸光度A0;然后将试管移入37℃下水浴30 min,取出后立即冰浴10 min,测其吸光度A,用下列公式计算杀菌活性(UL):
1.3 数据处理
试验结果用平均数±标准误(mean±S.E.)表示,采用SPSS 17.0统计软件对数据进行统计学分析,先对数据作单因素方差分析(One-way ANOVA),若组间差异显著,再用Duncan's法进行多重比较,显著水平为0.05。
增重率=(末均质量-初均质量)/初均质量×100%,
特定生长率=(ln末体质量-ln初体质量)/试验天数×100%,
成活率=(试验末鱼尾数/试验初鱼尾数) ×100%,
饲料系数=摄食饲料总量/鱼体增重量,
蛋白质效率=鱼体增重量/蛋白质摄取量,
肝体指数=肝脏质量/鱼体质量×100%,
内脏指数=内脏质量/鱼体质量×100%,
肥满度=体质量(g)/体长3(cm)×100%。
2 结果
2.1 用不同比例的饲料酵母替代鱼粉对大菱鲆幼鱼生长性能的影响
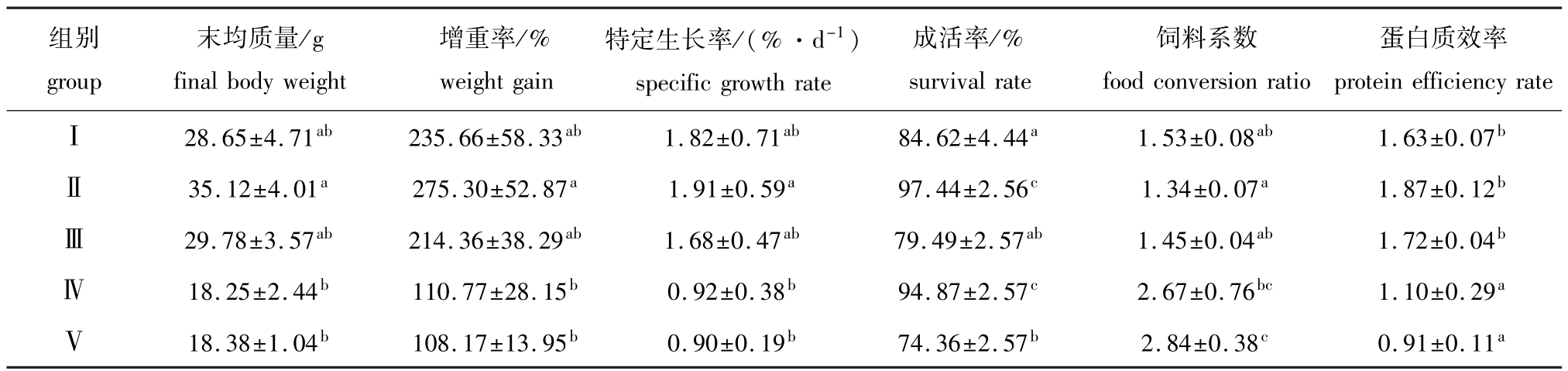
从表2可见:Ⅱ组大菱鲆幼鱼的增重率和特定生长率均最高,但与对照组相比均无显著差异(P>0.05);Ⅱ组幼鱼的饲料系数最低,Ⅴ组幼鱼的饲料系数最高,除Ⅴ组与对照组差异显著(P<0.05)外,其余试验组与对照组之间的差异均不显著(P>0.05);Ⅱ组幼鱼的蛋白质效率最高,除Ⅳ、Ⅴ组显著低于对照组外(P<0.05),其余试验组与对照之间的差异均不显著(P>0.05);Ⅱ组和Ⅳ组幼鱼的成活率比对照组显著提高15.15%和12.11%(P<0.05),而Ⅴ组比对照组显著降低12.12%(P<0.05)。
表2 用不同比例的饲料酵母替代鱼粉对大菱鲆幼鱼生长性能及饲料利用的影响
Tab.2 The effects of partial replacement of fish meal by feed yeast on growth performance and feed conversion in turbot Scophthalmus maximus
注:同列中标有不同小写字母者表示组间差异显著(P<0.05),标有相同小写字母者表示组间差异不显著(P>0.05),下同。
Note:The means with the different letters within the same column are significant differences at the 0.05 probability level,and the means with the same letters within the same column are not significant differences,et sequentia.
组别group protein efficiency rateⅠ28.65±4.71ab235.66±58.33ab1.82±0.71ab84.62±4.44a1.53±0.08ab1.63±0.07末均质量/g final body weight增重率/% weight gain特定生长率/(%·d-1) specific growth rate成活率/% survival rate饲料系数food conversion ratio蛋白质效率b 35.12±4.01a275.30±52.87a1.91±0.59a97.44±2.56c1.34±0.07a1.87±0.12bⅢ29.78±3.57ab214.36±38.29ab1.68±0.47ab79.49±2.57ab1.45±0.04ab1.72±0.04bⅣ18.25±2.44b110.77±28.15b0.92±0.38b94.87±2.57c2.67±0.76bc1.10±0.29aⅤ18.38±1.04b108.17±13.95b0.90±0.19b74.36±2.57b2.84±0.38c0.91±0.11Ⅱa
2.2 用不同比例的饲料酵母替代鱼粉对大菱鲆幼鱼形体指标的影响
从表3可见:Ⅱ组与Ⅲ组大菱鲆幼鱼的肝体指数分别比对照组显著提高83.08%和61.54%(P<0.05),Ⅳ组与对照组没有显著差异(P>0.05),而Ⅴ组幼鱼的肝体指数比对照组显著降低69.23% (P<0.05);Ⅱ组幼鱼的内脏指数比对照组显著提高24.60%(P<0.05),Ⅲ、Ⅳ组和Ⅴ组与对照组差异均不显著(P>0.05);Ⅱ组和Ⅴ组幼鱼的肥满度与对照组无显著差异(P>0.05),Ⅲ、Ⅳ组幼鱼的肥满度分别比对照组提高15.74%和12.99% (P<0.05),但Ⅲ、Ⅳ组之间差异不显著(P>0.05)。
2.3 用不同比例的饲料酵母替代鱼粉对大菱鲆幼鱼体成分的影响
由表3可见:全鱼水分和粗脂肪含量随着替代
比例的增加没有显著性差异(P>0.05);Ⅱ组大菱鲆幼鱼的粗蛋白含量显著高于对照组(P<0.05),Ⅲ组与对照组差异不显著(P>0.05),Ⅳ组和Ⅴ组显著低于对照组(P<0.05);Ⅱ组大菱鲆幼鱼的灰分含量显著低于对照组(P<0.05),Ⅲ组、Ⅳ组和Ⅴ组的灰分含量则分别高于对照组12.82%、22.01%和23.07%(P<0.05),但Ⅳ组和Ⅴ组之间无显著差异(P>0.05)。
表3 用不同比例的饲料酵母替代鱼粉对大菱鲆幼鱼形体指标和体成分的影响
Tab.3 The effects of partial replacement of fish meal by feed yeast on morphological indicators,and whole body composition in turbot Scophthalmus maximus%
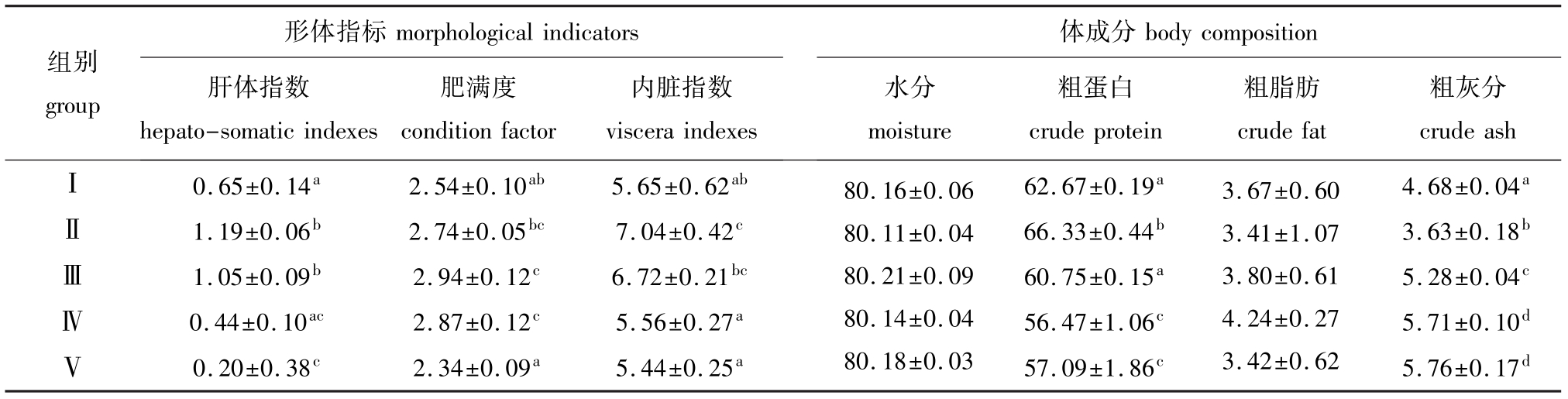
组别group morphological indicators肝体指数hepato-somatic indexes形体指标肥满度condition factor内脏指数viscera indexes body composition水分moisture体成分粗蛋白crude protein粗脂肪crude fat粗灰分crude ashⅠⅡⅢⅣⅤ0.65±0.14a1.19±0.06b1.05±0.09b0.44±0.10ac0.20±0.38c2.54±0.10ab2.74±0.05bc2.94±0.12c2.87±0.12c2.34±0.09a5.65±0.62ab7.04±0.42c6.72±0.21bc5.56±0.27a5.44±0.25a80.16±0.06 80.11±0.04 80.21±0.09 80.14±0.04 80.18±0.03 62.67±0.19a66.33±0.44b60.75±0.15a56.47±1.06c57.09±1.86c3.67±0.60 3.41±1.07 3.80±0.61 4.24±0.27 3.42±0.62 4.68±0.04a3.63±0.18b5.28±0.04c5.71±0.10d5.76±0.17d
2.4 用不同比例的饲料酵母替代鱼粉对大菱鲆幼鱼免疫机能的影响
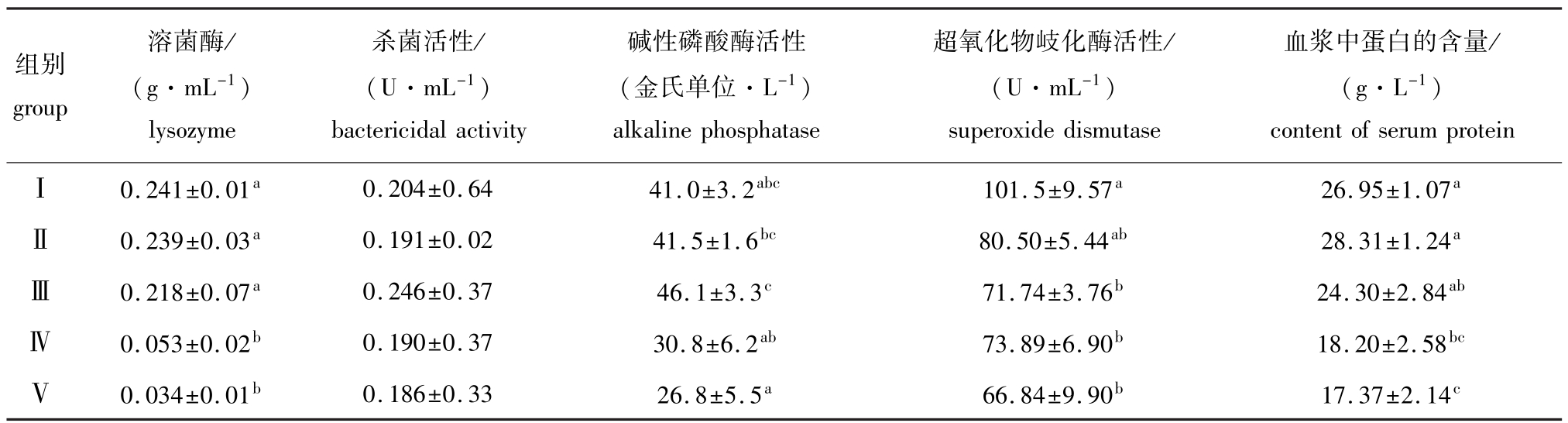
从表4可见:随着替代比例的增加,各试验组与对照组大菱鲆幼鱼血清中碱性磷酸酶的活性和杀菌活性差异均不显著(P>0.05);Ⅰ、Ⅱ组和Ⅲ组幼鱼血清中溶菌酶的活性与Ⅳ、Ⅴ组之间差异均显著(P<0.05),其余组间均无显著差异(P>0.05);Ⅱ组幼鱼血清中超氧化物岐化酶活性与对照组无显著差异(P>0.05),Ⅲ、Ⅳ组和Ⅴ组均比对照组低29.32%、27.20%和34.15%(P<0.05),其余组间均无显著差异(P>0.05);Ⅱ组和Ⅲ组幼鱼血浆中的蛋白含量与对照组差异不显著(P>0.05),Ⅳ组和Ⅴ组比对照组降低32.47%和35.55%(P<0.05),其余组间均无显著差异(P>0.05)。
表4 用不同比例的饲料酵母替代鱼粉对大菱鲆幼鱼免疫机能的影响
Tab.4 The effects of partial replacement of fish meal by feed yeast on immune efficiency in turbot Scophthalmus maximus
注:1 L血浆在37℃下与基准物作用15 min产生10 mg酚为1个金氏单位。
Note:1 L serum reacted with standard reagent to get produce 10 mg hydroxybenzene for 15 minutes at 37℃is defined as a unit of guinness.
组别group血浆中蛋白的含量/ (g·L-1) content of serum proteinⅠ0.241±0.01a0.204±0.6441.0±3.2abc101.5±9.57a26.95±1.07溶菌酶/ (g·mL-1) lysozyme杀菌活性/ (U·mL-1) bactericidal activity碱性磷酸酶活性(金氏单位·L-1) alkaline phosphatase超氧化物岐化酶活性/ (U·mL-1) superoxide dismutase aⅡ0.239±0.03a0.191±0.0241.5±1.6bc80.50±5.44ab28.31±1.24aⅢ0.218±0.07a0.246±0.3746.1±3.3c71.74±3.76b24.30±2.84abⅣ0.053±0.02b0.190±0.3730.8±6.2ab73.89±6.90b18.20±2.58bcⅤ0.034±0.01b0.186±0.3326.8±5.5a66.84±9.90b17.37±2.14c
3 讨论
诸多研究表明[16-20],在鱼类饲料中,用饲料酵母部分或全部替代鱼粉是可行的,但是要根据养殖鱼的种类和食性的差异来调整饲料配方,以满足鱼类对营养的需求。本试验中,用饲料酵母替代17%的鱼粉(Ⅱ组)时,大菱鲆幼鱼的生长性能最佳。这与张梁等[6]网箱养殖淡水白鯧的结果相同。
本试验结果表明,Ⅱ组大菱鲆幼鱼的成活率、增重率、特定生长率和蛋白质效率最高,但幼鱼的增重率、特定生长率和蛋白质效率均随饲料酵母替代比例的升高而下降。这说明适量的酵母有利于大菱鲆幼鱼的生长,但随着饲料中酵母含量的增加会影响大菱鲆幼鱼对饲料的转化率,从而导致大菱鲆幼鱼的增重率和成活率下降。但葛树立等[5]用活性酵母养殖罗非鱼时,随着替代比例的增加,试验鱼的增重率增加,饲料系数降低,表明活性酵母可
以明显促进罗非鱼的生长。其原因可能与养殖鱼的种类以及酵母的来源、组成等有关。用较高比例的饲料酵母替代鱼粉时,也同样降低了鲤[3]、淡水白鯧[6]、胡子鲶[19]的摄食与生长,这可能是高浓度的饲料酵母引起鱼体的免疫反应过度,导致用于生长的能量和营养素减少的缘故。Rumsey等[21]则认为,完整的酵母细胞因存在细胞壁,无法使胞内的营养成分释放出来,因而鱼类利用高含量酵母的能力较差。
幼鱼的消化系统发育不及成鱼完善,对各种环境因子(运输、储藏、食物因子、水质理化因子等)尤其是食物因子的变化反应比较敏感,当饲料中添加大量饲料酵母时,可能会对消化系统的发育产生一定的影响,肝体指数和内脏指数会发生较大变化。本试验中,Ⅱ组大菱鲆幼鱼的肝体指数、肥满度和内脏指数均高于对照组,说明一定比例的饲料酵母会刺激鱼体形体的生长,改善肝功能。但黄钧等[5]用加酶饲料酵母替代鱼粉饲养丰鲤时,鱼粉组的肥满度显著高于各饲料酵母替代组。
随着饲料酵母替代比例的增加,全鱼的水分和脂肪含量无明显变化,粗蛋白含量逐渐降低,灰分含量逐渐升高。当用饲料酵母替代鱼粉的比例为51%(Ⅳ组)和68%(Ⅴ组)时,大菱鲆幼鱼的粗蛋白含量显著下降,表明用饲料酵母替代鱼粉的比例过高时会影响蛋白质在鱼体内的沉积,这与高含量饲料酵母组的幼鱼对饲料的利用率较低有关。总体来看,Ⅱ组幼鱼的粗蛋白含量最高,显著高于对照组,而其粗脂肪含量又最低,说明饲料中添加质量分数为15%的饲料酵母能够增加鱼体的蛋白质含量,减少脂肪的堆积,显著提高了鱼肉的品质,使鱼肉更加鲜嫩可口。
溶菌酶广泛存在于动物体内的许多组织和体液中,是杀灭病原菌的物质基础。血浆中的溶菌酶主要来自血细胞,是一种碱性球蛋白,能够专一性地水解肽多糖分子中β-1,4糖苷键,从而破坏并裂解细胞壁,最终使细菌死亡,实现其机体的防御功能[22-23]。测定鱼体的溶菌酶活性,可以在一定程度上反映鱼类非特异性体液的免疫状态。
血浆中的蛋白,如免疫球蛋白(IgM)、补体等蛋白含量以及杀菌活性也可以作为鱼类的免疫指标。本试验中,各组间幼鱼的杀菌活性没有显著性差异,而血浆中的蛋白含量和溶菌酶含量均是Ⅱ组最高,当用饲料酵母替代鱼粉的比例增加时,幼鱼的杀菌活性反而下降。这说明饲料酵母可能会抑制血浆中的蛋白生成和溶菌酶的活性。但有些研究结果与此相反,如Baulny等[24]曾报道,酵母β-葡聚糖能增强大菱鲆的溶菌酶活性;陈超然等[9]的研究表明,各试验组鱼体血清中总蛋白的含量随着酵母β-葡聚糖添加量的增加而提高。
碱性磷酸酶是一种非特异性磷酸水解酶,能催化磷酸单脂的水解及磷酸基团的转移反应,对动物生存具有重要的意义。本试验中,随着饲料酵母添加比例的增加,碱性磷酸酶酶活性没有显著性的差异。而胡火庚等[8]的研究表明,随着酵母复合物添加量的增加,中华绒螯蟹血清中碱性磷酸酶的活性显著上升,表明酵母复合物对中华绒螯蟹的非特异免疫力有增强作用。
超氧化物歧化酶具有催化超氧离子自由基进行歧化反应的功能,是机体清除氧自由基的重要抗氧化保护酶,它能使自由基的形成和清除处于一种动态平衡,从而清除自由基对机体的危害,保护细胞免受损伤。当SOD活性降低时,其自由基等毒害物质就会积累。本试验中,血浆中的蛋白含量和SOD活性也都随着饲料酵母添加比例的增加而减少,说明添加高比例的饲料酵母可以减弱机体的免疫能力,这可能也是导致Ⅴ组死亡率增加的重要原因之一。然而,一些国外专家认为,饲料酵母同益生菌有同样的效果,可以提高动物的免疫系统,增强抵抗微生物入侵的能力。关于饲料酵母对大菱鲆免疫因子的影响还有待进一步研究。
综上所述,用饲料酵母替代饲料中17%左右的鱼粉时,可以使大菱鲆的生长、成活率、机体营养成分和免疫机能优于其它各组。
参考文献:
[1] 杨正勇,王春晓,冷传慧,等.国内外鲆鲽类养殖生产与贸易动态研究报告[R].上海:上海海洋大学,2009:13-18.
[2] 马爱军,陈四清,雷霁霖,等.饲料中主要能量物质对大菱鲆幼鱼生长的影响[J].海洋与湖沼,2001,32(5):527-533.
[3] 吕迅,于伟君,王丹,等.酵母替代鱼粉养鲤试验[J].水产科学,1991,10(3):5-9.
[4] 胡迪先,夏先林,程园,等.饲料酵母替代鱼粉作饵料的研究[J].中国饲料,1995(4):19-20.
[5] 葛树立.多维高蛋白活性饲料酵母养鱼试验[J].河北渔业, 2001(1):32.
[6] 张梁,周维禄,杨世平.饲料酵母替代部分鱼粉养殖淡水白鲳试验[J].郑州牧业工程高等专科学校学报,2003,23(1):4-5.
[7] 汪成竹,姚娟,陈昌福.酵母复合物对斑点叉尾鮰的免疫调节作用[J].现代农业科技,2008,11:262-264.
[8] 胡火庚,陈昌福.饲料中添加酵母复合物对中华绒螯蟹的免疫调节作用[J].长江大学学报:自然版,农学卷,2007,4(2):36-
40.
[9] 陈超然,陈萱,陈昌福,等.酵母对受免异育银鲫免疫应答的增强作用[J].华中农业大学学报,2003,22(4):380-384.
[10] 陈国凤,龚宏伟,施陈江,等.酵母膏对异育银鲫生长和抗应激能力的影响[J].饲料工业,2009,30(18):22-25.
[11] Williams S.Official Methods of Analysis[M].Washington D C, USA:AOAC,1984.
[12] Folch J,Lees M,Sloane-Stanley G H.A simple method of the isolation and purification of total lipid from animal tissues[J]. Journal of Biology and Chemical,1957,226:497-509.
[13] Delsal J L.New process for extracting lipids form serum by methylal:application to micro dosages of total cholesterol,phosphoaminolipids,and proteins[J].Bulletin of the Society of Chemical Biology,1944,26:99-105.
[14] Woyewoda A D,Shaw S J,Ke P J,et al.Recommended laboratory methods for assessment of fish quality[J].Canadian Technical Report of Fisheries and Aquatic Sciences,1986,1448:28-31.
[14] 周歧存,麦康森,刘永坚,等.动植物蛋白源替代鱼粉研究进展[J].水产学报,2005,29(3):404-410.
[15] Yin G,Jeney G,Race T,et al.Effect of two Chinese herbs(Astragalus radix and Scutellaria radix)on non-specific immune response of tilapia Oreochromis niloticus[J].Aquaculture,2006, 253:39-47.
[16] Lim E H,Lain T J,Ding J L,et al.Single-cell protein diet of a novel recombinant vitellogen in yeast enhances growth and survival of first-feeding tilapia(Oreochromis mossambicus)larvae[J].The Journal of Nutrition,2005,135(3):513-518.
[17] Sanderson G W,Jolly S O.The value of phaffia yeast as a feed ingredient for ingredient for salmonid fish[J].Aquaculture,1994, 124:193-200.
[18] Tacon A G.Feed ingredients for carnivorous fish species alternatives to fishmeal and other dietary resources[J].FAO Fish Circle, 1994,881:35.
[19] 程光平,黄钧,夏中生,等.酵母蛋白替代鱼粉饲养胡子鲶试验[J].广西农业生物科学,2001,20(1):41-44.
[20] 杜涛,黄洋,罗杰.酵母轮虫和以小球藻、螺旋藻强化的轮虫对3种仔鱼人工育苗效果的影响[J].大连水产学院学报, 2010,26(2):158-161.
[21] Rumsey G L,Hughes S G,Kinsella L.Use of dietary yeast Saccharomyces cerevisiae nitrogen by lake trout[J].J World Aquaculture Society,1990,21:205-209.
[22] Aoki T,Takami K,Kitao T.Drug resistance in a non-haemolytic Streptoccus isolated from cultured yellowtail Seriola quinqueradiata [J].Diseases of Aquatic Organisms,1990,8(2):171-177.
[23] Anderson D P,Siwicki A K.Duration of protection against Aeromonas salmonicida in brook trout immunostimulated with glucan or chitosan by injection or immersion[J].The Progressive Fish Culture,1996,56(3):258-261.
[24] Baulny M O D,Quentel C,Fournier V,et al.Effects of long-term oral administration of β-glucan as an immunostimulant or an adjuvant on some non-specific parameters of the immune response of turbot,Scophthalmus maximus[J].Diseases of Aquatic Organisms, 1996,26:139-147.
Effects of replacement of fish meal by feed yeast on growth performance and immunity in turbot Scophthalmus maximus
CUI Min,GUO Ran,XIA Hui
(Ocean College,Agricultural University of Hebei,Qinhuangdao 066000,China)
Abstract:Turbot Scophthalmus maximus with body weight of(9.02±0.15)g were randomly stocked into 15 glass tanks of each 60 cm×40 cm×50 cm with circulating sea water at a rate of 15 fish per tank and fed five isocaloric and isonitrogenous diets containing 0(GroupⅠ),15%(GroupⅡ),30%(GroupⅢ),45%(GroupⅣ)and 60%(GroupⅤ)of feed yeast,which replaced 0,17%,34%,51%and 68%of fish meal,at feeding rate of 3% -4%three times a day for 56 d.The results showed that there were the maximal weight gain rate(WGR) (275.30%),and specific growth rate(SGR)(1.91%/d)and the minimal foodd conversion ratio(FCR) (1.34)in GroupⅡcompared with the control group(235.66%,1.82%/d and 1.53).The fish in GroupⅡ(97.44%)and GroupⅣ(94.87%)had significantly higher survival rate(SR)than that in the control group (84.62%),but the fish in GroupⅤhad significantly lower(74.36%)survival.Crude protein contents in the fish were decreased,and the ash contents in the fish were increased with the increase in the dietary yeast.Lysozyme activity,total protein content and superoxide dismutase(SOD)activity in plasma were found to be decreased with the increase in feed yeast,and significant differences for the parameters were observed in the fish fed the diets containing to upon 51%of the yeast.It is concluded that the optimal dietary yeast is 17%based on the growth performance,morphological indicators,body composition and immunity.
Key words:Scophthalmus maximus;feed yeast;growth performance;immunity
中图分类号:S963.32
文献标志码:A
文章编号:2095-1388(2012)01-0058-06
收稿日期:2011-03-29
基金项目:国家发改委2008年重大产业技术开发项目;秦皇岛市科技计划项目(201101A207)
作者简介:崔敏(1985-),硕士研究生。E-mail:cuimin0335@163.com
通信作者:郭冉(1980-),博士,讲师。E-mail:toguoran@163.com



