马氏珠母贝精子质量形态评定中不同染色法染色效果的比较
宾承勇,王梅芳,豆伟,余祥勇
(广东海洋大学水产学院,广东湛江524025)
摘要:为筛选出适宜于马氏珠母贝Pinctada martensii精子形态分析的染色方法,采用曙红Y和结晶紫染液对不同方法制作的马氏珠母贝精液抹片进行染色,并通过显微镜观察比较染色效果。结果表明:1)采用将精液先抹片后染色(0.8 mg/mL曙红Y染液)的方法时,精子头部着色不完全,染色效果不随染色时间的延长而改善,精子形态特征不明显,故该方法不适于精子形态检测;2)将精液与20 mg/mL的曙红Y染液等体积混合后抹片,精子头部着深红色,尾部着浅红色,精子各部分结构清晰,形态特征明显,背景干净,对比明显;3)用5 mg/mL的结晶紫染液对精液进行渗透染色时,精子形态染色特征明显,头部着深紫色,尾部着浅紫色,背景干净,可较准确地判断精子的形态特征;4)依精子形态对马氏珠母贝精子进行分类,并确定了主要的畸形类型及其特点,马氏珠母贝精子畸形主要集中在精子的颈部和尾部,头部畸形情况较少;5)采用两种染色方法判定的正常精子率之间无显著差异(P<0.05),数据稳定,因此,这两种染色方法均可用于马氏珠母贝精子形态的评价中。
关键词:马氏珠母贝;精子;质量评价;染色
马氏珠母贝Pinctada martensii是培育海水珍珠的主要母贝,广泛分布于中国广东、广西和海南沿海。多年来,各科研单位在马氏珠母贝育苗养殖[1-3]、插核育珠[4-7]、良种选育[8-12]、病害防治等方面[13-15]已做了大量的研究。随着苗种生产、遗传育种、种质保藏等研究的进一步发展,对贝类精子的质量评价显得越来越迫切和重要。目前,关于精子质量评价主要集中在鱼类及蟹类等方面[16-21],而在贝类方面的研究还处于起步阶段。精子形态是其质量的一个重要表征,是评价精子功能最有价值的指标之一,所以精子形态检测是精子质量评价的常规指标之一。有关珠母贝精子的研究主要集中在精子的发生、超微结构及冷冻保存方面[22-26],有关精子质量检测方面的研究仅见喻达辉等[27]对精子活力的光镜观测,而有关精子的活体染色法与观察检测、形态分类及质量评判等的研究尚未见报道。随着染色方法的不断改进,精子形态学分析备受关注。本研究中,作者就马氏珠母贝的精子形态检测进行研究,旨在找到一种简单、有效、经济的染色方法来快速检测贝类精子的形态,客观、准确地评价精子的功能状态,为受精能力的预测、精子冷冻的研究等提供参考数据,这对于生产实践具有重要的意义。
1 材料与方法
1.1 材料
试验用马氏珠母贝于2009年11月取自湛江雷州,运回实验室后洗净暂养。
1.2 方法
1.2.1 精子的获得 挑选性腺发育成熟的鲜活雄贝,解剖后用吸管刺破性腺,吸取精液于50 mL小烧杯中,加入适量煮沸消毒过滤海水混匀。用血球
计数板计数,调整精液浓度为3×106个/mL。
1.2.2 抹片制作 吸取适量样品滴于干净的载玻片边侧,另取一张载玻片,用其边缘在滴加样本载玻片表面拖拉精液制成涂片。
1.2.3 染色方法
1)曙红Y染色
传统法用蒸馏水、煮沸消毒过滤海水分别配制20 mg/mL的曙红Y母液,使用时根据需要稀释到所需浓度。根据预试验结果,用蒸馏水及过滤海水配制曙红Y染液时,染液浓度均为0.8 mg/mL。采用“1.2.2”节中的方法制作精子抹片,待抹片自然干燥后分别向精子抹片上滴加两种染液进行染色,染色时间分别设置为8、30、60 min,弃去染液,自然干燥后观察。
改良法用过滤海水配制曙红Y染液,染液浓度分别为0.8、5、10、15、20 mg/mL。将染液和精子样品等体积混合后,立即制作抹片,待抹片自然干燥后观察。
2)结晶紫染色
直接染色法用煮沸消毒过滤海水配制20 mg/mL的母液,使用时根据需要稀释到所需浓度。根据预试验结果设置染液浓度为5 mg/mL,对抹片进行染色处理。向精子抹片上滴加适量染液,染色5 min后,弃去染液,自然干燥后观察。
渗透染色法吸取适量稀释精液于载玻片上,用另一张载玻片或盖玻片盖于其上,沿边缘滴加染液,在另一端用吸水纸吸取染料,使用渗透染色的方法使染料渗入且均匀分布,再拉开或揭开两张玻片,得到两张精子抹片,干燥后于显微镜下观察。
3)精子形态分析
在显微镜下观察(40×10倍),观察数量为200个精子以上,参照文献[28]中的方法,按下列标准对精子形态进行分类,并分别记录其结果。
正常精子:头部呈梨型,尾部与头部成一条直线。采用严格标准评估正常精子,头、颈、中段和尾部都正常的精子才为正常精子。
颈折角型:颈部发生明显弯曲,使头部和尾部中段长轴不在一条直线上,之间的夹角大于90度。
弯尾型:尾部发生大角度弯曲,使头部和尾部不在一条直线上。
圈尾型:尾尖卷曲形成小圆圈。
短尾型:尾部明显短于正常精子尾部。
其它畸形有圆型,无头,大头,无尾,双尾等。
1.3 数据处理
试验数据用平均数±标准差表示。用SPSS 13.0软件对数据进行处理和单因素方差分析,用邓肯氏(Duncan)法进行多重比较分析。
2 结果与分析
2.1 不同染色方法的染色效果
2.1.1 曙红Y染色法 将样品抹片自然干燥后,经0.8 mg/mL曙红Y染色,不同染色时间下的染色效果见表1。用蒸馏水及煮沸消毒海水配制的曙红Y染液均能使抹片上精子着色,但着色不完全(图1-A、B),即精子颈部、尾部皆可着色,而头部仅顶体着色。即使染色时间延长至1 h,仍只有头部的顶体着色,头部轮廓形态不清。用海水配制的曙红Y染液染色时,随着染色时间的延长,精子的着色并未加深,反而背景杂质染色加深且较多(图1-B)。故采用传统的先抹片再染色的方法不能对精子的头部进行形态特征的判别。
表1 精子用0.8 mg/mL的曙红Y染液染色时不同染色时间下的染色效果
Tab.1 The color pattern of sperm stained by 0.8 mg/mL Eosin Y under different time
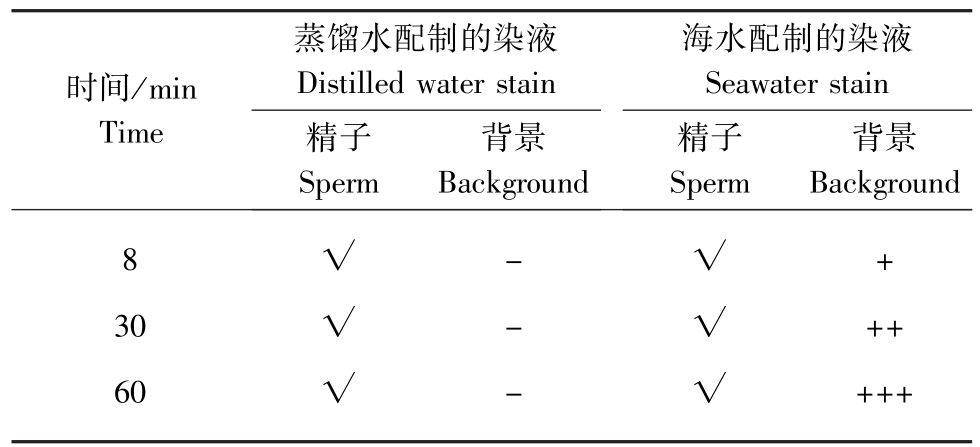
注:“√”表示精子着色;“-”表示背景干净、杂质少;“+”表示背景着色深、杂质多。
Note:“√”means the sperms colored;“-”means the less impurities background;“+”means the more impurities background.
蒸馏水配制的染液海水配制的染液时间/min Time Distilled water stain精子Sperm背景背景Background Seawater stain精子Sperm Background 8 30 60√√√---√√√+ ++ +++
考虑到用蒸馏水配置的染液与精子样品混合后会降低样品的渗透压,因而影响精子的形态,故只使用海水配制曙红Y染液。采用改良的染色方法时,即将样品与用海水配制的不同浓度的曙红Y染液等体积混合后,再进行抹片观察,不同浓度染液的染色效果见图1-C、D。采用0.8 mg/mL的曙红Y染液(即终浓度为0.4 mg/mL)染色时,可使精子略着红色,但染色较浅,结构模糊,观察精子形态特征较困难,且背景杂乱,影响观察效果;而采用20 mg/mL的曙红Y染液染色后(即终浓度为10 mg/mL),精子头部着深红色,尾部着浅红
色,背景为浅粉红色,对比明显,精子各部分结构清晰,形态特征明显,背景干净,易于观察;当使用的曙红Y染液浓度为0.8~20 mg/mL时,精子的着色程度随染液浓度的增大而加深,各部位结构也渐渐清晰。当曙红Y染液浓度达20 mg/mL时,染色效果最为理想。故本研究中在进行形态观察时,将精子样品与20 mg/mL的曙红Y染液等体积混合,采用先染色再抹片的改良方法进行染色处理。
2.1.2 结晶紫染色法 采用结晶紫染液染色时,处理方法不同,其染色效果也不同(图1-E、F)。
图1 -E为制作精子抹片后直接滴加染液的染色效果。显微镜下观察显示,精子头部、颈部、尾部皆着紫色,但头部着色不完全,仅头部顶体着
色,不能对精子的头部进行形态特征的判别。
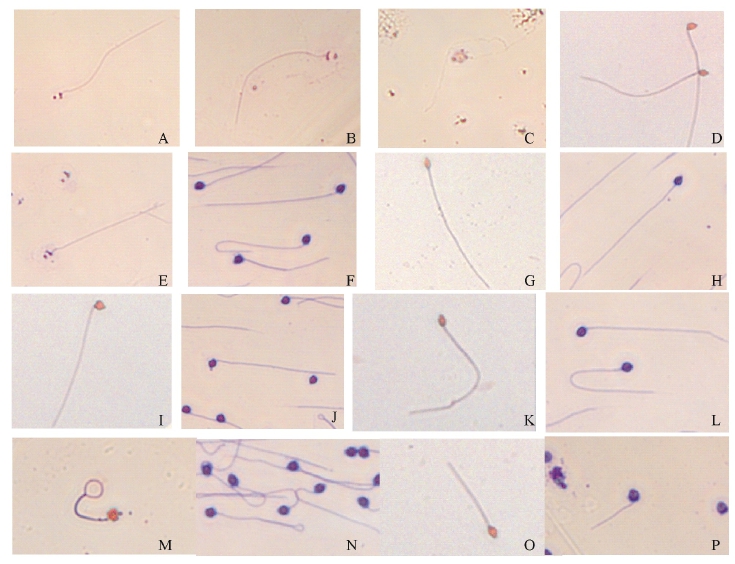
图1 用曙红Y、结晶紫染液染色后的精子染色特征以及正常、畸形(颈折角型、弯尾型、圈尾型、短尾型)精子的形态特征(40×10)
Fig.1 Characterization of the sperms stained by Eosin Y and Crystal Violet,and characterization of normal sperm, abnormal sperm(curved neck,curved tail,coiled tail,and defect tail)(40×10)
注:A用曙红Y染液染色后的精子,染液用蒸馏水配制(传统法);B用曙红Y染液染色后的精子,染液用海水配制(传统法);C用曙红Y染液染色后的精子,曙红Y染液浓度为0.8 mg/mL(改良法);D用曙红Y染液染色后的精子,曙红Y染液浓度为20 mg/mL(改良法);E用结晶紫染液染色后的精子(直接染色法);F用结晶紫染液染色后的精子(渗透染色法);G采用曙红Y染液染色时形态正常的精子;H采用结晶紫染液染色时形态正常的精子;I颈折角型精子(曙红Y染色法);J颈折角型精子(结晶紫染色法);K弯尾型精子(曙红Y染色法);L弯尾型精子(结晶紫染色法);M圈尾型精子(曙红Y染色法);N圈尾型精子(结晶紫染色法);O短尾型精子(曙红Y染色法);P短尾型精子(结晶紫染色法)。
Note:A Sperm stained by Eosin Y in distilled water(traditional method);B Sperm stained by Crystal Violet in Seawater(traditional method);C Sperm stained by 0.8 mg/mL Eosin Y(improved method);D Sperm stained by 20 mg/mL Eosin Y(improved method);E Sperm stained directly by Crystal Violet(direct staining);F Sperm stained by Crystal Violet(permeating staining);G Normal sperm stained by Eosin Y;H Normal sperm,stained by Crystal Violet;I Curved neck,stained by Eosin Y;J Curved neck,stained by Crystal Violet;K Curved tail,stained by Eosin Y;L Curved tail,stained by Crystal Violet;M Coiled tail,stained by Eosin Y;N Coiled tail,stained by Crystal Violet;O Defect tail,stained by Eosin Y;P Defect tail,stained by Crystal Violet.
图1 -F为采用渗透染色法的染色效果。该染色方法能使精子头部着深紫色,尾部着浅紫色,背景颜色为淡粉红色,对比明显,各部分结构清晰,染色特征明显,可较准确的对精子形态特征作出判断。故本研究中在进行形态观察时,用5 mg/mL的结晶紫染液对精子样品采用渗透染色法进行染色处理。
2.2 精子的正常形态及各种畸形
经曙红Y(染液浓度20 mg/mL,改良法)和结晶紫(染液浓度5 mg/mL,渗透染色法)染液染色后,依精子形态可将马氏珠母贝精子分为两大类:正常精子与畸形精子,其中畸形精子的主要类型为颈折角、弯尾、圈尾和短尾4种类型。马氏珠母贝精子的畸形主要集中在精子的颈部和尾部,头部畸形情况较少。各类型精子染色特征如图1-G~P所示。
2.3 不同染色方法的效果比较
用曙红Y、结晶紫染液染色后,对精子抹片的形态观察统计结果见表2。从表2可见:采用两种染液染色时观察到的正常形态精子的比例无显著差异(P>0.05);在畸形形态精子中,除用曙红Y染色法时测得的颈折角型精子比例(7.71%)显著高于用结晶紫染色法的结果(P<0.05)外,在其它各类型的畸形精子率上,用两种染液的染色结果并无显著差异(P>0.05)。这说明两种染色方法均适用于马氏珠母贝精子的形态观测上,其结果稳定可靠。
表2 不同染色方法对马氏珠母贝精子形态的影响
Tab.2 The morphology of the pearl oyster sperm stained by different methods
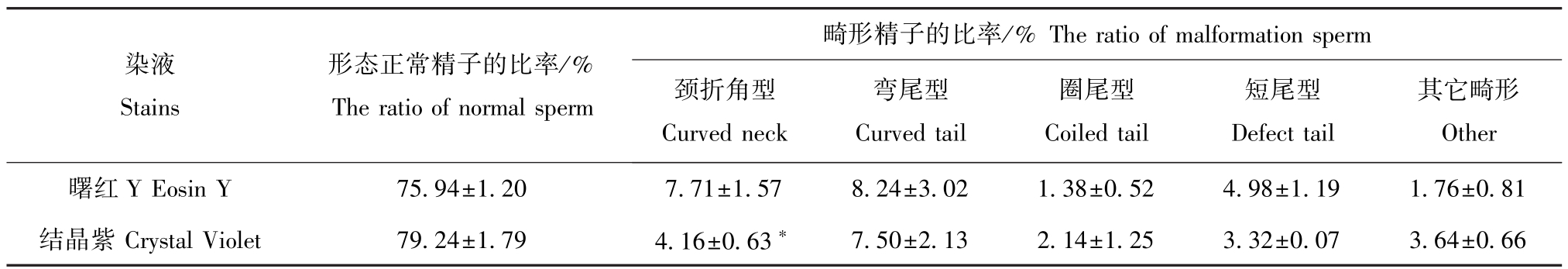
注:*表示不同方法染色结果之间差异显著(P<0.05)。
Note:*means significant difference by different methods(P<0.05).
畸形精子的比率染液Stains形态正常精子的比率/% The ratio of normal sperm 其它畸形7.50±2.132.14±1.253.32±0.073.64±0.66 /%The ratio of malformation sperm颈折角型Curved neck弯尾型Curved tail圈尾型Coiled tail短尾型Defect tail ±0.524.98±1.191.76±0.81结晶紫Crystal Violet79.24±1.794.16±0.63*Other曙红Y Eosin Y75.94±1.207.71±1.578.24±3.021.38
3 讨论
3.1 精子形态的分类及评估标准
精子形态是否正常,是影响精子能否正常受精的重要因素[29],而目前精子形态的分类在世界范围内还没有建立统一标准。由于采用的染色方法和形态学评定标准不同,导致各试验结果缺乏可比性[30]。传统分类方法中将精子分为正常、无定型、锥型头、大头、小头及未成熟型。但国内采用的多为世界卫生组织(WHO)推荐的形态分类标准。该标准主要将异常精子形态分为三大类,即头部缺陷、颈/中段缺陷和尾部缺陷[28]。在进行形态计数时,只对带尾部的且可辨认的精子进行精子计数,未成熟精子细胞包括圆形精子细胞阶段,不能作为精子计数。精子头脱落或无精子头的不作为精子计数,精子头脱落或无尾精子也不能作为头部缺陷计数[31]。在较早的精子形态评估方案中,形态异常的精子有多种缺陷同时存在时,只记录其中的一种,如头部缺陷与中段缺陷同时存在时,只记录头部缺陷;中段缺陷与尾部缺陷同时存在时,优先记录中段缺陷。现在常用的方法是,当精子只有一处缺陷时,只记录一处,若精子同时存在两处或三处缺陷时,应同时记录两处或三处[32]。本研究中,马氏珠母贝精子形态的分类主要参考以上文献及试验过程中所观察到的主要类型进行确定。分析表2数据发现,除弯尾型精子外,其它各类型精子率的浮动(标准差)均较小,表明对马氏珠母贝精子的形态分类结果稳定可靠、客观真实。在畸形精子中只有弯尾型精子的比例浮动最大,这从某种程度上暗示有人为因素的影响,可能是在制片干燥过程中,精子在载玻片上干燥后而不能保持原有形态造成的。同时,分类中参考的是对人类精子的分类标准,将此标准用于判断马氏珠母贝弯尾型精子,是否客观有待商榷。
3.2 涂片对精子形态的影响
载玻片质量对精子抹片效果有很大影响。试验中用载玻片需在强酸洗液中浸泡48 h,用蒸馏水冲洗干净,自然干燥后待用。未被强酸浸泡或浸泡时间不够,涂片时会因玻片上有油渍,精液涂片后液体界面会立刻收缩,导致精液无法均匀附着在玻片
上,且该片染色后背景杂质多,严重影响观察效果。
在马氏珠母贝精子涂片的制备中,涂片经曙红Y染液染色后弃去染液观察,玻片上明显有湿感,显微镜下观察,玻片上有大量的水滴,而精子的头部淹没于水滴中,仅能看到精子的尾部,同时背景杂质也较多。将玻片置于酒精灯旁烘干后观察,玻片上有大量的盐的方形结晶颗粒。随时间的延长可以观察到盐结晶颗粒吸水潮解,逐渐形成水滴。由于马氏珠母贝为海产贝类,故在稀释精液时使用了海水作为稀释液,而海水中的盐成分导致吸水现象的发生,且由于海水成分复杂,玻片上背景杂质也颇多。为消除此现象,先后使用酒精、蒸馏水对涂片进行了脱盐处理。用该方法虽然消除了盐的影响,背景杂质也大量减少,但同时也将染液冲洗掉了,使精子呈现无色状态。传统的湿片制备是将精液涂在载玻片上自然干燥,然后用乙醇固定,再行染色。用传统方法制作马氏珠母贝精子涂片经染色后观察发现,精子颈部、尾部皆着色,头部仅顶体部位着色,不能对精子的头部进行形态特征的判别。故用此方法制备的马氏珠母贝精子涂片并不适用于形态观察判别。为有效地消除涂片吸水及背景杂乱现象,本研究中对涂片的制作方法进行了改进,即先将染液和精液混合,再进行涂片。当将曙红Y染液浓度提高到20 mg/mL时,得到了清晰的精子涂片。
本研究中同时发现,不同的染料在使用方法上也存在差异。将曙红Y染液的染色方法应用到结晶紫染液上并不适合,而将结晶紫染液和马氏珠母贝精液混合后涂片,显微镜下观察到有大量精子聚集的现象,而使用压片的方法却能得到清晰的样片。
3.3 染色方法的比较
本试验中比较了曙红Y、结晶紫两种染色方法检测形态正常精子率之间的差异。结果显示,在精子形态学判定标准相同的情况下,两种染色方法之间形态正常的精子比率并无显著差异(P<0.05)。虽然采用曙红Y染色法时测得的颈折角型精子的比率显著高于用结晶紫染色方法的结果,但颈折角型精子所占精子总量的比例不足8%,对正常精子率与畸形精子率的总体判断不会造成影响。这种差异可能是因不同染色方法显现某种畸形精子的程度不一而造成的,类似的情况在人类精子形态检测中也出现过。如高久春等[33]使用改良巴氏染色法、瑞-吉染色法和考马斯亮蓝染色法对人类形态正常精子率及顶体完整率进行了检测。结果表明:用3种染色方法检测的形态正常精子率两两比较,差异均不显著;用瑞-吉染色法评价颈部和中段缺陷精子率及尾部缺陷精子率显著低于用改良巴氏染色法和考马斯亮蓝染色法的比率。
本试验中采用曙红Y及结晶紫两种染色方法时,判定的正常精子率间无显著差异,数据稳定,表明这两种染色方法均可用于马氏珠母贝精子形态的检测中,可以在生产实践中推广使用。
参考文献:
[1] 金启增.珍珠贝种苗生物学[M].北京:海洋出版社,1992:20-23.
[2] 陈兆和,周庆堂,何水养,等.马氏珠母贝早春育苗,缩短母贝养成期试验[J].湛江水产学院学报,1989,9(1-2):79-82.
[3] 张志强.影响马氏珠母贝人工育苗效果的原因浅析[J].湛江海洋大学学报,1994,14(1):4-10.
[4] 金启增,黎辉,何慧.珍珠生长激素在合浦珠母贝育珠中的作用[J].热带海洋,1998,17(4):44-50.
[5] 李咏梅,王梅芳,李有宁,等.马氏珠母贝育珠细胞小片和珠核处理技术研究:Ⅰ.不同处理液在海南陵水育珠的效果[J].广东海洋大学学报,2010,30(4):11-16.
[6] 王梅芳,余祥勇,李咏梅,等.马氏珠母贝育珠细胞小片和珠核处理技术研究Ⅱ.不同处理液在广东徐闻育珠试验效果的比较[J].广东海洋大学学报,2010,30(6):7-13.
[7] 劳赞,邓陈茂,梁盛.马氏珠母贝术前处理的研究[J].水产科学,2003,22(4):27-29.
[8] 张红玉,何毛贤,管云雁.马氏珠母贝红色壳家系不同世代遗传变异的SRAP分析[J].水产学报,2009,33(5):728-733.
[9] Deng Yuewen,Du Xiaodong,Wang Qingheng.Correlation and path analysis for growth traits in F1 population of pearl oyster Pinctada martensii[J].Manre Science Bulletin,2008,10(2):68-73.
[10] 王爱民,阎冰,叶力,等.马氏珠母贝不同地理种群内自繁和种群间杂交子一代主要性状的比较[J].水产学报,2003,27 (3):200-206.
[11] 王梅芳,余祥勇,刘永.马氏珠母贝雌雄同体和自体受精的研究[J].水生生物学报,2006,30(4):420-424.
[12] 王梅芳,余祥勇,刘永,等.马氏珠母贝杂交与自繁后代及企鹅珍珠贝间同工酶差异分析[J].农业生物技术学报,2005,13 (6):777-782.
[13] 王爱民,石耀华,吴星.4种防治马氏珠母贝多毛类寄生病方法的效果比较[J].海洋水产研究,2004,25(2):41-45.
[14] 李广丽,杜晓东,叶富良.合浦珠母贝同工酶的电泳分析[J].中国水产科学,2001,8(2):17-22.
[15] 王梅芳,余祥勇,刘永,等.2种珍珠贝的外套膜同工酶及粘液蛋白的电泳比较[J].华中农业大学学报,2004,23(5):555-559.
[16] 季相山,陈松林,赵燕,等.鱼类精子质量评价研究进展[J].中国水产科学,2007,14(6):1048-1052.
[17] Liu Q H,Li J,Xiao Z Z,et al.Use of computer-assisted sperm analysis(CASA)to evaluate the quality of cryopreserved sperm in red seabream(Pagrus major)[J].Aquaculture,2007,263(1-4):20-25.
[18] 管卫兵,王桂忠,李少菁.甲壳动物精子质量和活力评价[J].海洋通报,2003,22(2):83-88.
[19] 管卫兵,王桂忠,李少菁,等.锯缘青蟹精子低温冷藏及精子活力的染色法评价[J].台湾海峡,2002,21(4):457-462.
[20] 孙菊香,范丽君,贾林芝,等.伊红、PI染色法检测中华绒螯蟹活精子率[J].水产学报,2007,31(9):69-72.
[21] 马强,丁银娣,曲迪,等.伊红、台盼蓝检测河蟹精子存活率的比较[J].动物学杂志,2007,42(4):65-69.
[22] 沈亦平,马丽君,张锡元,等.台浦珠母贝的配子发生[J].动物学报,1992,38(2):113-116.
[23] 沈亦平,张锡元.合浦珠母贝精子发生过程的超微结构观察[J].武汉大学学报,1993(6):123-127.
[24] 杜晓东.三种珍珠贝精子发生及其超微结构的比较研究[J].湛江水产学院学报,1996,16(2):1-6.
[25] 余祥勇,王梅芳,陈钢荣,等.马氏珠母贝精子低温保存主要影响因素的研究[J].华南农业大学学报,2005,26(3):96-99.
[26] 王梅芳,余祥勇,刘永,等.马氏珠母贝精子的超低温保存[J].水产学报,2006,30(2):170-174.
[27] 喻达辉,陈竞春,苏天凤,等.合浦珠母贝精子的实验生物学初步研究[J].热带海洋,1998,17(1):83-86.
[28] 世界卫生组织.世界卫生组织人类精液精子——宫颈粘液相互作用实验室检验手册[M].4版.北京:人民卫生出版社, 2001:9-15.
[29] Coetzee K,De Villiers A,Thinus F K,et al.Clinical value of using an automated sperm morphology analyzer[J].Fertility and Sterility,1999,71(2):222-225.
[30] Zinaman M J,Brown C C,Selevan S G,et al.Semen quality and human fertility:a prospective study with healthy couples[J].Journal of Andrology,2000,21(1):145-153.
[31] 王书佳,李慕军.精子形态学在男性不育中的研究进展[J].医学综述,2009,15(10):1540-1542.
[32] 沙艳伟.精子形态相关因素分析[D].长春:吉林大学,2005: 44.
[33] 高久春,王瑞雪,许宗革,等.精子形态学分析中染色方法的比较[J].吉林大学学报,2005,31(5):778-780.
Comparison of different staining methods for morphological evaluation of the sperm quality in pearl oyster Pinctada martensii
BIN Cheng-yong,WANG Mei-fang,DOU Wei,YU Xiang-yong
(Fisheries College,Guangdong Ocean University,Zhanjiang 524025,China)
Abstract:The semen of pearl oyster Pinctada martensii was smeared and stained by two dyes Eosin Y and Crystal Violet for comparison of the staining effect and to evaluate the sperm quality in order to find out the suitable dying methods for the analysis of sperm morphology of pearl oyster.It was found that the sperm head was found to be dyed incompletely,and the sperm color was not improved with the extension of time,without obvious characteristics when the semen smear was stained with 0.8 mg/mL Eosin Y.Thus,this method is unfit for the sperm characteristic detection.After the sperm solution was mixed with 20 mg/mL Eosin Y,the sperm head was cardinal,and the tail plum,with clear parts of the sperm structure,obvious morphological characteristics and the very fair background. The obvious sperm characteristics including the dark violet sperm head and the light purple tail with the very fair background were observed in the semen stained with 5 mg/mL of Crystal Violet.So this method can be used to evaluate the sperm characteristics precisely.The main malformation was found in the pieces and tail of the sperm, few in the head according to the sperm characteristics shown by staining.The detection revealed that there were no significant differences in the evaluation of the normal sperm by the 5 mg/mL of Crystal Violet and by latter two methods(P>0.05),so either could be used to evaluate the sperm quality.
Key words:Pinctada martensii;sperm;quality evaluation;staining method
中图分类号:S968.31
文献标志码:A
文章编号:2095-1388(2012)01-0032-06
收稿日期:2011-04-07
基金项目:国家科技支撑计划项目(2007BAD29B03);广东省科技计划项目(2008B020800014);广东省重大科技兴海项目(A200708C01)
作者简介:宾承勇(1983-),男,硕士研究生。E-mail:bin_cy@126.com
通信作者:余祥勇(1966-)男,教授,博士。E-mail:yuxyong@tom.com


