饥饿和再投喂对中间球海胆代谢和生长的影响
秦艳杰,李霞,吴立新,周一兵
(大连海洋大学海洋生物资源可持续利用重点实验室,辽宁大连116023)
摘要:将体质量为(5.72±0.23)g的中间球海胆Strongylocentrotus intermedius分别饥饿0、3、6、9、12 d (分别记为C、S3、S6、S9、S12)后再饱食投喂至30 d,研究了饥饿与再投喂过程中海胆的代谢率、生长率、摄食率、食物转化率的变化。结果表明:在饥饿和再投喂过程中,S3组各指标与对照组无明显差异; S6、S9、S12组在恢复投喂过程中的一段时间内代谢率均维持较低水平,而特定生长率和食物转化率均在恢复投喂初期出现高峰。这说明S6、S9、S12 3个试验组海胆出现了部分补偿生长现象,这种补偿生长是再投喂后海胆通过降低代谢率及提高食物转化率来实现的。
关键词:中间球海胆;饥饿;再投喂;生长;代谢
在自然条件下,由于气侯和环境条件的变化,水产动物经常会在一定阶段面临食物匮乏而受到饥饿胁迫,当恢复摄食后,在一定时间内,其生长速度会加快甚至超过未饥饿个体,这种现象被称为补偿生长[1]。近些年来,对水产动物补偿生长的研究主要集中在鱼类,也有部分甲壳类和贝类的报道[2-5],研究内容主要包括能量代谢、生化组成、组织结构变化等[6-8]。国外关于饥饿对棘皮动物生长、繁殖和能量利用方面也有少量报道[9-12]。中间球海胆Strongylocentrotus intermedius的可食部分为生殖腺,产品主要销往日本等国家。国内对中间球海胆的研究主要集中在人工育苗、能量代谢以及营养成分的分析等方面[13-15]。关于中间球海胆在饥饿及再投喂过程中的生长、代谢特征目前尚未见报道。本试验中,作者对中间球海胆饥饿及恢复投喂过程中的代谢、摄食和生长指标进行了研究,旨在揭示其适应饥饿胁迫的生理和生态学对策,为提高海胆的经济效益和高效养殖提供参考资料。
1 材料与方法
1.1 海胆的来源及驯养
试验用中间球海胆(2龄)为大连碧龙海珍品有限公司海上吊笼式人工养殖的海胆,取回后在大连海洋大学生态实验室自动控温的水族箱中挂袋饲育。试验用水为砂滤自然海水,盐度为32,水温为(18±0.5)℃。每天换水一次,换水量为1/2~2/3,连续充气培养。饵料为新鲜孔石莼。驯养一周后开始试验。
1.2 方法
1.2.1 试验设计 选择大小、体质量相近的,性腺处于生长期的健康海胆279只,从中随机取9只,停食2 d后测量壳径、体质量、性腺质量等生长指标。测得海胆的初始体质量为(5.72±0.23) g,壳径为(2.46±0.16)cm。试验设为5组,每组设3个重复,每个重复组放18只海胆,试验在25 L水族箱中进行。一组为对照组(C组),一直饱食投喂30 d;其余4组为饥饿组,分别饥饿3、6、9、12 d(记为S3、S6、S9、S12组)后再饱食投喂至30 d。饥饿结束后,每组分别取样3只,测量其标准代谢及体质量、性腺质量等生长指标;于再投喂后第2、4、8、12天及试验结束时,每组分别取3只,停食2 d后测量其标准代谢及体质量、性腺质量等生长指标。对照组每5 d取3只海胆,停食2 d后测定各项指标。投喂期间均为饱食投喂,摄食量为投喂饵料与残饵质量之差。
1.2.2 指标的测定及计算 1)代谢率的测定。通过测定耗氧率、排氨率来代表标准代谢率。将每个海胆放入1 L盛满海水的广口瓶中,用保鲜膜封
口。空白对照组以同样的方法进行,只是瓶中不放入海胆。2 h之后用虹吸法取海水于50 mL碘量瓶中,用碘量法测定溶解氧,用次溴酸钠氧化法测定水样氨氮的含量。
耗氧率(mg/g·h)=(C0-Ct)V/(W×t),
排氨率(μg/g·h)=(Nt-N0)V/(W×t),式中:C0为空白瓶中溶解氧的含量(mg/mL);Ct为试验结束时溶解氧的含量(mg/mL);V为广口瓶中海水体积(mL);N0为空白瓶中氨氮的含量(μg/mL);Nt为试验结束时氨氮的含量(μg/mL); W为海胆的体质量(g);t为试验时间(h)。
2)生长及摄食指标的测定。特定生长率(SGR)、摄食率(FR)和食物转化率(FCE)分别按以下公式计算:
SGR(%·d-1)=100×(lnW2-lnW1)/t,
FR(%·d-1)=100×C/[t(W1+W2)/2],
FCE(%)=100×(W2-W1)/C,
其中:W1和W2分别为试验t时间前后海胆的体质量或性腺质量(g),均为用滤纸吸干水分后测得; C为摄食湿饵料的质量(g);t为试验时间(d)。
1.3 数据处理
采用SPSS 11.0统计软件,对数据做单因子方差分析,若组间差异显著,用LSD法做多重比较。
2 结果
2.1 海胆体质量及其特定生长率的变化
试验过程中,饥饿后S3组体质量稍有上升, S6组体质量无明显变化,S9、S12组体质量有所下降,但差异不显著(P>0.05);整个试验结束时, S3、S6组体质量均与对照组无显著差异(P>0.05),而S9、S12组体质量明显小于对照组(P<0.01)(表1)。
表1 中间球海胆体质量、性腺质量的变化情况(湿重,平均值±标准差)
Tab.1 The changes in body weight and gonad wet weight in sea urchin(Mean±S.D.)
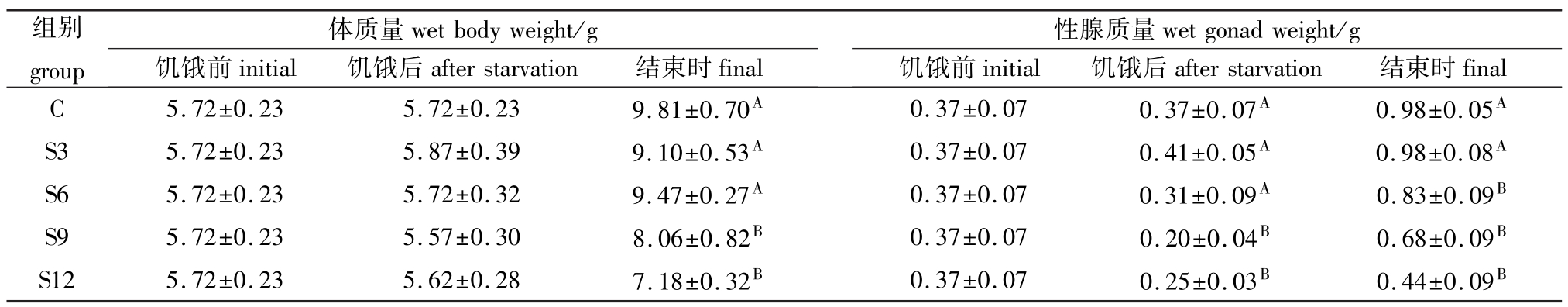
注:同列中标有不同大写字母者表示组间差异极显著(P<0.01),标有相同大写字母者表示组间差异不显著(P>0.05)。
Note:The means with different capital letters within the same column are very significantly different at the 0.01 probability level,and the means with the same letters within the same column are not significant differences.
组别group final C5.72±0.235.72±0.239.81±0.70A0.37±0.070.37±0.07A0.98±0.05 wet body weight/g饥饿前initial饥饿后after starvation结束时final体质量wet gonad weight/g饥饿前initial饥饿后after starvation结束时性腺质量A S35.72±0.235.87±0.399.10±0.53A0.37±0.070.41±0.05A0.98±0.08AS65.72±0.235.72±0.329.47±0.27A0.37±0.070.31±0.09A0.83±0.09BS95.72±0.235.57±0.308.06±0.82B0.37±0.070.20±0.04B0.68±0.09BS125.72±0.235.62±0.287.18±0.32B0.37±0.070.25±0.03B0.44±0.09B
从图1可见:对照组SGR曲线保持较平稳的状态;与对照组相比,饥饿结束时所有试验组SGR均显著降低,恢复投喂过程中S3组SGR迅速恢复至对照组水平;S6、S9、S12组SGR均出现一个相对高峰,可维持3~5 d,之后缓慢恢复至对照组水平。SGR最大值均出现在恢复投喂的第4天。
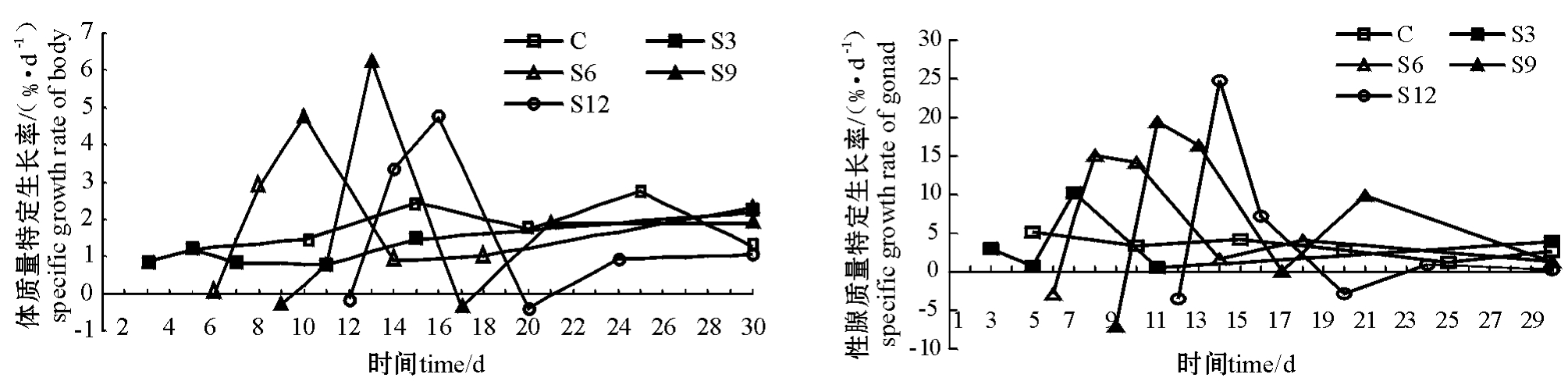
图1 中间球海胆体质量和性腺质量特定生长率的变化曲线
Fig.1 The changes in specific growth rate(SGR)of body weight and gonad weight in sea urchin
2.2 中间球海胆性腺质量及其特定生长率的变化
饥饿过程中,S3组性腺仍有所增长,S6组有所下降,但均与对照组无明显差异;S9、S12组饥饿过程中性腺质量极显著下降(P<0.01)。整个试验结束时,S3组性腺质量与对照组持平,S6、S9、S12组性腺湿重则仍显著小于对照组(P<0.01) (表1)。整个试验过程中正常投喂组性腺SGR保
持平稳状态。饥饿及再投喂过程中,S3组性腺SGR曲线基本保持稳定,只在投喂4 d时出现一个小的高峰。对于其它3个试验组来说,饥饿结束时性腺SGR显著低于正常水平,恢复投喂后均出现一个相对高峰,之后逐渐恢复至对照组水平,性腺SGR最大值均出现在投喂后第2天,并均可维持3~5 d(图1)。可见,各试验组海胆的体质量和性腺质量的特定生长率变化规律相似。
2.3 中间球海胆代谢率和摄食率的变化
从图2可见,整个试验过程中对照组耗氧率较稳定但有下降趋势。较对照组而言,饥饿及投喂过程使S3组耗氧率出现较小范围、较短时间的波动,但均未达到显著水平。S6、S9、S12组饥饿后耗氧率均显著低于对照组(P<0.05),恢复投喂后,耗氧率仍维持在较低的水平,维持时间为2~6 d,最后各试验组海胆耗氧率均能恢复至对照组水平。
对照组的排氨率维持在较稳定的水平。S3、 S6、S9组饥饿后其排氨率与对照组相近,S12组则显著下降;恢复投喂后,S3组无明显变化,其余各试验组海胆排氨率均经历一个下降过程并可维持2~5 d,然后缓慢恢复至对照组水平(图2)。
从图2可见:对照组随着海胆个体的生长,摄食率呈下降趋势;S3、S6、S9组恢复投喂初期,摄食率有短暂的上升,之后恢复至对照组水平; S12组则比较特殊,投喂后摄食率反而低于对照组,经4 d左右才缓慢恢复至对照组水平。
2.4 中间球海胆食物转化率的变化
整个试验过程中对照组食物向性腺的转化率较平稳;S3组出现较小的波动,但与对照组无显著差别;其他各试验组恢复投喂后转化率均出现了一个显著升高的过程,之后S6组逐渐恢复至对照组水平,S9组出现较大波动,S12组至试验结束时的食物转化率仍维持在较低水平(图2)。
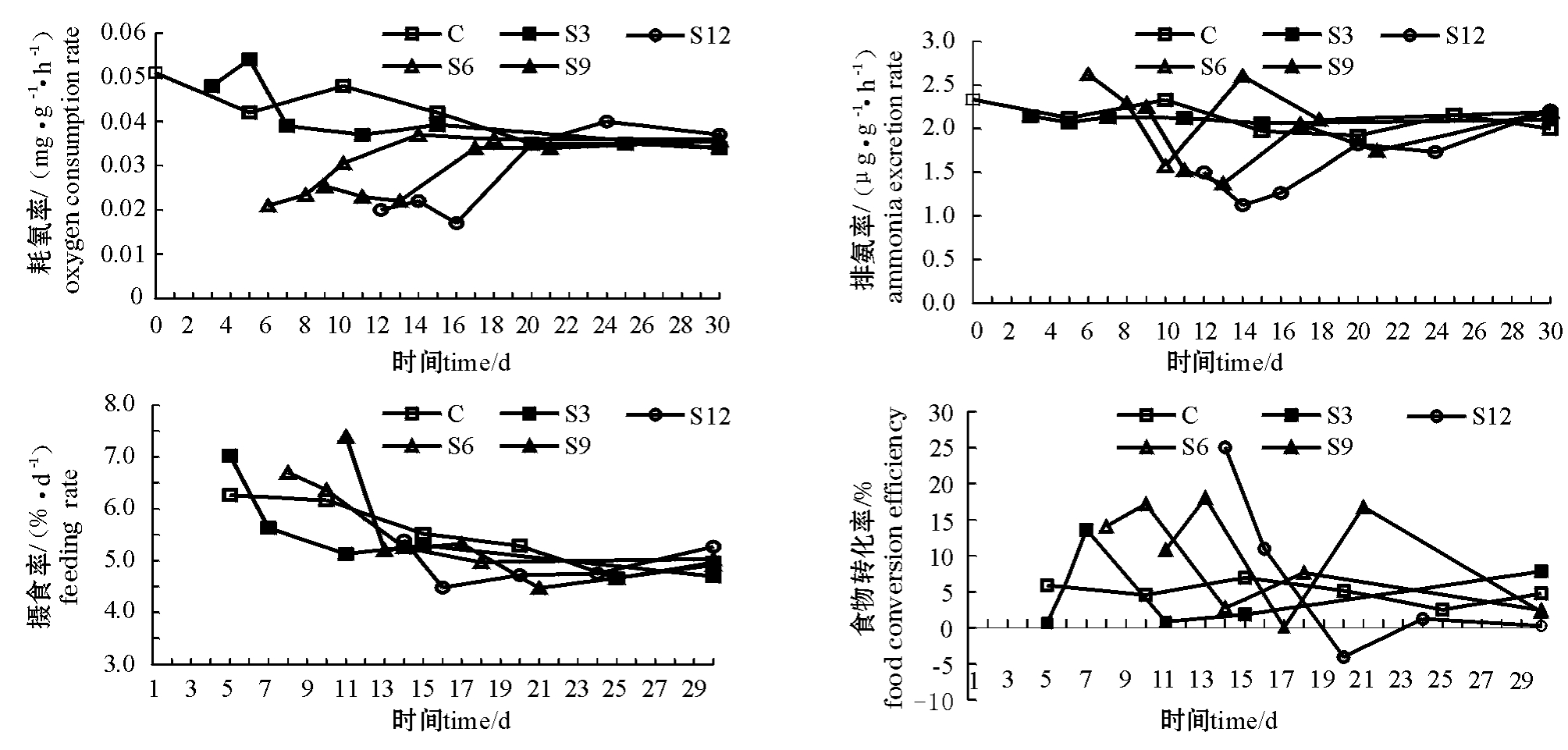
图2 中间球海胆的耗氧率、排氨率、摄食率和食物转化率(性腺)的变化曲线
Fig.2 The changes in oxygen consumption rate,ammonia excretion rate,feeding rate,and food conversion efficiency to gonad in sea urchin
3 讨论
3.1 饥饿和再投喂对中间球海胆生长的影响
补偿生长的有无和能力高低取决于动物的种类、饥饿程度、饥饿持续时间以及恢复饱食的时间长短,更确切地说取决于特定生长率升高的幅度和持续时间的长短。根据水产动物饥饿后恢复投喂过程中体质量及特定生长率的变化情况,将补偿生长的程度分为四类:超补偿生长、完全补偿生长、部分补偿生长和不能补偿生长[1,16]。本研究中针对体湿重和性腺质量两个生长指标,分别研究了中间球海胆的补偿生长现象。针对性腺生长的研究结果显示,S3组在饥饿及投喂过程中的特定生长率、代谢率、摄食率和食物转化率等指标均与对照组无明显差异,说明饥饿3 d对中间球海胆无明显影响;而S6、S9、S12组试验结束时性腺质量均显著低于对照组,且恢复投喂后均出现性腺SGR显著升高
的过程,因此认为这3组存在部分补偿生长现象。
3.2 中间球海胆补偿生长的机制
关于补偿生长的机制主要有以下3个观点[1,16]:1)恢复投喂的一段时间里,代谢水平较低,食物转化率提高,如虹鳟Salmo gairdneri[3]、南方鲇Silurus meridionalis[2]饥饿后主要通过这种方式达到补偿生长;2)正常喂食后,摄食水平提高,如鲇Ictalurus panctatus[17]和中国对虾Penaeus chinensis[4];3)食物转化率和摄食水平都有提高,常见于鲈Lateolabrax japonicus[18]、日本沼虾Macrobrachium nipponense[19]等。但也有的研究表明,同一种动物饥饿后补偿生长的机制可能是变化的,如真鲷Pagrosomus major幼鱼经短期饥饿后,在恢复生长中是通过提高摄食水平来达到补偿生长的,而继续延长饥饿时间则是通过提高食物转化率来达到补偿生长的[20]。本研究中,饥饿3~4 d时,S3组中间球海胆的各项指标均无显著变化,其代谢率仍维持在正常水平,说明该种海胆的耐饥饿能力较强。饥饿3 d对海胆无明显影响,这与有些学者对绿球海胆耐饥饿能力较强的研究结果类似[21-22]。随着饥饿时间的延长,S6、S9、S12组恢复投喂后摄食率升高不显著,但耗氧率和排氨率均可在较低水平上维持2~6 d,同时食物转化率出现一个显著上升的过程。由此可见,在恢复投喂初期,海胆的代谢耗能降低,食物转化率提高,并加快了蛋白质的合成过程,说明S6、S9、S12组是通过降低代谢率达到部分补偿生长的效果。需要指出的是,本研究中,饥饿时间最长的S12组至试验结束时代谢率和摄食率虽已经恢复至对照组水平,但特定生长率和食物转化率仍低于对照组。推断可能有两个原因:一是试验过程中投喂时间(18 d)不够充足,使以上两个指标未能得到充分恢复;二是由于饥饿时间较长,有可能对海胆的消化系统造成不可逆转的破坏,虽然摄食率已恢复正常,但食物转化率低,进而特定生长率也较低。随着饥饿时间的延长,水产动物消化器官会受到不同程度的影响,如胃壁变薄,分泌颗粒减少,肠管收缩,腺细胞结构不完整,腺体萎缩等。恢复投喂后,消化器官主要结构均有所恢复,但饥饿时间较长的试验组试验结束时均未恢复至正常水平,这与对美国红鱼Sciaenops ocellatus饥饿研究的结果相似[6]。据此推测,饥饿12 d的S12组试验结束时海胆消化器官很可能并未恢复至正常,因此出现了食物转化率和生长率仍然较低的现象,说明海胆可能已经无法从过度饥饿的影响下再度恢复。饥饿9 d时出现的食物转化率指标的波动很可能预示着饥饿的不可逆点,因此,建议生产中任何原因导致的海胆暂时饥饿尽量不要超过9 d。
3.3 饥饿和再投喂在海胆养殖生产中的意义
对畜禽类动物的补偿生长研究有利于通过改变投饲制度而获得经济效益,而研究水产动物补偿生长特点和规律不仅有助于揭示水产动物适应饥饿或营养不足胁迫的生理生态学对策,而且能为渔业资源管理及水产养殖实践提供理论指导。因此,水产动物饥饿研究已经逐渐成为营养生理学研究的热点之一[1,16]。海胆摄食量极大,但食物往往得不到充分消化即排出体外[23],不但造成饵料和人工的浪费,同时对环境造成严重污染,夏季还极易导致大规模病害的发生,所以有效控制海胆的摄食量非常有意义。另外,海胆的可食部分是生殖腺,早期发育阶段的生殖腺口感好,品质佳。待性腺进入成熟期,生殖细胞极易溢出,导致生殖腺失去完整形态,此时口感下降,经济价值迅速降低。研究结果表明,海胆性腺发育与食物供给密切相关[23,21]。李霞等[24]对饥饿及再投喂过程中中间球海胆性腺发育的研究结果也表明,随着饥饿时间的延长,海胆性腺发育迟缓。本试验结束时,对各试验组海胆解剖时也发现,对照组和S3组海胆性腺大多出现生殖细胞外溢,甚至呈液态的情况,说明该组海胆已经进入成熟期,而其他各试验组生殖腺结构仍非常完整。因此可以推断,饥饿是使海胆延缓上市甚至反季上市,保持较高经济价值的有效手段。
参考文献:
[1] 吴立新,董双林.水产动物继饥饿或营养不足后的补偿生长研究进展[J].应用生态学报,2000,11(6):943-946.
[2] 邓利,张波,谢小军.南方鲇饥饿后的恢复生长[J].水生生物学报,1999,23(2):167-172.
[3] Dohson S H,Holmes R M.Compensatory growth in the rainbow trout,Salmo gairdneri Richardson[J].J Fish Biol,1984,25(6): 649-656.
[4] 吴立新,董双林,田相利.中国对虾继饥饿后的补偿生长研究[J].生态学报,2001,21(3):452-457.
[5] Auster P J,Stewart L L.Compensatory growth in the bay scallop Argopecten irradians(L.)[J].J Northw Atl Fish Sci,1984,5:103 -104.
[6] 李霞,姜志强,谭晓珍,等.饥饿和再投喂对美国红鱼消化器官组织学的影响[J].中国水产科学,2002,9(3):212-216.
[7] 陈雷,姜志强,吴丹.饥饿和再投喂对漠斑牙鲆生化组成的影响[J].大连水产学院学报,2009,24(1):62-65.
[8] 吴立新,刘瑜,王欣,等.饥饿和再投喂对日本囊对虾代谢率的
影响[J].大连水产学院学报,2007,22(2):109-112.
[9] Boolootian R A,Lasker R.Digestion of brown algae and the distribution of nutrients in the purple sea urchin,Strongylocentrotus purpuratus[J].Comp Biochen Physiol,1964,11:273-289.
[10] Lares M T,Pomory C M.Use of body components during starvation in Lytechinus variegats(Lamarck)(Echinodermata:Echinoides)[J].J Exp Mar Biol Ecol,1998,225:99-106.
[11] Steven D B,James B M.Differential survivorship,reproduction, growth and nutrient allocation in the regular echinoid Lytechinus variegates(Lamarck)fed natural diets[J].J Exp Mar Biol Ecol, 1998,226:195-215.
[12] Takay Y,Imamura T.Chemical constituents of various body parts in the starved sea urchin,Strongylocentrotus intermedius(A.agassiz)[J].Sci Rep Hok Fish Stn,1996,49:17-30.
[13] 李霞,秦艳杰,李颖逾.中间球海胆饥饿代谢的研究[J].中国水产科学,2004,11(4):302-306.
[14] 王子臣,常亚青.虾夷马粪海胆人工育苗的研究[J].中国水产科学,1997,4(1):60-68.
[15] 赵艳,童圣英,张硕,等.温度和盐度对虾夷马粪海胆耗氧率和排氨率的影响[J].中国水产科学,1998,5(4):33-36.
[16] 谢小军,邓利,张波.饥饿对鱼类生理生态学影响的研究进展[J].水生生物学报,1998,22(2):181-188.
[17] Kim M K,Lovell R T.Effect of restricted feeding regimes on compensatory weight gain and body tissue changes in channel catfish Ictalurus punctatus in ponds[J].Aquaculture,1995,135:285 -293.
[18] 楼宝,史会来,骆季安,等.饥饿和再投喂对鲈幼鱼生长和生化组成的影响[J].大连水产学院学报,2008,23(3):173-178.
[19] 王军霞,李志华,谢松.饥饿补偿对日本沼虾生长及生化组成的影响[J].河北大学学报:自然科学版,2005,25(6):644-649.
[20] 张波,孙耀,唐启升.饥饿对真鲷生长及生化组成的影响[J].水产学报,2000,24(3):206-210.
[21] Michael P R.Resource allocation plasticity in sea urchins:rapid, diet induced,phenotypic changes in the green sea urchin,Strongylocentrotus droebachiensis(Müller)[J].J Exp Mar Biol Ecol, 1998,220:1-14.
[22] Minor M A,Scheibling R E.Effect of food ration and feeding regime on growth and reproduction of the sea urchin Strongylocentrotus droebachiensis[J].Mar Biol,1997,129(1):159-167.
[23] Kelly M S.The reproductive cycle of the sea urchin Psammechinus miliaris(Echinodermata:Echinoidea)in a Scottish sea loch[J].J Mar Biol Ass U K,2000,80:909-919.
[24] 李霞,秦艳杰,辛丽.饥饿和再投喂对中间球海胆性腺发育的影响[J].大连水产学院学报,2007,22(1):6-10.
Effects of starvation and refeeding on metabolism and growth in sea urchin,Strongylocentrotus intermedius
QIN Yan-jie,LI Xia,WU Li-xin,ZHOU Yi-bing
(Key Laboratory of Marine Bio-resources Sustainable Utilization in Liaoning Province,Dalian Ocean University,Dalian 116023,China)
Abstract:The sea urchin(Strongylocentrotus intermedius)with body weight of(5.72±0.23)g was starved for 0 (control group,C),3 d(S3),6 d(S6),9 d(S9)and 12 d(S12),and then re-fed until the 30th d to evaluate the effects of starvation on growth and metabolism in the sea urchin.The wet weight of whole body and gonad, special growth rate of body and gonad,the oxygen consumption rate,ammonia excretion rate and the food conversion efficiency were measured and calculated every five days in control group,on the day at the end of starvation, and 2,4,8 and 12 days after re-fed in four starved groups.Results showed that there were no significant differences in body wet weight between S3,S6 and C groups at the end of the experiment,but significantly lower in S9 and S12 than those in the control.There was significantly lower in gonad wet weight in S6,S9 and S12 compared to C and S3 at the end.The sea urchin in S6,S9 and S12 showed a peak in special growth rate in body and gonad after re-fed and lasted 3-5 days.The oxygen consumption rate and ammonia excretion rate were found to decrease for 4-8 days in S6,S9 and S12 at the beginning of re-fed.The food conversion efficiencies were increased in varying degrees after re-fed in the four experimental groups.It is indicated that the food deprivation for 6 d,9 d and 12 d leads to part compensatory growth in the sea urchin,which are contributed in the significant decrease in metabolic rate and the increase in the food conversion efficiency during the initial stage of refeeding.
Key words:Strongylocentrotus intermedius;starvation;refeeding;compensatory growth;metabolism
中图分类号:S968.22
文献标志码:A
文章编号:2095-1388(2011)06-0521-05
收稿日期:2011-03-01
基金项目:国家自然科学基金资助项目(30800849);大连市科学技术基金资助项目(2003BINS283)
作者简介:秦艳杰(1977-),女,博士,副教授。E-mail:qinyanjie@dlou.edu.cn


