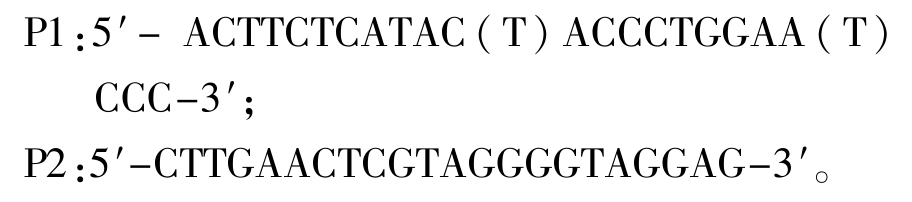
陈言峰,马文山,陈文慧,梁日深,廖富蘋,邹记兴
(华南农业大学动物科学学院,广东广州510642)
摘要:从患病斑鳢Channa maculata体内分离到一株细菌(FS20100810),经人工感染试验证实为该病的病原菌。该菌株兼性厌氧,为革兰氏阴性杆菌,能运动,无芽孢,无荚膜,能发酵葡萄糖、蔗糖、麦芽糖、甘露醇、七叶苷,氧化酶反应、接触酶反应、吲哚试验和M.R.试验均为阳性。该菌株对斑鳢的半致死浓度为6.83×105cfu/mL。16S rRNA基因序列与嗜水气单胞菌Aeromonas hydrophila的同源性为99.6%。药敏试验结果显示,该菌株对氧氟沙星、菌必治、先锋噻肟等抗生素敏感,对复方新诺明等中度敏感,对苯唑青霉素、青霉素G、氨苄青霉素耐药。通过对人工感染的斑鳢进行组织切片观察,发现病鱼的鳃、心肌、肝脏、肾脏、脾脏、肠道等器官组织均有明显的病理变化。
关键词:斑鳢;嗜水气单胞菌;16S rRNA;毒力因子;组织病理
斑鳢Channa maculata属于鲈形目、攀鲈亚目、鳢科、鳢属,俗称黑鱼、蛇头鱼、生鱼。斑鳢是一种肉质鲜美、营养和经济价值极高的淡水经济鱼类。自然界的斑鳢对不良水温、水质及缺氧有较强的耐受力,很少发病。但随着现代集约化高密度养殖规模的扩大,斑鳢的病害较为严重。本试验中,笔者从广东佛山市某斑鳢养殖场患病斑鳢体内分离到一株致病菌,通过鉴定,确定该致病菌为嗜水气单胞菌Aeromonas hydrophila,并对该菌株的致病力、毒力因子及患病斑鳢的组织病理学进行了研究,旨在为斑鳢养殖中病害的防治提供参考资料。
1.1 材料
患病斑鳢取自广东佛山市某斑鳢养殖场,症状为:患病部位出现圆形、椭圆形的红斑,病灶中间的鳞片脱落,坏死的表皮腐烂,形成溃疡,严重时甚至露出骨骼或内脏。健康的斑鳢购于广州市黄沙水产市场,体质量为(531±44)g。生化鉴定用微量生化管和羊血琼脂平板均购于广州环凯微生物有限公司。抗生素纸片购于杭州天和微生物试剂有限公司。细菌基因组DNA提取试剂盒购于广州东盛生物科技有限公司。
1.2 方法
1.2.1 病原菌的分离纯化 采用无菌操作对病原菌进行分离纯化。从发病濒死的斑鳢肝、肾、体表溃烂处取样,划线接种于普通营养琼脂培养基上, 37℃下培养24~48 h后,挑取占优势、形态一致的单个菌落进行纯培养,得到一株细菌FS20100810。
1.2.2 菌株FS20100810的生理、生化鉴定 挑取新鲜菌落接种于营养肉汤中培养18 h,取80 μL的肉汤培养物加入各微量生化管中,37℃下培养8~24 h,观察结果。
1.2.3 菌株FS20100810 16S rRNA基因序列的测定 用细菌的通用引物扩增16S rRNA,P1:5′-AGAGTTTGATCCTGGCTCAG-3′;P2:5′-TACGGCTACCTTGTTACGACTT-3′。引物由上海英骏生物技
术有限公司合成。50 μL的PCR反应体系中含有: 5 μL 10×PCR缓冲液(含Mg2+),2 μL 10 mmol/L 4×dNTP,各1 μL 10 mmol/L正向和反向引物,2 μL TaqDNA聚合酶(1 U/μL),2 μL模板,37 μL双蒸馏水。PCR反应条件为:94℃下预变性5 min;94℃下变性30 s,58℃下退火45 s,72℃下延伸1 min 30 s,共进行30个循环。扩增产物经电泳检测,用PCR产物回收试剂盒纯化后,送上海美吉生物医药科技有限公司测序。将所得序列与GenBank中的核酸序列进行Blast,用Clustal X和Mega软件进行同源性比较。
1.2.4 人工感染试验 将菌株FS20100810接种到营养琼脂培养基平板上,37℃下培养24 h,将其菌落用无菌生理盐水洗脱,制成菌悬液,分别稀释至浓度为2.72×108、2.72×107、2.72×106、2.72×105、2.72×104cfu/mL。以上每个浓度的菌悬液,按0.5 mL/尾的剂量分别腹腔注射10尾健康斑鳢,作为感染组。对照组的斑鳢按照0.5 mL/尾的剂量腹腔注射无菌的NaCl(15 g/L)溶液。连续观察15 d,记录鱼的发病症状及死亡情况,并对死亡鱼进行细菌再分离。另取10尾健康斑鳢,按1 mL/尾的剂量腹腔注射浓度为2.72×108cfu/mL的菌液,取濒死鱼的组织固定。
1.2.5 菌株FS20100810毒力因子的检测
1)溶血活性的测定。挑取新鲜菌落划线接种于体积分数为5%的羊血琼脂平板上,于30℃下培养48 h,观察结果。菌落周围出现溶血圈者,判定为溶血阳性。
2)胞外蛋白酶的检测。挑取新鲜菌落划线接种于10 g/L的脱脂奶蔗糖胰蛋白胨琼脂平板上, 28℃下培养24 h,在菌落周围出现清晰的溶蛋白圈者,判为阳性[1]。
3)脂酶的检测。挑取新鲜菌落划线接种于吐温80琼脂平板上,30℃下培养48 h,在菌落周围出现模糊的晕圈者,判为阳性[2]。
4)卵磷脂酶的检测。挑取新鲜菌落划线接种于卵黄琼脂平板上,30℃下培养48 h,在菌落周围出现不透明的区带者,判为阳性[2]。
1.2.6 菌株FS20100810溶血素基因和气溶素基因的PCR扩增 比较分析已登录GenBank的气单胞菌属的溶血素基因,根据这些序列的保守区域设计引物为
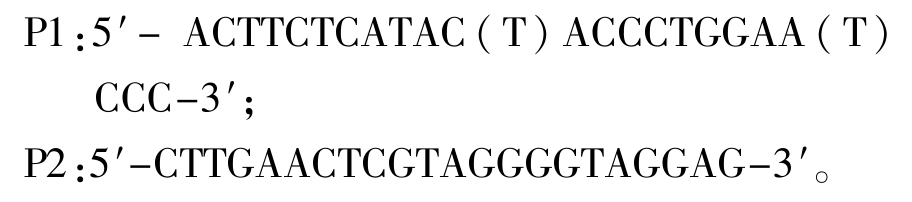
比较分析已登录GenBank的气单胞菌属的气溶素基因,根据这些序列的保守区域设计引物为

引物由上海英骏生物技术有限公司合成。扩增产物经电泳检测,用PCR产物回收试剂盒纯化后,送上海美吉生物医药科技有限公司测序。将所得序列与GenBank中的核酸序列进行Blast,用Clustal X和Mega软件进行同源性比较。
1.2.7 药敏试验 采用纸片扩散法进行。将该菌的24 h培养物用无菌生理盐水洗下制成1.5×108cfu/mL的菌悬液,取80 μL菌悬液涂布于营养琼脂培养基平板上,用无菌镊子将抗生素纸片贴在琼脂表面,于37℃下恒温培养48 h,记录抑菌圈的直径。
1.2.8 病理组织学观察 取人工感染后濒死的鱼6尾和健康的鱼3尾,分别取心、肝、肾、脾、鳃、肠,用体积分数为10%的中性福尔马林固定,石蜡包埋,切片,H.E染色,光学显微镜下观察并拍照。
2.1 形态特征
观察发现,在LB平板培养基上形成的菌落边缘整齐,表面湿润,隆起、光滑,半透明,颜色为灰白色至淡黄色,直径为1~2 mm。将该菌在营养肉汤(28℃)中培养24 h,其生长良好,呈均匀混浊。
2.2 生理生化鉴定
从表1可见,根据FS20100810的生理、生化特性的检测结果,鉴定该菌为嗜水气单胞菌[2]。
2.3 FS20100810的16S rRNA基因序列的测定
菌株FS20100810所扩增的16S rRNA基因序列长度为1 406 bp(图1),将该序列(Accession No. HQ529494)与GenBank中的序列进行比较,结果与嗜水气单胞菌同源性达99.6%,鉴定该菌应为嗜水气单胞菌。
2.4 人工感染试验
从人工感染后死亡的斑鳢体内能重新分离到原
感染细菌,表明菌株FS20100810即为该病的病原菌。根据改进的寇氏法[3],计算菌株FS20100810对斑鳢的半致死浓度LC50为6.83×105cfu/mL。
表1 FS20100810的生理生化特征
Tab.1 Physiological and biochemical characteristics of FS20100810
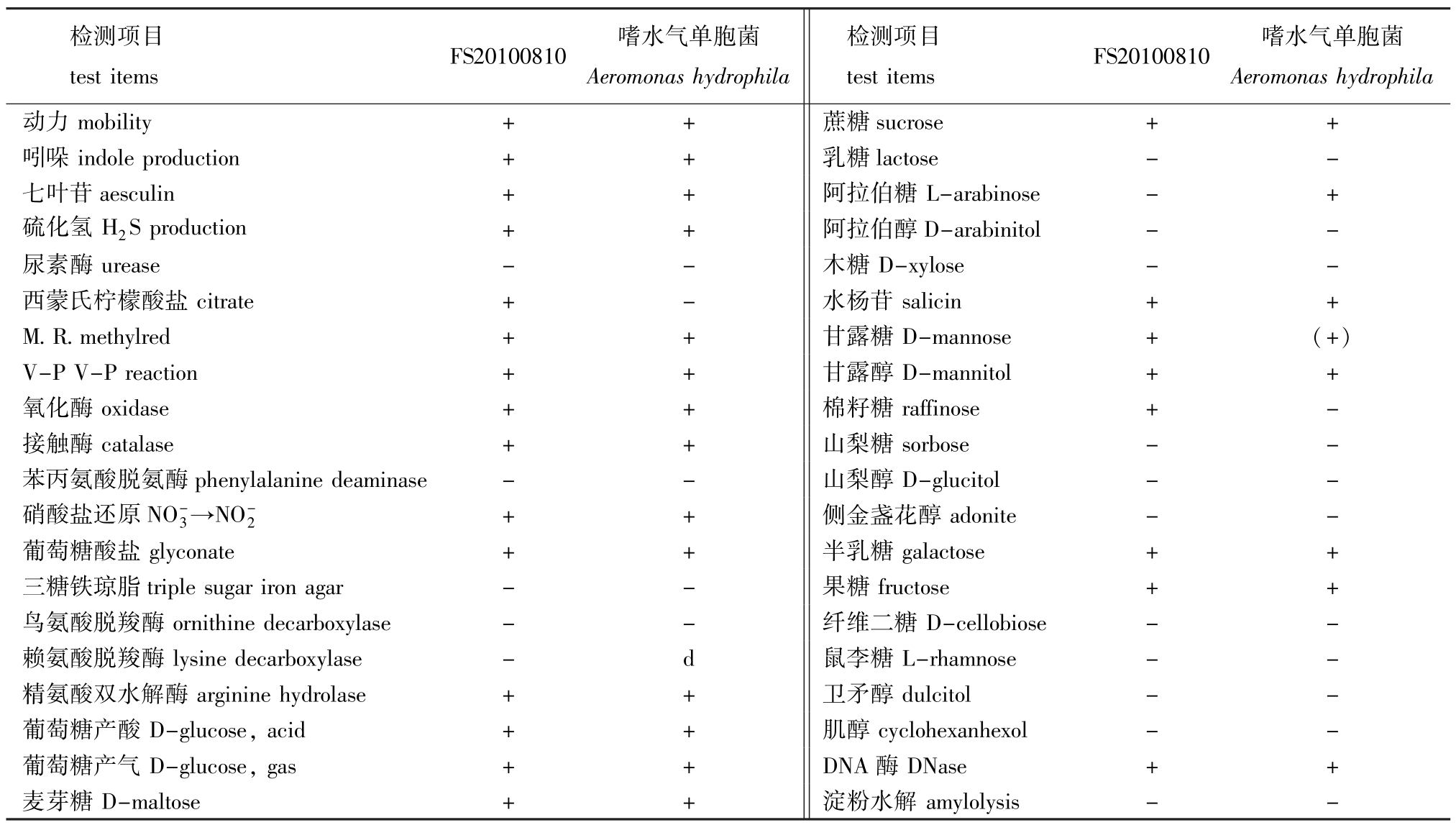
检测项目Aeromonas hydrophila动力mobility++蔗糖test itemsFS20100810嗜水气单胞菌Aeromonas hydrophila test itemsFS20100810嗜水气单胞菌检测项目sucrose++吲哚indole production++乳糖lactose--七叶苷aesculin++阿拉伯糖L-arabinose-+硫化氢H2S production++阿拉伯醇D-arabinitol--尿素酶urease--木糖D-xylose--西蒙氏柠檬酸盐citrate+-水杨苷salicin++ M.R.methylred++甘露糖D-mannose+(+) V-P V-P reaction++甘露醇D-mannitol++氧化酶oxidase++棉籽糖raffinose+-接触酶catalase++山梨糖sorbose--苯丙氨酸脱氨酶phenylalanine deaminase--山梨醇D-glucitol--硝酸盐还原NO-3→NO-adonite--葡萄糖酸盐glyconate++半乳糖2 + +侧金盏花醇galactose++三糖铁琼脂triple sugar iron agar--果糖fructose++鸟氨酸脱羧酶ornithine decarboxylase--纤维二糖D-cellobiose--赖氨酸脱羧酶lysine decarboxylase-d鼠李糖L-rhamnose--精氨酸双水解酶arginine hydrolase++卫矛醇dulcitol--葡萄糖产酸D-glucose,acid++肌醇cyclohexanhexol--葡萄糖产气D-glucose,gas++DNA酶amylolysis--DNase++麦芽糖D-maltose++淀粉水解
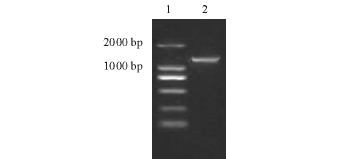
图1 FS20100810 16S rRNA基因的PCR扩增结果
Fig.1 PCRamplificationof 16SrRNAgeneof FS20100810
Note:1 DNA Marker;2 FS20100810.
2.5 FS20100810毒力因子的检测
从图2可见,菌株FS20100810在血液琼脂平板上产生β溶血,并产生胞外蛋白酶、酯酶和卵磷脂酶等毒力因子。
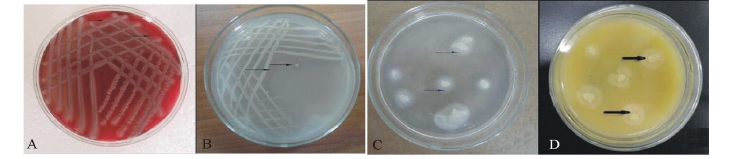
图2 FS20100810毒力因子的检测结果
Fig.2 Detection of virulence factors of FS20100810
注:A溶血性的检测,箭头示菌落周围形成明显的溶血环;B胞外蛋白酶的检测,箭头示菌落周围形成明显的溶蛋白圈;C脂酶的检测,箭头示菌落周围出现模糊的晕圈;D卵磷脂酶的检测,箭头示菌落周围出现不透明的区带。
Note:A,Detection of hemolytic activity,and occurrence of clear zones of hemolysis surrounding growth(arrow);B,Detection of extracellular protease,and occurrence of clear zones surrounding growth(arrow);C,Detection of lipase,and occurrence of zones of opaque precipitate surrounding growth(arrow);D,Detection of lecithinase,and occurrence of zones of opaque precipitate surrounding growth(arrow).
2.6 采用PCR扩增FS20100810溶血素基因和气溶素基因
从图3可见:用FS20100810溶血素基因扩增出355 bp大小的片段(Accession No.JF298810),将该序列与GenBank中的序列进行比对,结果与嗜水气单胞菌溶血素基因序列的同源性为98.7%。
从图4可见:用FS20100810气溶素基因扩增出331 bp大小的片段(Accession No.JF298811),将该序列与GenBank中的序列进行比对,结果与嗜水气单胞菌气溶素基因序列的同源性为92.8%。
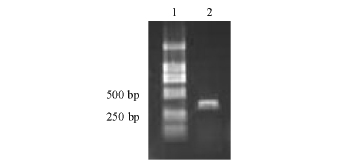
图3 用PCR扩增FS20100810的溶血素基因
Fig.3 PCR amplification of hemolysin gene of FS20100810
Note:1 DNA Marker;2 FS20100810.

图4 用PCR扩增FS20100810的气溶素基因
Fig.4 PCRamplificationofaerolysingeneof FS20100810
Note:1 DNA Marker;2 FS20100810.
2.7 药敏试验
药敏试验结果显示,FS20100810对氧氟沙星、菌必治、先锋噻肟等抗生素敏感,对复方新诺明等多种抗生素为中度敏感,对苯唑青霉素、青霉素G、氨苄青霉素、利福平有耐药性(表2)。
表2 FS20100810对23种抗生素药敏试验结果
Tab.2 Sensibility of FS20100810 to 23 types of antibiotics
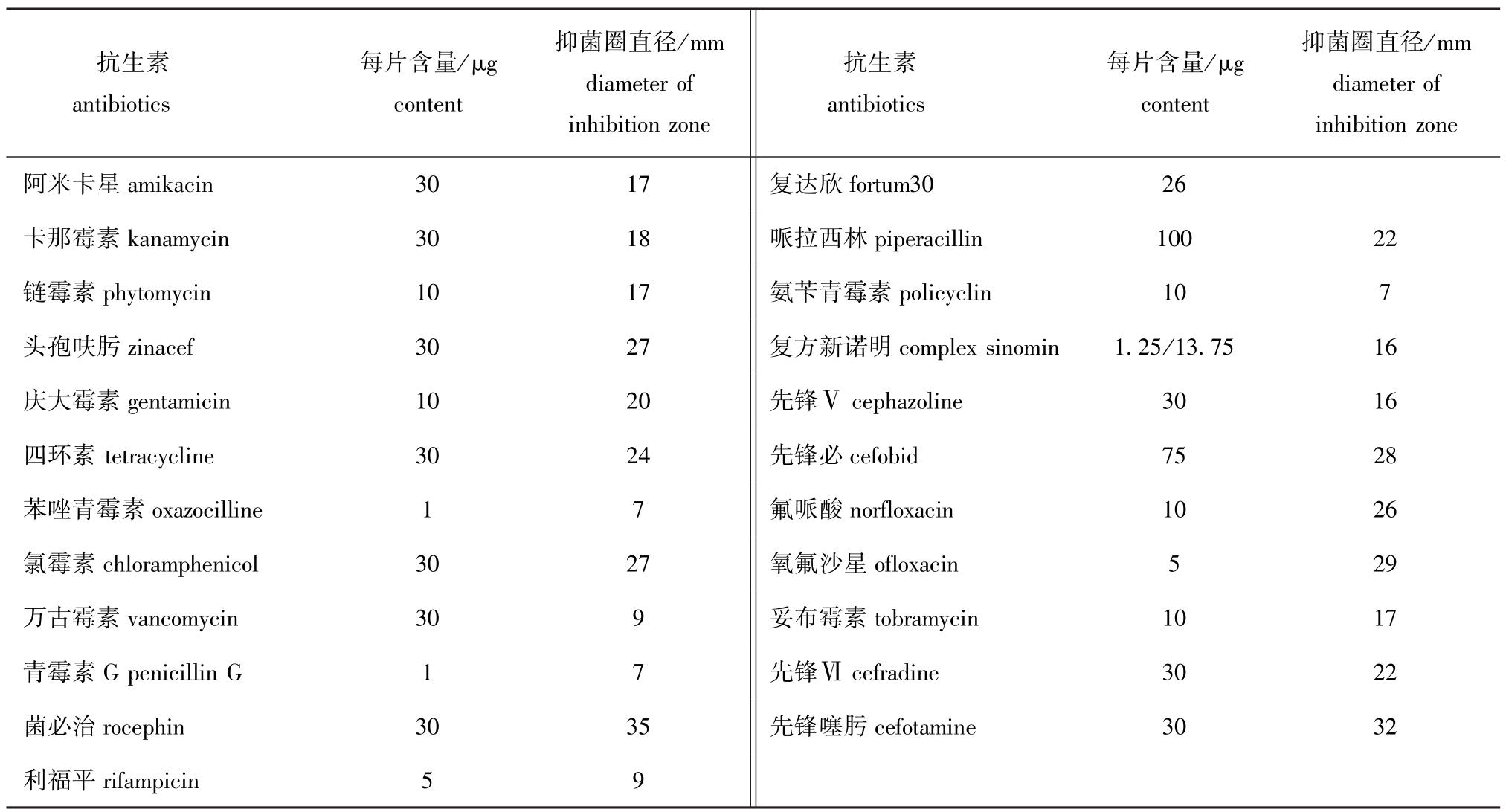
抑菌圈直径/mm diameter of inhibition zone阿米卡星amikacin3017复达欣抗生素antibiotics每片含量/μg content抑菌圈直径/mm diameter of inhibition zone抗生素antibiotics每片含量/μg content fortum3026卡那霉素kanamycin3018哌拉西林piperacillin10022链霉素phytomycin1017氨苄青霉素policyclin107头孢呋肟zinacef3027复方新诺明complex sinomin1.25/13.7516庆大霉素gentamicin1020先锋Ⅴcephazoline3016四环素tetracycline3024先锋必cefobid7528苯唑青霉素oxazocilline17氟哌酸norfloxacin1026氯霉素chloramphenicol3027氧氟沙星ofloxacin529万古霉素vancomycin309妥布霉素tobramycin1017青霉素G penicillin G17先锋Ⅵcefradine3022菌必治rocephin3035先锋噻肟cefotamine3032利福平rifampicin59
2.8 病理组织学观察
对照组鱼的组织学观察结果见图5-A、C、E、G、I、K。试验组鱼的病理组织学观察结果表明:肝细胞绝大部分坏死消失,只剩下肝组织结构的网状支架和细胞碎片,形成大小不等的空泡,溶解、消失的细胞相互融合,形成结构紊乱的坏死灶,并形成大量淤血(图5-B);脾组织变性坏死,溶解,形成结构紊乱的坏死灶(图5-D);肾小囊腔扩张,肾间质出血,大量红细胞浸润,肾小球扩张、充血,部分肾间质变性坏死(图5-F);鳃小
片基底部水肿,间隙变宽,上皮细胞与支持细胞分离,其间形成空腔,部分上皮细胞坏死、脱落(图5-H);心肌出血,心肌纤维间可见大量的红细胞,有的心肌纤维形成较大空隙,部分心肌纤维
变性坏死(图5-J);肠黏膜上皮层广泛性坏死脱落,基底膜排列紊乱,毛细血管扩张、充血(图5 -L)。
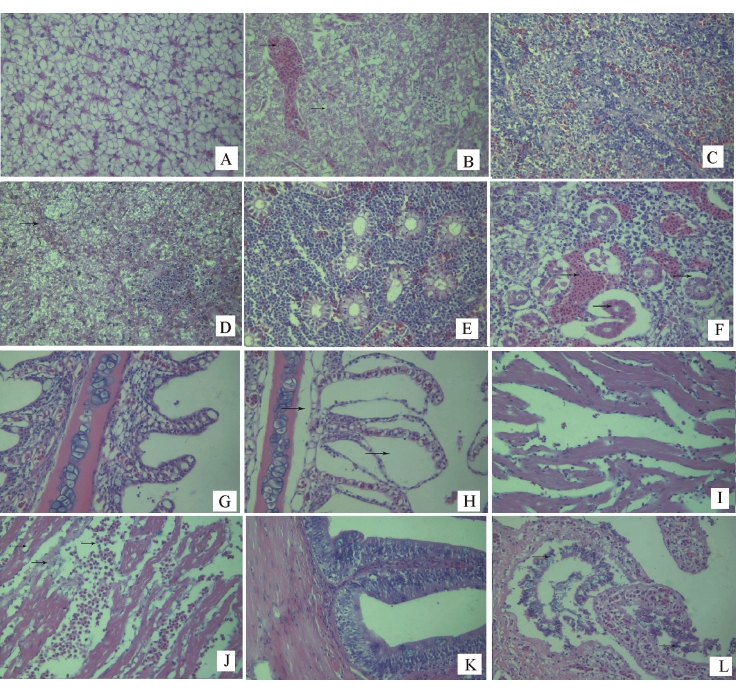
图5 对照组和试验组斑鳢正常及病理组织学的观察(×400)
Fig.5 Pathohistological observation of liver,spleen and kidney(×400)of the snakehead in the experimental groups and in the control group
注:A对照组鱼的肝;B攻毒组鱼的肝,形成大量淤血和圆空泡(箭头);C对照组鱼的脾;D攻毒组鱼的脾,组织广泛性的坏死(箭头);E对照组鱼的肾;F攻毒组鱼的肾,产生大量淤血,肾小球充血、萎缩(箭头);G对照组鱼的鳃;H攻毒组鱼的鳃,出现较大空腔(箭头);I对照组鱼的心肌;J攻毒组鱼的心肌,肌肉组织间出现空泡,红细胞浸润(箭头);K对照组鱼的肠;L攻毒组鱼的肠,黏膜上皮坏死脱落(箭头)。
Note:A,Liver of the fish in the control group;B,Liver of the fish in the experimental group,and congestion and rotund vacant antrums were observed(arrow);C,Spleen of the fish in the control group;D,Spleen of the fish in the experimental group,necrosis was prominent(arrow);E, Kidney of the fish in the control group;F,Kidney of the fish in the experimental group,congestion of nephridial tissues and hyperemia and atrophy of renal glomerulus were observed;G,Gill of the fish in the control group;H,Gill of the fish in the experimental group,vacant antrums were observed(arrow);I,Cardiac muscle of the fish in the control group;J Cardiac muscle of the fish in the experimental group,vacant antrums were observed in the cardiac musculature and musculature was congested with erythrocytes(arrow);K,Intestine of the fish in the control group;L,Intestine of the fish in the experimental group,epithelia fell off and died(arrow).
本研究中,菌株FS20100810的16S rRNA、溶血素、气溶素这三个基因的序列与GenBank中已知嗜水气单胞菌相应序列的同源性分别在99.6%、98.7%和92.8%以上。检测致病性嗜水气单胞菌有几项关键的生化指标,如氧化酶试验呈阳性,能发酵葡萄糖、蔗糖、阿拉伯糖、七叶苷和水杨苷[4]。尽管菌株FS20100810的阿拉伯糖为阴性和棉籽糖为阳性,不符合嗜水气单胞菌的特性,但综合生理生化与分子鉴定结果,可判定本试验中所分离的菌株为嗜水气单胞菌。
嗜水气单胞菌广泛存在于淡水、土壤和水生动物中,寄主范围广,是一种典型的人、兽、鱼共患病病原,可引起多种水产动物病害[5-7],从而给淡水养殖业造成巨大的经济损失。经计算,菌株FS20100810对斑鳢半致死浓度为6.83×105cfu/mL,依据鱼类致病菌的划分标准[8],此菌株对斑鳢具有较强的致病力,这与陈昌福等[9]的研究结果基本一致。该菌对鳢科其它鱼类是否也有较强的致病性,有待进一步研究。
溶血素是一种外毒素,可以参与细菌和宿主细胞的黏附及定植过程,也是嗜水气单胞菌的重要致病因子[10-12]。本研究中的溶血素用平板法检测的结果与用PCR检测的结果一致。
气溶素具有溶血性、细胞毒性和肠毒性,是嗜水气单胞菌主要的毒力因子之一[13-16]。本研究中,经PCR扩增出331 bp的片段,从分子水平上证明菌株FS20100810含有气溶素基因,并具有一定的致病性。
胞外蛋白酶是嗜水气单胞菌重要的毒力因子。嗜水气单胞菌能产生多种蛋白酶,如丝氨酸蛋白酶、弹性蛋白酶、酪素水解酶、明胶水解酶等,均能降解脱脂奶,在脱脂奶平板上产生溶蛋白圈。
脂酶是嗜水气单胞菌胞外酶的一种。有资料表明,脂酶有可能通过与动物的白细胞相互作用,或通过脂肪分解产生的脂肪酸影响免疫系统功能,从而构成毒力因子[17]。
卵磷脂酶作为重要的毒力因子,在宿主细胞内的存活、细胞溶解、细胞间的扩散中起着重要作用[18]。鉴于平板法的局限性,推测嗜水气单胞菌可能产生卵磷脂酶,是否属实,还有待于进一步研究。
本研究中,作者仅通过选择性培养基对嗜水气单胞菌FS20100810的胞外蛋白酶、酯酶和卵磷脂酶进行了初步的检测。
菌株FS20100810对23种抗生素敏感性的测定结果,可为今后对由嗜水气单胞菌引起的斑鳢感染症防治用药提供参考。考虑到菌株间差异性,提议进行药敏测定时应尽可能地对不同病例、不同病鱼的分离菌株进行测定以选择其确实有规律性的敏感药物。
人工感染后的病理组织学变化以广泛的组织细胞变性、坏死为主,其中肝、肠和心肌的病变与杜雄伟等[19]报道的嗜水气单胞菌感染剑尾鱼后组织病理变化基本一致。本研究中,菌株FS20100810感染对斑鳢脾脏的损害程度很大,与宋铁英等[20]报道的嗜水气单胞菌感染鳗鲡后脾脏病理变化较为轻微不一致。这可能是由于试验中所用的菌液浓度、攻毒剂量、取病料的时间不同所致。该菌对鳃的损害程度相对较小,推测可能是由于本研究中采用腹腔注射的感染方式,细菌在进入斑鳢体内后,首先侵入脾、肝、肾等组织器官,形成炎症,引起细胞实质性的变性坏死,鳃组织病变尚未加深时,病鱼已因肝、肾、脾功能发生严重障碍而死亡。
参考文献:
[1] 王春林,曹雪,刘晓丹,等.嗜水气单胞菌不同分离株生化特性及胞外蛋白酶的检测[J].畜牧与兽医,2008,40(6):16-19.
[2] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[3] 杨茂成.兽医统计学[M].北京:中国展望出版社,1990.
[4] 中华人民共和国国家质量监督检验检疫总局.GB/T 1865222002致病性嗜水气单胞菌检验方法[S].北京:中国标准出版社,2002.
[5] 潘厚军,吴淑勤,董传甫,等.鳜致病性嗜水气单胞菌GYK1株的鉴定、毒力及溶血性[J].上海水产大学学报,2004,13(1): 24-29.
[6] 刘加波,谢芝勋,邓显文,等.罗非鱼嗜水气单胞菌的分离鉴定[J].水利渔业,2006,26(4):100-103.
[7] Kirov S M,Hudson J A,Hayward L J,et al.Distribution of Aeromonas hydrophila hybridization groups and their virulence properties in Australasian clinical and environmental strains[J].Letters in Applied Microbiology,1994,18:71-73.
[8] Devesa S,Toranzo A E,Barja J L.Fish report of vibriosis in turbot (Scophthulnus maximus)cultured in northwestern Spain.AE Ellis [M]//Fish and Shellfish Pathology.London:Academic Press, 1985:131-140.
[9] 陈昌福,刘毅.斑鳢细菌性败血症病原菌的分离与鉴定[J].中
国兽医学报,1998,18(2):144-146.
[10] Hirono I,Aoki T.Nucleotide sequence and expression of an extracellular hemolysin gene of Aeromonas hydrophila[J].Microbial Pathogenesis,1991,11(3):189-197.
[11] Asao T,Kinoshita Y,Kozaki S,et al.Purification and some properties of Aeromonas hydrophila hemolysin[J].Infection and Immunity,1984,46:122-127.
[12] Asao T,Kozaki S,Kato K,et al.Purification and characterization of an Aeromonas hydrophila hemolysin[J].J Clinical Microbiol, 1986,24:228-232.
[13] 卢强,李连瑞,付宝权,等.致病性嗜水气单胞菌气溶素基因的克隆与高效表达[J].中国兽医学报,2004,24(1):21-23.
[14] Parker M W,Buckley J T,Postma J P,et al.Structure of the Aeromonas toxin proaerolysin in its water-soluble and membranechannel states[J].Nature,1994,367:19-28.
[15] Hardie K R,Schulze A,Parker M W,et al.Vibrio spp.secrete proaerolysin as a folded dimmer without the need for disulphide bond formation[J].Mol Microbiolp,1995,17(6):1035-1044.
[16] 陈怀青.嗜水气单胞菌外毒素研究进展[J].国外医学:微生物分册,1992,15(4):256-259.
[17] Eftimiadi C,Buzzi E,Tonetti M,et al.Short-chain fatty acids produced by anaerobic bacteria alter the physiological responses of human neutrophils to chemotactic peptides[J].Journal of Infection, 1987,14:43-53.
[18] Titball R W.Bacterial phospholipases C[J].Microbiol Rev, 1993,57:347-366.
[19] 杜雄伟,常藕琴,王晓辉,等.嗜水气单胞菌对剑尾鱼的致病性及组织病理学研究[J].长江大学学报:自然科学版,2005,2 (2):53-56.
[20] 宋铁英,龚晖,Khomyakova T I,等.嗜水气单胞菌ZN1攻击鳗鲡后的组织病理观察[J].福建农业学报,2008,23(1):25-30.
Histopathology and identification of pathogen Aeromonas hydrophila in diseased snakehead Channa maculata
CHEN Yan-feng,MA Wen-shan,CHEN Wen-hui,LIANG Ri-shen,LIAO Fu-pin,ZOU Ji-xing
(College of Animal Science,South China Agricultural University,Guangzhou 510642,China)
Abstract:A pathogen(FS20100810)was isolated from ulcered snakehead,Channa maculata,which was proved to be the pathogenic bacterium of the disease by re-infection experiments.The strain was found to be gram negative, anaerobic,bacilliform in shape and motile.It had no capsule and gemma,and utilized glucoses,sucrose,maltose, mannitol,esculin as energy and its oxidase reaction,catalase reaction,indole and M.R.test were positive.The half lethal concentration value for the strain to the snakehead was 6.83×105cfu/mL.Homology analysis showed that it had the high similarity to Aeromonas hydrophila with 99.6%similarity.The drug sensitivity showed the strain was sensitive to ofloxacin,ceftriaxone,and Cefotamine was intermediately sensitive to complex sinomin and was resistant to oxazocilline,penicillin G and ampicillin.There were obvious pathological changes in the tissues of the gills,cardiac muscles,livers,kidneys,spleens and intestines in the snakeheads challenged by strain FS20100810 by pathohistological observation.
Key words:Channa maculata;Aeromonas hydrophila;16S rRNA;histopathology;virulence factor
中图分类号:S941.42
文献标志码:A
文章编号:2095-1388(2011)06-0514-07
收稿日期:2011-01-05
基金项目:国家星火计划项目(2008GA780002);广东省教育部产学研结合项目(2011B090400270);清远市科技计划项目(2011C011106009)
作者简介:陈言峰(1981-),男,博士研究生。E-mail:chyfwf@126.com
通信作者:邹记兴(1966-),男,教授,博士生导师。E-mail:zoujixing@163.com