表1 耐盐红螺菌正交试验因素水平表
Tab.1 Factor levels in orthogonal test of Rhodospeudomonas capsulata
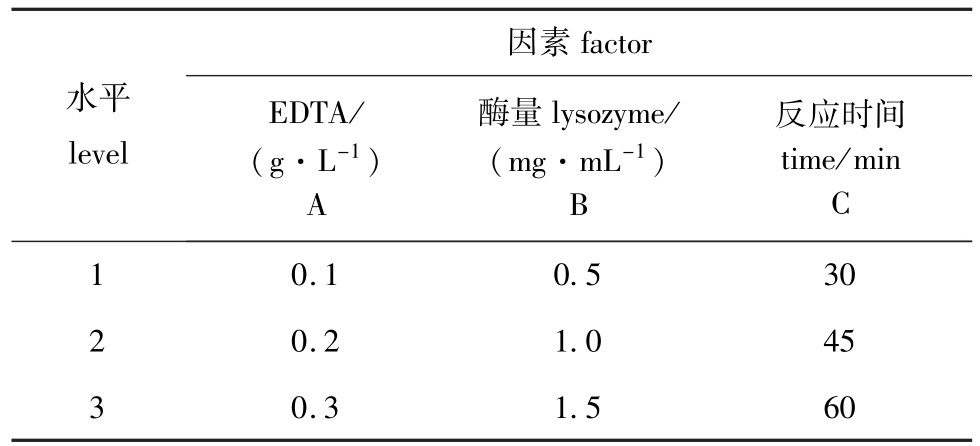
因素factor水平level EDTA/ (g·L-1) A酶量lysozyme/ (mg·mL-1) B反应时间time/min C 1 0.10.530 2 0.21.045 3 0.31.560
纪敦敦,邱宏端,谢航
(福州大学生物科学与工程学院,福建福州350108)
摘要:将高效降解氨氮的假丝酵母菌Candida sp.与高效降解亚硝酸盐氮的耐盐红螺菌Rhodospeudomonas capsulate进行原生质体融合,探讨原生质体制备及融合的条件,并对融合子进行了筛选。结果表明,原生质体制备的优化条件如下:耐盐红螺菌,溶菌酶量为1.5 mg/mL,EDTA浓度为0.1 g/L,作用时间为45 min;假丝酵母菌,蜗牛酶量为0.5 mg/mL,巯基乙醇的质量分数为0.1%,EDTA浓度为1 g/L,作用时间为30 min。两种原生质体在聚乙二醇(PEG-6000)和Ca2+的诱导下发生融合,在添加制霉菌素和链霉素的选择培养基上进行初筛,以生长稳定性及对氨氮、亚硝酸盐氮的降解效能等为指标进行复筛,获得了具有较好降解效能的融合子R1菌株。该菌株对亚硝酸盐氮的降解效能与耐盐红螺菌相同,达到90%以上;对氨氮的降解效能为63%,较耐盐红螺菌提高54%。
关键词:耐盐红螺菌;假丝酵母菌;氨氮降解;原生质体融合
光合细菌是水产养殖中良好的微生态制剂。大量研究表明,光合细菌能有效降低养殖水体的污染程度,如降低水体中有机物、氨氮与亚硝酸盐氮的浓度,提高水体中的溶氧等[1-3]。目前国内外均已将光合细菌作为养殖水质净化菌剂,并且进入生产性应用阶段。如东南亚各国、日本和中国的养鱼池和养虾池中均已较普遍地利用光合细菌来改善水质,且取得较好的效果[4-6]。光合细菌降解亚硝酸盐氮的效能大多为30%~90%[7-9],而对氨氮的降解率一般只有20%~60%[10-11],且对氨氮降解效能高的菌种通常降解亚硝酸盐氮的效果不佳[2,11],而对亚硝酸盐氮降解高的菌种降解氨氮的效果也较差,这在一定程度上影响了菌剂的应用效果。为此,选育一种能同时净化养殖水体中氨氮与亚硝酸盐氮的高效光合细菌优良菌株,对进一步促进与推广其生态养殖的应用及效果具有重要意义。
原生质体融合是20世纪70年代发展起来的基因重组技术[12],目前已成为菌种改良的重要手段之一。原生质体融合与其它基因重组方式相比,具有不受种属限制、遗传物质传递更为完整、获得更大的重组几率以及能提高育种速度等优点[13-14]。基于原生质体融合选育菌种的优点,在实验室前期已选育的耐盐红螺菌Rhodospeudomonas capsulate (降解亚硝酸盐氮90%以上)与假丝酵母菌Candida sp.(降解氨氮80%以上)的基础上,本研究中作者以两种高效净化水质的功能菌为试验菌株,通过原生质体融合技术选育提高耐盐红螺菌对氨氮的降解效能,旨在选育一种能高效降解氨氮和亚硝酸盐氮的光合细菌,并进一步应用于水产生态养殖中。
1.1 材料
1.1.1 菌种 耐盐红螺菌(编号C12)[15]和假丝酵母菌(编号B)[16]均为实验室筛选保藏的菌种。
1.1.2 培养基
1)基础培养基(g/L):光合细菌基础培养基包括CH3COONa 3.0,NaCl 1.0,(NH4)2SO40.3, MgSO40.2,KH2PO40.5,K2HPO40.3,CaCl20.05,酵母膏0.1,MnSO40.025,FeSO40.005,蛋白胨0.01,谷氨酸0.0002,pH为7.4,在121℃下灭菌20min。酵母菌基础培养基包括葡萄糖
20,蛋白胨10,酵母膏10,pH为自然值,在115℃下灭菌20 min。
2)高渗再生培养基:由光合细菌基础培养基中添加质量分数为17%的蔗糖制成。
3)融合子筛选选择培养基:在高渗再生培养基中添加制霉菌素原液和链霉素原液,使其最终浓度均达到100 U/mL。
4)养殖水体培养基:以淡水鱼塘的养殖水为基质(经滤纸过滤),添加氨氮标准溶液(NH4Cl溶液,氨氮浓度为1 000 μg/mL)与亚硝酸盐氮标准溶液(NaNO2溶液,亚硝酸盐氮浓度为1 000 μg/mL),配成pH为7.0,氨氮浓度为9~10 mg/L,亚硝酸盐氮浓度为1~2 mg/L的养殖水体培养基。在121℃下灭菌20 min备用。
1.1.3 试剂 Tris-HCl缓冲液包括0.2 mol/L Tris 10 mL,0.2 mol/L HCl 17 mL,蒸馏水13 mL,pH为7.36。SMM缓冲液包括蔗糖170g/L, MgCl2·6 H2O 4.1 g/L,顺丁烯二酸2.3 g/L,pH为6.7。以上缓冲液配制后在115℃下灭菌20 min。
制霉菌素原液是用体积分数为95%的乙醇配制成10 000 U/mL的溶液。链霉素原液是用无菌水配制成10 000 U/mL溶液。PEG溶液:含有质量分数为30%的PEG-6000、50 mmol/L CaCl2的SMM溶液。蜗牛酶:用山梨醇(0.8 mmol/L,pH为6.5,115℃下灭菌20 min)分别配制成浓度为0.5、1.0、1.5 mg/mL的溶液。溶菌酶:用SMM缓冲液分别配制成浓度为0.5、1.0、1.5 mg/mL的溶液。以上试剂使用前均进行过滤除菌。
1.2 方法
1.2.1 两种亲株生长曲线的测定
1)耐盐红螺菌 挑取斜面菌种接种于10 mL光合细菌基础培养基中,置于30℃光照条件下培养2 d,然后以5%的接种量继续接种于培养基(在250 mL三角瓶中加入100 mL培养基)中培养,并在不同的培养时间取样,用分光光度法(OD660nm)测定其细胞生物量,描绘其生长曲线。
2)假丝酵母菌 挑取斜面菌种接种于10 mL酵母菌基础培养基中,于30℃下以100 r/min振荡培养1 d,后以5%的接种量继续接种于三角瓶培养基中培养,在不同的培养时间取样,用分光光度法(OD560nm)测定细胞生物量,描绘其生长曲线。
1.2.2 两种亲株的抗性鉴定 分别在酵母菌、光合细菌基础培养基中添加体积分数为1%的制霉菌素、链霉素原液[17]及两种抗菌素原液,并振荡均匀制作成平板。将两种亲株分别划线在含单种及两种抗生素的平板上,将假丝酵母菌置于30℃恒温下培养1 d,将耐盐红螺菌置于光照条件下培养3 d (30℃),观察两种亲株在不同抗菌素平板上的生长情况。
1.2.3 两种亲株原生质体的制备与再生
1)耐盐红螺菌 吸取培养至对数生长期的菌液1.5 mL置于离心管中,离心(10 000 r/min离心5 min,下同),弃掉上清液,菌泥用Tris-HCl缓冲液进行洗涤、离心,反复两次。然后添加EDTA、溶菌酶溶液作用于细胞制备原生质体,待反应结束后离心除去溶菌酶,并用SMM缓冲液洗涤两次,生成的原生质体悬于SMM缓冲液中备用。同时根据正交试验因素水平表(表1)设计正交试验,探讨不同浓度的EDTA、溶菌酶溶液和不同反应时间对菌种制备原生质体的影响。此外,吸取0.5 mL原生质体悬液,用SMM缓冲液稀释适当倍数后,涂布于高渗再生培养基上,30℃下光照培养7 d,以观察其再生情况。
表1 耐盐红螺菌正交试验因素水平表
Tab.1 Factor levels in orthogonal test of Rhodospeudomonas capsulata

因素factor水平level EDTA/ (g·L-1) A酶量lysozyme/ (mg·mL-1) B反应时间time/min C 1 0.10.530 2 0.21.045 3 0.31.560
2)假丝酵母菌 吸取培养至对数生长期的菌液1.5 mL置于离心管中,离心(以10 000 r/min离心5 min,下同),弃掉上清液,菌泥用Tris-HCl缓冲液进行洗涤、离心,反复两次。将其置于含有巯基乙醇、EDTA的溶液中,在37℃、摇床条件下以200 r/min离心15 min,除去上清液,并添加蜗牛酶溶液作用于细胞制备原生质体,待反应结束后离心除去蜗牛酶,用SMM缓冲液洗涤、沉淀两次,将生成的原生质体悬于SMM缓冲液中备用。同时根据正交试验因素水平表(表2)设计正交试验,探讨不同浓度的巯基乙醇、EDTA、蜗牛酶溶液和不同反应时间对菌种制备原生质体的影响。此外,吸取0.5 mL原生质体悬液,用SMM缓冲液稀释适当倍数后,涂布于高渗再生培养基上,30℃
下恒温培养2 d,以观察其再生情况。
表2 假丝酵母菌正交试验因素水平表
Tab.2 Factor levels in orthogonal test of Candida sp.
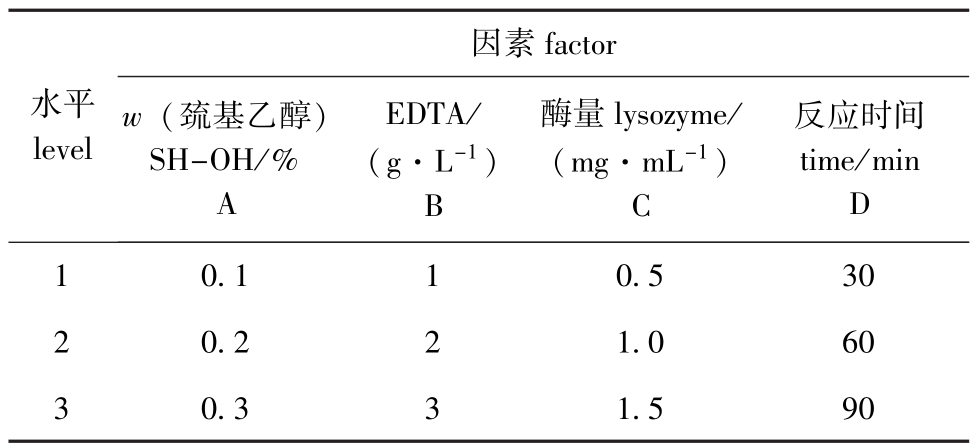
因素factor水平level w(巯基乙醇) SH-OH/% A EDTA/ (g·L-1) B酶量lysozyme/ (mg·mL-1) C反应时间time/min D 10.110.530 20.221.060 30.331.590
3)原生质体形成率、再生率的计算
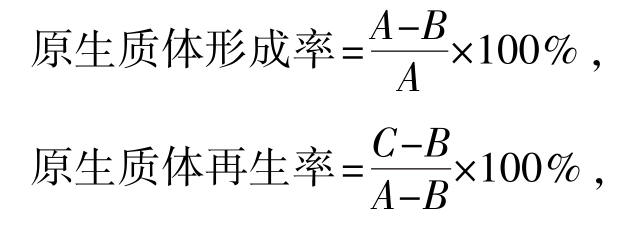
其中:A为未经酶处理的菌液在基础培养基平板上生长的菌落数;B为经酶处理后的菌液在基础培养基平板上生长的菌落数;C为经酶处理后的菌液在高渗再生培养基平板上生长的菌落数。
1.2.4 原生质体融合 分别吸取两种原生质体制备液0.75 mL于试管中,轻轻混匀后进行离心,弃上清液,加入PEG溶液1.5 mL,置于30℃下水浴中反应10 min,离心,除去PEG,将沉淀物用SMM溶液洗涤两次,后悬浮在1 mL SMM溶液中,并将菌液涂布在添加有两种抗菌素的选择培养基平板上,在30℃、光照条件下培养7 d,挑取生长的菌落初步获得融合子细胞。
1.2.5 融合子筛选 从含有两种抗菌素的选择培养基平板上挑取菌落进行斜面培养,经传代试验观察各菌株情况。将经过多次传代培养均生长良好的菌株进行水质净化试验。具体步骤如下:挑取融合子斜面菌接种于10 mL光合细菌基础培养基中,在30℃、光照下培养2 d,然后以5%的接种量接种于养殖水中,在30℃、100 r/min条件下振荡培养1 d,取样测定养殖水中的氨氮、亚硝酸盐氮的含量。采用纳氏试剂比色法测定氨氮含量[18],采用N-(1-萘基)-乙二胺光度法测定亚硝酸盐氮的含量[19]。相关计算公式如下:
其中:ρ0、ρ1分别为接入菌种前后氨氮、亚硝酸盐氮浓度。
氨氮降解效能增长率=(融合子降解率-耐盐红螺菌降解率)/耐盐红螺菌降解率×100%。
1.2.6 融合子R1菌株的形态与生长特征
1)形态特征 将筛选的融合子R1菌株与两种亲株分别接种于固体培养基培养,然后进行染色镜检,观察其菌落特征的差异。
2)生长曲线 将融合子R1菌株与两种亲株分别接种于试管培养基中进行活化培养,然后以5%的接种量接种于三角瓶光合细菌培养基中培养,每隔一定时间取样用平板菌落计数法测定其细胞生物量,描绘其生长曲线。
2.1 两种亲株的生长曲线
微生物生理状态是原生质体化的重要影响因素[20]。大多数研究表明,处于对数生长期的细胞生长代谢旺盛,细胞壁对酶解作用最为敏感,由这些细胞分离原生质体其原生质体的形成率和再生率都较高[21]。由于对数期初期菌量较少,而对数期末期细胞对酶的作用变得不太敏感[22],为此,制备原生质体通常选择对数期中期的菌进行破壁。本研究中,对两种亲株的生长曲线进行测定,结果表明:假丝酵母菌生长周期约2 d,培养6 h进入对数期,约31 h到达对数期后期,其生长对数期中期为15~16 h;耐盐红螺菌的生长周期约为4 d,培养2 d到达对数期末期,对数生长期中期约为36 h(图1)。这说明制备假丝酵母菌的原生质体培养菌龄为15~16 h较为适宜;制备耐盐红螺菌原生质体的培养菌龄为36 h较为适宜。
2.2 两种亲株对制霉菌素和链霉素的抗性
融合子的筛选是原生质体融合能否取得成功的一个非常重要的环节,利用抗药性标记筛选融合子是常用的方法之一。微生物的抗药性是菌种的重要特性,是由遗传物质决定的,不同种的微生物对某一种药物的抗性存在差异,利用这种差异即可对融合子进行选择[17]。本研究中对两种亲株的抗性进行鉴定,耐盐红螺菌只在添加制霉菌素的培养基上生长,假丝酵母菌只在添加链霉素的培养基上生长,两种亲株在同时添加制霉菌素和链霉素的培养基上均不能生长(表3)。本试验结果表明,两种亲株对试验抗菌素的抗药性不同,筛选两种亲株的原生质体融合子可用添加两种抗生素的培养基作为初筛选择培养基。
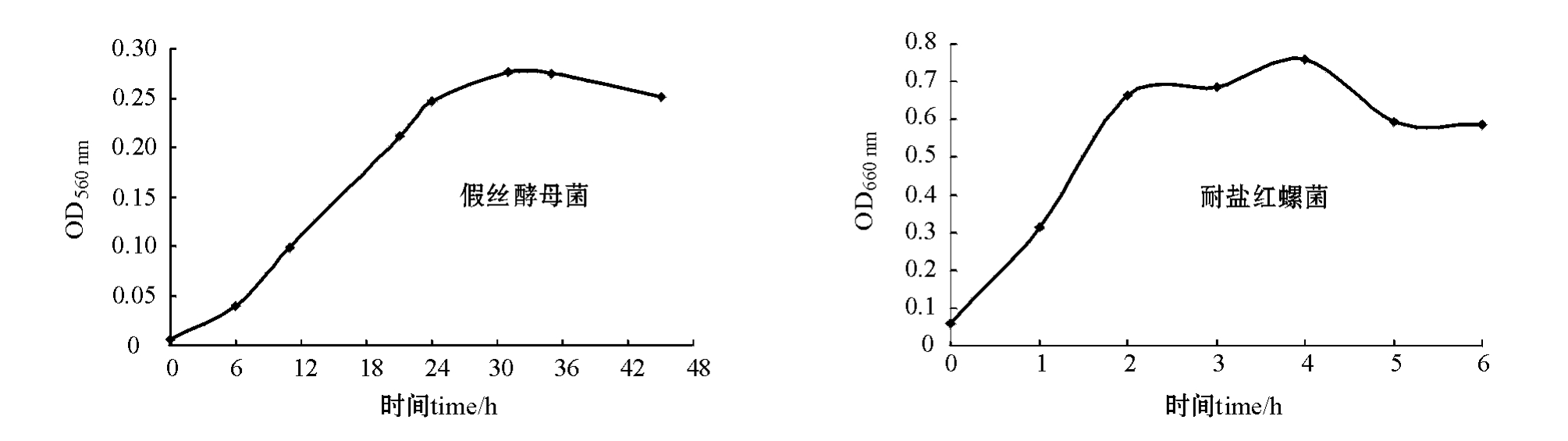
图1 假丝酵母菌和耐盐红螺菌的生长曲线
Fig.1 The growth curves of Candida sp.,and Rhodospeudomonas capsulata
表3 耐盐红螺菌与假丝酵母菌对抗菌素的抗药性
Tab.3 The resistance of the two bacterial strains to nystatin and streptomycin

注:“+”表示生长;“-”表示不生长。
菌株strains制霉菌素nystatin链霉素streptomycin制霉菌素+链霉素nystatin and streptomycin耐盐红螺菌Rhodospeudomonas capsulate + --假丝酵母菌Candida sp.-+-
2.3 两种亲株原生质体形成率与再生率的正交试验
2.3.1 耐盐红螺菌 耐盐红螺菌属于革兰氏阴性菌,其细胞壁成分和结构较复杂,仅利用溶菌酶处理得到的原生质体不利于融合。有研究表明,部分阳离子可明显抑制溶菌酶的活性,如基础培养基中含有的Mg2+[23]。通常选择加入EDTA处理以获得较好效果,因为EDTA作为螯合剂可避免金属离子对酶的抑制作用,因而提高了原生质体的形成率[23]。正交试验的极差分析结果表明(表4):影响耐盐红螺菌原生质体形成因素的主次顺序为反应时间>酶量>EDTA浓度,其最优组合为A1B3C2,即EDTA浓度为0.1 g/L、酶量为1.5 mg/mL、时间为45 min,采用该优化条件进行验证试验,其原生质体形成率为99.9%,再生率为8.7%;影响耐盐红螺菌原生质体再生的因素主次顺序为反应时间>酶量>EDTA浓度,其最优组合为A1B2C1,即EDTA浓度为0.1 g/L、酶量为1.0 mg/mL、反应时间为30 min,采用该优化条件进行验证试验,其原生质体的形成率为80.5%,再生率为15.2%。比较耐盐红螺菌原生质体制备与再生优化条件的验证结果,可以看出,在制备的优化条件下原生质体的形成率很高,而在再生的优化条件下原生质体的形成率较低。由于原生质体形成率的高低直接影响着细胞融合频率,因此,本试验中选择原生质体制备的优化条件进行后续研究。
表4 耐盐红螺菌L9(34)的正交试验及结果
Tab.4 Results of orthogonal test for Rhodospeudomonas capsulata L9(34)
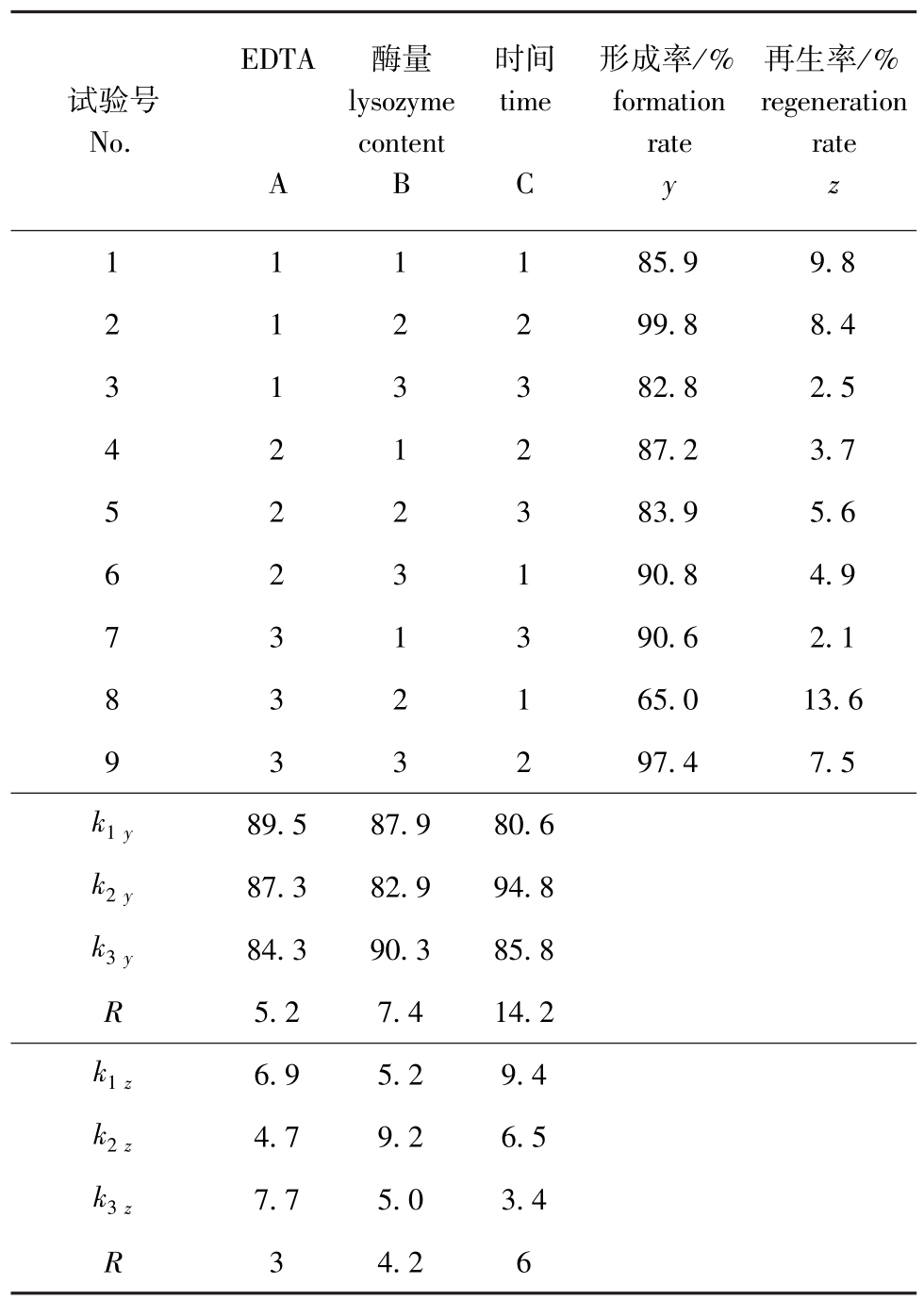
EDTA试验号No.再生率/% regeneration rate A酶量lysozyme content B时间time C形成率/% formation rate y z 1 11185.99.8 2 12299.88.4 3 13382.82.5 4 21287.23.7 5 22383.95.6 6 23190.84.9 7 31390.62.1 8 32165.013.6 9 33297.47.5 k1y89.587.980.6 k2y87.382.994.8 k3y84.390.385.8 R5.27.414.2 k1z6.95.29.4 k2z4.79.26.5 k3z7.75.03.4 R 34.26
2.3.2 假丝酵母菌 假丝酵母细胞壁是由内层的葡聚糖层和外层的甘露聚糖-蛋白质层构成,成分
和结构较为复杂。因此,除了添加蜗牛酶之外,还以EDTA和巯基乙醇作为前处理。研究表明,部分阳离子可明显抑制蜗牛酶的活性[24],如基础培养基中可能含有的Fe3+,因此加入EDTA作为螯合剂;而巯基乙醇能够还原外层蛋白质中的二硫键,增加外层壁的通透性,增强蜗牛酶的作用[25]。假丝酵母菌的原生质体制备与再生条件优化采用正交试验方法。正交试验结果表明(表5):影响假丝酵母菌原生质体形成因素的主次顺序为反应时间>巯基乙醇浓度>酶量>EDTA浓度,其最优组合为A1B1C1D1,即巯基乙醇的质量分数为0.1%、EDTA浓度为1 g/L、酶量为0.5 mg/mL、反应时间为30 min。采用该优化条件进行验证,其原生质体形成率为61.0%,再生率为36.1%;影响假丝酵母菌原生质体再生的因素主次顺序为巯基乙醇浓度>EDTA浓度>反应时间>酶量,其最优组合为A1B2C3D1,即巯基乙醇的质量分数为0.1%, EDTA浓度为2 g/L,酶量为1.5 mg/mL,反应时间为30 min。采用该优化条件进行验证,其原生质体形成率为52.3%,再生率为39.7%。比较假丝酵母菌的制备与再生优化条件,均可发现其形成率低于耐盐红螺菌,但其原生质体的再生率较高,假丝酵母菌原生质体的形成率与再生率受反应时间、EDTA、酶量和巯基乙醇浓度的影响较大。比较其制备和再生的优化条件验证结果,发现再生率相差不大,但在制备优化条件下形成率较高。为此,选择制备的优化条件进行后续研究。试验结果表明,两株亲株菌的原生质体制备与再生条件以及所获得的结果存在较大差异。这可能由于其细胞壁结构与组成存在的差异所致。
表5 假丝酵母菌L9(34)的正交试验及结果
Tab.5 Results of orthogonal test L9(34)for Candida sp.
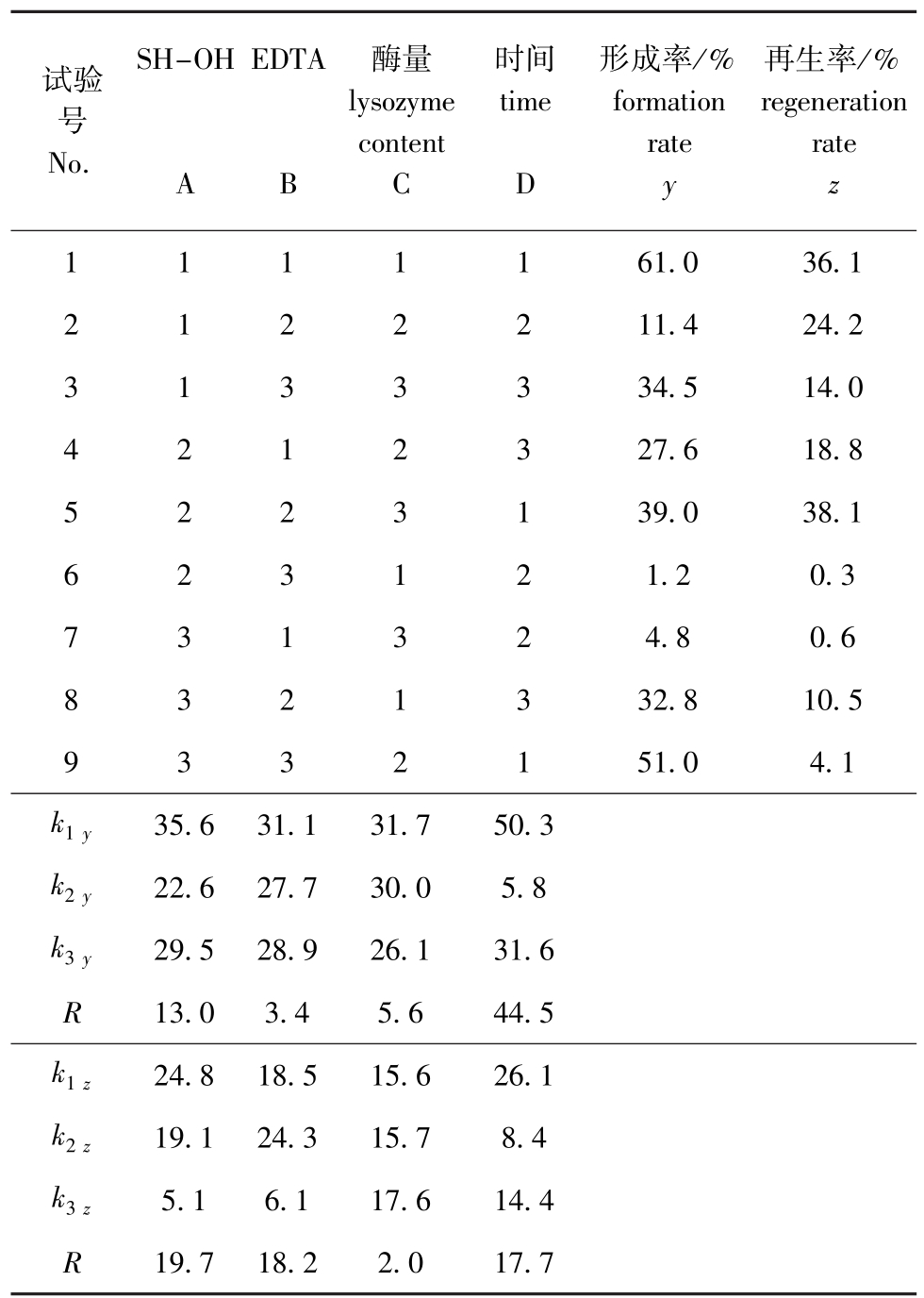
试验号No. SH-OHEDTA 再生率/% regeneration rate A B酶量lysozyme content C时间time D形成率/% formation rate y z 1111161.036.1 2122211.424.2 3133334.514.0 4212327.618.8 5223139.038.1 623121.20.3 731324.80.6 8321332.810.5 9332151.04.1 k1y35.631.131.750.3 k2y22.627.730.05.8 k3y29.528.926.131.6 R13.03.45.644.5 k1z24.818.515.626.1 k2z19.124.315.78.4 k3z5.16.117.614.4 R 19.718.22.017.7
2.4 融合子筛选
本试验中选用的耐盐红螺菌亲株只具有抗制霉菌素的特性,假丝酵母菌只具备抗链霉素的特性,但采用含链霉素和制霉菌素的培养基作为选择培养基挑选的融合子却具有双抗特性。双抗特性反映出双亲的抗性通过融合的渠道实现了统一,这可以作为其实现融合的有力证据。
将耐盐红螺菌与假丝酵母菌进行原生质体融合后,从选择培养基上共挑取了13个单菌落转接于斜面,培养后置于4℃下保存。将其在光合细菌基础培养基平板上划线培养,经过连续传代,观察各菌株生长的稳定性,最后选出6株生长良好的融合子接入养殖水体培养基,进行氨氮、亚硝酸盐氮降解效能复筛。从表6可见,融合子各菌株与耐盐红螺菌一样具有高效降解亚硝酸盐氮的效能,而氨氮降解效能较假丝酵母菌低,但与耐盐红螺菌亲株相比也有了较大幅度的提高。其中融合子R1菌株是降解效能较好的菌株,对水体中亚硝酸盐氮的降解率达98%,对氨氮的降解率达63%(较耐盐红螺菌提高54%)。
2.5 融合子R1菌株的形态特征与生长特性
2.5.1 形态特征 对融合子R1菌株与两种亲株的细胞形态和菌落进行观察,结果见表7。由表7可见,融合子R1的个体形态、菌落特征与耐盐红螺菌较为相似。
2.5.2 生长曲线 对融合子R1菌株与两种亲株在液体培养过程的细胞生物量进行测定,结果见图2。由图2可见:假丝酵母菌的生长特征与融合子R1及耐盐红螺菌差异较大,而融合子R1的生长周期与耐盐红螺菌较为相似,即培养12 h后进入对数生长期,培养48 h左右进入稳定期,且两种菌的细胞最大生物量也较为相似。
表6 融合子与两种亲株净化水质的效能比较
Tab.6 The degradation comparison of fusants with the bacterial strains
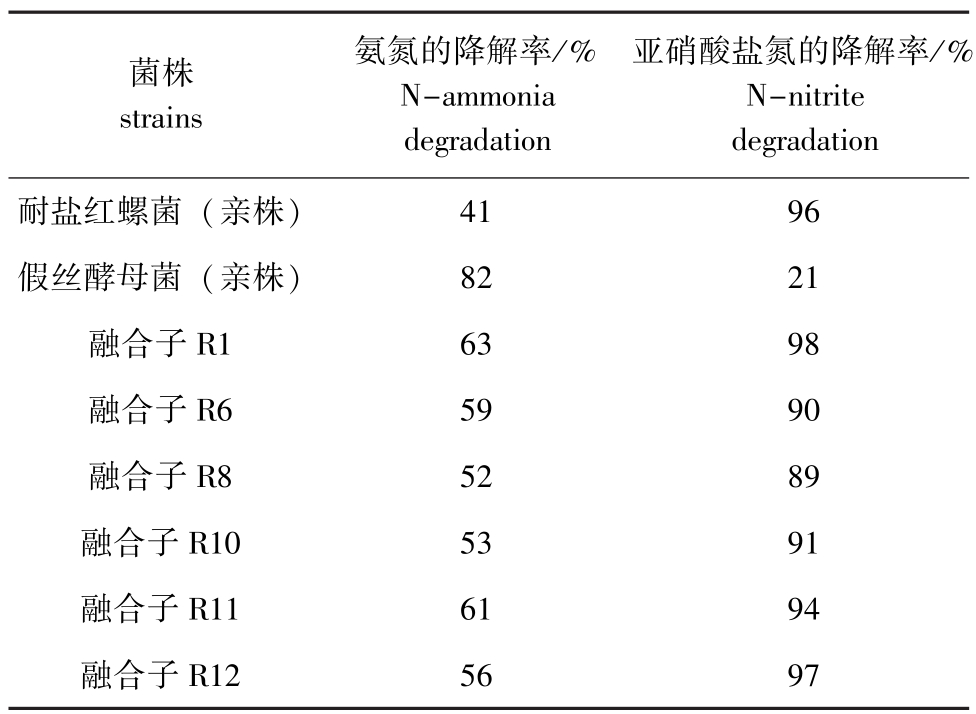
degradation耐盐红螺菌(亲株)菌株strains氨氮的降解率/% N-ammonia degradation亚硝酸盐氮的降解率/% N-nitrite 4196假丝酵母菌(亲株)8221融合子R16398融合子R65990融合子R85289融合子R105391融合子R116194融合子R125697
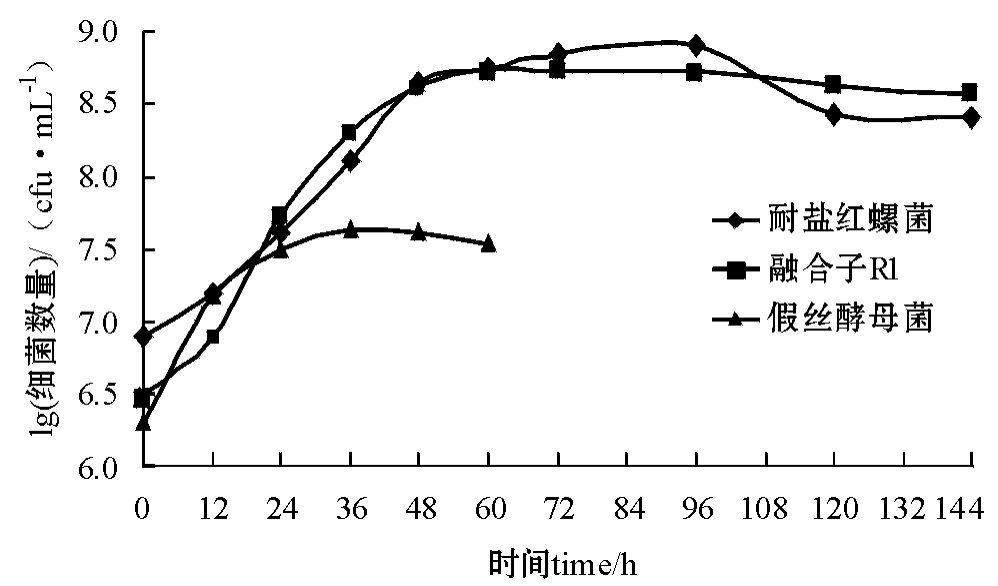
图2 融合子与两种亲株的生长曲线比较
Fig.2 The comparison of cultural curves between fusants and the two brood strains
表7 融合子与亲株的形态特征比较
Tab.7 The morphological comparison between fusants and the bacterial strains
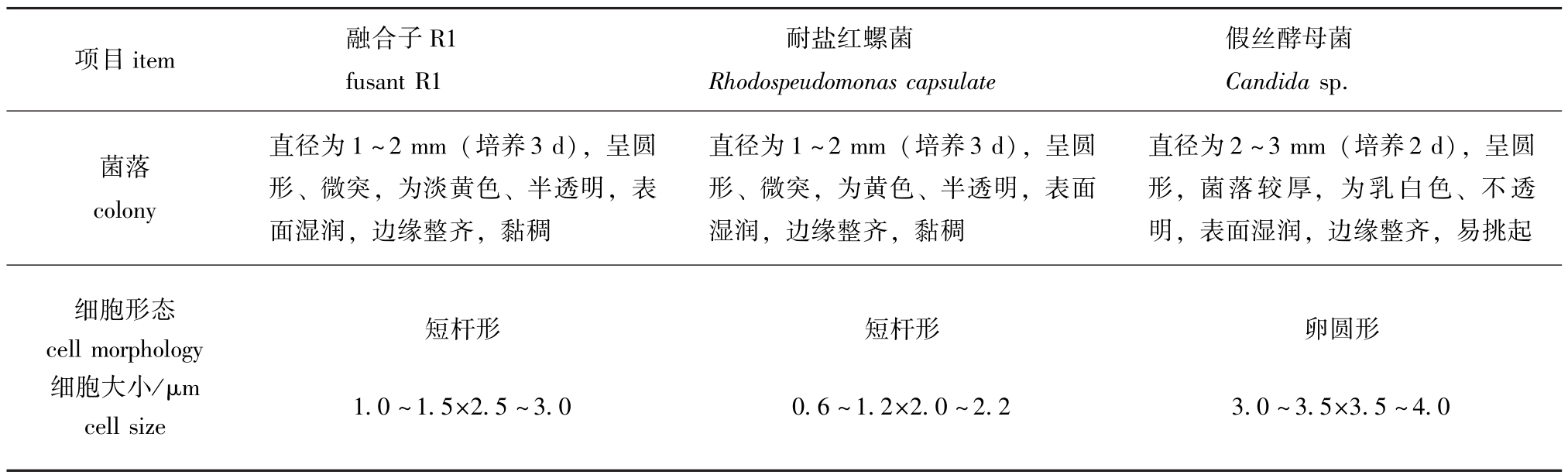
项目item 融合子R1 fusant R1耐盐红螺菌Rhodospeudomonas capsulate假丝酵母菌Candidasp.菌落colony细胞形态cell morphology细胞大小/μm cell size直径为1~2 mm(培养3 d),呈圆形、微突,为淡黄色、半透明,表面湿润,边缘整齐,黏稠短杆形1.0~1.5×2.5~3.0直径为1~2 mm(培养3 d),呈圆形、微突,为黄色、半透明,表面湿润,边缘整齐,黏稠短杆形0.6~1.2×2.0~2.2直径为2~3 mm(培养2 d),呈圆形,菌落较厚,为乳白色、不透明,表面湿润,边缘整齐,易挑起卵圆形3.0~3.5×3.5~4.0
1)氨氮和亚硝酸盐氮是水产养殖水体中化合态氮的两种存在形式,对水生动物均有较大的毒性[26]。本研究中以选育双重高效降解氨氮、亚硝酸盐氮的光合细菌为目标,利用实验室前期选育保存的高效净化养殖水体的功能菌(假丝酵母菌对氨氮的降解率达80%以上,耐盐红螺菌对亚硝酸盐氮的降解率达90%以上)为试验菌株,通过正交试验对两种亲株的原生质体制备与再生条件进行优化,并对结果进行验证。本试验结果表明,在优化条件下,耐盐红螺菌原生质体的形成率达99.9%,再生率为8.7%;假丝酵母菌原生质体的形成率为61.0%,再生率为36.1%。耐盐红螺菌在试验条件下其原生质体的形成率高于假丝酵母菌,但其再生率低于假丝酵母菌。这可能是由于两种菌株的亲缘关系较远,细胞壁结构与组成差异较大所致。
2)将两种亲株的原生质体在聚乙二醇(PEG -6000)和Ca2+的诱导下进行融合试验,通过选择培养基对融合子进行初筛,经过多次传代试验后,检测6株生长稳定的融合子对养殖水体中氨氮与亚硝酸盐氮的降解效能,并将筛选的优良菌株的形态和生长特性与原菌株进行了比较。结果表明,融合子R1菌株具有较好的降解效能,其降解亚硝酸盐氮的效能与耐盐红螺菌相同,达到90%以上,其降解氨氮效能达到60%以上,较耐盐红螺菌亲株提高了54%。融合子R1菌株细胞的形态大小、菌落特征与耐盐红螺菌均较为相似。
耐盐红螺菌可在盐度为1~40条件下生长,是淡水、海水中均可使用的光合细菌。本研究中通过将耐盐红螺菌与假丝酵母菌的原生质体进行融合,获得了对氨氮、亚硝酸盐氮降解效能较好的融合子菌种,从而为光合细菌更好地用于水产养殖中水质的净化奠定了基础。
参考文献:
[1] 付军,郝博,董元廖.几株光合细菌的分离鉴定及净水能力分析[J].湖北农业科学,2007,46(3):390-392.
[2] 王梦亮,马瑞清,罗生康.光合细菌对鲤鱼养殖水体生态系统的影响[J].水生生物学报,2001,25(1):98-101.
[3] 王玉堂.光合细菌及其在水产养殖业的应用[J].中国水产, 2009(4):49-51.
[4] 付保荣,曹向宇,冷阳,等.光合细菌对水产养殖水质和水生生物的影响[J].生态科学,2008,27(2):102-106.
[5] Bender J,Lee R,Sheppar M E A.A waste effluent treatment system based on microbial mats for black sea bass(Centropristis striata) recycled-water mariculture[J].Aquacultural Engineering,2004, 31:73-82.
[6] Hargreaves J A.Photosynthetic suspended-growth systems in aquaculture[J].Aquacultural Engineering,2006,34:344-363.
[7] 刘双江,孙燕,岑运华,等.采用光合细菌控制水体中亚硝酸盐的研究[J].环境科学,1996,16(6):21-23.
[8] 陈燕红,杨紫红,喻国辉,等.光照、氧气、pH和盐度对沼泽红假单胞菌2-8菌株生长和亚硝酸盐消除的影响[J].南方水产,2010,6(4):1-5.
[9] 施安辉,李桂杰,徐海燕,等.光合细菌菌种的分离、富集培养、纯化和菌种鉴定及净化水质研究[J].内陆水产,2002,27 (10):40-42.
[10] 张玲华,田兴山,周风珍.太空条件对荚膜红假单胞菌的生理指标及水质净化效果的影响[J].水产科学,2006,25(2):89-91.
[11] 张明磊,段登选,王志忠,等.光合细菌对重盐碱地养殖池塘水质的影响[J].海洋湖沼通报,2010(1):173-178.
[12] 霍乃蕊,韩克光.细胞融合技术的发展与应用[J].激光生物学报,2006,15(2):209-213.
[13] 毛雨,王丹,黄占斌,等.微生物原生质体融合育种技术及其应用[J].中国生物工程杂志,2010,30(1):93-97.
[14] 丁朋晓,杨季芳,谢和.原生质体融合技术及其在微生物遗传育种上的应用[J].贵州农业科学,2007,35(3):139-141.
[15] 邱宏端,石贤爱,郭养浩,等.耐盐和降高NH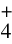 、NO
、NO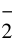 红螺菌科细菌的选育及应用[J].水产学报,1999,23(增刊):92-96.
红螺菌科细菌的选育及应用[J].水产学报,1999,23(增刊):92-96.
[16] 谢航,邱宏端,林娟,等.假丝酵母菌降解养殖水体氨氮的特性研究[J].农业工程学报,2005,8(8):142-145.
[17] 程树培.环境生物技术实验指南[M].南京:南京大学出版社,1995:42-45.
[18] 中华人民共和国国家标准.水质铵的测定纳氏试剂比色法GB7479-87[S].北京:中国标准出版社,1988.
[19] 中华人民共和国国家标准.大气降水中亚硝酸盐测定N-(1-萘基)-乙二胺光度法GB13580.7-92[S].北京:中国标准出版社,1993.
[20] 郑重谊,谢达平,谭周进,等.影响微生物原生质体融合技术的因素[J].湖南农业科学,2006(4):35-38.
[21] 王春平,韦强,鲍国连,等.微生物原生质体融合技术研究进展[J].动物医学进展,2008,29(5):64-67.
[22] 王鑫,车振明,黄韬睿.原生质体融合技术在微生物菌种选育中的应用[J].食品研究与开发,2008,29(10):174-176.
[23] 许红,徐奇友,刁新平.绿色添加剂溶菌酶及其应用[J].饲料工业,2005,26(2):10-14.
[24] 刘欣,杨凌,戴晓冬,等.蜗牛酶中一种β-葡萄糖苷酶的纯化及酶学性质的研究[J].中国微生态学杂志,2009,21(10):900 -915.
[25] 袁志明.巯基乙醇和蜗牛酶对酵母原生质体形成及蔗糖酶释放的影响[J].微生物学研究与应用,1992,44(2):4-8.
[26] 张平录.养殖水体中氮元素的转化与氨氮、亚硝酸盐的危害和防治[J].渔业致富指南,2006(11):45.
The improvement of N-ammonia degradation of photosynthetic bacteria by protoplast fusion
JI Dun-dun,QIU Hong-duan,XIE Hang
(College of Biological Science and Technology,Fuzhou University,Fuzhou 350108,China)
Abstract:A protoplast fusion was conducted between two efficient photosynthetic bacteria,N-ammonia degrading Candida sp.and N-nitrite degrading Rhodospeudomonas capsulate.The conditions of the protoplast formation and fusion were optimized,and the best fusant was selected.The better protoplast formation for Rhodospeudomonas capsulata was found under the conditions of:lysozyme at 1.5 mg/mL,EDTA 0.1 g/L and 45 min reaction time;for Candida sp.the better conditions of snail enzyme at 0.5 mg/mL,mercaptoethanol 0.1%,EDTA 1 g/L and 30 min reaction time.The fusion was induced by PEG 6000 and Ca2+.Fusants were screened out by selective media containing added nystatin and streptomycin.The fusant R1 with better efficient degradation was selected by growth stability and degradation.The fusant R1 showed N-nitrite degradation at a rate of more than 90%,as good as for Rhodospeudomonas capsulata,but had N-ammonia degradation of only 63%,increased by 54%.
Key words:Rhodospeudomonas capsulata;Candida sp.;N-ammonia degradation;protoplast fusion
中图分类号:Q939.99
文献标志码:A
文章编号:2095-1388(2011)05-0407-07
收稿日期:2010-12-27
作者简介:纪敦敦(1986-),女,硕士研究生。E-mail:125494956@qq.com
通信作者:邱宏端(1955-),女,教授。E-mail:hongduanlq@163.com