饲料脂肪水平对锦鲤体色和几项免疫指标的影响
孙向军1,罗琳1,姜志强2,孙砚胜1,史东杰1,梁拥军1
(1.北京市水产科学研究所,北京100068;2.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
摘要:研究了在螺旋藻添加的质量分数为12%时,饲料脂肪水平(5.36%、7.74%、10.52%、12.85%和15.45%均为质量分数)对红白锦鲤Ornmmental carp幼鱼(初始体质量为5.85 g±0.19 g)体色和免疫指标的影响。每组设3个重复,每个重复组饲养10尾锦鲤,表观饱食投喂60 d。结果表明:当饲料中脂肪水平为10.52%时,试验鱼皮肤中类胡萝卜素含量显著高于其它试验组(P<0.05),体表红质的a*值最高;试验鱼肝胰脏中超氧化物歧化酶、过氧化氢酶的活力随脂肪水平的升高而下降,饲料脂肪水平对碱性磷酸酶、乳酸脱氢酶等免疫指标没有产生显著影响(P>0.05)。上述研究说明,在配合饲料中添加一定量的螺旋藻时,锦鲤着色效果最好时的适宜饲料脂肪水平为10.52%,提高饲料脂肪水平不会持续提高锦鲤对螺旋藻的利用效率。
关键词:锦鲤;脂肪水平;体色;免疫
锦鲤Ornmmental carp的色质是决定其经济价值的关键因素。研究发现,影响鱼体着色最重要的因素是类胡萝卜素[1],而水产动物自身无法合成类胡萝卜素,只能从饲料中获取[2]。
螺旋藻Spirulina被广泛用于水产动物的饲料中或作为饲料添加剂[3-4]。螺旋藻含有丰富的蛋白质、氨基酸、多糖、维生素和微量元素[5-6],具有促进动物机体生长、提高免疫力的功能[7-8]。螺旋藻还富含类胡萝卜素(包括β-胡萝卜素、玉米黄素、海胆烯酮等),而锦鲤等大多数淡水鱼可将玉米黄质转变成虾青素(astaxanthin),贮存于体内用于着色,同时,其富含的β-胡萝卜素还能提高鱼体的着色效果。所以,在饲料中添加螺旋藻能有效改善鱼类的体色[3]。此外,螺旋藻中还含有鱼体本身所需的代谢酶,可以提高鱼类对饵料的利用率,改善其肉质[9]。
类胡萝卜素是脂溶性色素,在动物体内必须以脂类为载体进行运输和吸收利用。因此,饲料中脂类的含量会影响色素物质在鱼体组织和细胞中的沉积量。已有学者报道,饲料脂肪水平会影响虹鳟对类胡萝卜素的吸收利用率,从而影响其体色[10-11]。本试验中,作者在螺旋藻添加量一定的情况下,研究了不同脂肪水平饲料对锦鲤体色、生长以及免疫力的影响,旨在为确定锦鲤饲料中脂肪的适宜添加量提供参考资料。
1 材料与方法
1.1 材料
试验用锦鲤初始体质量为(5.85±0.19)g,由北京市水产科学研究所小汤山良种繁育中心提供。运回实验室后先暂养驯化2周,期间投喂基础饲料,待其适应实验室环境后开始正式试验。
1.2 方法
1.2.1 试验设计 试验共分6组,分别记为ZL1、ZL2、ZL3、ZL4、ZL5和对照组,每组设3个平行。试验在200 L的蓝色水槽中进行,每槽放鱼10尾,每日投喂2次(7:00,16:00),采用表观饱食投喂。每日换水1次,换水量为总水量的1/3,换水时吸底并收集粪便。试验用水为曝气24 h以上的自来水,水温为15~25℃,24 h充气。试验周期为60 d。
1.2.2 饲料的制作及饲料成分的测定 各试验组饲料的配方、营养组成及类胡萝卜素含量见表1。饲料原料经混合后用制粒机挤压成硬颗粒饲料,每
组饲料制成两种规格,直径分别为1.8、2.5 mm,在烘箱中(40℃)烘干2 h,至饲料水分含量为8%~9%。保存于冰箱(-20℃)中。混合维生素与混合矿物质均购于北京桑普有限责任公司,螺旋藻为金海岸水产养殖技术研发室产品。采用GB/T6435-1986中的方法测定饲料中的水分含量,采用GB/T6432-1994中的方法测定粗蛋白含量,采用GB/T6433-1994中的方法测定粗脂肪含量,采用GB/T6438-1992中的方法测定粗灰分含量。
表1 试验饲料配方和组成(干重)
Tab.1 Ingredients and approximate composition of the experimental diets(dry)
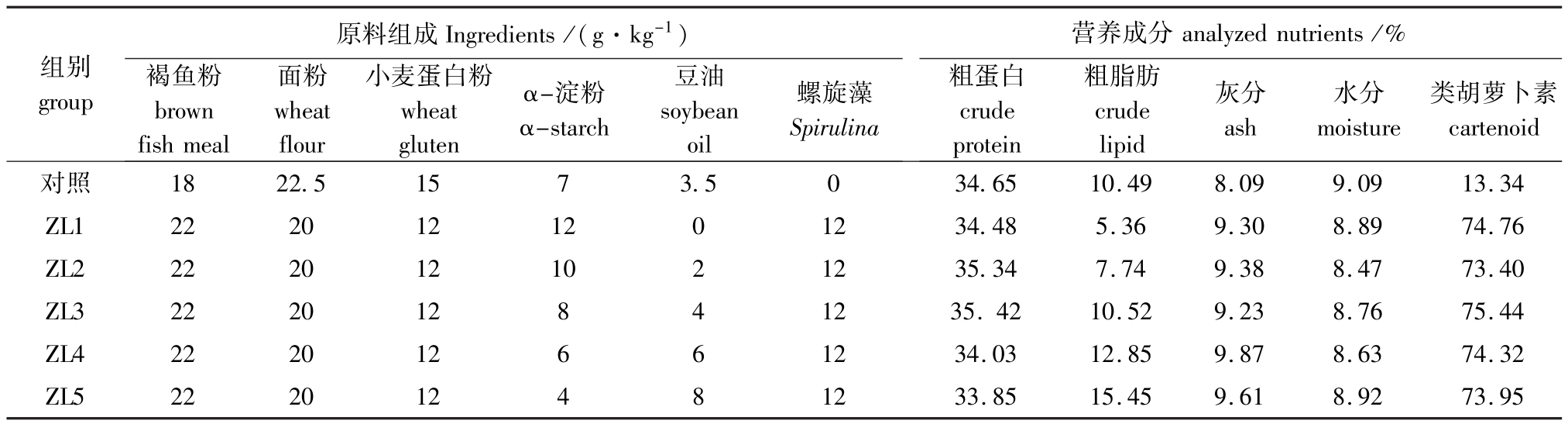
注:1)饲料中(g/kg)还包括玉米蛋白粉7、小麦麸8、豆粕15、混合维生素2、混合矿物质2;2)混合维生素(mg/kg)包括维生素E 4 100、维生素K3330、维生素B1830、维生素B21 600、维生素B6830、维生素A 25万IU/kg、维生素D38.3万IU/kg、胆碱42 000、烟酸2 000、泛酸2 000、叶酸80、肌醇8300、高稳定VC 6 600;3)混合矿物质(mg/kg)包括镁13 000、铁25 000、锰2 500、锌8 000、铜290、碘50、硒40。
Notes:1)the other dietary ingredients include(%):Corn gluten 7,wheat bran 8,Soybean meal 15,Vitamin mixture 2,Mineral mixture 2;2)Vitamin mixture(mg/kg):Vitamin E 4 100,Menadione(K3)330,Thiamine-nitrate 830,Riboflavin 1 600,Pyridoxine-HCl 830,Vitamin A 250 000 IU/kg,Vitamin D383 000 IU/kg,Choline chloride 42 000,Niacine(Nicotic acid)2 000,Panthothenate 2 000,Folic acid 80,Inositol 8 300,High stable vitamin C;3) Mineral mixture(mg/kg):Mg 13 000,Fe 25 000,Mn 2 500,Zn 8 000,Cu 290,I 50,Se 40.
原料组成Ingredients/(g·kg-1)营养成分analyzed nutrients/%组别group褐鱼粉brown fish meal面粉wheat flour小麦蛋白粉wheat gluten α-淀粉α-starch豆油soybean oil螺旋藻类胡萝卜素Spirulina粗蛋白crude protein粗脂肪crude lipid灰分ash水分moisture cartenoid 22.5 20 20 20 20 20对照ZL1 ZL2 ZL3 ZL4 ZL5 15 12 12 12 12 12 18 22 22 22 22 22 73.50 12 10 13.34 74.76 73.40 75.44 74.32 73.95 864 02468 12 12 12 12 12 34.65 34.48 35.34 35.42 34.03 33.85 10.49 5.36 7.74 10.52 12.85 15.45 8.09 9.30 9.38 9.23 9.87 9.61 9.09 8.89 8.47 8.76 8.63 8.92
1.2.3 鱼体色素的提取和测定
1)锦鲤体表红质L*、a*、b*值的测定Robinson[12]以L*(明度)、a*(a*代表偏红,-a*代表偏绿)、b*的值(b*代表偏黄,-b*代表偏蓝)来代表颜色的状态。本试验中采用测色色差计(GEB-104 Pantone Color-Cue)测定各组试验鱼体表的L*、a*、b*值并进行统计分析,以检验饲料脂肪水平对其体色的影响。测定各组中每尾试验鱼体表L*、a*、b*值时,先用吸水纸将鱼体表面的水分吸干,再将色差计的探头紧贴于试验鱼体表红斑处,并记录结果[13]。
2)总类胡萝卜素含量的测定 参考陈晓明等[14]的方法并略作修改。用电子分析天平(Sartorius BS210,德国)准确称取鲜样样品0.1 g,剪碎后,用丙酮定容至5 mL,放入超声波清洗机中在低温下用超声波震荡40 min后取出,以4 000 r/min离心10 min,放入冰箱(4℃)中静置24 h。将所得的鱼皮、血清、肝胰脏的色素萃取液分别置于1 cm具盖的比色皿中,以丙酮为空白对照管,用紫外-可见分光光度计(754型,上海光谱仪器有限公司生产)在200~800 nm下进行扫描,找出最大吸收峰所处的波长,在该波长下测定各组色素萃取液的吸光度值。
式中:A为吸光度值;K为常数(104);V为提取液体积(mL);E为摩尔消光系数(2 500);G为样品质量(g)。
1.2.4 免疫指标的测定 饲养试验结束后,每槽随机取鱼3尾,于尾静脉处取血,4℃下以4 000 r/min离心10 min收集血清,用于测定血清中的溶菌酶活力。解剖鱼体,取其肠和肝胰脏,剪碎,按质量体积比为1∶9加入预冷纯水,匀浆,制成10%匀浆液,以5 000 r/min在4℃下离心10 min,取上清液用于测定碱性磷酸酶(AKP)、过氧化氢酶(CAT)。再用去离子水将上清液稀释10倍制成1%的匀浆液,用于测定考马斯亮蓝蛋白、乳酸脱氢酶(LDH)、超氧化物歧化酶(SOD)。按照南京建成科技有限公司生产的试剂盒方法测定AKP、LDH、SOD,CAT活力(754型紫外分光光度计)和血清溶菌酶(LZM)的活力(酶标仪),用蛋白质测定试剂盒(考马斯亮兰法)测定组织匀浆中的蛋白质含量。
1.3 数据处理
所有数据采用Excel软件处理,以平均值±标准差(Mean±S.D.)表示。采用SPSS 16.0进行相
关性检验,用单因素方差分析作显著性检验,用Duncan法进一步做组间多重比较。
2 结果
2.1 饲料脂肪水平对锦鲤体色的影响
2.1.1 饲料脂肪水平对锦鲤体表红质L*、a*、b*值的影响 由表2可知,各试验组间锦鲤体表红质a*值间虽然没有显著差异(P>0.05),但随脂肪添加比例的升高,a*值呈现先升高再降低的趋势,且ZL3组值最大。
饲料中脂肪添加比例对试验鱼体表红质的L*值也没有显著影响(P>0.05);而脂肪水平对试验鱼体表红质的b*值有一定影响,即随脂肪添加比例的升高先下降再升高,且当脂肪添加比例为10.52%(ZL3组)时,试验鱼b*值显著低于ZL2、ZL4、ZL5组(P<0.05)。
表2 饲料脂肪水平对锦鲤体表L*、a*、b*值的影响
Tab.2 Influence of dietary lipid levels on values of L*、a*、b*in ornamental carp body surface
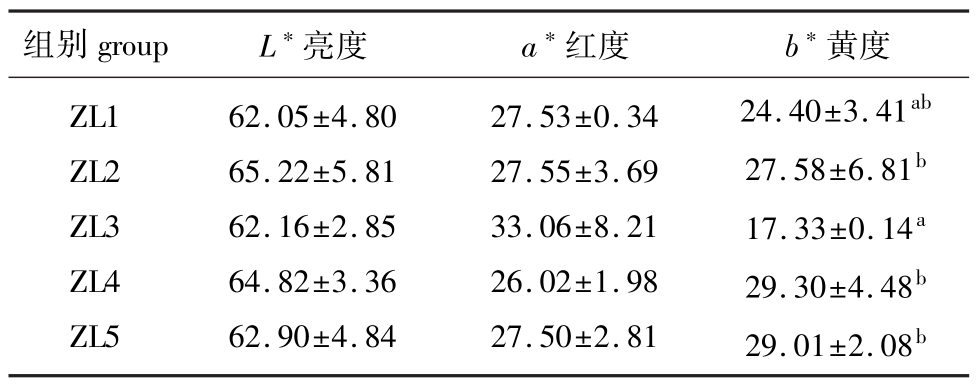
注:同列中标有不同小写字母者表示组间差异显著(P<0.05),标有相同小写字母者表示组间差异不显著(P>0.05),下同。
Note:The means with the different letters within the same column are significant differences at the 0.05 probability level,and the means with the same letters within the same column are not significant differences,et sequentia.
组别groupL*亮度a*红度b*黄度ZL1 ZL2 ZL3 ZL4 ZL5 62.05±4.80 65.22±5.81 62.16±2.85 64.82±3.36 62.90±4.84 27.53±0.34 27.55±3.69 33.06±8.21 26.02±1.98 27.50±2.81 24.40±3.41ab27.58±6.81b17.33±0.14a29.30±4.48b29.01±2.08b
2.1.2 饲料脂肪水平对锦鲤各组织中类胡萝卜素含量的影响 从表3可见:饲料脂肪水平对锦鲤皮肤中类胡萝卜素含量有一定的影响,即随着脂肪添加比例的升高,类胡萝卜素含量先升高再下降,当脂肪添加比例为10.52%(ZL3组)时,皮肤中类胡萝卜素含量达到最大,并且显著高于其它试验组(P<0.05);而饲料脂肪水平对锦鲤肝胰脏、血清中的类胡萝卜素含量没有显著影响(P>0.05)。锦鲤皮肤中的类胡萝卜素含量较肝胰脏、血清中的含量高得多。
表3 饲料脂肪水平对锦鲤皮肤、肝胰脏和血清中类胡萝卜素含量的影响
Tab.3 Influence of dietary lipid levels on total cartenoids contents in skin,hepatopancreas and serum of the ornamental carpmg/kg
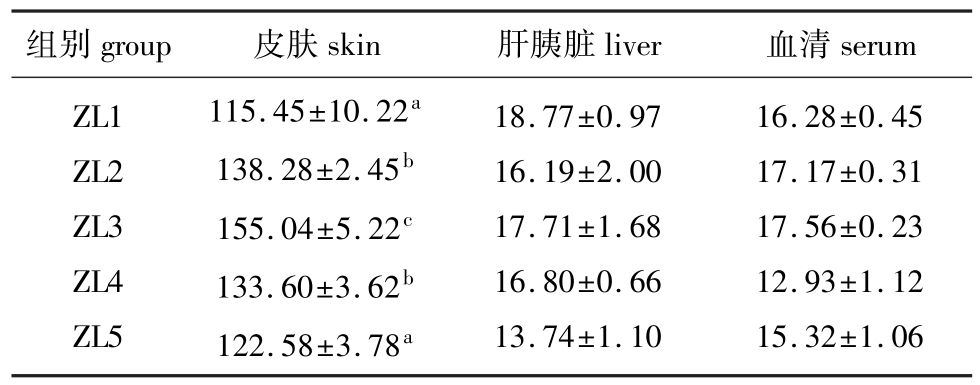
组别group皮肤skin肝胰脏liver血清serum ZL1 ZL2 ZL3 ZL4 ZL5 115.45±10.22a138.28±2.45b155.04±5.22c133.60±3.62b122.58±3.78a18.77±0.97 16.19±2.00 17.71±1.68 16.80±0.66 13.74±1.10 16.28±0.45 17.17±0.31 17.56±0.23 12.93±1.12 15.32±1.06
2.2 饲料脂肪水平对锦鲤免疫指标的影响
从表4可见:饲料脂肪水平的变化对AKP、LDH、CAT、LZM活力没有显著影响(P>0.05);但各试验组锦鲤血清中SOD活力却随着脂肪添加比例的升高而递减,ZL5组(脂肪添加比例为15.45%)SOD活力显著低于ZL1组(P<0.05),其余组间差异不显著(P>0.05)。
表4 饲料脂肪水平对锦鲤各项免疫指标的影响
Tab.4 Effects of dietary lipid levels on the immune parameters in the ornamental carp
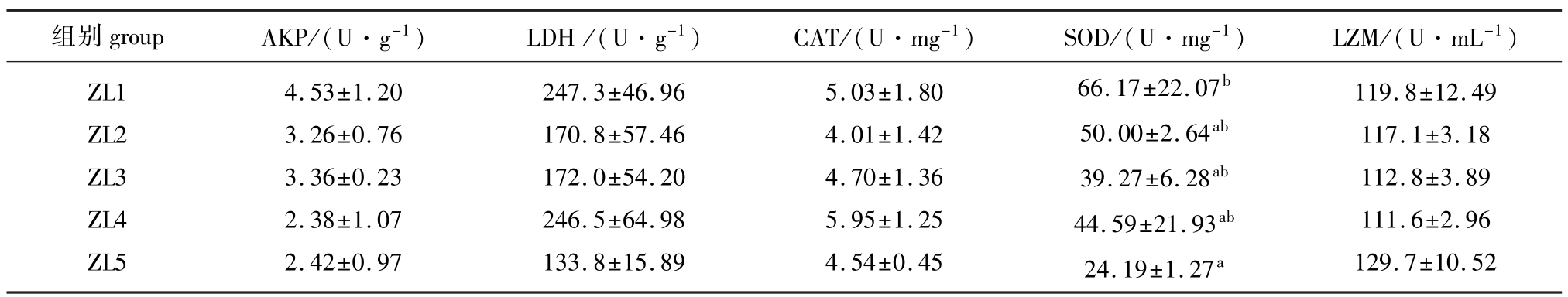
组别groupAKP/(U·g-1)LDH/(U·g-1)CAT/(U·mg-1)SOD/(U·mg-1)LZM/(U·mL-1) ZL1 ZL2 ZL3 ZL4 ZL5 4.53±1.20 3.26±0.76 3.36±0.23 2.38±1.07 2.42±0.97 247.3±46.96 170.8±57.46 172.0±54.20 246.5±64.98 133.8±15.89 5.03±1.80 4.01±1.42 4.70±1.36 5.95±1.25 4.54±0.45 66.17±22.07b50.00±2.64ab39.27±6.28ab44.59±21.93ab24.19±1.27a119.8±12.49 117.1±3.18 112.8±3.89 111.6±2.96 129.7±10.52
3 讨论
3.1 饲料脂肪水平与锦鲤体色的关系
螺旋藻中富含玉米黄质和β-胡萝卜素,而锦鲤等大部分淡水鱼可将黄体素、玉米黄质转变为虾青素[1],且β-胡萝卜素能提高发色效果,故螺旋藻能使鱼体增色。何培民[15]的试验表明,在配合饲料中添加富含β-胡萝卜素的螺旋藻粉,随着其含量的添加,锦鲤的体色变得更加艳丽。Okada等[16]用添加质量分数为5%和10%的螺旋藻粉的饲料喂养黄带鲹Caranx delicatissimus 83 d后,投喂含螺旋藻粉的试验鱼皮肤色素含量显著高于投喂沙丁鱼的对照组,且外观明亮带绿,黄带鲜明,体色
有明显改善。
在用测色色差计测定的指标中,a*值越大,说明红色斑块越红;L*值越大,说明亮度越高,颜色越鲜亮。本试验结果表明:锦鲤体表红质a*值随脂肪添加比例的升高呈现出先升高再降低的趋势,当脂肪添加比例为10.52%(ZL3组)时,锦鲤体表红质的红度即a*值最高(P<0.05)。
本试验中发现:随着饲料中脂肪添加比例的升高,锦鲤皮肤中类胡萝卜素的含量呈现出与a*值相同的变化趋势,脂肪添加比例为5.36%~10.52%时,皮肤中类胡萝卜素含量呈现递增趋势,说明脂肪对鱼体成色具有一定的促进作用。Nickell等[17]用含不同脂肪水平的饲料饲喂虹鳟时,结果与本试验相类似。研究表明:随着脂肪添加比例的升高,虾青素的着色程度和着色效率均有所升高。如Storebakken等[18]的研究表明,血清中虾青素含量的高低直接反映出鱼类对虾青素的吸收利用程度;Barbosa等[19]的试验结果也表明,饲喂含较高脂肪含量的虾青素饲料后,虹鳟血清中虾青素的浓度较高。
韩学哲[20]研究发现,当油脂添加的质量分数为0~20%时,虾青素对红剑尾鱼的着色效果先增加后降低,其中油脂添加量为20%时着色效果最差。Bjarne等[21]在对北极红点鲑Salvelinus alpinus的试验中发现,皮肤和肌肉中类胡萝卜素的含量随着试验时间的增长而升高,但虾青素的添加量只在试验初期对类胡萝卜素的积累影响显著。鱼类的体色并非始终随饲料中色素添加量的增加而加深,如果色素添加量超过一定限度,鱼体中沉淀的色素量会随其饲料中色素添加量的增加而下降。本试验中也出现过类似的情况,即当脂肪添加比例超过10.52%时,锦鲤皮肤中类胡萝卜素含量显著下降(P<0.05),说明脂肪对鱼体成色的促进作用并不是随脂肪添加比例的升高而无限增强。其原因可能是,鱼体沉积色素的能力具有一定限度,当饲料脂肪添加比例为10.52%时,鱼体沉积的色素量已经饱和,超过这个饱和度会导致一部分色素不能沉积在鱼体内,而是随着代谢将一部分色素排出体外,进而鱼体内色素含量下降。
Hardy等[22]的研究表明,鱼类通过消化系统吸收类胡萝卜素后,主要沉积于皮肤、肌肉、肝脏和肾脏中,在吸收代谢过程中,胆汁和血浆作用显著。March等[23]研究发现,在饵料中添加40、70、100 mg/kg虾青素时,虹鳟Oncorhynchus mykiss和大西洋鲑Salmo salar体末端着色最深,前端渐浅;而大鳞大马哈鱼O.tschawytscha中部着色最深,其次是前端和尾部。Metusalach等[24]用含65 mg/kg角黄素的饵料饲喂体质量为150 g的北极红点鲑Salvelinus alpinus幼鲑,24周后沉积类胡萝卜素的主要组织为肌肉,其次是皮肤、肝胰脏和性腺。本试验中,随着脂肪添加比例的升高,试验鱼肝胰脏、血清中的色素含量均呈现先升高再降低的趋势,但各试验组之间差异不显著(P>0.05)。与此同时,相对于皮肤来讲,肝胰脏、血清中的色素含量要少得多。由此推测,皮肤是锦鲤色素沉积的主要部位。这与张晓红等[25]用虾青素饲料饲喂血鹦鹉得出的结论相一致。
3.2 饲料脂肪水平对锦鲤免疫指标的影响
螺旋藻含有丰富的蛋白质、脂肪、维生素、矿物质、叶绿素、β-胡萝卜素及多糖类物质,多糖中的藻多糖和藻蓝蛋白均能增强骨髓细胞的增殖活力,促进胸腺、脾脏等免疫器官的生长和促进血清蛋白的生物合成,因此螺旋藻具有增强机体免疫力的作用[9]。机体内关键性的抗氧化酶主要包括超氧化物歧化酶、过氧化氢酶和谷胱甘肽过氧化物酶(GPx)等。其中SOD可催化O 生成H2O2,从而清除O
生成H2O2,从而清除O ,而CAT能催化H2O2生成水和氧气,因此,SOD和CAT可作为机体非特异性免疫指标,来评判免疫刺激剂对机体非特异性免疫力的影响。本研究结果表明,在饲料中添加螺旋藻后,试验鱼肝胰脏中的SOD活性降低。其原因可能是螺旋藻在试验鱼机体内也能很好地发挥抗氧化作用,使自由基在尚未发挥作用前就被清除了,导致诱导性酶活性降低,从而维持动物体自身自由基的产生和清除的动态平衡。本试验中,饲料脂肪水平的变化没有对试验鱼碱性磷酸酶、乳酸脱氢酶、过氧化氢酶、血清溶菌酶活力产生显著影响(P>0.05)。
,而CAT能催化H2O2生成水和氧气,因此,SOD和CAT可作为机体非特异性免疫指标,来评判免疫刺激剂对机体非特异性免疫力的影响。本研究结果表明,在饲料中添加螺旋藻后,试验鱼肝胰脏中的SOD活性降低。其原因可能是螺旋藻在试验鱼机体内也能很好地发挥抗氧化作用,使自由基在尚未发挥作用前就被清除了,导致诱导性酶活性降低,从而维持动物体自身自由基的产生和清除的动态平衡。本试验中,饲料脂肪水平的变化没有对试验鱼碱性磷酸酶、乳酸脱氢酶、过氧化氢酶、血清溶菌酶活力产生显著影响(P>0.05)。
参考文献:
[1] 冷向军,李小勤.水产动物着色的研究进展[J].水产学报, 2006,30(1):138-143.
[2] Goodwin T W.The Biochemistry of the caroteoids[M].London: Chapman and Hall,1985:64-69.
[3] 神尾尋司.メキシコに於けるスピルリナの養殖[J].養殖, 1982(6):85-91.
[4] 吴琴瑟.螺旋藻在水产养殖中的应用[J].湛江水产学院学报, 1994,14(2):76-80.
[5] Johnson P,Shubert E.Availability of iron to rats from Spirulina a blue-green alga[J].Nutrition Research,1986,6(1):85-94.
[6] 沈子伟,陈小江,郭建林.螺旋藻在水产养殖中的应用[J].水产养殖,2007(3):43-45.
[7] 黄维政,黄峙,郑文杰,等.硒螺旋藻增强小鼠免疫功能的实验研究[J].中华实用中西医杂志,2006,19(3):337-339.
[8] 丁晶晶,金安娜,施丽丽,等.螺旋藻对慢性肝损伤小鼠肝组织抗氧化能力的影响[J].湖泊科学,2004,16(4):343-348.
[9] 王文博,高俊莲,孙建光,等.螺旋藻的营养保健价值及其在预防医学中的作用[J].中国食物与营养,2009(1):48-51.
[10] Torrissen O J,Wardy R W,Shearer,et al.Effects of dietary canthaxanthin level and lipid level on apparent digestibility coefficients for canthaxanthin in rainbow trout(Oncorhynchus mykiss)[J].Aquaculture,1990,88(3/4):351-362.
[11] Torrissen O J.Pigmentation of salmonids:factors affecting carotenoid deposition in rainbow trout(Salmo gairdneri)[J].Aquaculture,1985,46(2):133-142.
[12] Agatsuma Y.Aquaculture of the sea urchin(Strongylocentrotus nudus)transplanted from coralline flats in Hokkaido,Japan[J].J Shellfish Res,1998,17(1/4):1541-1547.
[13] 陈林,符秋娟.四种食用色素对金鱼体色的影响[J].上海水产大学学报,2005,16(1):80-82.
[14] 陈晓明,徐学明,金征宇.富含虾青素的法夫酵母对金鱼体色的影响[J].中国水产科学,2004,11(1):70-73.
[15] 何培民.螺旋藻对锦鲤生长和体色的影响[J].水产学报, 1999,23(2):162-168.
[16] Okada S,Liao W,Mori T,et al.Pigmentation of cultured striped jack reared on diets supplemented with the blue-green alga Spirulina maxima[J].Nippon Suisan Gakkaishi,1991,57(7):1403-1406.
[17] Nickell D C,Bromage N R.The effect of dietary lipid level on variation of flesh pigmentation in rainbow trout(Oncorhynchus mykiss)[J].Aquaculture,1998,161(1/4):237-251.
[18] Storebakken T,GoswamiU C.Plasma carotenoid concentration indicates the availability of dietary astaxanthin for Atlantic salmon, Salmo salar[J].Aquaculture,1996,146(1/2):147-153.
[19] Barbosa M J,Morais R,Choubert G.Effect of carotenoid source and dietary lipid content on blood astaxanthin in rainbow trout(Oncorhynchus mykiss)[J].Aquaculture,1999,176(3/4):331-341.
[20] 韩学哲.饲料中不同添加物对观赏鱼体色的影响[D].石家庄:河北大学,2001.
[21] Bjarne H,Grete H,Even H,et al.Pigmentation of 1,2 and 3 year old Arctic charr(Salvelinus alpinus)fed two different dietary astaxanthin concentrations[J].Aquaculture,1995,138(1/4):303-312.
[22] Hardy R,Torrissen O,Scott T.Absorption and distribution of14C -labeled canthaxanthin in rainbow trout(Oncorhynchus mykiss) [J].Aquaculture,1990,87(3/4):331-340.
[23] March B,Macmillan C.Muscle pigmentation and plasma concentrations of astaxanthin in rainbow trout,Chinook salmon,and Atlantic salmon in response to different dietary levels of astaxanthin [J].Progressive Fish-Culturist,1996,58(3):178-186.
[24] Metusalach,Synowiecki J,Brown J,et al.Deposition and metabolism of dietary canthaxanthin in different organs of Arctic charr (Salvelinus alpinus L.)[J].Aquaculture,1996,142(1):99-106.
[25] 张晓红,吴锐全,王海英,等.虾青素和螺旋藻对血鹦鹉体色的影响[J].大连水产学院学报,2009,24(1):80-82.
Effects of dietary lipid levels on body pigmentation and immune indicators in Koi carp Cyprinus carpio
SUN Xiang-jun1,LUO Lin1,JIANG Zhi-qiang2,SUN Yan-sheng1,SHI Dong-jie1,LIANG Yong-jun1
(1.Beijing Fisheries Institute,Beijing 100068,China;432.Key Laboratory of North Mariculture,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China)
Abstract:A feeding trial with triplication was conducted to investigate the effects of dietary lipid levels on body pigmentation and immune indicators in koi carp Cyprinus carpio.The koi carp with initial body weight of(5.85±0. 19)g were fed five diets containing 12%Spirulina and different lipid levels(5.36%,7.74%,10.52%,12.85%, and 15.45%)to apparent satiation at 15-25℃for 60 days.The results showed that there was significantly higher concentration of carotenoid in the skin of the fish fed the diet containing 10.52%lipid(with the maximal value) than that in the fish fed the other experimental diets(P<0.05).The superoxide dismutase(SOD)and catalase (CAT)activities were found to be decreased with the increase in dietary lipid levels.No significant differences in alkaline phosphatase(AKP),and lactate dehydrogenase(LDH)activities were observed in the fish fed different diets(P>0.05).It was concluded that the diet containing 10.52%lipid level showed improvement of body color in the koi carp fed the diet containing equivalent Spirulina.
Key words:koi carp;lipid level;body color;immune
中图分类号:S963.8
文献标志码:A
文章编号:2095-1388(2011)05-0397-05
收稿日期:2010-12-30
基金项目:北京市重大科技计划项目(D09060500430901);观赏鱼产业技术体系北京市创新团队建设项目;北京市农林科学院所级优秀科技创新团队资金资助项目
作者简介:孙向军(1968-),男,硕士研究生,高级工程师。E-mail:sunxiangjun3875@hotmail.com
通信作者:梁拥军(1969-),男,硕士,高级工程师。E-mail:liangyongjun@hotmail.com




 生成H
生成H