传染性造血器官坏死病毒毒株核蛋白基因片段的克隆及序列分析
韩硕1,赵前程1,吴斌2,李叶2,王玫2
(1.大连海洋大学食品工程学院,辽宁大连116023;2.辽宁出入境检验检疫局,辽宁大连116001)
摘要:利用RTG-2细胞对传染性造血器官坏死病毒(IHNV)的敏感性对IHNV-DL进行扩增,采用TRIzol法提取病毒RNA,用IHNV核蛋白基因的一对通用引物进行RT-PCR扩增,将扩增出的一条786 bp的基因纯化、克隆至pMD18-T载体中进行序列测定,并与国内外已公布的病毒核蛋白基因进行比对和分析。结果表明:此病毒的核酸序列与标准毒株RB-1、代表毒株WRAC的同源性分别为96.3%和93.6%;翻译出的氨基酸序列与标准毒株RB-1、代表毒株WRAC的同源性分别为96.1%和93.5%。系统进化树分析结果表明,此毒株与中国近期公布的毒株zyx有密切的亲缘关系。
关键词:传染性造血器官坏死病毒;纯化;克隆;序列分析
传染性造血器官坏死病(Infectious haematopoietic necrosis,IHN)是一种主要感染大马哈鱼和虹鳟鱼苗及其幼鱼的急性、系统性的严重传染病[1],给全球大马哈鱼和虹鳟的养殖业造成巨大的经济损失[2]。以前IHN只在北美及欧洲的一些国家流行。1968年,IHNV随红大马哈鱼鱼卵从阿拉斯加传入日本北海道[3]。近年来,随着水生动物及其产品进口贸易的增加,IHN也传入中国,并在中国一些地区流行,在自然环境中也可以爆发并造成严重的经济损失[4]。所以OIE(Office International Des Epizooties)将IHN命为口岸鱼类第一类检疫病害。
IHN病原即传染性造血器官坏死病毒(Infectious haematopoietic necrosis virus,IHNV),属弹状病毒科、诺拉弹状病毒属[5],单链负股RNA,基因组全长为11 kbp。病毒粒子由RNA聚合酶蛋白(L)、磷酸化蛋白(P或M1)、基质蛋白(M或M2)、表面糖蛋白(G)和核蛋白(N)组成[6]。其中,N蛋白和病毒RNA紧密结合,并且此结构域和其它已知的与RNA结合的蛋白序列间具有高特异性[7]。
本研究中,作者利用RTG-2细胞对IHNV的敏感性,对冻存并已鉴定的IHNV-DL病毒进行扩增,产生典型的细胞病变状态,采用N基因上一段高保守性和高特异性的786 bp片段的一对通用引物,对扩增出的病毒进行RT-PCR鉴定,对其结果进行纯化、克隆进而测序,并将结果与已公布的各国外毒株和国内毒株zyx的相应基因及氨基酸进行了比对和分析,构建其核酸和氨基酸序列进化树,从而为IHNV核蛋白基因结构与功能的进一步研究提供基础资料。
1 材料与方法
1.1 材料
1.1.1 细胞、毒株和菌种 RTG-2细胞和IHNVDL病毒由辽宁出入境检验检疫局技术中心动物检疫实验室提供。大肠杆菌感受态细胞DH5α由该实验室制备保存。
1.1.2 主要试剂 逆转录酶AMV、RNA酶抑制剂HRP、r-Taq DNA聚合酶、胶回收(小量)试剂盒、pMD18-T Vector、质粒(小量)抽提试剂盒均购自宝生物工程(大连)有限公司。
1.1.3 引物 本试验中使用的引物为扩增IHNV核蛋白基因的通用引物,即扩增786 bp的目的片
段。
上游引物F1:
5'-TCAAGGGGGGAGTCCTCGA-3',
下游引物R1:
5'-CACCGTACTTTGCTGCTAC-3'。
引物由宝生物工程(大连)有限公司合成。
1.2 方法
1.2.1 病毒的扩增 将病毒液按1∶10、1∶100和1∶1 000三个稀释度接种于长满单层的RTG-2细胞上,用含体积分数为2%的胎牛血清MEM培养液于15℃下培养,至80%以上细胞出现CPE现象,收集病毒,于-20℃下保存备用。
1.2.2 提取RNA 按TRIzol法提取病毒RNA。
1.2.3 目的片段的扩增及鉴定 按文献[8]中的方法进行逆转录聚合酶链式反应,PCR扩增产物经15 g/L琼脂糖凝胶电泳鉴定。
1.2.4 目的基因的克隆及测序 回收目的片段,并按常规方法将目的片段与pMD18-T Vector连接,将连接产物转化到大肠杆菌感受态细胞DH5α中,然后将转化菌涂布于含有氨苄的LB培养基上,于37℃下过夜培养。挑取单菌落进行扩大培养。菌液经PCR扩增后将产物进行电泳,用有目的条带的阳性菌液提取质粒。质粒经内切酶EcoR I和Pst I酶切,对电泳后有目的条带的质粒进行测序。
1.2.5 序列分析 质粒DNA由宝生物工程(大连)有限公司用M13-47引物完成测序。用DNAS-tar软件对测序结果与已公布的核酸序列(15个)、翻译出的氨基酸序列(15个)进行核酸和氨基酸同源性的分析;用MEGA等软件对与来自NCBI上nucleotide blast中的高度相似序列(28个)进行核酸和氨基酸进化树的构建。
2 结果与分析
2.1 病毒的扩增
将IHNV-DL病毒接种于RTG-2单层细胞上,按1∶10、1∶100和1∶1 000稀释的病毒液分别在42、48 h和96 h使80%以上的细胞产生病变(图1)。
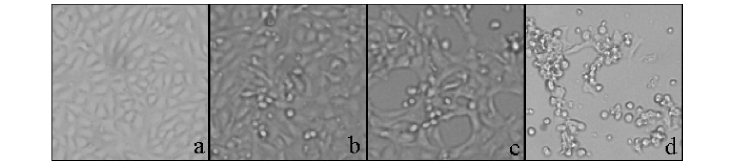
图1 接种IHNV-DL病毒的RTG-2细胞的病变
Fig.1 Pathologic lesion in RTG-2 inoculated with IHNV-DL
注:a正常单层RTG-2细胞;b、c、d分别为在RTG-2细胞中接种按1∶1 000稀释的病毒液48、72 h和96 h。
Note:a The normal RTG-2 cell;b Cell with 1∶1 000 IHNV-DL for 48 h;c Cell with 1∶1 000 IHNV-DL for 72 h;d Cell with 1∶1 000 IHNVDL for 96 h.
2.2 RT-PCR扩增的结果
琼脂糖凝胶电泳结果显示,在786 bp的位置上有扩增条带,与引物预期扩增条带大小相符(图2)。
2.3 重组质粒的鉴定
将获得的阳性质粒进行酶切验证,得到了接近786 bp大小的条带和一条大于2 000 bp的条带(图3),说明目的基因序列连接到了pMD18-T载体中。
2.4 序列分析
采用NCBI在线nucleotide blast分析,搜索到高相似序列57条,其中有2个完整的病毒基因序列,26个N基因完整序列,其他为N基因部分序列。利用DNAStar软件将测出的序列IHNV-DL与15条国内外报道的核酸序列以及翻译出氨基酸序列进行比较,结果显示(表1):核酸序列同源率为93.3%~99.6%,翻译出氨基酸同源率为93%~99.6%。与黑龙江省哈尔滨市报道的毒株zyx (NCBIid:HM099906.1)有最高的同源率99.6%。
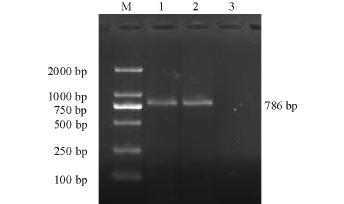
图2 PCR产物的电泳图
Fig.2 Electrophoresis for PCR product
注:M为DL 2000 Marker;1、2为PCR产物;3为阴性对照。
Note:M,DL2000 Marker;1,2,PCR product of IHNV-DL; 3,Negative control.
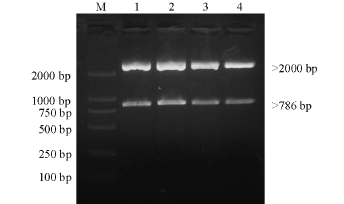
图3 质粒酶切产物的电泳图
Fig.3 The electrophoresis of pMD18-T-IHNV
注:M为DL2000 Marker;1~4为质粒酶切产物。
Note:M,DL2000 Marker;1,2,3,and 4,Recombinant plasmid pMD18-T-IHNV digested by EcoRI and PstI.
表1 IHNV-DL与国内外报道的毒株同源性的比较(右上为核酸同源率,左下为氨基酸同源率)
Tab.1 Homological comparison of IHNV-DL among reported IHNV gene all over the world(amio acids in the left below, nucleotide in the top right)%
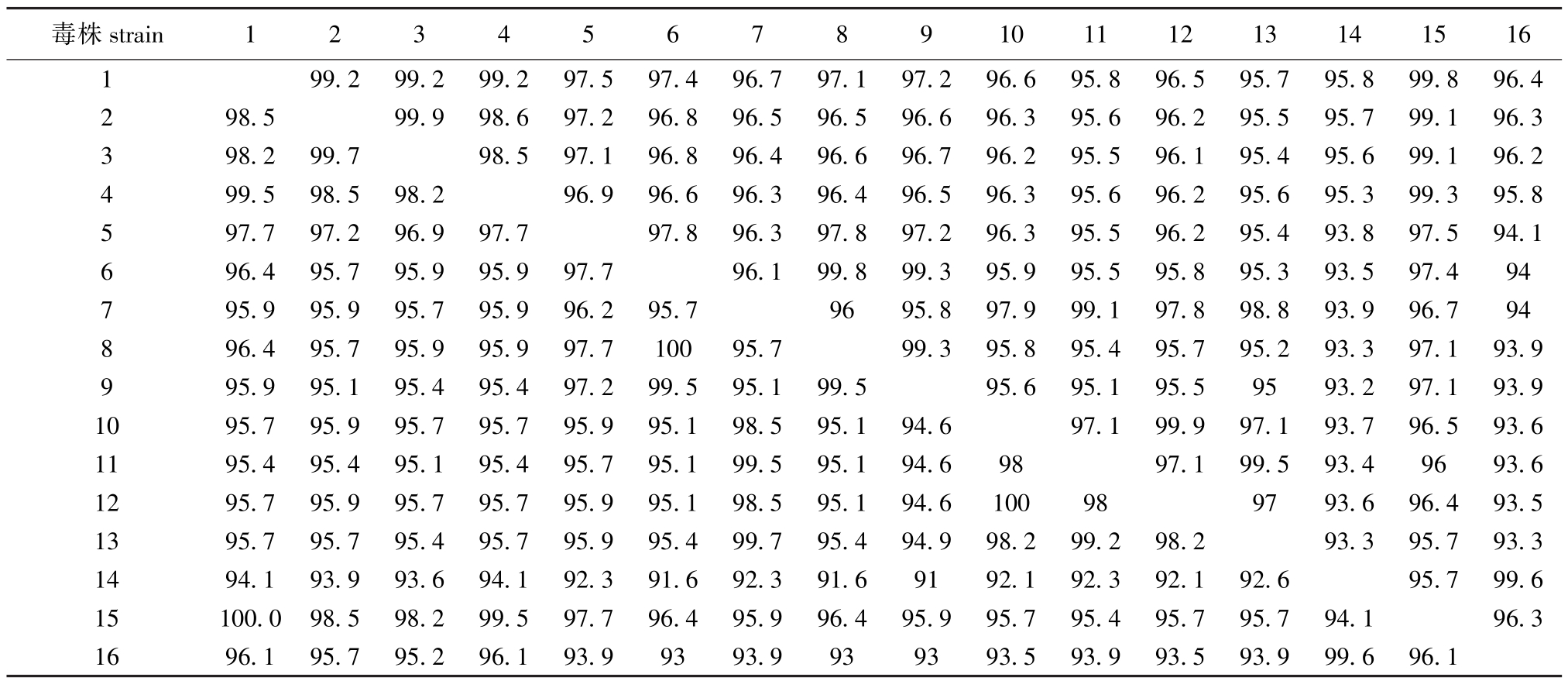
Note:1 RB-76;2 LWS-87;3 Carson-89;4 LB91KI;5 LR-73;6 SRCV;7 LR-80;8 Col-85;9 Col-80;10 WRAC;11 193-110;12 CST -82;13 HO-7;14 zyx;15 RB-1;16 IHNV-DL.
毒株993.593.999.696.1 .896.595.795.899.896.4 2 98.599.998.697.296.896.596.596.696.395.696.295.595.799.196.3 398.299.798.597.196.896.496.696.796.295.596.195.495.699.196.2 499.598.598.296.996.696.396.496.596.395.696.295.695.399.395.8 5 97.797.296.997.797.896.397.897.296.395.596.295.493.897.594.1 6 96.495.795.995.997.796.199.899.395.995.595.895.393.597.494 795.995.995.795.996.295.79695.897.999.197.898.893.996.794 8 96.495.795.995.997.710095.799.395.895.495.795.293.397.193.9 9 95.995.195.495.497.299.595.199.595.695.195.59593.297.193.9 1095.795.995.795.795.995.198.595.194.697.199.997.193.796.593.6 1195.495.495.195.495.795.199.595.194.69897.199.593.49693.6 1295.795.995.795.795.995.198.595.194.6100989793.696.493.5 1395.795.795.495.795.995.499.795.494.998.299.298.293.395.793.3 1494.193.993.694.192.391.692.391.69192.192.392.192.695.799.6 15100.098.598.299.597.796.495.996.495.995.795.495.795.794.196.3 1696.195.795.296.193.99393.9939393.593. strain12345678910111213141516 1 99.299.299.297.597.496.797.197.296.695
2.5 碱基的变化
IHNV-DL与NCBI上已公布的标准毒株RB-1 (NCBI接收序列号U50402.1)和代表毒株WRAC (NCBI接收序列号AY442518.1)比较,核酸序列同源性分别为96.3%和93.6%。共有23个碱基突变位点(图4)。
2.6 氨基酸的变化
IHNV-DL与标准毒株RB-1和代表毒株WRAC翻译出的氨基酸序列比较,同源性分别为96.1%和93.5%,共有7个氨基酸突变位点(图5)。
2.7 进化树分析
对IHNV-DL核酸和翻译出的氨基酸序列进行遗传进化树分析,结果见图6。
3 讨论
本试验中,将IHNV-DL核蛋白核酸序列与已公布的其它15种IHNV完整N基因进行比对。结果表明:其与14种国外毒株同源率为93.3%~96.4%,其中,与IHNV标准毒株RB-1同源率为96.3%,与代表毒株WRAC同源率为93.6%;IHNV-DL翻译出的氨基酸序列与国外毒株氨基酸序列同源率为93.0%~96.1%,其中,与标准毒株RB-1同源率为96.1%,与代表毒株WRAC同源
率为93.5%。刘荭等[9]将国内养殖场患病的牙鲆和虹鳟及国外进境的匙吻鲟鱼卵中检测出的IHNV序列与标准毒株RB-1进行比较,在患病的牙鲆和虹鳟体内检出的IHNV核酸序列同源性都为98.1%,氨基酸序列同源率分别为97%和99%;国外进境鱼卵检出的IHNV序列同源率为92.5%,氨基酸序列同源率为93%。这与本研究中毒株序列的比对结果相似。

图4 IHNV-DL核酸序列的比对(框内为核酸突变位点)
Fig.4 Mutation comparison of nucleic acids(Mutations in the frame)
将IHNV-DL核酸序列与标准毒株RB-1和代表毒株WRAC比对的结果表明,共有23个碱基突变位点,其中4个位点为T→C,8个位点为C→T; 1个位点为T→G,1个位点为G→T;1个位点为
G→A,3个位点为A→G;4个位点为C→A,1个位点为X→G。Leong等[10]的研究结果表明,不同毒株之间核蛋白的相对分子质量存在差异,这与本试验结果相似。对IHNV-DL序列翻译的氨基酸序列与标准毒株RB-1和代表毒株WRAC进行比对,结果表明,共有7个氨基酸发生突变,影响了IH-
NV-DL的疏水性。其中,第117位中性的甘氨酸突变为酸性的天冬氨酸,从而影响了IHNV-DL的酸碱性。这是否对病毒的侵染力有影响,有待进一步研究证实。

图5 IHNV-DL氨基酸序列的比对(框内为氨基酸突变位点)
Fig.5 Sequnenc comparison of amino acids in IHNV-DL(Mutations in the frame)
图6 核酸序列和氨基酸序列的进化树
Fig.6 Phylogenetic tree of the nuclecic acid sequence,and the amino acid sequence
本研究中,将IHNV-DL序列翻译出的氨基酸序列与15种毒株的序列进行比对,结果与一些毒株的同源率一致。同源率为96.1%的毒株分别为RB-76(AY442516.1)、LB91KI(AY438975.1)和RB -1(U50402.1);同源率为93.9%的毒株分别为LR -73(AY442513.1)、LR-80(AY442514.1)、193-110 (AY442507.1)和HO-7(AY442512.1);同源率为93.5%的毒株分别为WRAC(AY442518.1)和CST-82(AY442511.1);同源率为93%的毒株分别为SRCV(AY442517.1)、Col-85(AY442510.1)和Col-80(AY442509.1)。Morzunov等[11]比较了IHNV标准毒株RB-1和代表毒株WRAC的核蛋白氨基酸序列的同源性,结果表明,IHNV不同毒株核蛋白氨基序列存在差异,这与本试验结果相似。本研究中,将IHNV-DL序列翻译出的氨基酸序列与28个高度相似毒株氨基酸序列间建立氨基酸进化树,结果同样验证了IHNV-DL与上述同源率相同的4组毒株分别属于进化树的4个分支,IHNV-DL与这4支毒株的亲缘关系十分相近。
IHNV-DL核酸序列和翻译出来的氨基酸序列与中国毒株zyx(HM099906.1)的同源性均为99.6%,并且构建出来的核酸和氨基酸进化树都表明二者之间有密切的亲缘关系。
参考文献:
[1] Wolf K.Fish Viruses and Fish Viral Diseases[M].Ithaca,N Y: Cornell University Press,1988.
[2] 王光玉,曲径,徐仲,等.传染性造血组织坏死病毒(IHNV)的危害、检疫及防治[J].中国动物检疫,2006,23(10):34-35.
[3] Sano T,Nishimura T,Okamoto N,et al.Studies on viral diseases of Japanese fishes:VI.Infectious hematopoietic necrosis(IHN)of samonids in the mainland of Japan[J].J Tokyo Univ Fish,1977, 63:81-85.
[4] Niu L Q,Zhao Z Z.The epidemiological IHN and IPN of rainbow trout in northeast China[J].Journal of Fisheries of China,1988, 12:327-332.
[5] Walder PJ,Benmansour A,Calisher C H,et al.Family rhabdoviridae[C]//Van-Regenmortel M H,Bishop D H,Fauquet C M.The seventh report of the International Committee on Taxonomy of Viruses.San Diego:Academic Press,2000:563-583.
[6] Kurath G,Athern K G,Pearson G D,et al.Molecular cloning of the six mRNA species of infectious hematopoietic necrosis virus,a fish rhabdovirus,and gene order determination by R-loop mapping [J].J Virol,1985,53:462-468.
[7] Said T,Bruley H,Lamoureux A,et al.An RNA-binding domain in the viral haemorrhagic septicaemia virus nucleoprotein[J].J Gen Virol,1988,79:47-50.
[8] 刘荭,史秀杰,高隆英,等.鱼病毒性神经坏死病病毒(VNNV)不同基因型等鉴别方法的建立及在VNN检疫和监测中的应用[J].水产学报,2004,28(6):695-702.
[9] 刘荭,范万红,史秀杰,等.国内养殖鱼类和进境鱼卵中传染性造血器官坏死病毒(IHNV)的检测及基因分析[J].华中农业大学学报,2006,25(5):544-549.
[10] Leong J,Hsu Y L,Engelking H M,et al.Strain of infectious hematopoietic necrosis(IHN)virus may be identified by structural protein differences[J].Dev Biol Stand,1981,49:43-55.
[11] Moriunov S P,Winton J R,Nichol S T.The complete genome structure and phylogenetic relationship of infectious hematopoietic necrosis virus[J].Virus Research,1995,38:175-192.
Cloning and sequencing of nucleocapsid protein in infectious hematopoietic necrosis virus strain
HAN Shuo1,ZHAO Qian-cheng1,WU Bin2,LI Ye2,WANG Mei2
(1.School of Food Engineering,Dalian Ocean University,Dalian 116023,China;2.Liaoning Entry-Exit Inspection and Quarantine Bureau,Dalian 116001,China)
Abstract:The infectious hematopoietic necrosis virus(IHNV-DL)was amplified by RTG-2 cells,and the RNA in IHNV-DL was extracted by the TRIzol method.A gene of 786 bp was amplified from the nucleoprotein gene of IHNV-DL and cloned to the vector of pMD18-T in which the gene was sequenced and compared with the nucleoprotein gene of virus which was published.The results showed that the homology of nucleotide sequence was found to be 96.3%between the amplified products of the samples and IHNV
reference s:train RB-1,and 93.6%between the amplified products of samples and IHNV representative strain WRAC,with the homology of 96.1%and 93.5% between the induced amino acids sequence.The phylogenetic tree showed that the strain had a close relationship with the strain zyx published recently.
Key words:infectious haematopoietic necrosis virus(IHNV);purification;cloning;sequence analysis
文章编号:2095-1388(2011)03-0232-06
中图分类号:S941.41
文献标志码:A
收稿日期:2010-07-07
基金项目:国家质量监督检验检疫总局科技项目(2010IK003)
作者简介:韩硕(1985-),女,硕士研究生。E-mail:hanshuowz@126.com
通信作者:吴斌(1968-),女,研究员。E-mail:wubin69@163.com






