曹丽萍1,贾睿2,丁炜东1,殷国俊1
(1.中国水产科学研究院淡水渔业研究中心,农业部水生动物遗传育种和养殖生物学重点开放实验室,江苏无锡214081; 2.南京农业大学无锡渔业学院,江苏无锡214081)
摘要:以叔丁基氢过氧化物(t-BHP)诱导异育银鲫Carassius auratus gibel原代培养肝细胞损伤模型,采用不同的给药顺序,通过检测肝细胞培养上清液中谷丙转氨酶(ALT/GPT)、微量丙二醛(MDA)、谷光甘肽过氧化物酶(GSH-PX)和超氧化物歧化酶(SOD)的含量以及肝细胞的增殖活性,研究了五味子提取物对急性肝细胞损伤的保护作用。结果表明:以浓度为1 mmoL/L的t-BHP作用肝细胞2 h诱导肝损伤模型,加入五味子提取物后能通过提高上清液中GSH-PX和SOD酶活力以及抑制脂质过氧化产物MDA的生成来减轻t-BHP对肝细胞的损伤,减少GPT的释放,使GPT活力水平的升高受到明显抑制,显著提高了肝细胞的存活率(P<0.05或P<0.01);预防治疗组(DT)中五味子提取物对损伤肝细胞的保护效果明显要优于预防组(D)和治疗组(T)。说明五味子提取物对由t-BHP造成的肝细胞急性损伤具有一定的保护作用,该保护作用可能与其抗氧化、清除自由基的能力有关;中药与损伤剂的给予顺序会影响五味子提取物对肝细胞的保护作用。
关键词:异育银鲫;五味子提取物;原代培养;模型
近年来,鱼类肝胆综合症在全国许多地区频繁发生,给水产养殖业造成极大的经济损失。其病因多样,目前还没有有效的治疗方法,各种抗生素、杀虫剂和抗病毒药物都不能有效地控制鱼类肝胆综合症。因此,发展新的研究系统快速而深入地研究肝毒剂的毒理,筛选护肝药物并探索其作用机理显得尤为重要。近年来,研究发现,一些中草药具有免疫调节和保护肝脏的作用[1-2],且无毒、无害、成本低廉,在肝病的治疗方面有良好的疗效和巨大的潜力。
原代培养肝细胞作为护肝药物体外研究体系,能较好地体现供体动物的生物学特性,实时地反映细胞层面的生命活动,实验周期短,灵敏性及可复性好,所需药物量少[3-5]。利用体外培养肝细胞的损伤模型对药物进行生物活性、毒性评价、代谢特点等方面的研究已经广泛应用于药物研发过程中,并正在迅速发展[6]。国内研究原代培养异育银鲫Carassius auratus gibelio肝细胞损害模型的报道尚不多见,在水产方面的研究和应用几乎是空白。
五味子,为木兰科植物五味子Schisandra chinensis和华中五味子Schisandra sphenanthera的成熟果实,前者习称北五味子。北五味子果实醇提物、种仁醇提取物能明显降低实验性肝损害所致的高血清转氨酶[7-9]。从20世纪70年代起中国开始使用五味子治疗慢性肝炎,取得了良好的疗效。本试验中,作者建立了以叔丁基氢过氧化物(t-BHP)诱导异育银鲫原代培养肝细胞损伤模型,采用不同的给药顺序,通过检测肝细胞培养上清液中一些生化指标以及肝细胞的增殖活性,研究了北五味子醇提取物对急性肝细胞损伤的保护作用,旨在
进一步筛选出对鱼类既有保肝作用又有免疫调节作用的中草药,为开发鱼类免疫调节和保肝中草药配方提供参考资料。
1.1 材料
1.1.1 五味子提取物 五味子提取物为木兰科植物五味子Schisandra chinensis的干燥成熟果实提取物,有效成分为木脂素类(如五味子醇甲、五味子乙素和五味子甲素及其它有机酸类),购自南通四海植物精华有限公司。
1.1.2 试验鱼 试验用异育银鲫(6月龄)取自中国水产科学研究院淡水渔业研究中心渔场,体质健康、无伤,体质量为150 g左右。将异育银鲫饲养于循环水系统中,培养水温为25℃,每天投喂2次商品饲料。
1.1.3 试剂和仪器 L-15培养基、HBSS(Hanks Balanced Saults)溶液、链霉素/青霉素(streptomycin/penicillin)和肝素(heparin)购于美国SIGMA公司;新生小牛血清(FCS)和细胞培养板购自于GIBCO公司;t-BHP(分析纯)购于国药集团化学试剂有限公司;GPT、MDA、GSH-PX和SOD测定试剂盒购于南京建成生物工程研究所科技有限公司;723分光光度计购自上海欣茂仪器有限公司。
1.2 方法
1.2.1 五味子提取物的配置 用FCS-L-15培养基(含100 IU/mL的S/P、10 U/mL的heparin和体积分数为5%的FCS)配成0.1、0.2和0.4 mg/mL的浓度,用0.22 μm的过滤器过滤,备用。
1.2.2 t-BHP的配置 t-BHP用CS-L-15培养基(含100 IU/mL的S/P、10 U/mL的heparin和体积分数为15%的CS)配成1 mmoL/L的浓度,用0.22 μm的过滤器过滤,备用。
1.2.3 异育银鲫肝细胞的分离[10]随机选取异育银鲫,用MS-222麻醉后,去血。在超净台内,无菌条件下剖取异育银鲫的肝脏,取适量肝组织放至培养皿中,用HBSS溶液洗至白色。将肝组织切成1 mm3的小块,按5~10倍肝质量体积的比例加入质量分数为2.5%的胰酶消化液消化10~15 min,待肝组织的细胞分散成单个或大量小细胞团时加入FCS终止消化。过100目筛,剩下的组织块可根据所需细胞数量对其再进行消化。将滤液转入离心管中,于4℃下以1 000 r/min离心2 min,弃上清液,用HBSS溶液清洗沉淀以除去消化液,将沉淀悬浮后于4℃下进行梯度离心(60×g,30×g)5 min。用台盼蓝法进行细胞活性的检测并计数,只有在活细胞数达到细胞总数的90%以上时,方可用于肝细胞损伤模型的构建和药理研究。用CS-L -15培养基(含100 IU/mL的S/P、10 U/mL的heparin和体积分数为15%的CS)调整细胞浓度为106个/mL,接种到96孔板上,每孔100 μL,27℃下培养24 h后,备用。
1.2.4 t-BHP致肝原代细胞损伤及五味子提取物的保护处理 将肝细胞加入96孔板培养24 h后,弃上清液,在待用细胞中加入t-BHP和不同浓度的五味子提取物,造成肝细胞体外损伤并观察五味子提取物对该模型的作用。各试验组具体设置方法为:
1)空白对照组(C组),用L-15培养基培养肝细胞,100 μL/孔,培养4 h后收集上清液;
2)t-BHP模型组(M组),用L-15培养基培养肝细胞2 h后再换用含1 mmoL/L t-BHP的L-15培养基,100 μL/孔,继续培养2 h后收集上清液;
3)预防组(五味子提取物的剂量分别为0.1、0.2、0.4 mg/mL,记为D1、D2、D3组),用含不同浓度五味子提取物的L-15培养基培养2 h后,换用含1 mmoL/L的t-BHP的L-15培养基,100 μL/孔,继续培养2 h后收集上清液;
4)治疗组(五味子提取物的剂量分别为0.1、0.2、0.4 mg/mL,记为T1、T2、T3组):用含1 mmoL/L t-BHP的L-15培养基培养2 h后,再换用含不同浓度五味子提取物的L-15培养基继续培育2 h,100 μL/孔,收集上清液;
5)预防治疗组(五味子提取物的剂量分别为0.1、0.2、0.4 mg/mL,记为DT1、DT2、DT3组),用含不同浓度五味子提取物的L-15培养基培养2 h后,换用含1 mmoL/L t-BHP的L-15培养基继续培养2 h,再换用含不同浓度五味子提取物的的L-15培养基培育2 h,收集上清液,100 μL/孔。以上每个实验组均设8个重复孔,各组取上清液检测生化指标。
1.2.5 谷丙转氨酶(ALT/GPT)、微量丙二醛(MDA)、谷光甘肽过氧化物酶(GSH-PX)和超氧化物歧化酶(SOD)含量的测定 将异育银鲫的血清分离后,用0.22 μm的过滤器过滤,灭能后备用,按照GPT、MDA、GSH-PX和SOD测定试剂盒的方法测定。
1.2.6 用MTT法检测细胞生长活力[11]C组、M组和D1~D3组收集上清液后,将96孔细胞板移至离心机上离心10 min(350×g),倾去上清液,每孔加100 μL体积分数为5%的FCS-L-15和20 μL MTT,于27℃下继续培育4 h。倾去上清液,每孔加150 μL DMSO,振荡10 min,使结晶物充分溶解,选择570 nm波长,在酶联免疫检测仪上测定各孔光吸收值,记录结果。
细胞存活率按下列公式[12]计算:
1.3 数据分析
谷丙转氨酶(ALT/GPT)、微量丙二醛(MDA)、谷光甘肽过氧化物酶(GSH-PX)和超氧化物歧化酶活力测定及数据分析按照试剂盒操作说明进行。实验数据用平均值±标准误表示,数据分析采用SPSS 15软件包中的单因素方差分析(one-way-ANOVA)处理,对样本之间进行t检验。显著性水平设为0.05和0.01。
2.1 五味子提取物对损伤肝细胞培养上清液中生化指标的影响
2.1.1 五味子提取物对损伤肝细胞培养上清液中GPT的影响 将低、中、高浓度的五味子提取物和t-BHP以不同顺序作用于体外培养的原代肝细胞,培养上清液中GPT的变化如图1所示。从图1可见:用t-BHP损伤肝细胞后,促进了肝细胞内GPT酶的释放,模型损伤组(M组)培养上清液中GPT的水平较空白对照组(C组)明显升高,差异极显著(P<0.01),表明模型建立成功;与模型组(M组)比较,预防组内五味子提取物浓度为0.2 mg/mL(D2组)和0.4 mg/mL(D3组)、治疗组内五味子提取物浓度为0.2 mg/mL(T2组)以及预防治疗组内(DT1~DT3组)不同剂量的五味子提取物均能抑制GPT水平的升高(P<0.01或P<0.05)。
2.1.2 五味子提取物对损伤肝细胞培养上清液中MDA、SOD及GSH-PX的影响 将低、中、高浓度的五味子提取物和t-BHP以不同的顺序作用于体外培养的原代肝细胞,培养上清液中MDA、SOD及GSH-PX的变化见图1。从图1可见:用t-BHP损伤肝细胞的M组较空白组(C组)培养上清液中的MDA含量明显升高,SOD和GSH-PX则极显著降低(P<0.01),表明模型建立成功;与模型组(M组)比较,预防组(D1~D3组)不同浓度的五味子提取物均能显著提高GSH-PX活性(P<0.05),对抑制MDA活性和提高SOD活性却没有明显作用;治疗组较模型组除五味子提取物浓度为0.2 mg/mL的T2组能有效地提高GSH-PX活性(P<0.05)外,其它浓度组对提高SOD水平、抑制MDA活性均无明显差异(P>0.05);与模型组比较,预防治疗组(DT1~DT3组)各浓度的五味子提取物均能显著提高SOD和GSH-PX水平(P<0.05或P<0.01),0.2 mg/mL的五味子提取物还能显著降低上清液中MDA的水平(P<0.05)。
2.2 五味子提取物对肝细胞增殖活性的影响
用t-BHP诱导肝细胞损伤后2 h,在倒置显微镜下观察可见,部分肝细胞形态发生改变,胞膜粗糙并部分破裂,细胞器肿胀,核固缩或核破裂,部分细胞坏死或变形。中药处理组肝细胞坏死明显减少,形态大部分正常,细胞核清晰可见(图2)。
用MTT法测定了各处理组肝细胞的存活率,结果表明,用t-BHP损伤后的模型组细胞活性明显下降,仅为正常组的43.34%;而五味子提取物预防组的肝细胞存活率明显上升,0.1、0.2 mg/mL和0.4 mg/mL剂量组的肝细胞存活率分别为80.77%、90.05%和87.49%,与t-BHP模型组相比,差异极显著(P<0.01)(表1)。
表1 五味子提取物对肝细胞存活率的影响
Tab.1 Effect of Schisandrins extracts on cell viability
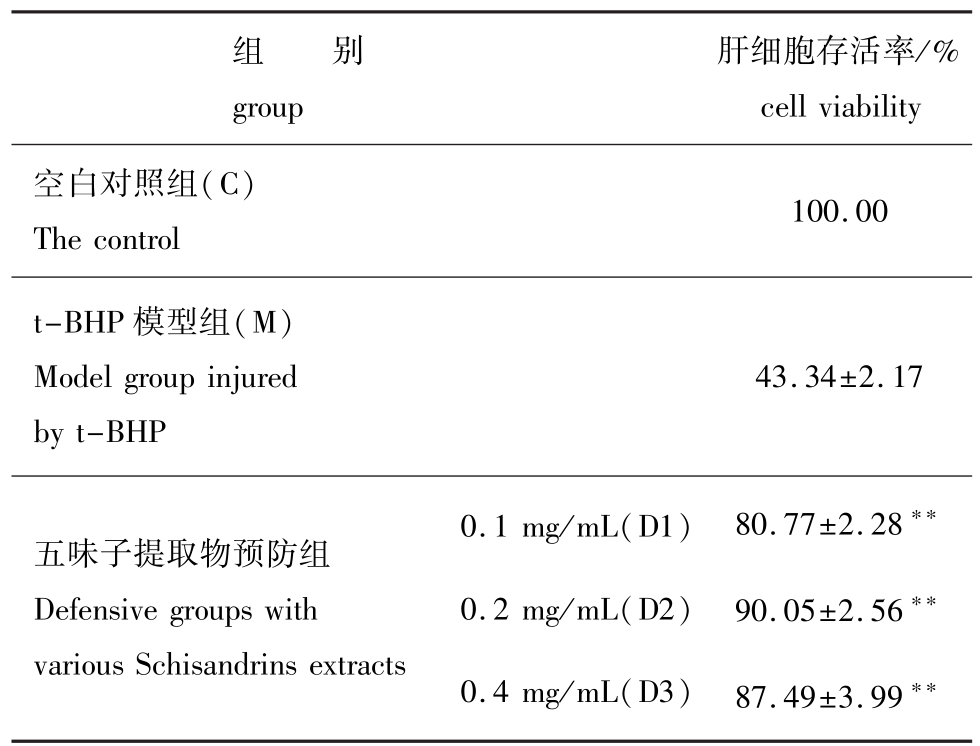
注:**表示与模型组比较差异极显著(P<0.01)。
Note:**means very significant difference compared with the control model group(P<0.01).
cell viability空白对照组(C) The control组 别group肝细胞存活率/% 100.00 t-BHP模型组(M) Model group injured by t-BHP 43.34±2.17五味子提取物预防组Defensive groups with various Schisandrins extracts 0.1 mg/mL(D1) 0.2 mg/mL(D2) 0.4 mg/mL(D3) 80.77±2.28**90.05±2.56**87.49±3.99**
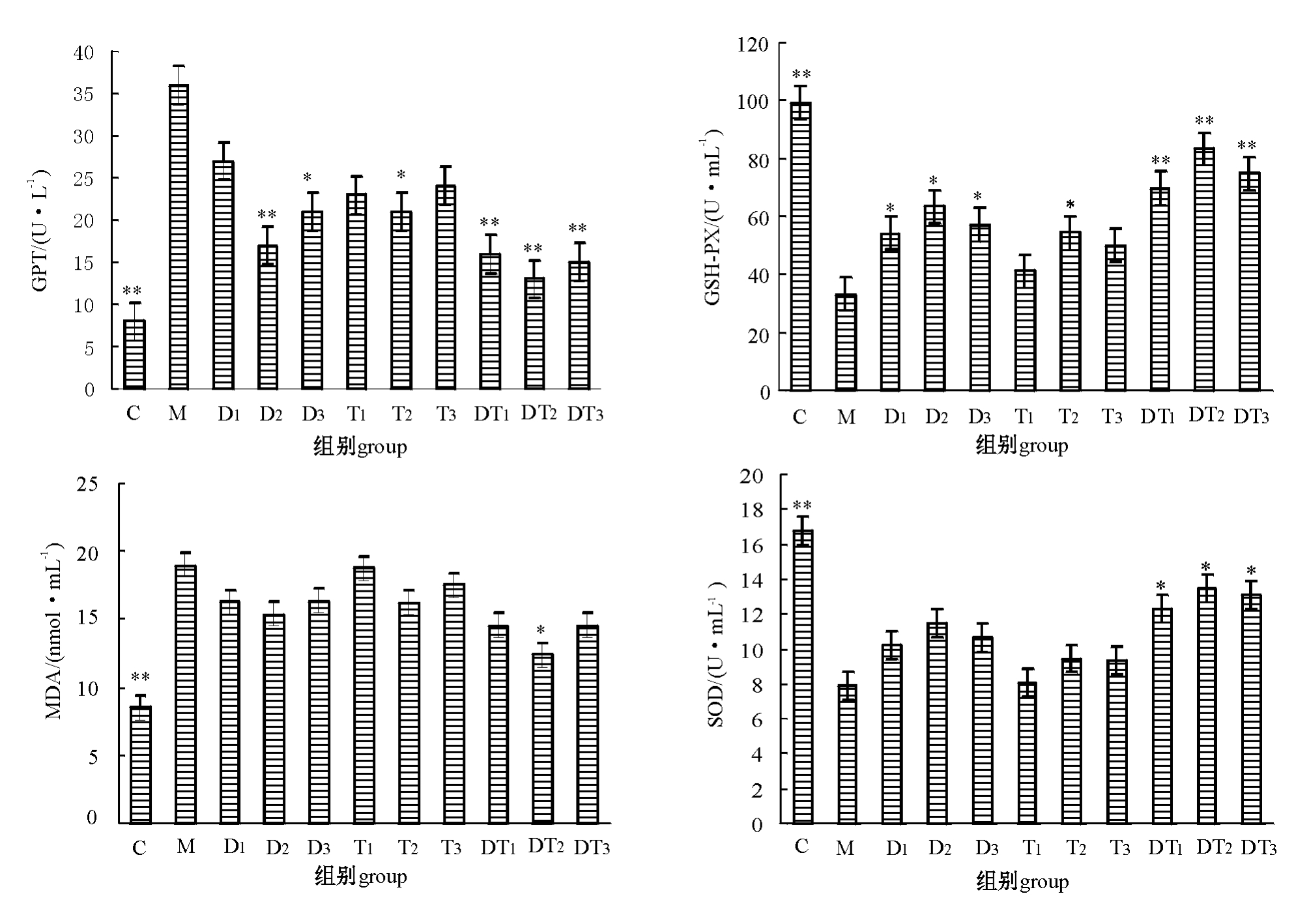
图1 五味子提取物对用t-BHP损伤的肝细胞培养上清液中GPT、MDA、GSH-PX和SOD的影响
Fig.1 Influences of Schisandrins extracts on the levels of GPT,MDA,GSH-PX,and SOD in supernatant of cultured hepatocytes injured by t-BHP
注:*表示与模型组(M组)差异显著(P<0.05);**表示与模型组(M组)差异极显著(P<0.01)。
Note:*means significant difference compared with the model group(P<0.05);**means very significant difference compared with the model group(P<0.01).
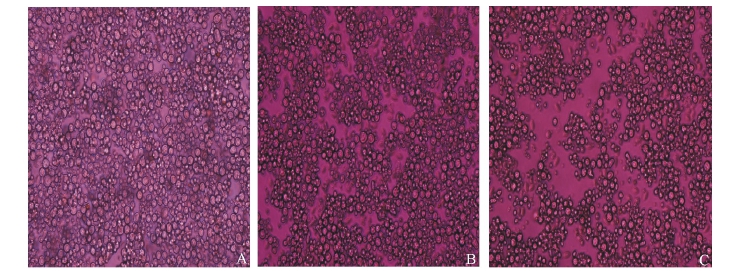
图2 离体肝细胞的形态观察(×200)
Fig.2 Morphological observation of the hepatocytes in crucian carp in vitro(×200)
注:A正常对照组;B五味子提取物保护组;C t-BHP诱导损伤组。
Note:A the control;B Schisandrins extracts treated;C t-BHP injured.
在多种肝病(包括炎症/免疫介导肝细胞损伤、酒精和化学药物性肝损伤及缺血再灌注性肝损伤等)的肝细胞损伤中,多种酶、自由基以及脂质过氧化反应均发生较大的变化[13-15],氧化应激是它们的共同损伤机制。在肝损伤的病变过程中,氧化应激及自由基引起的氧化损伤主要由活性氧化物质和活性氮化物所致,它们是细胞代谢过程中产生的含氧或含氮的活性产物,可通过脂质过氧化等途径诱导组织细胞损伤,具有重要的生理和病理作用。氧化物质t-BHP虽不是自由基,但它属活性氧类,有高反应性,可促进自由基的生成,引发生物膜的脂质过氧化反应,导致细胞的坏死和凋亡[16]。
GPT是肝内的主要功能酶,在肝脏组织损伤及坏死时,酶从细胞内溢出进入细胞培养上清液中,使得相关转氨酶的水平显著升高。本研究中,将含1 mmoL/L t-BHP的L-15培养基作用于异育银鲫肝细胞2 h后,促进了GPT的释放,其含量显著升高,同时各药物组均能抑制GPT水平的升高。齐彦等[17]的研究结果表明,北五味子醇提物能够显著降低由CCL4引起的小鼠肝中GPT的增高;胡彦武[18]观察了五味子藤茎对小鼠酒精性肝损伤后血清中GPT、GOT的影响时也发现,五味子藤茎通过降低血清中转氨酶水平来有效防治小鼠酒精性肝损伤。本试验结果与齐彦等[17]和胡彦武[18]的研究结果相同。
MDA是细胞膜脂质过氧化反应的终产物[19],细胞中MDA含量的多少可反映细胞脂质过氧化的损伤程度[20-21]。本研究中,用t-BHP损伤肝细胞后,培养上清液中MDA的含量明显升高;预防治疗组,0.2 mg/mL的五味子提取物能显著降低上清液中MDA的水平。陈荣华等[22]在研究五味子醇提残渣中粗多糖的体外抗氧化活性时也得出了相似的结论,即五味子粗多糖能显著降低小鼠肝匀浆液中MDA的生成,具有良好的体外抗氧化作用;刘玉芹[23]在研究中药配伍对肉鸡抗氧化指标的影响时发现,五味子同样可降低肉鸡血清中MDA含量。
SOD、GSH-PX是细胞内源性重要的抗氧化剂,其含量多少是衡量细胞抗氧化能力的重要指标。当体内代谢过程中产生自由基时,SOD可与其反应产生HO,HO与GSH在GSH-PX催化下生成水,从而使自由基清除[24]。本研究中发现,预防治疗组内各浓度的五味子提取物均能显著提高SOD和GSH-PX水平,表明了五味子在异育银鲫抗t-BHP诱导肝损伤中的重要作用。燕菲等[25]在研究五味子与黄芪多糖对小鼠急性肝损伤的协同保护作用时也有类似的阐述,即五味子提取物和黄芪多糖通过协同作用提高了对乙酰氨基酚致肝损伤小鼠肝脏的还原性谷胱甘肽和抗氧化水平,降低了血清中GOT和GPT水平,减轻了对肝组织细胞的损伤。
本试验中以t-BHP为损伤剂成功建立了异育银鲫肝细胞体外损伤模型,研究五味子提取物对急性肝细胞损伤的保护作用。结果显示:五味子提取物能通过提高GSH-PX和SOD酶活力以及抑制脂质过氧化产物MDA的生成来减轻t-BHP对肝细胞的损伤,减少GPT的释放,使GPT活力水平的升高受到明显抑制,显著提高肝细胞的存活率,显示出对t-BHP造成的肝细胞急性损伤具有一定的保护作用,且该保护作用可能与其抗氧化和清除自由基的能力有关。本试验结果为进一步了解五味子提取物对损伤肝细胞保护的药理作用机制及筛选更多的中草药提供了基础资料,但五味子醇提取物中各具体成分的保肝药理还需进一步的研究。
本研究中还发现,中药与损伤剂的给予顺序会影响五味子提取物对肝细胞的保护作用。从对生化指标的测定值中可以看出,预防治疗组中五味子提取物对损伤肝细胞的保护效果明显要优于预防组和治疗组,这可能与草药作用的时间长短有关。而预防组的保护效果较治疗组更加明显,可能是五味子提取物对肝损伤的预防作用比治疗作用更重要。
参考文献:
[1] 刘红柏.中草药免疫增强剂的研究现状及其在水产上的应用[J].水产学杂志,2002,15(2):91-94.
[2] 郭艳芳,胡文祥.几种保肝降酶单味中药研究进展[J].中华现代中医学杂志,2007,3(2):116-119.
[3] Zheng Q Z,Lou Y J.Pathologic characteristics of immunologic injury in primary cultured rat hepatocytes and protective effect of glycyrrhizin in vitro[J].Acta Pharmacologica Sinica,2003,24(8): 771-777.
[4] Grajeda-Cota P,Ramírez-Mares M V,Gonzalez M E.Vitamin C protects against in vitro cytotoxicity of cypermethrin in rat hepatocytes[J].Toxicology in Vitro,2004,18(1):13-19.
[5] Jamshidzadeh A,Fereidooni F,Salehi Z,et al.Hepatoprotective activity of Gundelia tournefortii[J].Journal of Ethnopharmacology, 2005,101(1-3):233-237.
[6] McGowan J A,Strain A J,Bucher N R.DNA synthesis in primary cultures of adult rat hepatocytes in a defined medium:Effects of epidermal growth factor,insulin,glucagon,and cyclic-AMP[J]. Cellular Physiology,1981,108(3):353-363.
[7] 陈延镛,舒增宝,黎莲娘.五味子的研究——北五味子降谷丙转氨酶有效成分的分离、鉴定[J].中国科学,1976(1):98-101.
[8] 王胜春,田卫斌,胡咏武,等.柴胡丹参五味子加减配伍对小鼠慢性肝损伤的作用[J].解放军药学学报,2002,18(1):37-39.
[9] 宋小妹,曹林林,董彬彬,等.南五味子有效成分的提取工艺研究[J].现代中医药,2003(5):24-25.
[10] 李效宇,刘永定,宋立荣.鲢、鲤和鲫肝细胞原代培养[J].水生生物学报,2001,25(4):420-421.
[11] 郑永唐,贲昆仑.测定细胞存活和增殖的MTT方法的建立[J].免疫学杂志,1992,8(4):266-269.
[12] Brain S D,Williams T J,Tippins J R,et al.Calcitonin gene-related peptide is a potent vasodilator[J].Nature,1985,313:54-56.
[13] 杨牧祥,王志波,于文涛,等.中药酒速愈对急性酒精中毒小鼠肝脏氧化酶的影响[J].中国中西医结合急救杂志,2006,13 (3):162-164.
[14] 陈梁,朱锦善,任建平.柴胡疏肝散对四氯化碳所致大鼠急性肝损伤的防治作用[J].中西医结合肝病杂志,2004,14(1):42 -43.
[15] 王小莺,胡国良,张彩英,等.保肝护脾液对四氯化碳所致小鼠急性肝损伤的保护作用[J].中兽医学杂志,2006(2):10-11.
[16]Baek S M,Kwon C H,Kim J H,et al.Differential roles of hydrogen peroxide and hydroxyl radical in cisplatin-induced cell death in renal proximal tubular epithelial cells[J].J Lab Clin Med,2003, 142(3):178-186.
[17] 齐彦,郭丽新,周迎春,等.五味子对四氯化碳所致小鼠急性肝损伤的作用研究[J].中医药学报,2009,37(4):26-27.
[18] 胡彦武.五味子藤茎对小鼠酒精性肝损伤血清转氨酶的影响[J].食品与药品,2008,10(11):53-54.
[19] Gutteridge J M C.Lipid peroxidation and antioxidants as biomarkers of tissue damage[J].Clin Chem,1995,41:1819-1828.
[20] Mansour M A.Protective effects of thymoquinone and desferrioxamine against hepatotoxicity of carbon tetrachloride in mice[J]. Life Sci,2000,66:2583-2591.
[21] Hu Y Y,Liu C H,Wang R P,et al.Protective actions of salvianolic acid A on hepatocyte injured by peroxidation in vitro[J].World J Gastroenterl,2000,6(3):402-404.
[22] 陈荣华,吴向阳,仰榴青,等.五味子醇提残渣中粗多糖的体外抗氧化活性研究[J].时珍国医国药,2009,20(6):1512-1513.
[23] 刘玉芹.女贞子、五味子及其与寡聚糖配伍对肉鸡免疫功能和抗氧化指标的影响[J].河北科技师范学院学报,2009,23 (1):7-11.
[24] Koneri R,Balaraman R,Firdous Vinoth,et al.Hepatoprotective effects of Momordica cymbalaria Fenzl against carbon tetrachloride induced hepatic injury in rats[J].Pharmacologyonline,2008(1): 365-374.
[25] 燕菲,张巧燕,张宏,等.五味子与黄芪多糖协同保护对乙酰氨基酚致小鼠急性肝损伤[J].药学实践杂志,2009,27(5): 340-344.
Protective effects of schisandrins extracts on injuried primary cultured hepatocytes induced by t-BHP in crucian carp Carassius auratus gibel
CAO Li-ping1,JIA Rui2,DING Wei-dong1,YIN Guo-jun1
(1.Key Open Laboratory for Genetic Breeding of Aquatic Animals and Aquaculture Biology,Ministry of Agriculture,Freshwater Fisheries Research Center,Chinese Academy of Fishery Sciences,Wuxi 214081,China;2.Wuxi Fisheries College,Nanjing Agricultural University,Wuxi 214081,China)
Abstract:The activities of inhibiting alanine minotransferase(GPT),malondisldehyde(MDA),superoxide dismutase(SOD),and glutathione peroxidas(GSH-PX)in cell culture supernatants and the survival rate of the injuried hepatocytes in vitro induced by t-BHP and then exposed to various concentrations of Schisandrins extracts (0.1,0.2 and 0.4 mg/mL)before(defense),after(treatment)and both before and after(defense-treatment) the culture were determined in the crucian carp Carassius auratus gibel to study on the protective and antioxidant effects of the Schisandrins extract.The model of acute hepatopancreatic damage was found to be established by exposure to 1 mmoL/L t-BHP for 2 h.The extracts were found to reduce the injury of hepatopancrease by increasing the activity of glutathione peroxidas(GSH-PX)and superoxide dismutase(SOD),restraining the lipid peroxidation production-malondisldehyde(MDA),inhibiting alanine minotransferase(GPT),to release and to remarkably improve the survival of the hepatocytes(P<0.05,or P<0.01)in the supernatant of cultured hepatocytes injured by t-BHP induction.It is concluded that the Schisandrins extracts possess direct protective effect on primary hepatocyte injury induced by t-BHP,which is primarily involved in the scavenging oxygen free radicals and anti-oxidative activity of CMPS.The biochemical indicators showed that the protection of the extracts were significantly better in the defense-treatment group(DT)than that in the defense group(D)and treatment group(T).
Key words:Carassius auratus gibel;Schisandrins extract;primary culture;model
文章编号:2095-1388(2011)03-0197-06
中图分类号:S917
文献标志码:A
收稿日期:2010-08-29
基金项目:科技部国际科技合作项目(2009DFA32620);江苏省国际科技合作计划(BZ2008008);无锡市科技计划(国际科技合作) (CZE00906);中央级公益性科研院所基本科研业务费专项资金(中国水产科学研究院淡水渔业研究中心)资助项目(2011JBFC05);广东省渔业生态环境重点实验室开放基金课题(LFE-2009-02)
作者简介:曹丽萍(1977-),女,助理研究员。E-mail:caolp@ffrc.cn
通信作者:殷国俊,男,研究员。E-mail:yingj@ffrc.cn