表1 新西兰兔的免疫程序
Tab.1 Rabbit immunization program
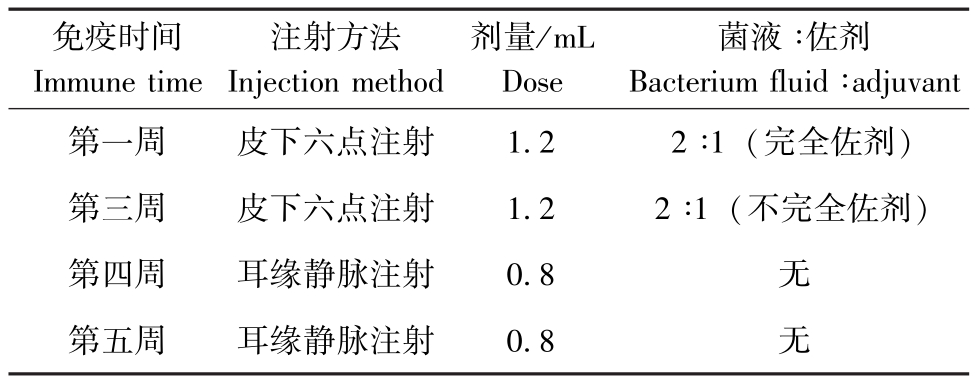
免疫时间Immune time Bacterium fluid∶adjuvant第一周皮下六点注射1.22∶1(完全佐剂)注射方法Injection method剂量/mL Dose菌液∶佐剂第三周皮下六点注射1.22∶1(不完全佐剂)第四周耳缘静脉注射0.8无第五周耳缘静脉注射0.8无
王忠1,邓灯1,刘慧1,程顺峰1、2,张晓君2,王文琪1
(1.青岛农业大学动物科技学院,山东青岛266109;2.淮海工学院江苏省海洋生物技术重点建设实验室,江苏连云港222005)
摘要:采用十二烷基肌氨酸钠(Sarkosyl)和苯甲基磺酰氟(PMSF)两种方法提取两种海洋致病性弧菌——鱼肠道弧菌Vibrio ichthyoenteri和秦皇岛弧菌Vibrio qinhuangdaora sp.nov.的外膜蛋白,并应用SDSPAGE分析了其外膜蛋白的构成。电泳图谱显示,相对分子质量为44 000、36 000、34 000、26 000、23 000的蛋白条带为两种弧菌外膜蛋白中的共有条带。采用Western-Blotting法比较了两种弧菌外膜蛋白抗原性的异同,结果表明,鱼肠道弧菌外膜蛋白中相对分子质量分别为46 000、43 000、34 000、32 000、28 000、26 000的结构蛋白可同时与两种弧菌抗血清发生反应;秦皇岛弧菌外膜蛋白中相对分子质量分别为46 000、26 000的结构蛋白可同时与两种弧菌抗血清发生反应。两种弧菌中均存在相对分子质量为46 000、26 000的外膜蛋白,且具有共同的抗原性。
关键词:鱼肠道弧菌;秦皇岛弧菌;外膜蛋白;抗原性
鱼肠道弧菌Vibrio ichthyoenteri为革兰氏阴性致病菌,秦皇岛弧菌Vibrio qinhuangdaora sp.nov.为新发现的一种革兰氏阴性致病菌。这两种菌可感染大菱鲆Scophthalmus maximus、牙鲆Paralichthys olivaceus、石鲽kareius bicoloratus等海水养殖经济鱼类,已对中国水产养殖业造成了一定危害[1-5]。外膜蛋白(outer membrane protein,OMP)是革兰氏阴性细菌细胞壁中所特有的结构,国内外已对OMP免疫原性和免疫保护性进行了大量研究,结果证实在确定致病性弧菌共同保护性抗原的基础上,可制备针对不同种、不同血清型弧菌的疫苗。目前,对多种致病性海洋弧菌的OMP已有一些研究[4-12],但对鱼肠道弧菌与秦皇岛弧菌OMP的相关比较研究尚未见报道。本研究中,作者以鱼肠道弧菌、秦皇岛弧菌为试验材料,采用十二烷基肌氨酸钠(Sarkosyl)和苯甲基磺酰氟(PMSF)法提取两种弧菌的OMP,制备两种弧菌的全菌血清,并利用Westernblotting技术分析了这两种弧菌OMP的抗原性。
1.1 材料
鱼肠道弧菌、秦皇岛弧菌由淮海工学院江苏省海洋生物技术重点建设实验室提供,其中秦皇岛弧菌是从患败血症的牙鲆上分离的,经鉴定为弧菌属一个新菌种,且经中国典型培养物保藏中心(China Center for Type Culture Collection,CCTCC)复核鉴定并依据《细菌命名国际法规》(ICNB)分类定名[1-3]。纯系新西兰大白兔从青岛药检所购得。
弗氏完全佐剂、不完全佐剂、十二烷基肌氨酸钠、苯甲基磺酰氟(PMSF)、碱性磷酸酶标记羊抗兔IgG、氯化硝基四氮唑蓝(NBT)、5-溴-4-氯-3-吲哚-磷酸(BCIP)、硝酸纤维素膜(NC膜)均购自Sigma公司。
1.2 方法
1.2.1 兔抗鱼肠道弧菌、秦皇岛弧菌全菌血清的制备 1)菌悬液的制备。将两种弧菌分别接种于营养肉汤培养基中,28℃下富集培养24 h;以3 000 g离心10 min,用10 mmol/L磷酸盐缓冲液(PBS,pH为7.4)重悬,用McFarland比浊法定细菌浓度为9×109CFU/mL;用体积分数为0.2%的福尔马林灭活24 h(4℃),涂布于平板,28℃下培养24 h,无活菌;4℃下以3 000 g离心20 min,等体积PBS重悬沉淀,分装并于4℃下保存。
2)抗血清的制备。免疫纯系雌性新西兰健康大白兔,免疫程序如表1所示。
表1 新西兰兔的免疫程序
Tab.1 Rabbit immunization program

免疫时间Immune time Bacterium fluid∶adjuvant第一周皮下六点注射1.22∶1(完全佐剂)注射方法Injection method剂量/mL Dose菌液∶佐剂第三周皮下六点注射1.22∶1(不完全佐剂)第四周耳缘静脉注射0.8无第五周耳缘静脉注射0.8无
于第5周加强免疫后的第6天抽血,测定抗体效价大于3 200,第7天从心脏一次性采血,室温下倾斜放置1 h后转入4℃下过夜;4℃下以3 000 g离心20 min得抗血清,分装,于-70℃下保存。
1.2.2 外膜蛋白的制备 1)用Sarkosyl法提取OMP[5]。将150 mL菌悬液以3 000 g离心20 min,沉淀用20 mmol/L Tris-HCl缓冲液(pH为8.0)于4℃下离心(3 000 g),洗涤3次,而后用上述缓冲液重悬;采用冰浴超声波破碎5 min(功率为200 W,破碎5 s,间歇5 s),然后于4℃下离心20 min(3 000 g),取上清液离心30 min(3000 g),沉淀用400 μL 15 mmol/L Tris-HCl缓冲液(pH为7.6,含22.5 g/L的Sarkosyl)、1 400 μL 10 mmol/L Tris-HCl缓冲液(pH 7.6,含15 g/L的Sarkosyl)及100 μL重蒸水重悬;32℃下水浴30 min,4℃下离心30 min(23 000 g),用20 mmol/LTris-HCl缓冲液(pH为7.4)重悬沉淀;4℃下以23 000 g离心30 min,沉淀用PBS重悬,即为OMP样品,分装并于-20℃下保存。
2)用PMSF法提取外膜蛋白。参照文献[13]等的方法略有改动。将摇瓶培养的菌悬液150 mL置于离心管中,振荡均匀,4℃下以3 000 g离心20 min,弃上清液,沉淀于4℃下以3 000 g离心洗涤3次;将沉淀用10 mL含有2 mmol/L PMSF的PBS液重悬,水浴40 min(45℃);采用超声波破碎5 min(功率为200 W,破碎5 s,间歇5 s),再于4℃下以23 000 g离心30 min,上清液即为OMP样品,分装并于-20℃下保存。
1.2.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE) 采用解离非连续缓冲系统垂直板电泳,电泳凝胶由质量分数为12%分离胶和5%浓缩胶两部分组成。鱼肠道弧菌、秦皇岛弧菌OMP分别与电泳样品缓冲液(含0.5 mol/L的Tris-HCl (pH 6.8)、10 g/L的SDS、10 g/L的疏基乙醇、体积分数为10%的甘油、0.2 g/L的溴酚蓝)等体积混匀,煮沸5 min,冷却后加样,每孔加15 μL样品;采用Tris甘氨酸(Gly)电泳缓冲液(0.025 mol/L tris-Base、0.25 mol/L甘氨酸、0.1%SDS、pH为8.3)4℃下电泳;浓缩胶部分恒定电流为30 mA,分离胶部分恒定电流为60 mA。电泳结束后,凝胶经前固定液固定,考马斯亮蓝R250染色后用全自动凝胶成像系统扫描,用Gel-Pro软件分析各分离蛋白的相对分子质量。
1.2.4 Western-blotting免疫印迹 取出凝胶转移到电泳转移槽中,加入转移缓冲液(0.025 mol/L Tris、0.1925 mol/L Gly、20%甲醇、pH 8.3)200 mA,转移3.5 h;而后取出NC膜,用50 g/L牛血清白蛋白于37℃下封闭1 h,用PBST(含体积分数为0.05%Tween-20的PBS缓冲液)洗涤3次,每次5 min;将膜浸于抗鱼肠道弧菌全菌血清(1∶1 000)或抗秦皇岛弧菌全菌血清(1∶1 000)中,37℃下温育1 h,再用PBST洗涤3次,每次5 min;以正常兔血清代替第一抗体,作为阴性对照,将膜置于碱性磷酸酶标记的羊抗兔IgG(1∶500)中,37℃下温育1 h,用PBST洗涤3次,每次5 min;最后将膜置于20 mL现配制的NBT/BCIP发色液中发色。
2.1 外膜蛋白的SDS-PAGE
用PMSF法提取鱼肠道弧菌OMP共有20条带,相对分子质量为43 000~66 000和23 000~36 000,用该法提取秦皇岛弧菌OMP共有20条带,相对分子质量为46 000~58 000和26 000~36 000;用Sarkosyl法提取鱼肠道弧菌OMP有13条带,相对分子质量为26 000~48 000,该法提取秦皇岛OMP共有10条带,相对分子质量为32 000~44 000(图1-(a))。
2.2 Western-blotting免疫印迹
抗鱼肠道弧菌抗体与用Sarkosyl法提取的两种弧菌抗原反应的蛋白带的相对分子质量为:鱼肠道弧菌84 000、76 000、62 000、46 000、44 000、43 000、36 000、34 000、28 000、26 000;秦皇岛弧菌46 000、36 000、26 000。抗秦皇岛弧菌抗体与用Sarkosyl法提取的两种弧菌抗原反应的蛋白带的相对分子质量为:鱼肠道弧菌46 000、43 000、34 000、32 000、28 000、26 000;秦皇岛弧菌49 000、46 000、44 000、43 000、34 000、32 000、26 000、23 000。
抗鱼肠道弧菌抗体与用PMSF法提取的两种弧菌的抗原反应结果为:鱼肠道弧菌蛋白带有13条,相对分子质量为26 000~36 000;秦皇岛弧菌蛋白带有6条,相对分子质量为63 000、54 000、52 000、44 000、36 000、26 000。抗秦皇岛弧菌抗体与用PMSF法提取的两种弧菌的抗原反应结果为:鱼肠道弧菌蛋白带有7条,相对分子质量为42 000~52 000;秦皇岛弧菌蛋白带有12条,相对分子质量为26 000~52 000(图1-(b)、(c))。
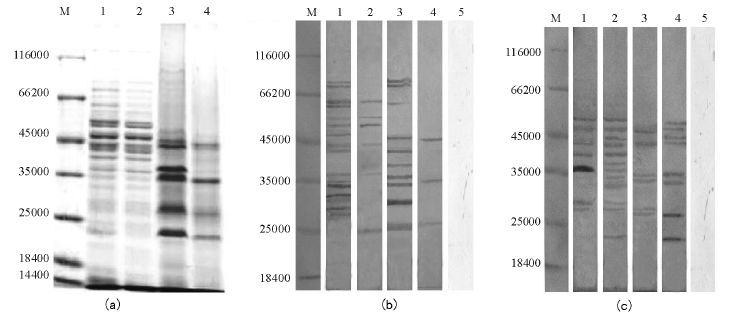
图1 两种弧菌外膜蛋白的SDS-PAGE图谱(a)以及与抗鱼肠道弧菌全菌(b)、抗秦皇岛弧菌全菌(c)血清的免疫印迹结果
Fig.1 SDS-PAGE of OMPs in two Vibrio(a),and westtern-blotting profiles of OMPs of the two strains Vibrio strains with antiserum against Vibrio ichthyoenteri whole cells(b),and Vibrio qinhuangdaora sp.nov.whole cells(c)
注:M Marker;1为用PMSF法提取鱼肠道弧菌OMP,OMPs of Vibrio ichthyoenteri by PMSF;2为用PMSF法提取秦皇岛弧菌OMP,OMPs of Vibrio qinhuangdaora sp.nov.by PMSF;3为用Sarkosyl法提取鱼肠道弧菌OMP,OMPs of Vibrio ichthyoenteri by Sarkosyl;4为用Sarkosyl法提取秦皇岛弧菌OMP,OMPs of Vibrio qinhuangdaora sp.nov.by Sarkosyl;5为阴性对照,Negative control。
通过比对用Sarkosyl、PMSF方法提取的两种弧菌OMP的Westtern-blotting结果可知,鱼肠道弧菌OMP中相对分子质量为46 000、43 000、34 000、32 000、28 000、26 000的结构蛋白可同时与抗鱼肠道弧菌抗体、抗秦皇岛弧菌抗体反应;秦皇岛弧菌OMP中相对分子质量为46 000、26 000的结构蛋白可同时与抗鱼肠道弧菌抗体、抗秦皇岛弧菌抗体反应。
目前,关于鳗弧菌Vibrio anguillarum、溶藻胶弧菌Vibrio alginolyticus、溶血弧菌Vibrio parahaemolyticus、哈维氏弧菌Vibrio harveyi和创伤弧菌Vibriovulnificus等OMP构成的分析较多[4-5,8-9,13-15]。如唐小千等[4]采用Sarkosyl法提取的鱼肠道弧菌OMP由7条带组成;张伟妮等[5]利用Sarkosyl法提取的鱼肠道弧菌有6条蛋白带组成。本研究中用Sarkosyl法提取的鱼肠道弧菌OMP有13条带。产生这一差异可能与同种细菌OMP组成的异同和细菌的培养条件、OMP的制备方法、菌株的致病性及其来源、血清型等有关[5,8,14]。
战文斌等[15]报道,Westtern-blotting法具有直观性和特异性。本试验中采用该法分析OMP抗原性,病原菌经SDS-PAGE电泳,将样品中的蛋白质组分进行初步分离,经Western-blotting转印,可将电泳后的蛋白带转移至硝酸纤维素膜上,显示出不同病原菌的特异性抗原决定簇,并可计算出特异性蛋白带的相对分子质量。病原细菌各有其特异的抗原决定簇,决定了病原菌种的抗原特异性。虽在同属细菌间存在交叉反应,但通过Westternblotting可以直观地看出各细菌抗原决定簇的多少和特异性蛋白带相对分子质量的大小。本试验结果表明,用Sarkosyl法提取的鱼肠道弧菌OMP与抗秦皇岛弧菌全菌血清有6条阳性条带;而用Sarkosyl法提取的秦皇岛弧菌OMP与抗鱼肠道弧菌全菌血清有3条阳性条带。这说明秦皇岛弧菌OMP上的秦皇岛弧菌与鱼肠道弧菌的共同抗原决定簇,具有较强的免疫原性,免疫动物机体后能产生抗体,而鱼肠道弧菌OMP上的二者共同抗原决定簇其免疫原性较弱,未能激发动物机体产生抗血清。
周丽等[8]在提取鳗弧菌、溶藻胶弧菌的OMP时,发现51 000蛋白带是鳗弧菌、溶藻胶弧菌共同的特异性抗原。张伟妮等[5]报道,36 000蛋白带是鳗弧菌、溶藻胶弧菌、鱼肠道弧菌共同的特异性抗原。唐小千等[4]分析了鳗弧菌、鱼肠道弧菌、溶藻弧菌、副溶血弧菌、哈维氏弧菌和创伤弧菌6种海洋致病性弧菌36 000 OMP的特异性,认为弧菌属内不同的弧菌之间虽然存在一些相对分子质量相同或相近的蛋白,但它们之间并不一定存在免疫交叉特性,即便某几种弧菌之间的相对分子质量相同的蛋白存在免疫交叉,但其蛋白等电点也不尽相同,可能为不同类型的蛋白。本试验中虽然发现鱼肠道弧菌OMP中与两种弧菌抗血清反应的条带有5条,秦皇岛弧菌OMP中与两种弧菌抗血清反应的条带为2条,且相对分子质量为46 000、26 000蛋白带为2种弧菌的共同特异性抗原,但该两种蛋白是否具有相同的抗原决定簇,还需要进一步研究氨基酸组成的排列顺序以及决定氨基酸的基因组。
参考文献:
[1] 陈翠珍,张晓君,房海,等.牙鲆(Paralichthys olivaceus)秦皇岛弧菌感染症及其病原细菌研究[J].海洋与湖沼,2006,37(1): 35-40.
[2] 陈翠珍,房海,张晓君,等.牙鲆鱼肠道弧菌感染症及病原特性研究[J].热带海洋学报,2006,25(5):80-86.
[3] 张晓君.三种海水养殖鱼类的主要细菌性疾病研究[D].青岛:中国海洋大学,2006:1-90.
[4] 唐小千,战文斌,周丽,等.6种海洋致病性弧菌36kDa外膜蛋白特性分析[J].中国海洋大学学报,2009,39(2):197-202.
[5] 张伟妮,周丽,邢婧,等.大菱鲆致病性溶藻弧菌SR1的外膜蛋白及其抗原性分析[J].中国水产科学,2007,14(3):419-424.
[6] Rahman M H,Kuroda A,Dijkstra J M,et al.The outer membrane fraction of Flavobacterium psychrophilum induces protective immunity in rainbow trout and ayu[J].Fish and Shellfish Immunology, 2002,12:169-179.
[7] Maji S,Mali P,Joardar S N.Immunoreactive antigens of the outer membrane protein of Aeromonas hydrophila,isolated from goldfish, Carassius auratus(Linn.)[J].Fish and Shellfish Immunology, 2006,20(4):462-473.
[8] 周丽,刘洪明,战文斌,等.鳗弧菌、溶藻胶弧菌外膜蛋白的分离及特性[J].中国水产科学,2003,10(1):31-35.
[9] 黄志坚,何建国.溶藻弧菌外膜蛋白(Va-OMP)的免疫原性及免疫保护性[J].水产学报,2006,30(4):538-543.
[10] 高磊,李健,王群,等.鳗弧菌L218株的限铁条件和铁调节外膜蛋白的免疫效果[J].水产学报,2007,31(4):472-477.
[11] 李晓霞,邱玉玉,王海荣.肠致病性大肠杆菌外膜蛋白免疫保护性研究[J].中国免疫学杂志,2007,23(5):394-397.
[12] Mao Z J,Yu L,You Z Q,et al.Cloning,expression and immunogenicity analysis of five outer membrane proteins of Vibrio parahaemolyticus zj2003[J].Fish and Shellfish Immunology,2007,23 (3):567-575.
[13] 田丁,林天龙,龚晖,等.创伤弧菌外膜蛋白的分离及其抗原性分析[J].福建农学报,2008,23(4):337-341.
[14] 刘洪明.水产动物主要病原细菌免疫特性的比较研究[D].青岛:中国海洋大学,2003.
[15] 战文斌,齐继光,刘洪明,等.水产动物6种主要病原菌与抗血清的免疫交叉反应[J].中国水产科学,2004,11(1):14-19.
Atigenicity comparison of outer membrane proteins in two bacteria Vibrio ichthyoenteri,and Vibrio qinhuangdaora sp.nov.
WANG Zhong1,DENG Deng1,LIU Hui1,CHENG Shun-feng1,2,ZHANG Xiao-jun2,WANG Wen-qi1
(1.College of Animal Science and Technology,Qingdao Agriculture University,Qingdao 266109,China;2.Jiangsu Key Laboratory of Marine Biotechnology,Huaihai Institute of Technology,Lianyungang 222005,China)
Abstract:The major outer membrane proteins(OMPs)were extracted from two species bacteria Vibrio ichthyoenteri,and Vibrio qinhuangdaora sp.nov.by Sarkosyl and PMSF methods,and analyzed by SDS-PAGE.The Sarkosyl electrophoresis revealed 6 common protein bands in the extracts,with the common bands with relative molecular weights of 44 000,36 000,34 000,26 000,and 23 000 in Vibrio ichthyoenteri and Vibrio qinhuangdaora sp.nov. Western-blotting were used with rabbit antiserum against Vibrio ichthyoenteri whole cells and Vibrio qinhuangdaora sp.nov whole cells to analyse difference in the strain Vibrio ichthyoenteri and strain Vibrio qinhuangdaora sp.nov. Six OMPs were detected in the strain Vibrio ichthyoenteri with molecular weights of 46 000,43 000,34 000,32 000, 28 000,and 26 000,and two OMPs in the strain Vibrio qinhuangdaora sp.nov with molecular weights of 46 000,and 26 000,indicating that the OMPs with molecular weights of 46 000,and 26 000 were the common special antigen in the two bacterial strains.
Key words:Vibrio ichthyoenteri;Vibrio qinhuangdaora sp.nov;outer membrane protein;antigenicity
文章编号:2095-1388(2011)02-0184-04
中图分类号:S941
文献标志码:A
收稿日期:2010-06-18
基金项目:国家自然科学基金资助项目(30901106);山东省自然科学基金资助项目(Y2007D31,ZR2009DM036);江苏省海洋生物技术重点建设实验室研究基金资助项目(2009HS11);青岛农业大学高层次人才科研基金资助项目(630701)
作者简介:王忠(1984-),男,硕士研究生。E-mail:wangzhongyt@163.com
通信作者:王文琪(1969-),女,教授。E-mail:wenqiwang@qau.edu.cn