仿刺参体腔细胞CD35的化学发光免疫检测
张峰1、2,张莉1,倪慧1,张斯1
(1.大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023; 2.大连海洋大学生命科学与技术学院,辽宁大连116023)
摘要:应用化学发光免疫检测(Chemiluminesent Immunoassay,CLIA)技术检测仿刺参Apostichopus japonicus体腔细胞CD35。单克隆CD35一抗抗体,用辣根过氧化物酶标记羊抗鼠IgG二抗,选择对碘苯酚作为发光增强剂,鲁米诺和过氧化氢作为辣根过氧化物酶的底物;对照组用无菌海水代替一抗和二抗,进行化学发光免疫检测。结果显示:试验组发光值(1 321 596.00)和对照组(16 773.20)的发光值差异极显著(P<0.01);仿刺参体腔细胞膜上能够检测到CD35的存在,表明仿刺参体腔细胞膜上具有补体受体。
关键词:化学发光免疫检测;仿刺参;体腔细胞;CD35
Ⅰ型补体受体(CR1、CD35)是一类相对分子量为90 000~250 000的单链穿膜糖蛋白[1],主要存在于红细胞膜上,并有黏附免疫复合物(IC)使之被吞噬细胞清除的作用。Nelson[2]发现,人类红细胞与特异调理过的梅毒螺旋体及肺炎双球菌结合(称为免疫黏附),首次提出人类红细胞具有免疫黏附的功能,且这种黏附需要激活补体C3,并认为红细胞膜上可能存在免疫黏附受体。Nishioka等[3]证实这种免疫黏附现象是通过人红细胞膜C3受体(第一补体受体,CR1)来实现的。Fearon[4]从人类红细胞上分离纯化到CR1。Siegel等[5]首次提出了“红细胞免疫系统(red cell immune system)”的新概念。Medof通过体外试验证明,红细胞CR1和血浆中I因子共同作用将黏附的免疫复合物(IC)中的C3b降解为C3dg、C3d,而失去致炎性[6]。目前,对Ⅰ型补体受体的研究主要集中在高等脊椎动物,对无脊椎动物特别是棘皮动物尚未见报道。
仿刺参Apostichopus japonicus是北方沿海重要的养殖物种,有很高的营养和经济价值。随着仿刺参养殖规模的不断扩大和病害的日趋严重,从免疫机制上预防和控制疾病的发生显得尤为重要。有关仿刺参补体研究报道较少,张峰等[7-8]研究了仿刺参补体C3类似物,但未见关于仿刺参补体受体CD35的研究,尤其是应用化学发光免疫技术研究的相关报道。化学发光免疫检测技术具有灵敏度高、专一性强、线性范围广、检测时间短及无放射性污染等优点,已被应用于抗原、抗体检测等生物和医学领域并受到广泛关注。本试验中,作者应用化学发光免疫检测(Chemiluminesent Immunoassay, CLIA)技术对仿刺参体腔细胞补体受体CD35进行初步研究,并在高灵敏度的化学发光体系中增加了对碘苯酚发光增强剂,可使鲁米诺发光体系增强1 000倍,以延长化学发光的时间[9],旨在为仿刺参病害防御研究和免疫防治工作提供科学依据。
1 材料与方法
1.1 材料
1.1.1 试验动物 仿刺参(3龄)取自大连旅顺附近海域,平均体质量为300 g左右。取回后置于实验室内水族箱中,避光,充气,沙滤海水流水暂养。试验期间,定期投喂配合饲料,水温为16℃。
1.1.2 主要试剂、缓冲液和发光激发液 主要试剂有:鼠抗人CD35单克隆抗体(深圳晶美生物工程有限公司生产),HRP-羊抗鼠IgG单克隆抗体
(北京博奥森生物技术有限公司生产);鲁米诺(Luminol,Fluka),对碘苯酚(p-iodo-phenol, Fluka),二甲基甲酰胺(DMSO,Amerisco 0231),双氧水(体积分数为30%),EDTA、NaCl、Na2HPO4、KH2PO4等其它试剂均为国产分析纯。
洗涤缓冲液为0.01 mol/L PB(pH 7.4,含9.0 g/L NaCl、体积分数为0.05%的Tween-20)。封闭缓冲液为0.05 mol/L PB(pH 7.4,含9.0 g/L NaCl、10 g/L BSA)。发光激发液由鲁米诺(5× 10-4mol/L)、对碘苯酚(4×10-4mol/L)和双氧水(0.1 mol/L)组成。
1.1.3 仪器 Biosystem ModulusTMMicroplate Multimode Reader化学发光检测仪由Turner公司生产,化学发光检测用白色96孔板(由Promega公司生产)。此外,还有高速离心机和电热恒温水浴锅。
1.2 方法
1.2.1 人红细胞化学发光免疫检测——对照试验
1)人血红细胞的制备。静脉采集新鲜血液,以10∶1的比例加入EDTA-Na2抗凝剂(20 g/L),混匀。以1 500 r/min离心5 min,弃上清液,取底层积压血红细胞,用PBS缓冲液稀释,调节红细胞浓度为108个/mL,44℃下保存待用。
2)人红细胞CD35化学发光免疫测定。取96微孔板,将人血红细胞(108个/mL)加入到微孔板中,每孔加入100 μL,4℃下包被过夜。弃溶液后,用洗涤缓冲液洗板3次,每孔加入封闭缓冲液150 μL,室温下封闭2 h,弃封闭液。在包被有人红细胞的微孔板中,每孔加入鼠抗人Ⅰ型补体受体(CR1/CD35)单克隆抗体100 μL,室温下振荡1.5 h后,用洗涤缓冲液洗涤3次。再将HRP-羊抗鼠IgG单克隆抗体加入到96孔板中,每孔加入100 μL,室温下振荡1.5 h后,洗涤3次。在加样器中加入100 μL激发液,在化学发光检测分析仪上测量各孔的相对发光值RLU(Relative light uints)。试验对照组用分析缓冲液100 μL代替人红细胞样品。
1.2.2 仿刺参体腔细胞的采集与处理 取实验室暂养的健康仿刺参,从仿刺参腹部距口1/3处,用一次性注射器抽取体腔液,加入到装有1 mg/mL EDTA-Na2抗凝剂的离心管中,以1 000 r/min离心5 min。弃上清液,取底层沉积细胞用无菌海水调整细胞浓度为1×108个/mL,4℃下保存待用。
1.2.3 仿刺参体腔细胞化学发光免疫检测 参照文献[10-11]中的方法并加以改进。取96微孔板,每孔加入100 μL仿刺参体腔细胞(108个/mL),4℃下包被过夜。弃溶液后,用洗涤缓冲液洗板3次,每孔加入封闭缓冲液150 μL,室温下封闭2 h,弃封闭液。在包被有仿刺参体腔细胞的微孔板中,每孔加入鼠抗人Ⅰ型补体受体(CR1/CD35)单克隆抗体100 μL,室温下振荡1.5 h后,用洗涤缓冲液洗涤3次。再将HRP-羊抗鼠IgG单克隆抗体加入到96孔板中,每孔加入100 μL,室温下振荡1.5 h后,洗涤3次,在加样器中加入100 μL激发液,在化学发光检测分析仪上,测量各孔的相对发光值RLU。对照组用分析缓冲液100 μL代替仿刺参体腔细胞样品。
1.2.4 仿刺参最适抗凝剂的选择 本试验中,仿刺参体腔液分别用柠檬酸钠、草酸钠和EDTA-Na2作抗凝剂,以期达到最佳的试验效果。
1.3 统计分析
试验结果均用SPSS 13.0软件进行统计分析,显著性差异以P<0.05计。
2 结果
2.1 人红细胞CD35化学发光免疫检测
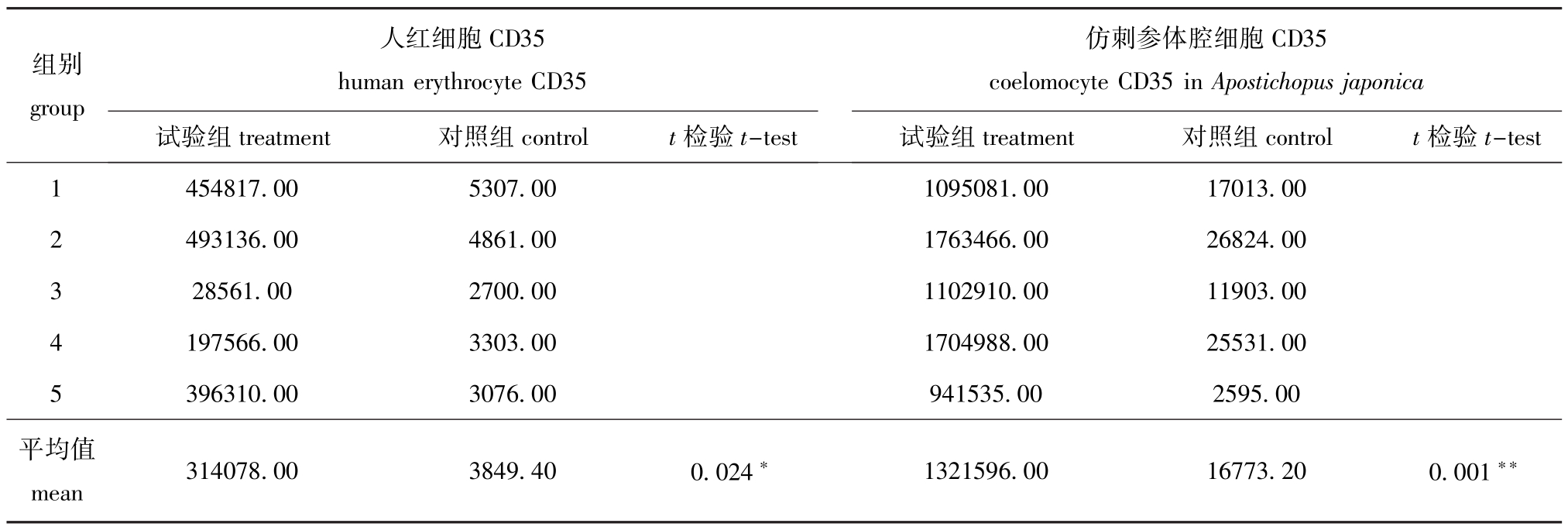
从表1可见:人红细胞膜试验组同对照组差异显著(P<0.05),表明人红细胞膜中存在CD35,同时也证明本试验中应用化学发光免疫检测技术检测细胞膜CD35的可行性及检测结果的可靠性。
2.2 仿刺参体腔细胞CD35化学发光免疫检测
从表1可见:仿刺参体腔细胞膜CD35检测结果显示,试验组与对照组差异极显著(P<0.01),表明仿刺参体腔细胞膜上存在CD35,即仿刺参体腔细胞膜上具有补体受体。
2.3 最适抗凝剂的选择
从表2可见,使用的3种抗凝剂中,EDTANa2的抗凝效果最佳。
3 讨论
以往有关CD35的报道都是针对红细胞进行,显示CD35总数的85%以上存在于红细胞上[4],检测手段主要为花环试验、PCR和流式细胞仪等。本试验中首次将化学发光免疫检测技术应用到对CD35的检测上,不仅检测到人红细胞膜存在CD35,同时也证明仿刺参体腔细胞膜表面也具有
CD35类似物。
表1 人红细胞和仿刺参体腔细胞CD35试验组和对照组发光值的显著性检验
Tab.1 Significance tests of relative light uints(RLU)of human erythrocyte CD35,and coelomocyte CD35 in sea cucumber Apostichopus japonica
注:*表示与对照相差异显著(P<0.05),**表示与对照相差异极显著(P<0.01),下同。
Note:*means significant difference compared with the control(P<0.05),**means very significant difference compared with the control(P<0.01),et sequentia.
组别group人红细胞CD35 human erythrocyte CD35试验组treatment对照组controlt检验t-test Apostichopus japonica试验组treatment对照组controlt检验t-test仿刺参体腔细胞CD35 coelomocyte CD35 in 1 454817.005307.001095081.0017013.00 2 493136.004861.001763466.0026824.00 3 28561.002700.001102910.0011903.00 4 197566.003303.001704988.0025531.00 5 396310.003076.00941535.002595.00平均值mean314078.003849.400.024*1321596.0016773.200.001**
表2 不同抗凝剂效果的比较
Tab.2 Comparison of different anticoagulants
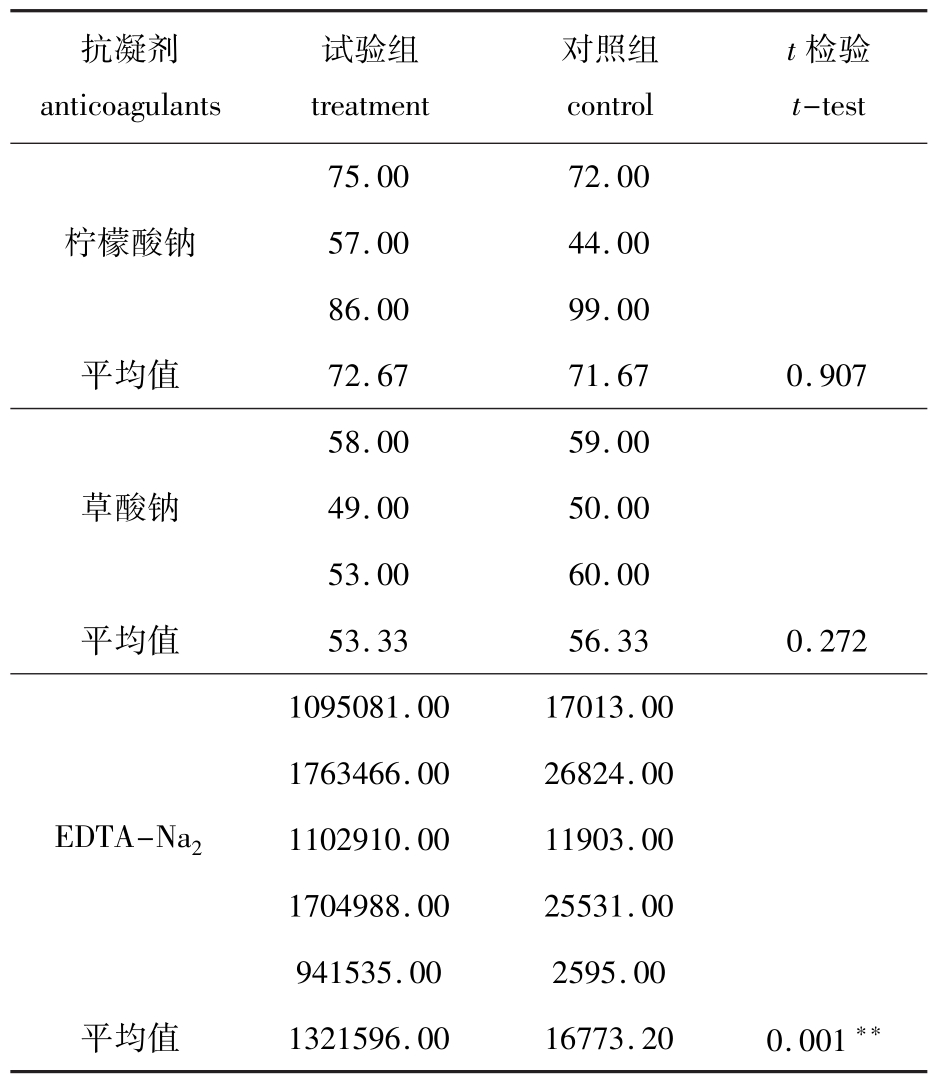
抗凝剂anticoagulants试验组treatment对照组control t检验t-test 75.0072.00柠檬酸钠57.0044.00 86.0099.00平均值72.6771.670.907 58.0059.00草酸钠49.0050.00 53.0060.00平均值53.3356.330.272 1095081.0017013.00 1763466.0026824.00 EDTA-Na21102910.0011903.00 1704988.0025531.00 941535.002595.00平均值1321596.0016773.200.001**
在检测人红细胞CD35时,选择对碘苯酚作为化学发光的增强剂,应用优化的对碘苯酚-鲁米诺-双氧水发光体系进行检测[9],结果表明,试验组与对照组差异显著,能够检测到人红细胞膜上存在CD35,该结果也印证了以往学者关于人类红细胞膜上存在CD35的研究结果,说明化学发光免疫检测技术切实可行,可以将该方法应用到对CD35的检测上。
在人红细胞的检测中,各试验组之间存在差异,其原因可能是由于血液采集对象的不同造成的。CD35的含量因性别而异,男性粒细胞的CD35表达量要高于女性,而女性淋巴细胞和单核细胞特别是单核细胞的CD35表达量却要高于男性[12]。此外,人体中的CD35含量一直处于动态变化之中,随着人体的生理机制以及时间而呈节律性变化,即使同一个体不同时期红细胞的免疫活性也不相同,而且有昼夜节律性。红细胞保存时间的延长,其CR1和C3b结果都有下降趋势,这可能与红细胞的老化有关。国外已有学者利用电子显微镜观察,发现衰老的红细胞与其年轻的相比,其膜表面的CR1分子结构和序列没有改变,但分子数量要明显减少[13]。
目前对水产动物红细胞免疫功能的研究很少。Schraml等[14]发现虹鳟Oncorhynchus mykiss的红细胞具有补体依赖的免疫黏附活性,初步证明了虹鳟红细胞表面有CD35表达。张振冬等[15]首次发现牙鲆红细胞具有黏附金黄色葡萄球菌的功能。本试验中首次检测到仿刺参体腔细胞膜上含有CD35类似物。CD35作为补体受体可以参与清除循环免疫复合物(CIC),还可作为一种补体活化调节因子,可以通过抑制C3转化酶形成和促进C 3b或C 4b降解,阻止补体继续活化。本试验中检测到仿刺参体内存在有CD35类似物,从侧面说明仿刺参体内有补体C3类似物的存在,也说明仿刺参体具有补体系统抗病免疫机制。
在检测因素中用EDTA-Na2作为仿刺参体腔细
胞的抗凝剂能达到最佳的测定效果,而采用柠檬酸钠和草酸钠作为抗凝剂时,仿刺参体腔细胞不能很好地与抗体结合,标记效果不明显,不宜使用。张峰等[16]曾研究过柠檬酸钠、肝素钠、EDTA-Na2和草酸钠4种抗凝剂对仿刺参体腔细胞的抗凝效果。研究结果表明,1.0~1.5 mg/mL EDTA-Na2作为仿刺参体腔细胞的抗凝剂效果最好,即使长时间作用,仍能使细胞保持伸展状态,本试验结果很好地印证了这一点。
参考文献:
[1] Lach-Trifilieff E,Marfurt J,Schwarz S,et al.Complement receptor 1(CD35)on human reticulocytes:normal expression in systemic lupus erythematosus and HIV-infected patients[J].J Immunol, 1999,162(12):7549-7554.
[2] Nelson R A.The immune adherence phenomenon:an immunologically specific reaction between microorganisms and erythrocytes leading to enhanced phagocytosis[J].Science,1953,118(3077): 733-737.
[3] Nishioka K,Linscott W D.Components of guinea pig complement: I.Separation of a serum fraction essential for immune hemolysis and immune adherence[J].J Exp Med,1963,118(5):767-793.
[4] Fearon D T.Regulation of the amplification C3 convertase of human complement by an inhibitory protion isolated from human erythrocyte membrane[J].Proceedings of the National Academy of Sciences of the USA,1979,76(11):5869-5871.
[5] Siegel I,Liu T L,Gieicher N.The red-cell immune system[J]. Lancet,1981,318:556-559.
[6] 赵孟春,李宏全,段瑞旭,等.红细胞免疫系统的回顾与展望[J].畜牧兽医科技信息,2006(1):16-18.
[7] 张峰,宫晶,王海峰,等.仿刺参补体类似物活性的测定[J].大连水产学院学报,2007,22(4):246-247.
[8] 张峰,王海峰,宫晶,等.仿刺参体腔液补体类似物化学发光免疫检测[J].核农学报,2007,21(4):413-416.
[9] 李晓霞.增强化学发光免疫分析的研究进展[J].延安大学学报:自然科学版,2002,21(4):48-53.
[10] Wang F S,Chu F L,Jin L,et al.Acquired but reversible loss of erythrocyte complement receptor 1(CR1,CD35)and its longitudinal alteration in patients with severe acute respiratory syndrome [J].Clin Exp Immunol,2005,139(1):112-119.
[11] 焦奎,张书圣.酶联免疫分析技术及应用[M].北京:化学工业出版社,2004:162-164.
[12] 顾静雄,马坚.CD35表达的性别差异与自身免疫病易感性[J].江苏医药,1999,25(6):425-426.
[13] Fishelson Z,Marikovsky Y.Reduced CR1 Expression on aged erythrocytes:immuno-eletron microscopic and functional analysis [J].Mech Ageing Dve,1993,72(1):25-35.
[14] Schraml B,Baker M A,Reilly B D.A complement receptor for opsonized immune complexes on erythrocytes from Oncorhynchus mykiss but not Ictalarus punctatus[J].Molecular Immunology, 2006,43(10):1595-1603.
[15] 张振冬,张培军,莫照兰.牙鲆红细胞免疫功能的初步研究[J].高技术通讯,2006,16(12):1312-1315.
[16] 张峰,宋志东,刘洪伟,等.4种抗凝剂对刺参体腔细胞的抗凝效果[J].大连水产学院学报,2006,21(1):87-89.
Detection of CD35 in coelomocytes of sea cucumber Apostichopus japonicus by chemiluminescence immunoassay
ZHANG Feng1,2,ZHANG Li1,NI Hui1,ZHANG Si1,
(1.Key Laboratory of Marine Bio-resources Restoration and Habitat Reparation in Liaoning Province,Dalian Ocean University,Dalian 116023,China;2.School of Life Science and Technology,Dalian Ocean University,Dalian 116023,China)
Abstract:The CD35 analogue in coelomocytes of sea cucumber Apostichopus japonica was defected by chemiluminesent immunoassay(CLIA)in which monoclonal CD35 antibody was used as primary antibody,horseradish peroxidase(HRP)-conjugated goat monoclonal anti-mouse IgG as secondary antibody,p-iodo-phenol as luminous reinforcing agent,and luminol solution-H2O2as the substrate of HRP.In the control group,free bacteria physiological solution as monoclonal anti-secondary antibody.There was significant difference in the relative light unit (RLU)in the experiment group(1 321 596.00)and control group RLU(16 773.20)(P<0.01).The results showed that the CD35 was found in the coelomocytes membrane of the sea cucumber,indicating that there is complement body in the coelomocytes membrane of the sea cucumber.
Key words:chemiluminescence immunoassay;Apostichopus japonicus;coelomocyte;CD35
文章编号:2095-1388(2011)02-0176-04
中图分类号:TS207.5
文献标志码:A
收稿日期:2010-04-12
基金项目:国家自然科学基金资助项目(3047132)
作者简介:张峰(1957-),男,教授。E-mail:fengz57@gmail.com

