
王贤玉1,宋洁1、2,王伟利1,姜兰1,罗理1,柯剑1、2
(1.中国水产科学研究院珠江水产研究所,广东广州510380;2.上海海洋大学水产与生命学院,上海201306)
摘要:在水温为(25±2)℃下,按10 mg/kg的剂量给吉富罗非鱼Oreochromis niloticus单次口服氧氟沙星,用高效液相色谱法测定鱼血浆和组织中的药物浓度,研究氧氟沙星在吉富罗非鱼体内的代谢及消除规律。结果表明:血浆及组织药时数据均符合一级吸收二室开放模型,吸收分布迅速,但消除较为缓慢,血浆、肌肉、肝胰脏、肾脏中的达峰时间(Tmax)分别为0.41、3.19、0.18、0.59 h;最大血药浓度分别为7.98 μg/mL、17.24、36.10、46.65 μg/g,组织中肝胰脏的药物浓度最高,在测定时间内各组织的药物浓度均高于血浆;药物消除速度依次为肾脏>肌肉>肝胰脏,消除半衰期(T1/2β)分别为12.90、19.45、28.27 h。以10 μg/kg为最高残留限量,在本试验条件下,建议休药期不低于8 d。在治疗罗非鱼疾病时,氧氟沙星的给药剂量为10 mg/kg,每天两次,连续使用2~3 d。
关键词:吉富罗非鱼;药代动力学;氧氟沙星;残留
氧氟沙星(Ofloxacin,OFLX)又名氟嗪酸,为第三代喹诺酮类抗菌药物,具有广谱、高效、低毒等特点[1]。该药在食用动物中的残留会引起人类病原菌对其产生耐药性,其产生的毒副作用还会对人体产生直接的危害[2],因而已引起人们的关注。目前,有关OFLX在吉富罗非鱼(GIFT strain Oreochromis niloticus)体内的药动学研究国内外尚未见报道,且同一种药物在不同动物种类、不同温度条件下其药动及残留特征也有所差别[3-4]。为此,本试验中作者探讨了口灌给药后,OFLX在吉富罗非鱼体内的药代动力学特征,旨在了解OFLX在吉富罗非鱼组织中的代谢过程和消除规律,并对OFLX在吉富罗非鱼体内的残留监控进行指导,同时为推荐临床用药及建议休药期提供参考。
1.1 材料
吉富罗非鱼由珠江水产研究所实验基地提供,健康无伤病,体质量为(200±10)g。试验前将试验鱼在池中暂养1周,水温控制在25℃,用增氧泵充氧,饲喂不含任何药物的全价饲料。经抽查,所有试验用吉富罗非鱼组织中均不含OFLX。
氧氟沙星标准品质量分数为98.6%,由中国药品生物制品检验所提供。甲醇和乙腈为HPLC级,其它试剂均为分析纯。
试验仪器有Waters-2695高效液相色谱仪并配有Waters-2475荧光检测器,匀浆机(德国IKA T18),分析天平(瑞士METTLER TOLEDO),振荡器(太仓市科教器材厂),回旋振荡器(上海一恒科技仪器有限公司),离心机(SIGMA)。
色谱条件:色谱柱为Waters Atlantis dC18色谱柱(150 nm×4.6 mm,5 μm);流动相为φ(乙腈)∶φ(磷酸缓冲液)=18∶82(0.01 mol/L磷酸,用三乙胺调pH值为3.0),过滤脱气后现用;流速为1.0 mL/min;柱温为30℃;激发波长为280 nm;发射波长为450 nm;进样量为20 μL。
1.2 方法
1.2.1 试验设计及采样 试验用吉富罗非鱼共56
尾,随机分为14组,每组4尾,每一时间点取1组鱼,另取数尾未给药的吉富罗非鱼作为空白对照。将试验鱼用套有塑料软管的注射器以10 mg/kg给药剂量口灌OFLX溶液(用超纯水配制),无回吐者保留试验。给药前禁食24 h,给药4 h后投饵,并于给药后0.083、0.5、0.75、1、2、4、6、12、16、24、48、72、96、120 h分别取血浆、肌肉、肝胰脏和肾脏样品,全部样品置于-20℃冰箱冷冻保存,用于药物分析。
1.2.2 前处理方法 将血浆于室温下解冻,漩涡混匀。准确吸取0.5 mL置于2 mL塑料离心管中,沿管壁缓缓加入0.5 mL体积分数为5%的三氯乙酸·甲醇溶液,漩涡1 min,混匀后以12 000 r/min离心15 min。取上清液,经0.45 μm微膜过滤后置于棕色进样瓶中,用高效液相色谱仪进行检测。
称取组织样品(包括肌肉、肝胰脏、肾脏) 2.0 g(精确到0.01 g),加入4 mL体积分数为6%的高氯酸,高速均质1 min,水平震荡30 min,以3 000 r/min离心10 min。取上清液2 mL(肝胰脏样品中加2 mL正己烷脱脂),以10 000 r/min离心10 min,肝胰脏样品需去除正己烷层,用0.45 μm微膜过滤后置于棕色进样瓶中,用高效液相色谱仪进行检测。
1.2.3 血浆标准曲线的制备 准确吸取0.5 mL血浆于2 mL塑料离心管中,依次加入系列浓度的OFLX标准液,分别制得0.05、0.1、0.2、0.5、1.0、5.0 mg/L的血浆加标样品(n=4),涡旋混匀,静置30 min,按“1.2.2”节方法处理和测定。将测得的氧氟沙星药物峰面积的平均值(X)与所对应的药物浓度(Y)作线性回归,求得标准曲线回归方程和相关系数(R)。
1.2.4 肌肉、肝胰脏、肾脏标准曲线的制备 准确称取组织样品2.0 g,依次加入系列浓度的OFLX标准液,制得0.1、0.2、0.5、1.0、2.0、5.0 mg/kg的组织加标样品(n=4)。静置30 min。按“1.2.2”节方法处理和测定。将测得的氧氟沙星药物峰面积的平均值(Y)与所对应的药物浓度(X)做线性回归,求得标准曲线回归方程和相关系数(R)。
1.2.5 检测限(LOD)与定量限(LOQ)的确定
准确取0.5 mL血浆或2.0 g鱼组织样品,分别添加标样制得0.01、0.02、0.05、0.075、0.1 mg/L(mg/kg)添加样品,每个浓度设4个重复,按上述方法进行处理和测定。3倍信噪比计算为检测限,10倍信噪比定为定量限。
1.2.6 回收率及变异系数的测定 准确取0.5 mL血浆或2.0 g鱼组织样品,分别添加标样制得0.1、0.5、1.0 mg/L(mg/kg)添加样品,静置30 min,按照上述方法处理和测定。每个浓度设4个重复,共做4批。将所测得的药物峰面积(S)分别按回收率计算公式和变异系数计算公式计算,得出回收率和变异系数。
1.3 数据处理与休药期的计算
1.3.1 数据处理 各组织药物浓度平均值-时间数据采用3P97药动学参数计算程序处理,并自动选择最佳模型,进行线性拟合并得到相关参数。
1.3.2 休药期的计算 根据OFLX在吉富罗非鱼体内的药动学特征,在消除后期服从指数消除:
C=C0e-kt,
故可以先用残数法(用消除相的最后几个点的药时浓度数据)来计算消除速率常数(β),以时间为横坐标,药物浓度的常用对数lgC为纵坐标,并用Excel软件进行一元线性回归,计算斜率。消除速率常数β=-斜率×2.303。故可以根据消除后期测定的组织药物浓度及规定的最高残留限量(MR),用下面的公式计算各组织药物浓度降至规定水平所需时间T:

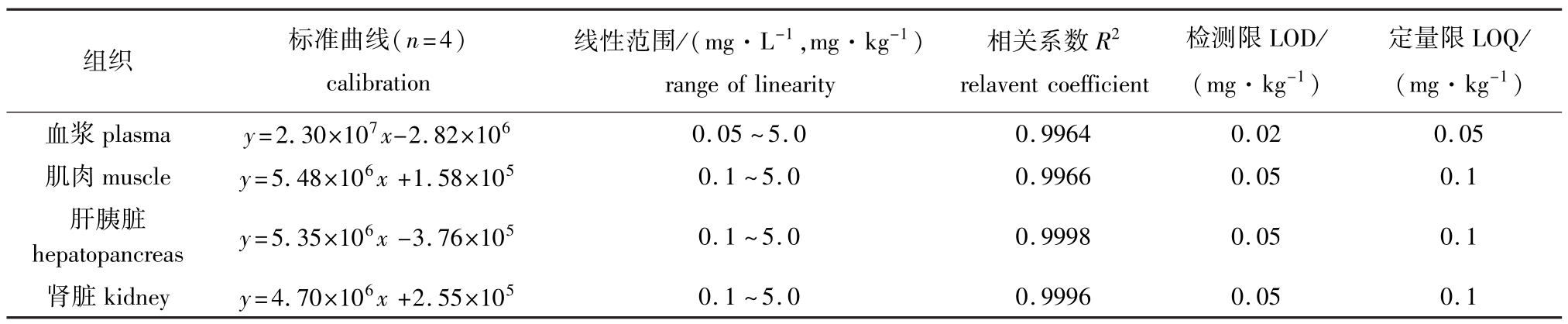
2.1 标准曲线与最低检测限
本试验中采用外标法定量,得到数据线性回归计算标准曲线,所得各种药物的相关系数(R2)均在0.9900~0.9999,检测限低,能满足残留检测的要求(表1)。
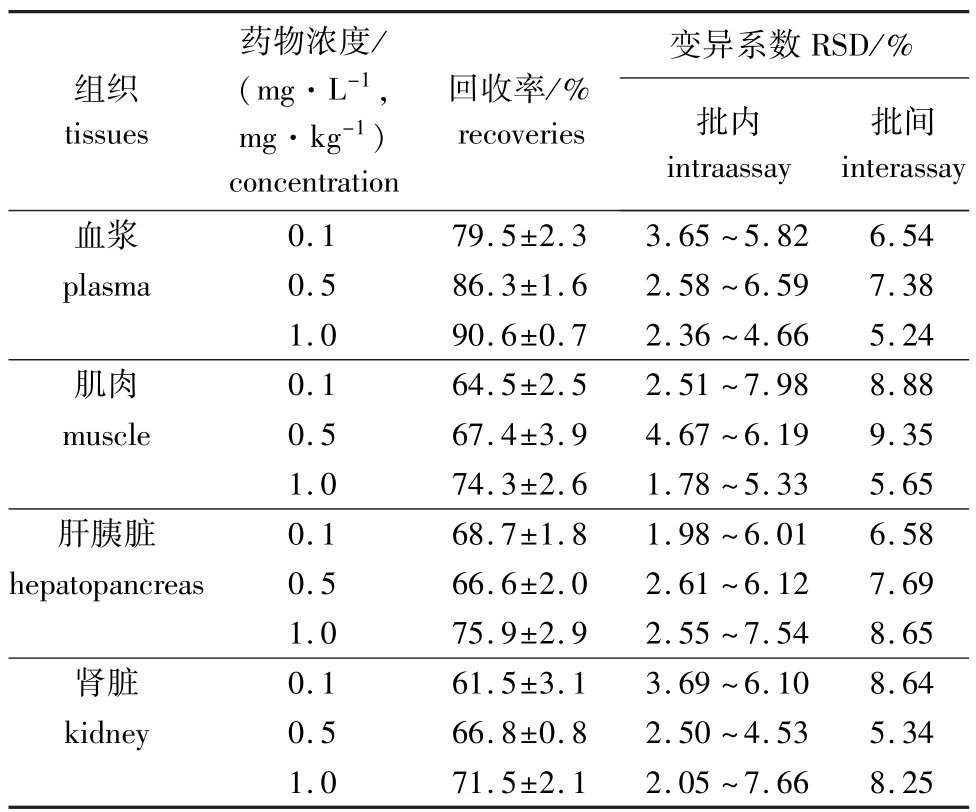
2.2 回收率与变异系数
从表2可见:OFLX在吉富罗非鱼血浆及组织中的回收率为61.5%~90.6%,批内变异系数为1.78~7.98%,批间变异系数为5.24%~9.35%。
2.3 氧氟沙星在吉富罗非鱼体内的药代动力学
从图1可见:对吉富罗非鱼口灌给药,OFLX在组织中吸收迅速,组织中肝胰脏的药物浓度最高,在测定时间内,各组织的药物浓度均高于血浆,肌肉和肝胰脏组织中药物浓度均出现“双峰”现象。
表1 OFLX在吉富罗非鱼血浆、肌肉、肝胰脏及肾脏中的标准曲线、检测限及定量限
Tab.1 The calibration,LOD and LOQ of OFXL in plasma,muscles,hepatopancreas and kidney in GIFT tilapia strain Oreochromis niloticus
组织标准曲线(n=4) calibration线性范围/(mg·L-1,mg·kg-1) range of linearity相关系数R2relavent coefficient检测限LOD/ (mg·kg-1)定量限LOQ/ (mg·kg-1) 0.1~5.00.99960.050.1 0.05~5.00.99640.020.05肌肉muscley=5.48×106x+1.58×1050.1~5.00.99660.050.1肝胰脏hepatopancreasy=5.35×106x-3.76×1050.1~5.00.99980.050.1肾脏kidneyy=4.70×106x+2.55×105血浆plasmay=2.30×107x-2.82×106
表2 OFLX在吉富罗非鱼血浆和组织中的回收率及变异系数(¯x±S.E.,n=4)
Tab.2 The recoveries and variation coefficient of OFXL in plasma and tissues of GIFT tilapia strain Oreochromis niloticus
变异系数组织tissues 0.168.7±1.81.98~6.016.58 hepatopancreas0.566.6±2.02.61~6.127.69 1.075.9±2.92.55~7.548.65肾脏回收率/% recoveries药物浓度/ (mg·L-1, mg·kg-1) concentration RSD/%批内intraassay批间0.179.5±2.33.65~5.826.54 plasma0.586.3±1.62.58~6.597.38 1.090.6±0.72.36~4.665.24肌肉interassay血浆0.164.5±2.52.51~7.988.88 muscle0.567.4±3.94.67~6.199.35 1.074.3±2.61.78~5.335.65肝胰脏0.161.5±3.13.69~6.108.64 kidney0.566.8±0.82.50~4.535.34 1.071.5±2.12.05~7.668.25
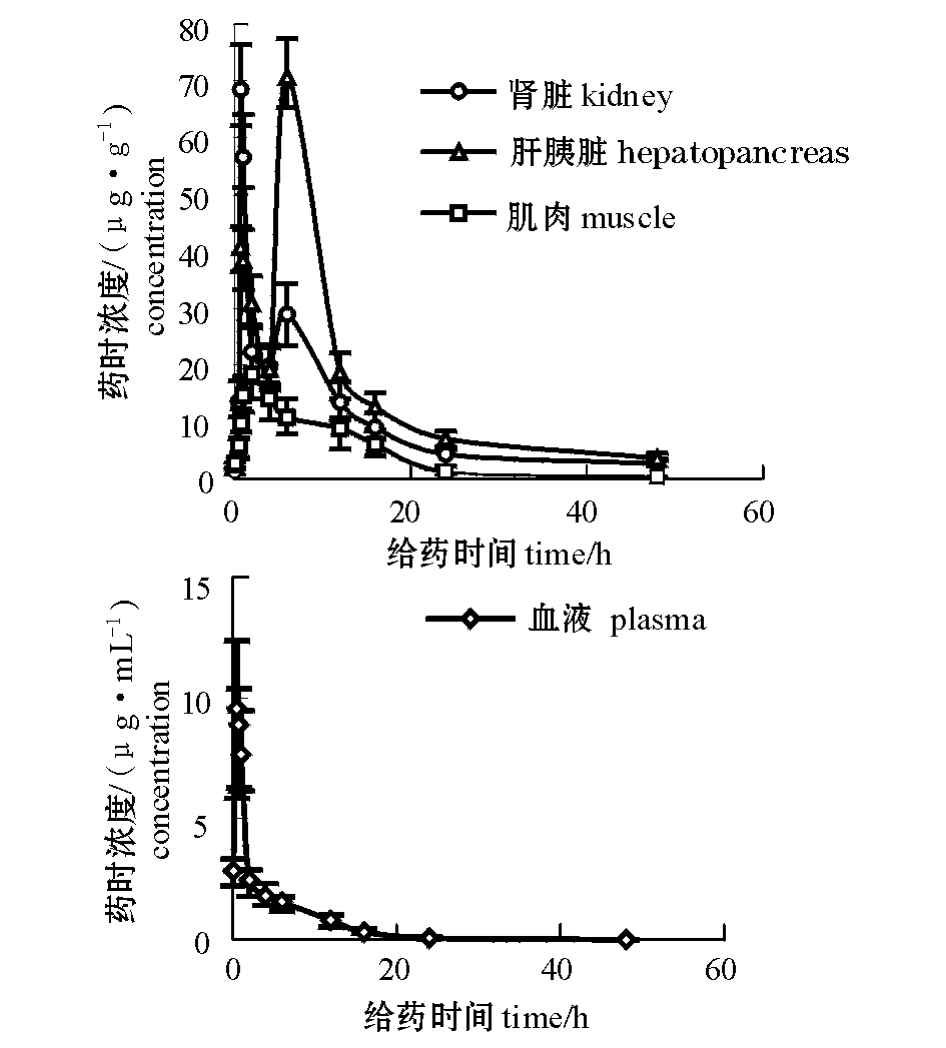
图1 口灌给药OFLX在吉富罗非鱼体内血浆及各组织中的药时曲线
Fig.1 The concentration-time curve of OFLX in plasma and tissues of GIFT strain Oreochromis niloticus after oral administration
应用3P97软件分别对血浆、肌肉、肝胰脏、肾脏中测得的药物浓度进行分析拟合。拟合结果可用一级吸收二室开放性模型来描述。其血浆(C1)、肌肉(C2)、肝胰脏(C3)、肾脏(C4)的OFLX药时关系方程分别为
C1=28.5e-2.1t+3.14e-0.09t-31.64e-3.66t;
C2=243.9e-0.29t+0.74e-0.04t-244.64e-0.35t;
C3=25.15e-0.15t+12.07e-0.02t-37.22e-22.77t;
C4=74.54e-0.91t+14.96e-0.054t-89.50e-3.50t。
其药代动力学参数见表3。
3.1 氧氟沙星在鱼体内的药代动力学特征
吉富罗非鱼以10 mg/kg的剂量单次经口灌服OFLX后,药物在血浆、肌肉、肝胰脏、肾脏中的达峰时间Tmax分别为0.41、3.19、0.18、0.59 h,最高药物浓度Cmax分别为7.98 μg/mL、17.24、36.10、46.65 μg/g。说明OFLX在吉富罗非鱼体内吸收迅速,在很短的时间内就可以在血液及组织中达到峰浓度。本试验中发现,药物在肝胰脏中0.18 h就可以达到峰值,这可能与药物的“首过效应”有关,即OFLX经胃肠道给药,在尚未吸收进入血液循环之前,在肠黏膜和肝胰脏被代谢,因而使进入血液循环的OFLX减少[5]。
OFLX在单次口灌给药后,试验鱼肌肉和肝胰脏中出现了“双峰现象”。目前关于口服给药后药物C-T曲线的双峰现象研究报道较多,认为引起该现象的主要原因是由于药物的肠肝循环和非齐性吸收所致,两峰间隔时间为2~20 h[6-7]。本试验结果表明:对吉富罗非鱼单次口灌给药后,肝胰脏在0.18 h达到峰值后,药物浓度开始下降;6 h后药物在肝胰脏中出现另外一个峰值,说明药物排泄进入十二指肠后,可在小肠重吸收返回肝胰脏,形
成肠肝循环,出现双峰现象。非齐性吸收这种吸收现象主要是胃肠道的不同部位和管壁对某些药物的通透性不同,当口服药物后,不同部位的吸收时间和吸收速率并不一致。一般有两个吸收部位:一个吸收部位在胃肠道上部,另一个在下部[8]。因此,当药物在不同部位被吸收时,在检测组织中的药物浓度时会出现两个药物浓度峰。故对吉富罗非鱼单次口灌给药后,肌肉和肝胰脏中出现的双峰现象可能是由肠肝循环和非齐性吸收所引起的。
表3 OFLX在吉富罗非鱼体内的药代动力学参数
Tab.3 Pharmacokinetic parameters of OFLX in GIFT tilapia strain Oreochromis niloticus

参数parameter kidney A/(μg·mL-1)血浆plasma肌肉muscle肝胰脏hepatopancreas肾脏28.50243.9025.1574.54 α/h-12.100.290.150.91 B/(μg·mL-1)3.140.7412.0714.96 β/h-10.090.040.020.054 Kα/h-13.660.3522.773.50 T1/2α/h0.332.394.620.76 T1/2β/h7.7419.4528.2712.90 T1/2Kα/h0.191.980.030.20 AUC/ (μg·h-1·mL-1)39.92162.86658.42334.65 K21/h-10.500.040.070.235 K10/h-10.380.260.060.21 K12/h-11.320.030.050.52 Cmax/(μg·mL-1)7.9817.2436.1046.65 Tmax/h 0.413.190.180.59
在同一时间点,组织(特别是肝胰脏和肾脏)中药物浓度比血浆中的浓度高出很多,这说明肝胰脏和肾脏是OFLX代谢和排泄的主要器官,OFLX很容易在肝胰脏和肾脏富集残留;同时,也说明OFLX在吉富罗非鱼体内穿透力很强,分布广泛,很容易被吸收,适合治疗全身感染。药物在吉富罗非鱼血液、肾脏、肌肉、肝胰脏中消除半衰期(T1/2β)分别为7.74、12.90、19.45、28.27 h,表明OFLX在吉富罗非鱼体内的消除较为缓慢,平均滞留时间较长。
张柞新等[9]研究发现,给鲤单次混饲口服氧氟沙星(10 mg/kg)后,其药代动力学特征符合一级吸收一室开放模型,吸收半衰期(T1/2Kα)为0.621 h,消除半衰期(T1/2K)为15.96 h,最高血药浓度(Cmax)为2.776 mg/L,达峰时间(Tmax)为5.44 h。葛建[10]对鲤按20 mg/kg单剂量口灌给药,其药时数据符合开放性一级吸收二室模型,氧氟沙星在鲤体内口服吸收较快,吸收半衰期(Tl/2α)为0.24 h;而且分布既快又广,其分布半衰期为0.30 h,表观分布容积(Vd/F)为5.79 L/kg,同时在体内滞留时间较长,消除半衰期为24.27 h。上述结果均表明,氧氟沙星在鲤体内吸收较迅速,达峰时间较短,血药峰浓度高,消除缓慢,保持有效杀菌浓度时间长,适用于鱼类细菌性疾病的预防和治疗。这也与本研究结果类似,但模拟出来的房室模型存在差异,此差异可能是由于种属、性别、水温、给药方式、给药剂量等原因造成的。由于造成水产动物的药代动力学上差异的原因非常复杂,须慎重分析其差异才能制定出合理的给药方案。
3.2 临床用药的建议
喹诺酮类为典型的浓度依赖性药物,浓度越高,病原菌清除越快,细菌产生耐药性的可能性越小[11],最好的评估参数为血液AUC0~24/MIC (AUIC)与Cmax/MIC。Forrest等[12]研究发现,使用喹诺酮类治疗的64例肺炎患者中,AUIC<125时,疗效和细菌清除率为42%和26%;当AUIC>125时,两者分别为80%和82%。因此认为, AUIC为125时是抗肺炎链球菌的最低有效值。当然这个最低有效值还有待进一步研究,理论上是希望这两个参数越大越好。
氧氟沙星对鱼类常见致病菌的MIC为:CR79 -1-1苏伯利产气单胞菌0.02 mg/L;ST78-3-3点状产气单胞菌点状亚种0.03 mg/L;56-12-10荧光假单胞菌(荧光极毛杆菌)0.625 mg/L;G4鱼害黏球菌0.625 mg/L;58-20-9肠型点状产气单胞菌0.039 mg/L;对其他大部分菌的MIC90为0.062~0.5 mg/L[9]。因此本研究中对各个细菌的AUIC值大部分为64~2 000,Cmax/MIC值为12~400。这表明对吉富罗非鱼按10 mg/kg的剂量单次口灌服OFLX,其在体内表现为良好的抗菌活性。在给药后的0.5~16 h内,血药浓度都在0.625 mg/L以上,即在给药后16 h的时间内能够有效地抑制大部分细菌的生长。考虑到体内和体外环境的差异,吉富罗非鱼间的个体差异以及一些未知的干扰因素,建议治疗吉富罗非鱼细菌性疾病时, OFLX的给药剂量为10 mg/kg,每天2次,连用2~3 d,首次剂量加倍[13]。
3.3 休药期的确定
Steffenak等[14]认为,喹诺酮类因与骨中的二价离子和皮肤中的黑色素有亲合性,故这两种组织
可能会成为鱼体内残留喹诺酮类药物的储存库,并在停药后很长一段时间内慢慢释放到其他组织中,造成潜在的残留危害,不过具体情况还需进一步试验证实。日本肯定列表规定,OFLX在鸡的可食用组织中的最大残留限量(MRL)为50 μg/kg,中国农业部暂未制定OFLX在动物体内的MRL。因此,OFLX在水产品中的MRL尚未确定。为慎重起见,这里暂且建议将OFLX在吉富罗非鱼组织中的MRL定为10 μg/kg。通过上述休药期公式计算可知,各组织的理论休药期为:肌肉5 d,肝胰脏8 d,肾脏6 d。考虑到氧氟沙星残留可能储藏在骨和皮肤中,并缓慢释放出来,为了充分保障消费者的安全,选择肌肉及其他组织内药物浓度均低于10 μg/kg的时间为可以食用的时间。因此,在本试验条件下,建议OFLX在吉富罗非鱼体内的休药期为8 d。
参考文献:
[1] Gruneberg R N,Felmingham D,O′HareM D,et al.The comparative in vitro activity of ofloxacin[J].J Antimicrob Chemother,1988,22 (Suppl C):9-19.
[2] Sherri B T,Calvin C W,Jose E R,et al.Confirmation of fluoroquinolones in catfish muscle by electrospary liquid chromatography mass spectrometry[J].J AOAC Int,1998,8(3):554-562.
[3] 王翔凌,方之平,操继跃,等.盐酸沙拉沙星在鲫体内的残留及消除规律研究[J].水生生物学报,2006,30(2):198-203.
[4] 潘玉善,操继跃,方之平,等.甲磺酸达氟沙星在鲫体内药物动力学及残留研究[J].中国农业科学,2006,39(2):418-424.
[5] 金仲品.什么是药物的首过效应[J].中国临床医生,2001,29 (10):53.
[6] Kroboth P D,Smith R B,Rault R,et al.Effects of end-stage renal disease and aluminum hydroxide on temazepam kinetics[J].Clinical Pharmacology and Therapeutics,1985,37:453-459.
[7] Pentikainen P J,Neuvonen P J,Penttila A.Pharmacokinetics and pharmacodynamics of glipizide in healthy volunteers[J].Int J Clin Pharmacol Ther Toxicol,1983,21:98-107.
[8] Staveris S,Houin G,Tillement J P,et al.Primary dose-dependent pharmacokinetic study of veralipride[J].Journal of Pharmaceutical Sciences,1985,74:94-96.
[9] 张祚新,张雅斌,刘艳辉,等.氧氟沙星(Ofloxacin)在鲤鱼体内的药代动力学[J].中国兽医学报,2004,24(4):383-385.
[10] 葛建.氧氟沙星在鲤鱼体内的药物动力学和残留研究[D].武汉:华中农业大学,2004:1-2.
[11] 乔军.氟喹诺酮类药物的合理应用[J].中国现代药物应用, 2010(9):151-153.
[12] Forrest A,Nix D E,Ballow C H,et al.Pharmacodynamics of intravenous ciprofloxacin in seriously ill patients[J].Antimicrob Agents Chemother,1993,37:1073-1081.
[13] 王广基.药物代谢动力学[M].北京:化学工业出版社,2005.
[14] Steffenak L,Hormazabal V,Yndestad M.Reservoir of quinoloe residues in fish[J].Food Addit Contam,1991,8:777-780.
Pharmacokinetics and residues of ofloxacin in GIFT tilapia strain Oreochromis niloticus
WANG Xian-yu1,SONG Jie1,2,WANG Wei-li1,JIANG Lan1,LUO li1,KE jian1,2
(1.Pearl River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Guangzhou 510380,China; 2.College of Fisheries and Life Science,Shanghai Ocean University,Shanghai 201306,China)
Abstract:The metabolism and elimination of ofloxacin(OFLX)were studied in plasma and tissues of GIFT strain Nile tilapia(Oreochromis niloticus)after oral administration(10 mg/kg body weight)at(25±2)℃by high performance liquid chromatography(HPLC)method.The results showed that the distribution of OFLX in plasma and tissues were described by two open-compartment model with first order absorption with rapid absorption and distribution and slow elimination.The peak time of OFLX were found 0.41 h in plasma,3.19 h in muscle,0.18 h in liver,and 0.59 h in kidney after the oral administration.The peak concentrations of OFLX were observed to be 7.98 μg/mL in plasma,17.24 μg/g in muscle,36.10 μg/g in liver and 46.65 μg/g in kidney.There was higher OFLX level in the liver than that in other tissues and higher OFLX level in the tissues than that in the plasma at the same time.The order of the elimination was descendantly arranged as the following:kidney>muscle>liver with T1/2βof 12.90 h,19.45 h and 28.27 h,respectively.According to the maximum residue limit(MRL)of 10 μg/kg in the tissues,it is suggested that the withdrawal period be over 8 d under this experiment condition,that OFLX be orally applied at a dose of 10 mg/kg,in 12 h interval for 2-3 days when the drug is used for bacterial disease in fish.
Key words:GIFT strain Oreochromis niloticus;ofloxacin;pharmacokinetics;residue
文章编号:2095-1388(2011)02-0144-05
中图分类号:S948
文献标志码:A
收稿日期:2010-04-02
基金项目:国家“十一五”科技支撑计划项目(2006BAD03B04-02);广东省农业攻关项目(2008A020100006)
作者简介:王贤玉(1982-),男,硕士研究生。E-mail:wang_xian_yu@163.com
通信作者:姜兰(1965-),女,副研究员。E-mail:jianglan2@tom.com