雷氏七鳃鳗耗氧率和窒息点的研究
王晓光,于伟君,李军,石俊艳,魏宏祥,宣明春,寇凌霄,齐鹤,刘勇,吴瑞兰
(辽宁省淡水水产科学研究院,辽宁辽阳111000)
摘要:在不同温度下,分别采用流水和静水呼吸室法,测定雷氏七鳃鳗变态前后及以规格为标准分类的大规格成年雷氏七鳃鳗Lampetra reissneri(成鳗大)、小规格成年雷氏七鳃鳗(成鳗小)、大规格幼年雷氏七鳃鳗(幼鳗大)和小规格幼年雷氏七鳃鳗(幼鳗小)的耗氧量、耗氧率和窒息点。结果表明:成鳗大(8.59 g±0.20 g)、成鳗小(5.42 g±0.10 g)和幼鳗小(5.27 g±0.17 g)的耗氧率存在昼夜变化;其中成鳗大的最高耗氧率(0.167 mg/g·h±0.022 mg/g·h)、最低耗氧率(0.035 mg/g·h±0.003 mg/g·h)与成鳗小的最高耗氧率(0.192 mg/g·h±0.036 mg/g·h)、最低耗氧率(0.051 mg/g·h±0.016 mg/g·h)均出现在8:00和16:00;幼鳗小的最高耗氧率(0.119 mg/g·h±0.027 mg/g·h)和最低耗氧率(0.038 mg/g·h± 0.013 mg/g·h)分别出现在18:00和14:00。在1~20℃时,雷氏七鳃鳗的耗氧率与水温呈正相关,成鳗大(10.45 g±0.13 g)的关系式为Y大=0.0254X0.9115(R2=0.8516),成鳗小(4.65 g±0.07 g)的关系式为Y小=0.0272X0.9406(R2=0.8840);而幼鳗小(5.92 g±0.05 g)的耗氧量、耗氧率随着水温的升高,呈波浪式上升。在1~15℃时,成鳗大(10.67 g±0.18 g)的窒息点随着水温的上升而降低,其关系式为Y大= 0.2224X-0.3945(R2=0.9710),在15~20℃时,其窒息点随着水温的上升而上移,窒息点曲线呈“V”字型;在1~10℃时,成鳗小(5.46 g±0.12 g)的窒息点随着水温上升而降低,关系式为Y小=0.4427X-0.6561(R2=0.8866),在10~20℃时,其窒息点随着水温的上升呈上升趋势,但差异不显著(P>0.05);在1~15℃时,幼鳗小(5.74±0.83 g)的窒息点随着水温的上升而降低,在15~20℃时,其窒息点随着水温的升高而上升,关系式为Y幼=0.3008X-0.4003(R2=0.8581)(P<0.05)。体质量不同的成鳗大(10.10 g±0.13 g)与成鳗小(4.79 g±0.08 g)的耗氧量差异显著(P<0.05),而耗氧率则无显著差异(P>0.05);体质量不同的幼鳗大(7.60 g±0.15 g)与幼鳗小(4.79 g±0.09 g)的耗氧量和耗氧率均无显著差异(P>0.05)。
关键词:雷氏七鳃鳗;耗氧率;窒息点
七鳃鳗隶属于圆口纲Cyclostomata、七鳃鳗目Petromyzoniformes、七鳃鳗科Petromyzonidae,现有1科3亚科6属41种。中国有1属3种,即东北七鳃鳗Lampetra mori、雷氏七鳃鳗L.reissneri和日本七鳃鳗L.japonicus,均分布在东北的鸭绿江,辽河东部山区支流的太子河和浑河,辽东半岛碧流河,吉林通化浑江、松花江和嫩江上游甘河等地。七鳃鳗被誉为“活化石”[1],是脊椎动物中原始类型的代表,在脊椎动物演化史上有着重要的地位[2]。近年来,由于环境污染、过度捕捞、洄游被切断等因素,七鳃鳗的栖息地缩减,产卵场和生活环境被破坏,导致其种群数量锐减,资源量下降,现已被列入《中国濒危动物红皮书》。目前,国内外学者已开展了七鳃鳗的比较形态学和早期脊椎动物[3-4]、遗传学[5-6]、组织学[7-8]、基因组学和蛋白组学方面[9-10]以及营养成分[11]、免疫机制[12]等方面的研究。但有关七鳃鳗耗氧率的昼夜变化规律,温度、体质量与耗氧率、窒息点的相互影响尚未见报道。为此,作者对不同规格的雷氏七鳃鳗成体和幼体的耗氧率和窒息点进行了研究,以期了解七鳃鳗的新陈代谢规律及生理和生活状况,丰富其呼吸生理学等基础理论,对这一古老物种的
保护、科研、活鱼运输、人工放流等提供参考。
1 材料与方法
1.1 材料
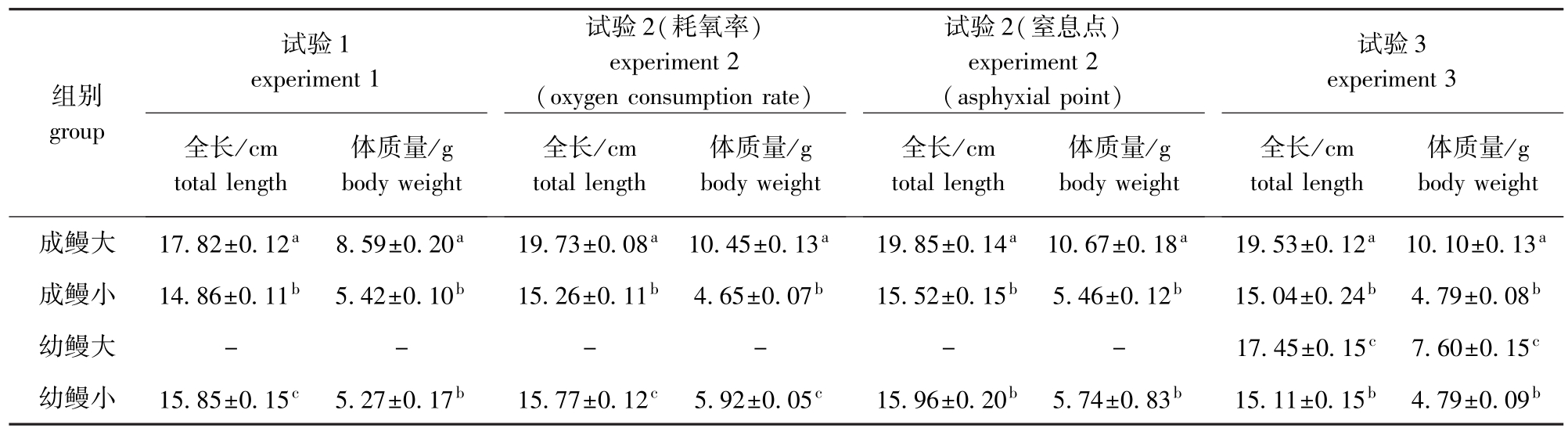
试验用鱼分两批(2009年10月30日、11月19日)采自抚顺市新宾县太子河上游。运回后放入箱底布有中沙与鹅卵石的水族箱中(200 cm×90 cm×100 cm)暂养2 d,再移入箱底同样布有中沙与鹅卵石的小水族箱中(60 cm×40 cm×50 cm)暂养2 d,使其逐渐适应小水体的试验环境,4 d之内不投饵,使测定数据尽可能接近其基础代谢水平。试验用水与暂养箱水为同一水源,均为曝气5 d以上的自来水,pH为7.2±0.2,溶解氧为(9.28±0.40)mg/L以上。选择体质健壮、无病、无伤、无畸形的七鳃鳗为试验鱼。用滤纸将试验鱼体表的水分吸干后称重。按变态前后及规格将试验鱼分为成鳗和幼鳗,其中成鳗按体质量分为成鳗大和成鳗小,幼鳗按体质量分为幼鳗大和幼鳗小。用于各种试验的雷氏七鳃鳗的生物学数据见表1。
表1 雷氏七鳃鳗的生物学数据
Tab.1 The biological data in the lamprey Lampetra reissneri
注:同列中标有不同小写字母者表示组间差异显著(P<0.05),标有相同小写字母者表示组间差异不显著(P>0.05),下同。
Note:The means with different letters within the same column are significant differences at the 0.05 probability level,and the means with the same letters within the same column are not significant differences,et sequentia.
试验1试验3组别group experiment 1试验2(耗氧率) experiment 2 (oxygen consumption rate)试验2(窒息点) experiment 2 (asphyxial point)experiment 3全长/cm total length体质量/g 全长/cm total length体质量/g 体质量/g 体质量/g body weight成鳗大17.82±0.12a8.59±0.20a19.73±0.08a10.45±0.13a19.85±0.14a10.67±0.18a19.53±0.12a10.10±0.13 body weight body weight全长/cm total length body weight全长/cm total length a成鳗小14.86±0.11b5.42±0.10b15.26±0.11b4.65±0.07b15.52±0.15b5.46±0.12b15.04±0.24b4.79±0.08b幼鳗大------17.45±0.15c7.60±0.15c幼鳗小15.85±0.15c5.27±0.17b15.77±0.12c5.92±0.05c15.96±0.20b5.74±0.83b15.11±0.15b4.79±0.09b
1.2 方法
1.2.1 试验1 雷氏七鳃鳗24 h耗氧率的变化参照陈宁生等[13]的流水呼吸室装置略加改动。呼吸室体积为5 L,瓶底布有3.5 cm厚的中沙,沙上有鹅卵石。将试验鱼分为3组(成鳗大、成鳗小和幼鳗小),每组放10尾,每组设一平行。将鱼放入呼吸室后,调节流量使出水溶解氧在6.0 mg/L以上,水温为(14±0.5)℃。鱼在呼吸室内适应2~3 h,再调节流量使出水溶解氧在4.0 mg/L左右,待鱼处于自然平稳状态时,试验开始计时。每2 h测定一次水温、单位时间水流量、进出呼吸室水的溶解氧[14]。为减少夜间取样对鱼体的干扰, 18:00至次日5:00呼吸室用黑塑料包裹,连续测量24h,计算耗氧量和耗氧率。耗氧量(mg/尾·h)和耗氧率(mg/g·h)的计算公式[15]分别为
耗氧量=(A1-A2)×S/M,
耗氧率=(A1-A2)×S/W,
其中:A1为进水中的溶解氧(mg/L);A2为出水中的溶解氧(mg/L);S为单位时间的流量(L/h); M为试验鱼尾数;W为试验鱼体总质量(g)。
1.2.2 试验2 水温对耗氧率和窒息点的影响采用静水呼吸室法,呼吸室装置及鱼体稳定方法同“1.2.1”。将试验鱼分为3组(成鳗大、成鳗小、幼鳗小),每组放10尾,每组设一平行。温度分别设为1、5、10、15、20℃5个梯度,温度误差在±0.5℃以内。试验前采用逐级升温或降温的方法,使鱼适应试验水温,待其处于自然平稳状态后开始试验,封闭进、出水。试验时间为12:00~14:00(20℃时成鳗大组为1 h)。试验结束后计算试验前、试验后呼吸室的耗氧量和耗氧率。
测定窒息点时方法同上。当水温升高或降至试验温度时,封闭上下水,使鱼密封在呼吸室内,待试验鱼死亡达50%以上时测定呼吸室的溶解氧,此时的溶解氧浓度作为该温度下的窒息点。
耗氧量(mg/尾·h)和耗氧率(mg/g·h)的计算公式分别为
耗氧量=(B1-B2)×V/(M×T),
耗氧率=(B1-B2)×V/(W×T),
式中:B1为试验前的溶解氧(mg/L);B2为试验后的溶解氧(mg/L);V为呼吸室水体积(L);T为试验前后的时间差(h);M为试验鱼尾数;W为试验鱼的总质量(g)。
1.2.3 试验3 体质量对耗氧率的影响 采用静水呼吸室法,呼吸室装置及鱼体稳定方法同流水呼吸法。将试验鱼分为4组(成鳗大、成鳗小、幼鳗大、幼鳗小),每组放10尾,每组设一平行,水温为(10±0.5)℃,试验时间为12:00~14:00。试验期间保持室内安静,避免阳光直射,鱼体始终保持在自然状态下。试验结束后参照“1.2.2”计算耗氧量、耗氧率。
1.3 数据处理
所有试验数据均表示为平均值±标准误(Mean ±S.E.),采用单因素方差分析法进行显著性检验,显著性水平设为0.05。
2 结果
2.1 七鳃鳗耗氧率的昼夜变化
试验期间,100%幼鳗小、80%成鳗小及60%成鳗大钻入沙中,鱼体始终处于安静状态,无异常现象。从表1可见:3种不同规格的七鳃鳗中,除成鳗小与幼鳗小的体质量间无显著差异(P>0.05)外,其余成鳗大、成鳗小的全长和体质量间均有显著差异(P<0.05)。
从图1可见,不同规格七鳃鳗的耗氧率存在明显的昼夜变化规律,其昼夜变化曲线基本一致。随着夜晚的来临,成鳗大的耗氧率随着成鳗大耗氧量的增加而逐渐上升,分别在4:00和8:00出现两个峰值,在8:00时达到最高峰(0.167 mg/g·h± 0.022 mg/g·h),最低值(0.035 mg/g·h±0.003 mg/g·h)则出现在16:00;下半夜的耗氧率(0.125 mg/g·h±0.018 mg/g·h)明显高于上半夜(0.075 mg/g·h±0.006 mg/g·h)和白天(0.057 mg/g·h± 0.009 mg/g·h),且差异显著(P<0.05)(表2)。
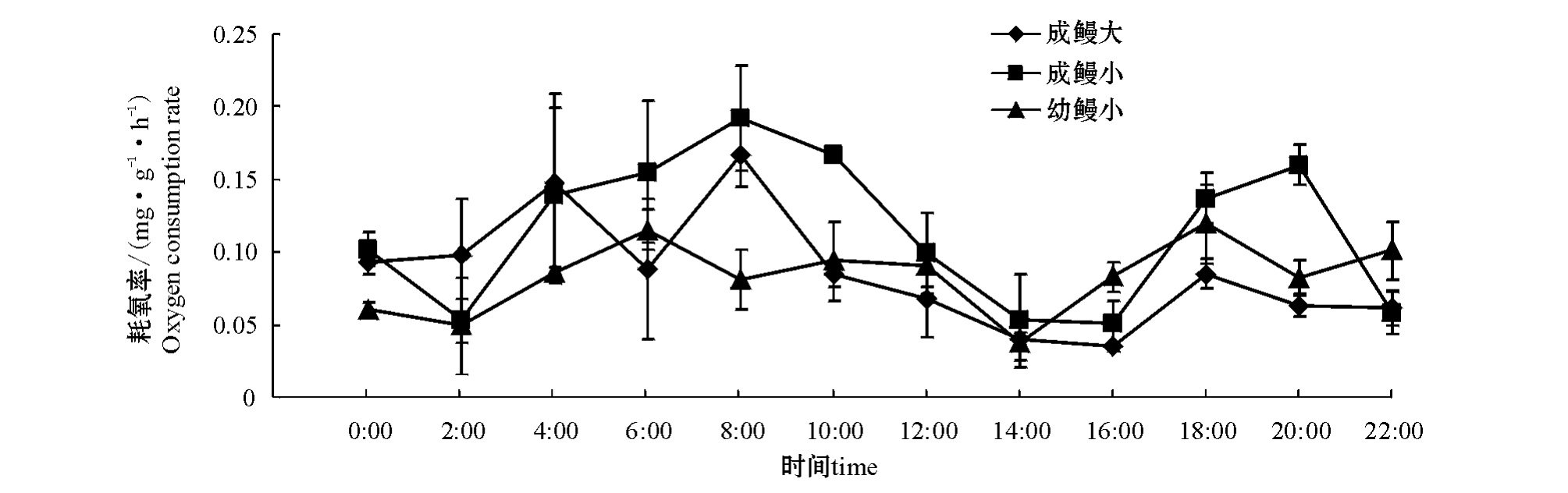
图1 不同规格雷氏七鳃鳗24 h的耗氧率
Fig.1 The oxygen consumption rate in the lamprey with various sizes in 24 h
表2 不同规格雷氏七鳃鳗耗氧率的昼夜变化
Tab.2 Changes in oxygen consumption rate of in the lamprey with various sizes in 24 hmg/(g·h)
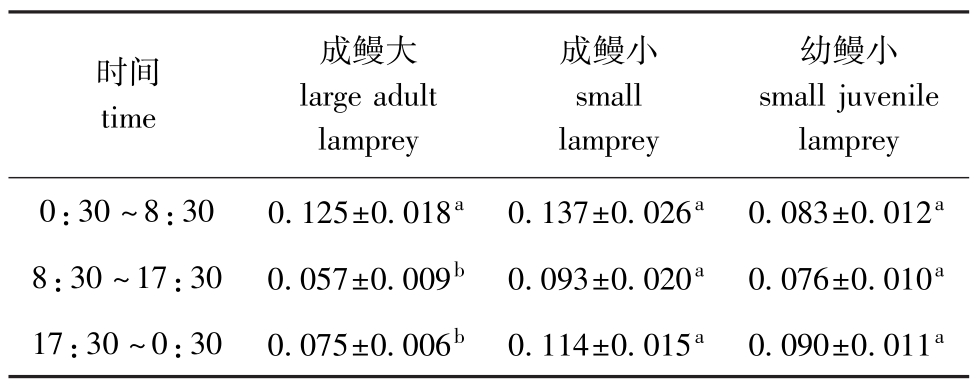
lamprey 0:30~8:300.125±0.018a0.137±0.026a0.083±0.012时间time成鳗大large adult lamprey成鳗小small lamprey幼鳗小small juvenile a 8:30~17:300.057±0.009b0.093±0.020a0.076±0.010a17:30~0:300.075±0.006b0.114±0.015a0.090±0.011a
从午夜至凌晨成鳗小的耗氧率逐渐上升,在8:00达最高峰(0.192 mg/g·h±0.036 mg/g·h),随后其耗氧率逐渐降低,16:00耗氧率降到最低(0.051 mg/g·h±0.016 mg/(g·h)。与成鳗大相同,成鳗小下半夜的耗氧率略高于上半夜及白天,但昼夜耗氧率差异不显著(P>0.05)(表2)。
与成体相比,幼鳗小24 h的耗氧率在一定范围内波动,波动幅度小于成鳗。其耗氧率最大峰值出现在18:00(0.119 mg/g·h±0.027 mg/g·h),最低值出现在14:00(0.038 mg/g·h±0.013 mg/g·h);与成鳗不同,幼鳗小上半夜的耗氧率略高于下半夜和白天,但昼夜耗氧率差异不显著(P>0.05)(表2)。
2.2 温度对雷氏七鳃鳗耗氧率的影响
试验期间,试验鱼活动正常。从表1可见:3种不同规格的七鳃鳗中,成鳗大、成鳗小和幼鳗小的全长和体质量间均有显著差异(P<0.05)。
从表3可见,雷氏七鳃鳗的耗氧量和耗氧率与水温密切相关,随着水温的升高,成鳗的耗氧量逐渐加大,耗氧率也增加。在1~20℃时,成鳗的耗氧率(Y)与水温(X)呈正相关,其中成鳗大的
关系式为Y大=0.0254X0.9115(R2=0.8516),成鳗小的关系式为Y小=0.0272X0.9406(R2=0.8840)。
与成鳗不同,在1~20℃时,幼鳗小的耗氧量和耗氧率却随着水温的升高,呈波浪式上升。
表3 不同温度下雷氏七鳃鳗的耗氧量和耗氧率
Tab.3 The oxygen consumption amount and oxygen consumption rate in the lamprey Lampetra reissneri at different temperatures
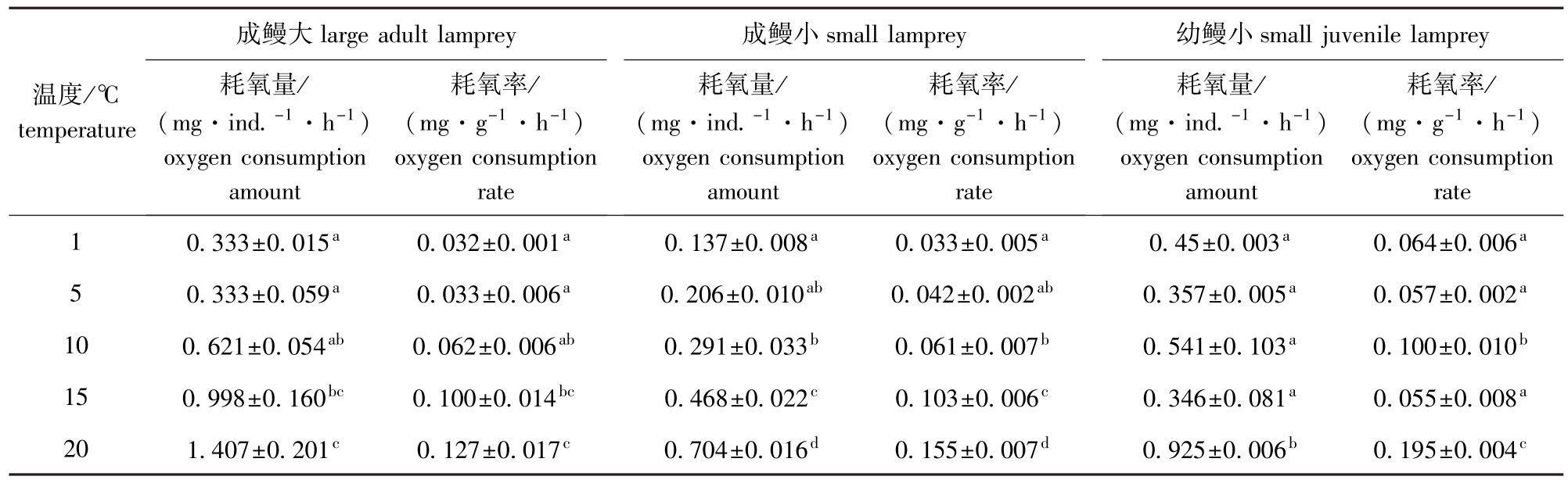
成鳗大成鳗小幼鳗小温度/℃temperature耗氧率/ (mg·g-1·h-1) oxygen consumption耗氧率/ (mg·g-1·h-1) oxygen consumption耗氧率/ (mg·g-1·h-1) oxygen consumption rate 10.333±0.015a0.032±0.001a0.137±0.008a0.033±0.005a0.45±0.003a0.064±0.006 large adult lamprey耗氧量/ (mg·ind.-1·h-1) oxygen consumption amount rate small lamprey耗氧量/ (mg·ind.-1·h-1) oxygen consumption amount rate small juvenile lamprey耗氧量/ (mg·ind.-1·h-1) oxygen consumption amount a 50.333±0.059a0.033±0.006a0.206±0.010ab0.042±0.002ab0.357±0.005a0.057±0.002a100.621±0.054ab0.062±0.006ab0.291±0.033b0.061±0.007b0.541±0.103a0.100±0.010b150.998±0.160bc0.100±0.014bc0.468±0.022c0.103±0.006c0.346±0.081a0.055±0.008a201.407±0.201c0.127±0.017c0.704±0.016d0.155±0.007d0.925±0.006b0.195±0.004c
2.3 温度对雷氏七鳃鳗窒息点的影响
从表1可见:成鳗大的体质量和全长与成鳗小、幼鳗小均有显著差异(P<0.05),但成鳗小的体质量和全长与幼鳗小均无显著差异(P>0.05)。
从表4可见,温度对3种不同规格试验鱼的窒息点有一定的影响。在1~15℃时,成鳗大的窒息点(Y)随着水温(X)的上升而降低,关系式为Y大=0.2224X-0.3945(R2=0.9710);在15~20℃时,其窒息点随着水温的上升而上移,窒息点曲线呈“V”字型。
表4 不同温度下雷氏七鳃鳗的窒息点
Tab.4 The asphyxial point of Lampetra reissneri at different temperaturesmg/L
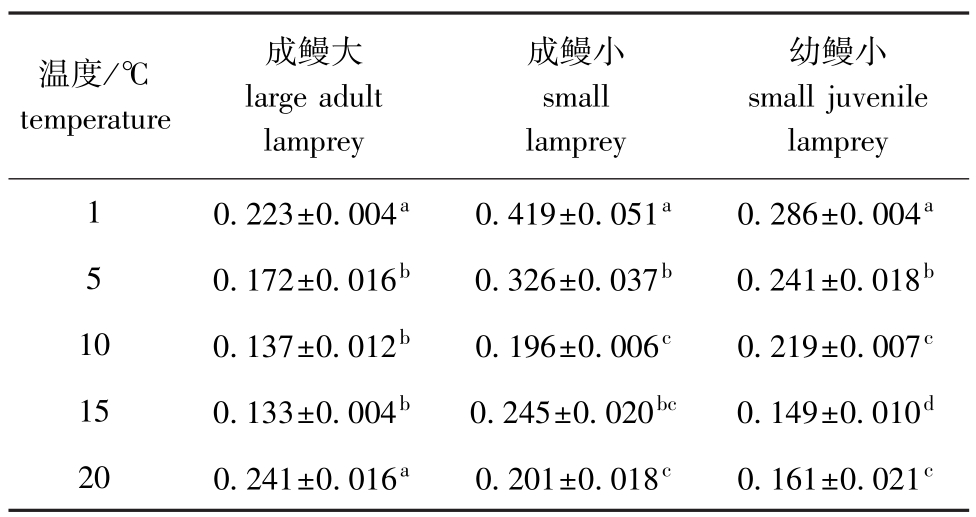
温度/℃temperature lamprey 10.223±0.004a0.419±0.051a0.286±0.004成鳗大large adult lamprey成鳗小small lamprey幼鳗小small juvenile a 50.172±0.016b0.326±0.037b0.241±0.018b100.137±0.012b0.196±0.006c0.219±0.007c150.133±0.004b0.245±0.020bc0.149±0.010d200.241±0.016a0.201±0.018c0.161±0.021c
在1~10℃时,成鳗小的窒息点随着水温的上升而降低,关系式为Y小=0.4427X-0.6561(R2= 0.8866);在10~15℃时,其窒息点随着水温的上升呈上升趋势,但差异并不显著(P>0.05);在20℃时,其窒息点有所下降。
在1~15℃时,幼鳗小的窒息点随着水温的上升而降低,但在15~20℃时,随着水温的升高而上升,趋势同成鳗大,关系式为Y幼=0.3008X-0.4003(R2=0.8581)。
随着温度的降低,成鳗呼吸频率下降,15℃时频率为88~132次/min,1℃时频率为32~54次/min,窒息时间随温度的下降而延长。相同温度下幼鳗窒息滞后。
对七鳃鳗窒息过程的连续观察表明,3种规格的雷氏七鳃鳗窒息死亡的过程基本一致。当溶解氧充足(封闭时溶解氧>3.0 mg/L)时,雷氏七鳃鳗在呼吸室内处于自然状态,70%成鳗、100%幼鳗小躲藏在沙石中,未躲藏的成体则静卧在呼吸室底部或吸附在室底的鹅卵石上。在15℃下,溶解氧充足时,七鳃鳗呼吸频率为88~132次/min,随着密闭呼吸室内溶氧量的降低,躲藏在沙土中的雷氏七鳃鳗逐渐钻出,呼吸加快,呼吸频率为140~198次/min,其烦躁不安,出现上下蹿动,游动异常,成体较幼体激烈。七鳃鳗体色逐渐变浅、发黄,呼吸减慢,呼吸频率为26~40次/min,两侧鳃孔鼓动较大,出现深呼吸,卧于呼吸室底部。昏迷前有上窜的挣扎过程,昏迷时鱼体侧卧,部分鱼体出现身体扭曲,失去平衡死亡。当50%以上的雷氏七鳃鳗出现此症状时,试验结束。
2.4 体质量对雷氏七鳃鳗耗氧率的影响
从表1可见:4种规格的雷氏七鳃鳗中,除成鳗小的全长和体质量与幼鳗小均无显著差异外(P>0.05),其余组间均有显著差异(P<0.05)。
从表5可见:七鳃鳗的体质量不同,其耗氧量和耗氧率也不相同;成鳗大和成鳗小的耗氧量随着体质量的增加而增加;与耗氧量不同,成鳗大与成鳗小的耗氧率基本相同,其中成鳗大的耗氧量与成鳗小的耗氧量差异显著(P<0.05),而耗氧率却无显著差异(P>0.05)。
表5 体质量对雷氏七鳃鳗耗氧率的影响
Tab.5 The effect of body weight on oxygen consumption rate of Lampetra reissneri
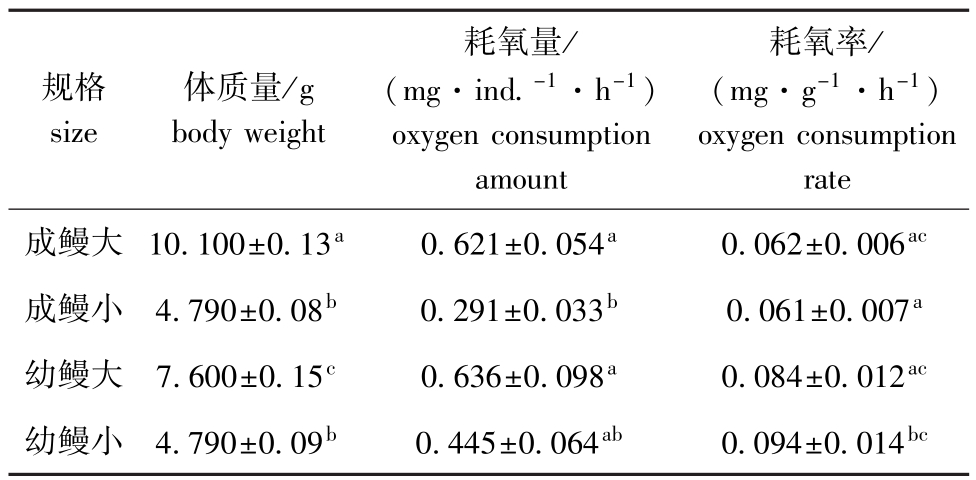
规格size体质量/g body weight rate成鳗大10.100±0.13a0.621±0.054a0.062±0.006耗氧量/ (mg·ind.-1·h-1) oxygen consumption amount耗氧率/ (mg·g-1·h-1) oxygen consumption ac成鳗小4.790±0.08b0.291±0.033b0.061±0.007a幼鳗大7.600±0.15c0.636±0.098a0.084±0.012ac幼鳗小4.790±0.09b0.445±0.064ab0.094±0.014bc
幼鳗的耗氧量也随着体质量的增加而增加,但耗氧率随体质量的增加而减小,其中幼鳗大的耗氧量和耗氧率与幼鳗小均无显著差异(P>0.05)。
3 讨论
3.1 雷氏七鳃鳗的昼夜节律
耗氧率是水产养殖中一个十分重要的参数,可直接或间接地反映鱼类的新陈代谢规律、生理和生活状况,同时也是研究生物能量的代谢基础数据[16]。Clausen[17]研究认为,淡水鱼昼夜耗氧有规律变化可能代表着自然环境中鱼类活动周期,耗氧大的时期一般为鱼类进食或活动旺盛时期。鱼类耗氧率具有一定的昼夜节律[18],同时也具有多样性和持续性的特点,其主要受鱼类的食物组成和摄食率的影响[19]。许多学者对鱼类的昼夜节律进行了深入的研究,鱼类耗氧率的昼夜节律可分3种类型[20]:(1)白天平均耗氧高于夜间,这些鱼白天活动较频繁,进食补充能量,消耗较多溶氧;(2)白天相对静止,夜间活动较频繁,夜间平均耗氧高于白天,属“昼伏夜出”型;(3)还有一部分鱼类昼夜耗氧均值差异不显著,它们白天和夜晚都有耗氧高峰期与低峰期,都有进食。
本试验结果表明,成鳗的耗氧率存在昼夜节律性,夜间耗氧率(18:00~8:00)高于白天(8:00~18:00),其昼夜耗氧变化规律属于上述第二种类型,夜均耗氧明显高于白天,下半夜高于上半夜,在8:00形成最大峰值。这与七鳃鳗白天钻入沙内或藏于石下,夜出觅食的习性相符[21]。由此可以推测:白天雷氏七鳃鳗钻入沙内或隐藏于石下,活动量减小,耗氧就较少;随着夜晚的来临,七鳃鳗钻出来摄食,活动量增大,耗氧则较多;而天亮时,雷氏七鳃鳗要寻找藏身地点,最终形成高峰值。
与成鳗不同,幼鳗昼夜耗氧变化不显著,这可能与幼鳗的饵料和生活习性有关。幼鳗眼部不发达,口部吸盘也没有形成。在自然界中,幼鳗潜入河底泥土中,顺流伸出口,以摄食浮游生物或泥土中的有机物为生,且活动量较成鳗小,所以幼鳗昼夜耗氧变化不显著。此外在试验期间也观察到幼鳗始终隐藏在沙中不活动,活动量较成鳗小。
3.2 体质量对雷氏七鳃鳗耗氧的影响
诸多研究结果表明,鱼类体质量与耗氧量呈正相关,与耗氧率呈负相关[22],本研究结果与此一致。幼鱼阶段这一规律更为明显,这可能与幼鱼特定的发育时期有关。幼鱼正处于生长发育时期,组织分化、器官形成、个体发育迅速及新陈代谢旺盛等,均需要消耗较多的氧,因此耗氧量就大;同时,幼鱼的鳃相对面积比成鱼大,随着鱼体的长大,各个组织器官的成熟,新陈代谢相对减弱,耗氧率就相对降低[23]。
成鳗的头长占其全长的18.5%,幼鳗的头长占其全长的19.4%。由表3可见,体质量相近的成鳗和幼鳗,幼鳗的耗氧量与耗氧率均大于成鳗(15℃除外)。七鳃鳗的耗氧量随着体质量的增加而增加,呈正相关;耗氧率随着体质量的增加而减少,呈负相关。测量时还发现,全长相近的成鳗和幼鳗,幼鳗体质量多高于成鳗。这与自然界中幼鳗变态前主要潜进河底泥土中,顺流伸出口,吃“等食”,且活动量小的生活习性相符。
3.3 温度对雷氏七鳃鳗耗氧的影响
鱼是变温动物,而变温动物的新陈代谢水平不稳定,体温随着外界的变化而变化。因此,水温在鱼的生命活动中起着重要作用,它会直接或间接地影响鱼类的生长、发育、形态、行为、数量和分布。在其适温范围内,体温随水温的升高而升高,体内各种细胞酶活性增强,各种生理生化反应随之增强,基础代谢旺盛,对氧的需求量增加,致使耗氧量上升[23]。与一般鱼类相似,温度对雷氏七鳃鳗的影响也表现为,随着水温的升高,其耗氧量和耗氧率都逐渐升高。
3.4 温度对雷氏七鳃鳗窒息点的影响
多数研究结果表明,在一定温度范围内,鱼类窒息点与体质量的关系可分两种类型:(1)窒息点随体质量的增加而上升[24-25],呈正相关;(2)窒息点随体质量的增加而降低[26],呈负相关。本试验结果表明,成鳗与第二种类型相一致,即随体
质量的增加窒息点降低,呈负相关,表明个体越大的鱼耐低氧能力越强。鱼类各个生长阶段对温度的要求常常是不同的[27-28]。有学者认为[26],窒息点最低时,是其各种生理机能处于最佳状态,体质最强、抵抗力最强时。
从表4可见,窒息点存在着个体差异,最低窒息点的成鳗大、幼鳗出现于15℃,分别为(0.133 ±0.004)、(0.149±0.010)mg/L,成鳗小则出现在10℃时,为(0.196±0.006)mg/L。这与其5月中旬进入繁殖期,且体质最强、状态最佳相吻合。
与其它鱼类的窒息点相比(体质量、温度相近),雷氏七鳃鳗的窒息点高于异育银鲫(体质量为8.2 g,水温为24℃时窒息点为0.0583 mg/L)[29]、低于花鱼骨(体质量为6.55 g,20℃时的窒息点为0.4529 mg/L)[25]和叶尔羌高原鳅(体质量为7.66 g,窒息点为1.2105 mg/L)[26]。鱼类的窒息点与其生态习性密切相关。研究结果表明,底层鱼类的窒息点较上层鱼类的窒息点低,肉食性鱼类的窒息点较高,温和食性鱼类的较低[30]。雷氏七鳃鳗属于底层鱼类,成体主要以浮游植物和浮游动物为食,幼体主要以沙石上的植物碎屑和附着藻类为食[21],这与该鱼耗氧率低的结果相符。说明雷氏七鳃鳗在一定温度范围内耐低氧能力较强,运输时应选择在白天10:00~16:00,温度为10~15℃下进行。
有关七鳃鳗的相关研究较少。本试验中,作者是在室内条件下测定了雷氏七鳃鳗的耗氧率和窒息点,虽然可以反映该鱼的新陈代谢及生理和生活状况,但与规模化养殖条件下该鱼的实际生存状况还是有一定的差别[31-32],因此,本试验结果仅供养殖生产者参考。
参考文献:
[1] Janvier P.Palaeontology:modern look for ancient lamprey[J].Nature,2006,443:92l-924.
[2] Janvier P,Lund R.Hardistiella montanensis n.gen.et sp.(Petromyzontidae)from the Lower Carboniferous of Montana with remarks on the affinities of the lampreys[J].Journal of Vertebrate Paleontology,1983,2:407-413.
[3] Murakami Y,Ogasawara M,Satoh N,et al.Compartments in the lamprey embryonic brain as revealed by regulatory gene expression and the distribution of reticulospinal neurons[J].Brain Res Bull, 2002,57:271-275.
[4] McCauley D W,Bronner-Fraser M.Importance of SoxE in neural crest development and the evolution of the pharynx[J].Nature, 2006,441:750-752.
[5] Sasaki M,Hitotsumachi S.Notes on the chromosomes of a freshwater lamprey,Eutosphenum reissneri(Cyclostomata)[J].Chromosome Information Service,1967,8:22-24.
[6] Yamazaki Y,Yokoyama R,Nishida M,et al.Taxonomy and molecular phylogeny of Lethenteron lampreys in eastern Eurasia[J].Journal of Fish Biology,2006,68:251-269.
[7] 景国荣,王岫彬,何迎春,等.溪七鳃鳗外周血相的初步观察[J].哈尔滨师范大学:自然科学学报,1986(2):95-97.
[8] 孙婴宁,马飞,邵淑娟,等.日本七鳃鳗消化系统显微与超微结构[J].动物学杂志,2006,41(6):14-22.
[9] 朱丽娜,戴雅丽,马飞,等.日本七鳃鳗(Lampetra japonica)肝脏ESTs分析与比较转录组研究[J].中国科学:C辑,生命科学, 2007,37(6):609-619.
[10] 高琪,逢越,吴毓,等.日本七鳃鳗(Lampetra japonica)口腔腺表达序列标签(EST)分析[J].遗传学报,2005,32(10):1045-1052.
[11] 张凯,郭文场,李训德,等.日本七鳃鳗肌肉脂肪酸的组成分析[J].中国水产科学,2000,7(1):116-117.
[12] 刘岑杰,刘欣,吴毓,等.日本七鳃鳗类淋巴细胞的分离及细胞学特征[J].动物学杂志,2008,43(1):82-87.
[13] 陈宁生,施腺芳.草鱼、白鲢、花鲢的耗氧率[J].动物学报, 1955,7(1):34-57.
[14] 国家环境保护局.GB/T 7489-1987.水质溶解氧的测定:碘量法[S].北京:中国标准出版社,1987:124-129.
[15] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 18654.8-2008.养殖鱼类种质检验,第8部分:耗氧率与临界窒息点的测定[S].北京:中国标准出版社,2008:1-5.
[16] Kaushik S J.Nutritional bioenergetics and estimation of waste production in non-salmonids[J].Aquat Living Resour,1998,11(4): 211-217.
[17] Clausen R G.Oxygen consumption in freshwater fishes[J].Ecology,1936,17(2):216-226.
[18] Parker N C.Chronobiologic approach to aquaculture[J].Trans Am Fish Soc,1984,113:545-552
[19] Lucas M C,Priede I G,Utilization of metabolic scope in relation to feeding and activity by individual and grouped zebrafish,Brachydanio rerio(Hamilton-Buchanan)[J].J Fish Biol,1992,41:175-190.
[20] 乔德亮,李思发,凌去非,等.白斑狗鱼耗氧率和窒息点研究[J].上海水产大学学报,2005,14(2):202-206.
[21] 解玉浩,李文宽,解涵.东北地区淡水鱼类[M].沈阳:辽宁科学技术出版社,2007:1-7.
[22] 徐连伟,董宏伟,邹作宇,等.匙吻鲟幼鱼耗氧率与窒息点的研究[J].大连水产学院学报,2009,24(4):359-361.
[23] 廖勋波,张明.鄱阳湖黄颡鱼耗氧率与窒息点的研究[J].中国饲料,2008(3):39-40.
[24] 陈琴,章太卓,徐夏声.黄颡鱼耗氧率与窒息点的初探[J].内陆水产,2001(3):9-11.
[25] 顾若波,徐钢春,闻海波.花鱼骨耗氧率和窒息点的初步研究[J].上海水产大学学报,2006,15(1):118-122.
[26] 雷曼红,陈根元,程勇,等.叶尔羌高原鳅耗氧率和窒息点的
初步研究[J].渔业现代化,2007,34(5):8-10.
[27] 董双林,赵文.养殖水域生态学[M].北京:中国农业出版社, 2004:22-26.
[28] 王吉桥,赵兴文.鱼类增养殖学[M].大连:大连理工大学出版社,2000:15-24.
[29] 付立霞,乔德亮.异育银鲫耗氧率和窒息点的研究[J].水产养殖,2009,30(4):15-18.
[30] 赵振山,印杰,高贵琴,等.泥鳅与大鳞副泥鳅耗氧率与窒息点的研究[J].水利渔业,1999,19(1):2-3.
[31] Ruer P M,Cech J J Jr,Doroshov S I.Routine metabolism of the white sturgeon,Acipenser transmontanus:effect of population density and hypoxia[J].Aquaculture,1987,62:45-52.
[32] Jobling M.The influences of feeding on the metabolic rate of fshes:a short review[J].J Fish Biol,1981,18:385-400.
Oxygen consumption and asphyxial point in Asiatic brook lamprey Lampetra reissneri
WANG Xiao-guang,YU Wei-jun,LI Jun,SHI Jun-yan,WEI Hong-xiang, XUAN Ming-chun,KOU Ling-xiao,QI He,LIU Yong,WU Rui-lan
(Freshwater Fisheries Science Institute of Liaoning Province,Liaoyang 111000,China)
Abstract:The oxygen consumption rate,oxygen consumption amount and asphyxial point were measured in Asiatic brook lamprey Lampetra reissneri with different body weight by a flow-through chamber and static chamber at different temperature.There were significant rhythms of oxygen consumption in the adult lamprey with body weigh(8.59 ±0.20)g,and the juveniles with body weight(5.42±0.10)g and(5.27±0.17)g.The peak oxygen consumption rate(0.167±0.022)mg/g·h and the minium oxygen consumption rate(0.035±0.003)mg/g·h in the adult lamprey with body weight(8.59±0.20)g were observed at 8:00 and 16:00,respectively.For the lamprey with body weight(5.42 g±0.10 g),however,the peak oxygen consumption rate(0.192±0.036)mg/g·h and the minium oxygen consumption rate(0.051±0.016)mg/g·h were found at 8:00和16:00,respectively.Moreover,the peak oxygen consumption rate(0.119±0.027)mg/g·h and the minium oxygen consumption rate(0.038±0.013)mg/ g·h in the juveniles with body weight(5.27 g±0.17)g were occurred at 18:00 and 14:00,respectively.There was a positive relationship between water temperature(1-20℃)and oxygen consumption rate in the adult lamprey:Y=0.0254X0.9115(R2=0.8516)(body weight:10.45 g±0.13)g and Y=0.0272X0.9406(R2=0.8840) (body weight:4.65 g±0.07)g.Furthermore,the oxygen consumption rate and oxygen consumption amount of the juveniles with body weight(5.92 g±0.05 g)increased with the increase in temperature.The negative relationship between the point of the lamprey with body weight(10.67 g±0.18 g)and temperature(1-15℃)was expressed as the equation:Y=0.2224X-0.3945(R2=0.971)while there was a positive relationship between the asphyxial point of the adult lamprey and temperature(15-20℃),and a negatively relationship between the asphyxial point of the adult lamprey with body weight(5.46 g±0.12 g)and temperature(1-10℃)as the equation:Y=0.4427X-0.6561(R2=0.8866).In 15-20℃,the asphyxial point of the lamprey with body weight(5.74 g±0.83 g)was increased with the increase in temperature as the equation:Y=0.3008X-0.4003(R2=0.8581)(P<0.05).There was significantly difference between the oxygen consumption of adult lamprey with body(10.10 g±0.13 g)and(4.79 g±0. 08 g)(P<0.05),but there were no significant difference between the oxygen consumption rates(P>0.05).There were no significant difference in the juveniles with body weight(7.60 g±0.15 g),and(4.79 g±0.09 g)(P>0. 05).
Key words:Lampetra reissneri;oxygen consumption rate;asphyxial point
文章编号:2095-1388(2011)02-0119-07
中图分类号:Q175
文献标志码:A
收稿日期:2010-04-22
基金项目:辽宁省海洋与渔业厅科研项目(200824)
作者简介:王晓光(1963-),女,高级工程师。E-mail:wxg0822@126.com
通信作者:于伟君(1954-),男,教授,研究员级高工。E-mail:lndsjcz@hotmail.com





