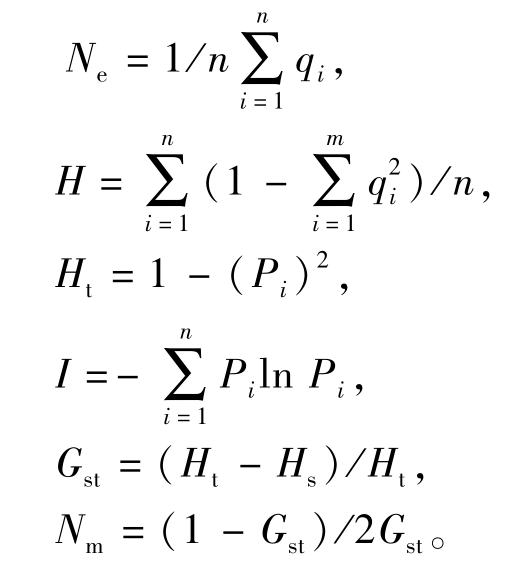
赵文1、2,毕进红1,韩婷婷1,魏杰1、2,柴晓杰1、2,芦佳轩1,邢跃楠1
(1.大连海洋大学辽宁省水生生物学重点实验室,辽宁大连116023;2.大连海洋大学生命科学与技术学院,辽宁大连116023)
摘要:利用随机扩增多态性DNA(RAPD)技术对西藏拟溞Daphniopsis tibetana 4个群体(新疆赛里木湖、西藏色林错、纳木卡错和班戈湖)的遗传多样性进行了初步研究,用21个随机引物对4个群体80个样本进行了随机扩增,从中筛选出5个扩增效果比较稳定的引物,共得到多态位点为25个。利用POPGENE32分析表明,西藏拟溞各群体遗传变异由高向低依次为色林错(SLC)>赛里木湖(SLM)>纳木卡错(NMKC)>班戈湖(BGH)。根据遗传距离结果,采用UPGMA和NJ方法分别进行聚类分析,结果表明,赛里木湖(SLM)和色林错湖(SLC)两群体亲缘关系较近,纳木卡错(NMKC)与班戈湖(BGH)两群体之间的亲缘关系比较近。
关键词:西藏拟溞;遗传多样性;RAPD
西藏拟溞Daphniopsis tibetana是一种冷水性盐水枝角类,适合在高海拔、高寒、贫营养型盐水水体中生活。目前,对该溞的研究集中于其自然分布、生物学特征、形态构造、染色体核型、耗氧率、营养成分、碱度和pH对西藏拟溞存活、生长和生殖的影响等方面[1-6],对西藏拟溞遗传多样性的分子水平上的研究尚属空白。
随机扩增多态性DNA技术(RAPD)是研究种内及种属间亲缘关系的一种简便、快速、灵敏的方法[7]。Hellsten等[8]应用RAPD标记检测了两种象鼻溞Bosmina sp.种群的基因变异,并对其分类予以鉴定。陆开宏等[9]以蒙古裸腹溞Moina mongolica和多刺裸腹溞M.macrocopa为材料,对枝角类RAPD扩增条件进行了摸索和优化,认为微型裸腹溞M.micrura的形态和生态变异是种内分化的结果。张鹏等[10]对12个品系的裸腹溞进行RAPD检测,进一步从DNA水平上探讨裸腹溞种间及品系间的亲缘进化关系。本试验中,作者采用RAPD技术研究了4个湖泊——西藏色林错、纳木卡错、班戈湖和新疆赛里木湖的西藏拟溞的遗传多样性,旨在为准确认识西藏拟溞的系统进化和不同品系西藏拟溞之间的遗传差异,以及其生物进化的历史和适应潜力提供基础数据,最终达到开发利用的目的。
1.1 材料
试验用西藏拟溞的溞种于2007年采自西藏的色林错(SLC)、纳木卡错(NMKC)、班戈湖(BGH)和新疆赛里木湖(SLM)。其中在班戈湖采集的西藏拟溞样品先饥饿48 h,然后用液氮保存,运回实验室;其它群体在大连海洋大学水生生物学重点实验室用配置的海水(经煮沸消毒)驯化培养,温度为16℃,每个群体取样20只。
1.2.1 单只西藏拟溞全基因组DNA的提取 参照Wizard Genomic DNA Purification Kit试剂盒(Promega公司)及安瑞生等[11]、董云伟等[12]的DNA提取方法,提取单只西藏拟溞的基因组DNA。具体方法如下:1)试验前一两天更换西藏拟溞培养液,且48 h不投饵;2)挑取较大西藏拟溞个体(用解剖镜观察肠道已排空)置于纯水中40 min; 3)挑取单只西藏拟溞个体置于0.2 mL离心管中,加入20 μL预冷的核裂解液;4)将离心管置于冰箱(-20℃)中10 min,取出后用研磨杵在冰上充分研磨,再加入40 μL核裂解液;5)于37℃下水浴30 min,取出在室温下冷却5 min,加入25 μL蛋白沉淀液,剧烈震荡;6)于冰箱(4℃)中
放置5 min,取出后在室温下离心5 min(15 000× g);7)取上清液加入等体积的异丙醇和1 μL糖原,摇匀,室温放置30 min;8)室温下离心10 min(12 000×g),去除上清液,晾干,加入60 μL体积分数为70%的乙醇;9)室温下离心10 min (12 000×g),这时会在离心管底部发现白色沉淀,弃上清液,加入20 μL无菌纯水,置于冰箱(4℃)中过夜。
1.2.2 RAPD扩增 PCR仪(Mastercycler 5333)由德国Eppendorf公司生产,引物及酶均购自上海生工生物工程有限公司。PCR反应体系如下:模板DNA 2.5 μL,10×PCR buffer 2.5 μL,MgCl2(25 mmol/L)2 μL,dNTP(10 mmol/L)0.25 μL,引物(10 pmol/μL)0.25 μL,Taq DNA Polymerase(5 U/μL)0.2 μL,补超纯水至总体积25 μL。反应程序如下:94℃下预变性4 min;94℃下变性30 s,38℃下退火1 min,72℃下延伸2 min,如此进行38个循环;最后在72℃下延伸7 min,扩增完后于4℃下保存。扩增产物经15 g/L的琼脂糖电泳检测,EB染色,凝胶成像系统拍摄并记录结果。
1.3 数据统计及分析
根据观察结果,按照相同迁移位置上有扩增带记为1、无扩增带记为0的方法,记录清晰、可重复且长度为250~2 000 bp的RAPD扩增带,生成0/1矩阵图,用POPGENE32计算种群内及种群间的多态位点百分率(P)、有效等位基因数(Ne)、基因多样性指数(H)、Shannon信息指数(I)、种群总遗传变异(Ht)、种群内的遗传变异(Hs)、遗传分化系数(Gst)、基因流(Nm)。其中相关系数计算公式如下:
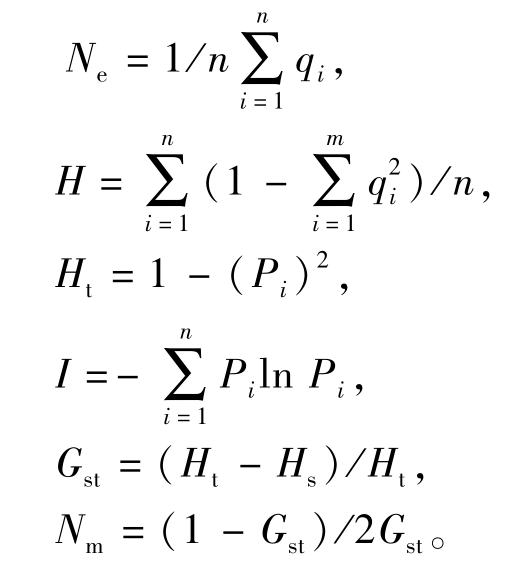
式中:qi为群体中第i个位点上等位基因频率;n为检测到的等位基因数目;Pi为种群中第i个等位基因的频率。
计算种群间的Nei's遗传距离,采用UPGMA法和NJ法分别进行聚类分析,构建系统发生树。
2.1 RAPD扩增结果
参考陆开宏等[8]的方法,从21条RAPD引物(S16、S18、S22、S23、S24、S25、S26、S27、S28、S29、S30、S32、S33、S34、S35、S36、S37、S38、S39、S40、S54)中筛选出5个扩增效果比较稳定的引物,用于数据统计。筛选出来的引物名称、序列及扩增位点和多态位点见表1。部分引物扩增的电泳图见图1、图2。
表1 各条引物、序列、扩增位点和多态位点
Tab.1 Primers,sequences,amplification loci and polymorphic loci
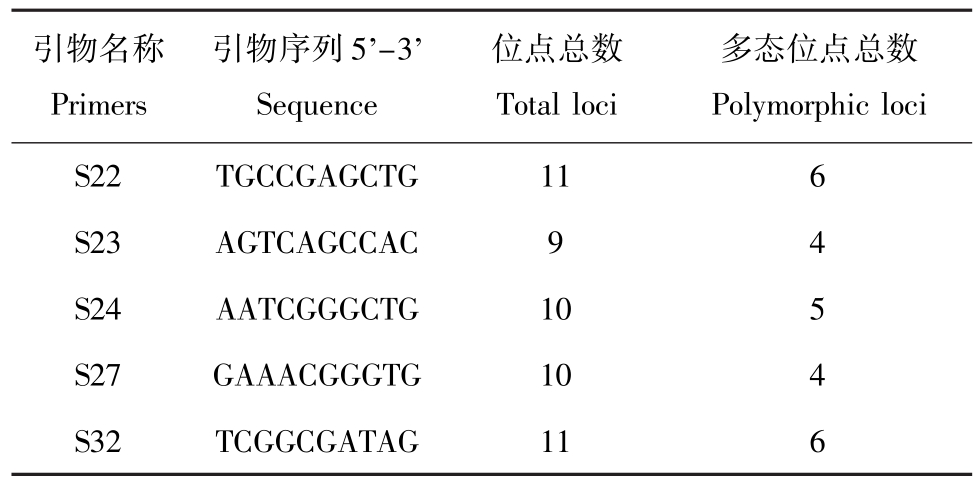
引物名称Primers引物序列5'-3' Sequence位点总数Total loci多态位点总数Polymorphic loci S22TGCCGAGCTG116 S23AGTCAGCCAC94 S24AATCGGGCTG105 S27GAAACGGGTG104 S32TCGGCGATAG116
2.2 西藏拟溞遗传距离和聚类分析的结果
2.2.1 西藏拟溞群体内的遗传多样性 用POPGENE32对西藏拟溞4个群体的遗传多样性进行统计分析(表2),根据观测等位基因数Na、有效等位基因数Ne、Nei's基因多样性H,多态位点百分率P及Shannon多样性指数I,各群体遗传变异程度由高到低依次为色林错(SLC)>赛里木湖(SLM)>纳木卡错(NMKC)>班戈湖(BGH)。
2.2.2 西藏拟溞群体间的遗传分化 根据Nei's的总基因多样性指数Ht(0.3391±0.0258)和种群内的基因多样性指数Hs(0.1908±0.0111),估测种群间的Nei's基因分化系数Gst为0.4373,即在总的遗传变异中有43.73%存在于群体之间,群体内变异占到了56.27%。基因流为0.6433。
2.2.3 西藏拟溞群体间的遗传多样性 西藏拟溞的4个群体中,两两群体之间的遗传相似性值为0.7321~0.8064,遗传距离值为0.2152~0.3118。SLM与SLC的遗传相似性最高,SLM与BGH的遗传相似性最低;SLM与SLC的遗传距离最小,SLM与BGH的遗传距离最大(表3)。
表2 西藏拟溞4个群体的遗传多样性分析
Tab.2 The genetic diversity of four populations of water fleas Daphniopsis tibetana

群体Populations /% NMKC1.4314±0.50021.2838±0.37600.1629±0.观测等位基因数Na有效等位基因数Ne Nei's基因多样性H Shannon信息指数I多态位点百分率P 20460.2401±0.294443.14 SLC1.8039±0.40101.4520±0.33920.2710±0.17880.4089±0.250680.39 BGH1.4118±0.49711.1469±0.25490.0957±0.15040.1541±0.224841.18 SLM1.6863±0.46861.4085±0.39630.2334±0.20760.3470±0.290268.63
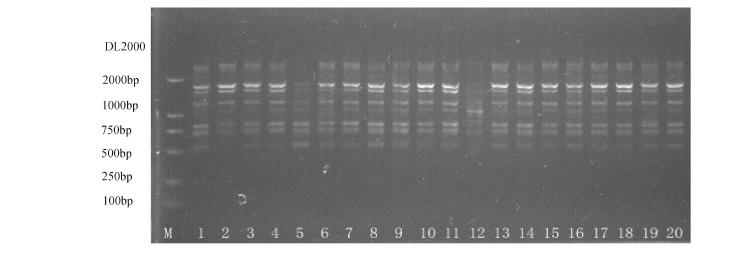
图1 用随机引物S22对纳木卡错湖西藏拟溞(20个体)扩增的RAPD结果
Fig.1 The RAPD results of the Primer S22 for NMKC population
注:M为相对分子质量标准DL2000;泳道1~20为个体1~20。
Note:M,DL2000;Lane No.1-20,Individual No.1-20.
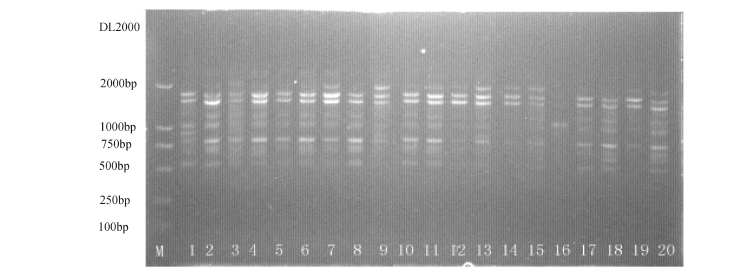
图2 用随机引物S24对赛里木湖西藏拟溞(20个体)扩增的RAPD结果
Fig.2 The RAPD results of the Primer S24 for SLM population
注:M为相对分子质量标准DL2000;泳道1~20为个体1~20。
Note:M,DL2000;Lane No.1-20,Individual No.1-20.
根据POPGENE计算出西藏拟溞4个群体间的遗传距离,利用Mega 4.0软件,用UPGMA法和NJ法分别进行聚类分析,构建系统发生树。结果表明,用两种方法得到的系统进化树一致(图3)。4个群体中,赛里木湖(SLM)和色林错(SLC)两群体聚为一支,纳木卡错(NMKC)与班戈湖(BGH)两群体聚为一支。
2.2.4 西藏拟溞个体间的遗传多样性 基于遗传相似性系数(Nei's系数),对80只西藏拟溞单只进行聚类分析(图4)。通过聚类图可以看出,各个群体内的个体都聚在了一起。
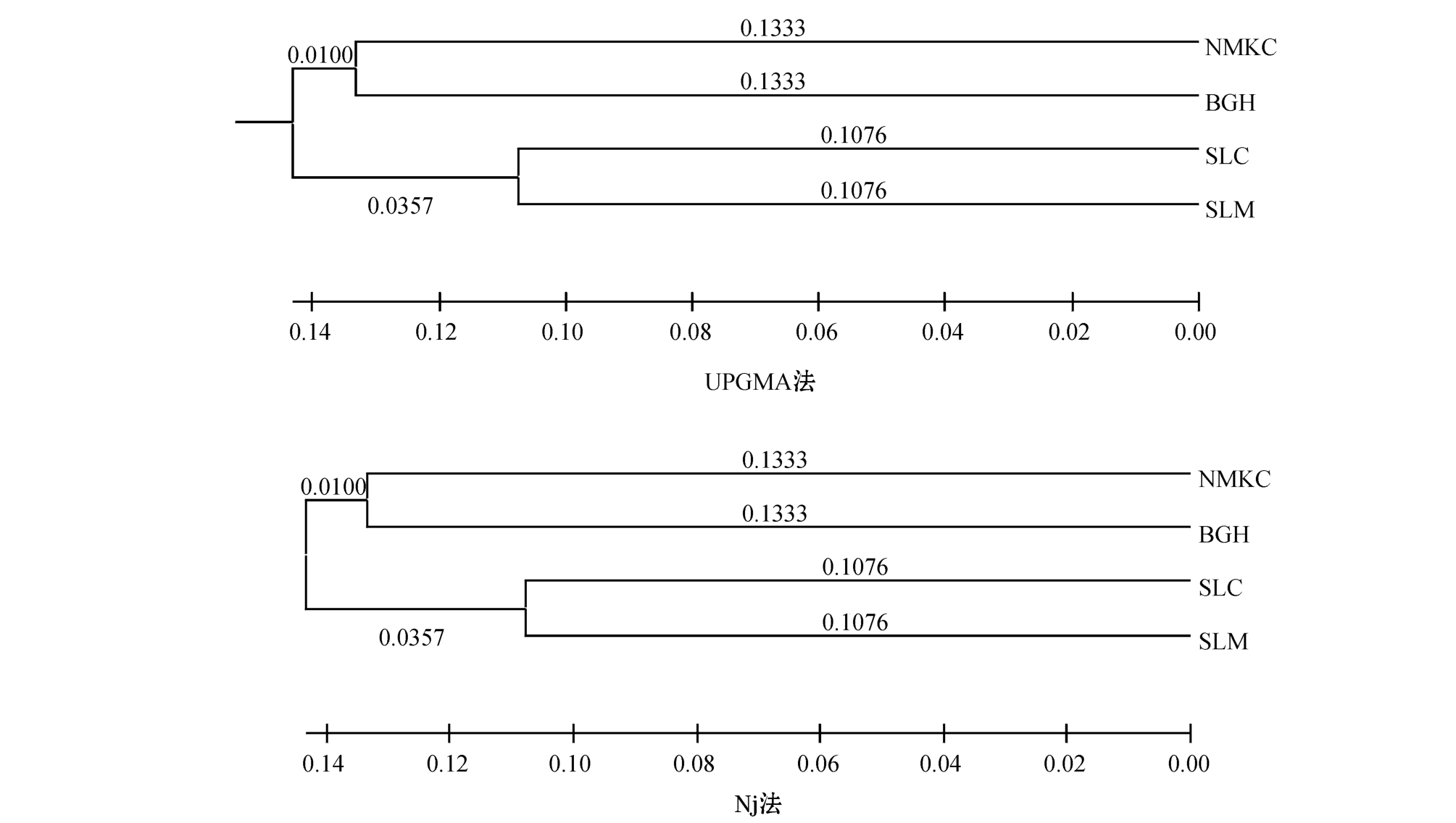
图3 用UPGMA法和NJ法构建的西藏拟溞群体的系统发生树
Fig.3 Phylogenetic tree among 4 populations of water fleas Daphniopsis tibetana by UPGMA and NJ
表3 西藏拟溞群体间Nei's的遗传一致度(右上角)和遗传距离(左下角)
Tab.3 Nei's genetic identity(above diagonal)and genetic distance(below diagonal)among populations of water fleas Daphniopsis tibetana
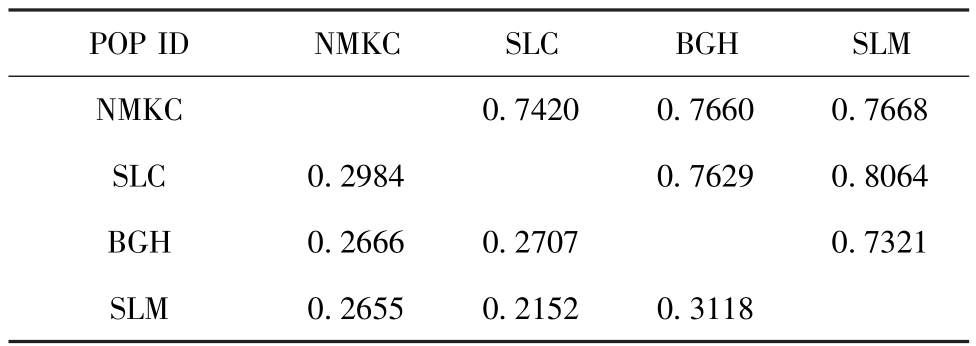
POP IDNMKCSLCBGHSLM NMKC0.74200.76600.7668 SLC0.29840.76290.8064 BGH0.26660.27070.7321 SLM0.26550.21520.3118
3.1 西藏拟溞DNA提取方法和RAPD取样量
本试验初期设计了两种DNA的提取方法,分别为酚-氯仿提取DNA方法和试剂盒提取DNA方法。由于西藏拟溞单只个体较小(成溞体长为1.2~2.3 mm,体质量为0.13~1.05 mg),在用酚-氯仿提取DNA的过程中,DNA很容易被降解或丢失。与其它枝角类相比,西藏拟溞的几丁质外壳特别硬,在用裂解液裂解之前必须进行研磨。本研究中尝试了不同的研磨方式,如用液氮在研钵中研磨,或者用匀浆器在冰上研磨,但由于西藏拟溞的个体太小,其效果都不理想,会使DNA丢失。用试剂盒提取DNA时,为了减少DNA的丢失,在0.2 mL的离心管中提取,并且用小研磨杵在其中研磨。提取的DNA最后溶解到20 μL的超纯水中。
另一方面,采用RAPD分析时需要取多少样才合适,无确切答案。根据Tajima[13]的DNA序列抽样分布理论,在DNA水平上估计群体变异时,样本数量n=10(甚至5)就可以了。抽样理论为较精确地探明自然界DNA水平的变异并最大限度地控制和节省试验消耗提供了理论依据。本试验中每个群体取20个个体来进行试验,确定为最适取样量。
3.2 不同产地西藏拟溞群体的遗传多样性
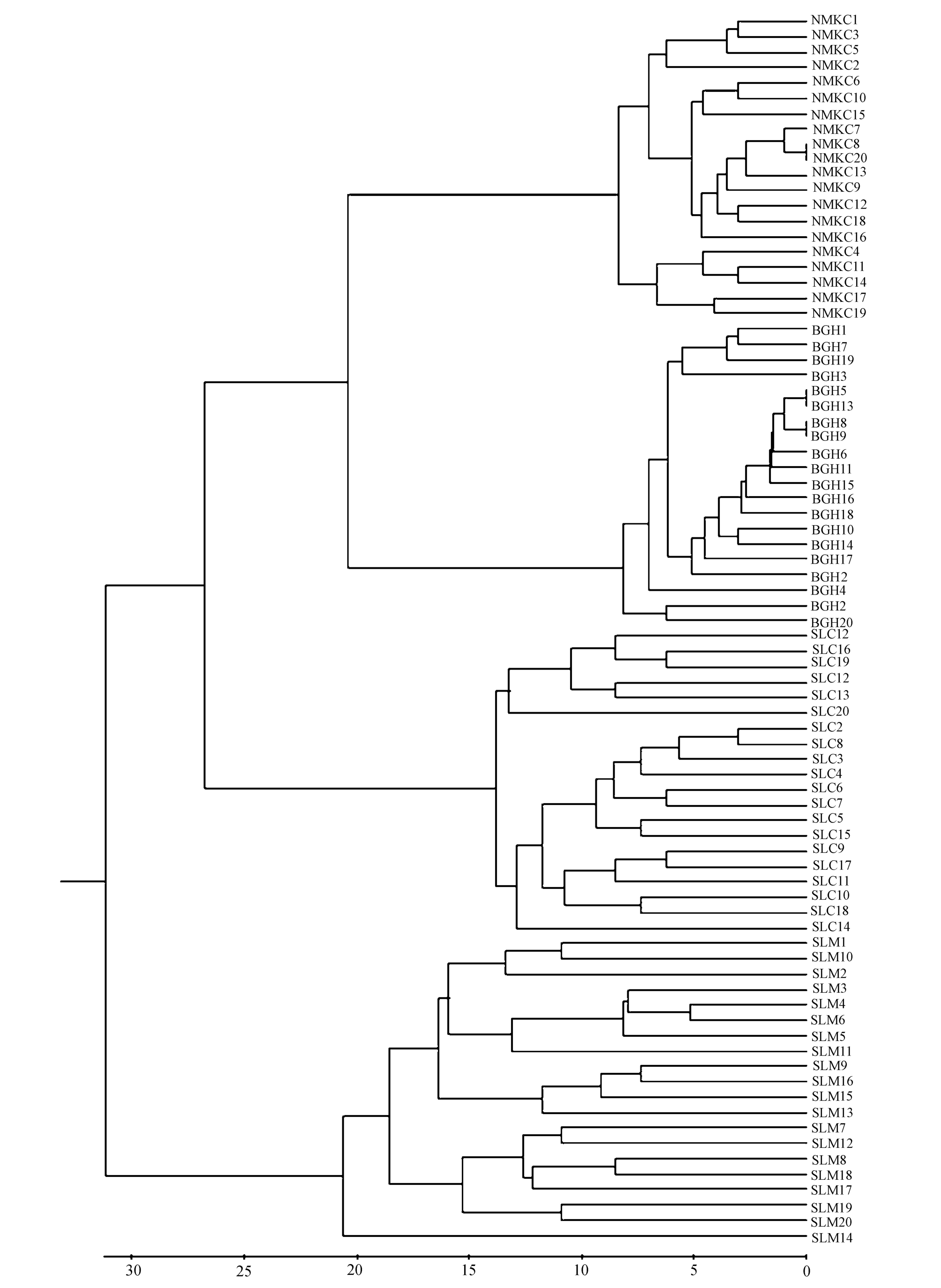
图4 西藏拟溞个体间Nei's遗传距离的UPGMA聚类图
Fig.4 UPGMA dendrogram for water fleas Daphniopsis tibetana based on Nei's genetic distance
西藏拟溞分布于高海拔、低温、盐度较高的水域,其存活、生长和繁殖受诸多生态因子的影响,其遗传多样性也不例外。本试验中初步揭示了不同水体西藏拟溞的遗传多样性存在的差异,4个西藏拟溞群体的亲缘关系中,纳木卡错群体与班戈湖群体较近,而赛里木湖群体与色林错群体较近。分析其原因,可以推测地理隔离和盐度变化具有重要作用。本试验中赛里木湖地处新疆,海拔为2071.9 m,面积为454 km2,水深为106 m,盐度为3~4
g/L;而西藏的3个湖泊均在藏北班戈县和申扎县境内,海拔为4 500~4 600 m,色林错、纳木卡错和班戈湖面积依次为1 658、17、80 km2,水深依次为33、1.5、1.2 m,盐度依次为10(18.3~18.8)、16.5(5~21)、26(26~40.5)g/L,Cl-离子含量依次为3.06、4.18、4.08 mg/L。可见,色林错与赛里木湖均为大而深的盐湖,盐度相对较低,且变动小,而班戈湖与纳木卡错盐度较高,且变化较大,因而西藏拟溞在长期适应过程中产生了不同的遗传多样性。郑绵平等[14]认为,在30 ka BP前,色林错与班戈错为同一大湖,湖面积可达10 000 km2,那么西藏拟溞是何时出现的有待考证。两湖隔离后水质发生了变化,导致两湖西藏拟溞出现遗传多样性差异。但这些仅是推测而已,至于不同产地西藏拟溞遗传多样性差异以及亲缘进化关系的原因还有待进一步研究。
参考文献:
[1] 赵文,王巧晗,郑绵平,等.西藏拟溞生物学的初步研究[J].大连水产学院学报,2002,17(3):209-214.
[2] 赵文,王巧晗.西藏拟溞形态构造的再描述[J].大连水产学院学报,2005,20(3):165-173.
[3] 赵文,张鹏,霍元子,等.西藏拟溞的染色体核型研究[J].大连水产学院学报,2004,19(3):167-170.
[4] 赵文,张琳,霍元子.温度、盐度和体长对西藏拟溞(Daphniopsis tibetana)耗氧率的影响[J].生态学报,2005,25(7):1149-1953.
[5] 赵文,霍元子,高敬.西藏拟溞营养成分的分析与评价[J].中国水产科学,2006,13(3):446-451.
[6] 赵文,霍元子,薛东宁.碱度和pH对西藏拟溞存活、生长和生殖的影响[J].水生生物学报,2007,31(3):332-338.
[7] Williams J G K,Kubelik A R,Livak K J,et al.DNA polymorphisms amplified by arbitrary primers are useful as genetic markers [J].Nucleic Acids Res,1990,18:6531-6535.
[8] Hellsten M E,Sundberg P.Genetic variation in two sympatric European populations of Bosmina spp.(Cladocera)tested with RAPD markers[J].Hydrobiologia,2000,421:157-164.
[9] 陆开宏,石志猛,王扬才.枝角类RAPD条件优化和遗传多样性分析[J].上海水产大学学报,2003,12(4):303-307.
[10] 张鹏,赵文,刘卫东,等.5种裸腹溞群体遗传变异及亲缘关系的初步分析[J].大连水产学院学报,2007,22(3):180-183.
[11] 安瑞生,谭声江,陈晓峰.小型昆虫DNA提取时匀浆方法的改进[J].昆虫知识,2002,39(4):311-312.
[12] 董云伟,牛翠娟.单只轮虫DNA提取及其细胞色素C氧化酶Ⅰ亚基部分序列测定[J].动物学研究,2002,23(1):81-83.
[13] Tajima F.Evolutionary relationship of DNA sequences infinite populations[J].Genetics,1983,105:437-126.
[14] 郑绵平,刘俊英,齐文.从盐湖沉积探讨40ka BP以来青藏高原古气候演替[C]//郑锦平.盐湖资源环境与全球变化.北京:地质出版社,1999:6-27.
Genetic diversity of four populations of Cladocera Daphniopsis tibetana
ZHAO Wen1,2,BI Jin-hong1,HAN Ting-ting1,WEI Jie1,2, CHAI Xiao-jie1,2,LU Jia-xuan1,XING Yue-nan1
(1.Key Laboratory of Hydrobiology in Liaoning Province,Dalian Ocean University,Dalian 116023,China; 2.School of Life Science and Technology,Dalian Ocean University,Dalian 116023,China)
Abstract:The genetic diversity of four populations(Selincuo in Tibet,SLC;Namukacuo in Tibet,NMKC;Bangehu in Tibet,BGH;Sailimuhu in Xinjiang,SLM)of Daphniopsis tibetana Sars were studied by RAPD technique. Twenty-one random primers were used to test eighty samples of four populations,and five primers were chosen for generation of a total of 51 high steady bands.The order of genetic variations analyzed by POPGENE32 in the four populations were arranged as SLC>SLM>NMKC>BGH.The phylogenetic tree among 4 populations constructed by the heredity distance indicated that the population SLM had higher genetic relationship with SLC,and the population MNKC showed higher genetic relationship with BGH.
Key words:Daphniopsis tibetana;genetic diversity;RAPD
文章编号:2095-1388(2011)02-0108-06
中图分类号:S917.4;Q959.223
文献标志码:A
收稿日期:2010-04-08
基金项目:国家自然科学基金资助项目(30671625,40776065,31072210)
作者简介:赵文(1963-),男,教授。E-mail:zhaowen@dlfu.edu.cn