异育银鲫各组织器官中细胞色素P450药酶活性的比较
贾娴1、2,胡琳琳1,房文红1,汪开毓2,胡晓1
(1.中国水产科学研究院东海水产研究所,农业部海洋与河口渔业资源及生态重点开放实验室,上海200090; 2.四川农业大学动物医学院,四川雅安625014)
摘要:对异育银鲫Carassius auratus gibelio肝胰脏、肾、鳃、肠和肌肉等组织器官中细胞色素P450 (CYP450)主要药酶活性进行检测,研究其在异育银鲫各组织中的分布。结果显示:以CO还原差示光谱法测得异育银鲫肝胰脏、肾、鳃、肠、肌肉微拉体的细胞色素P450及b5含量均以肝胰脏微粒体中最高,其次为肾、鳃、肠微粒体,肌肉中最低。以氨基比林N-脱甲基、红霉素N-脱甲基、苯胺-4-羟化反应分别作为CYP2B、CYP3A和CYP2E的探针反应,测得氨基比林N-脱甲基酶(APD)及红霉素N-脱甲基酶(ERND)活性在上述组织中分布差异性类似,均表现为肝胰脏微粒体中最高,分别为(1.668±0.104)、(0.941±0.061)nmol/(min·mg),其次为肾、鳃、肠微粒体,肌肉微粒体中最低,分别为(0.245± 0.011)、(0.078±0.019)nmol/(min·mg);苯胺-4-羟化酶(AH)活性以肝胰脏微粒体最高,为(0.052±0.009)nmol/(min·mg),其次为鳃微粒体,肌肉微粒体中最低,不能检出。研究表明,异育银鲫主要组织微粒体中具有细胞色素P450亚型活性,且它们在异育银鲫体内的分布和活性存在着组织和器官差异性,以肝胰脏组织中的含量和活性为最高。
关键词:异育银鲫;微粒体;细胞色素P450;组织分布
药物在体内的生物转化主要是通过药物代谢酶起作用,因而研究参与药物代谢的酶及其酶促反应成为药理学研究的一个十分活跃的领域[1]。对于鱼类细胞色素P450(CYP450),国外针对虹鳟已有较为全面的研究,但其多见于环境与分子毒理学研究以及环境污染物的监测。国内有关水产动物组织微粒体药酶的研究不多,如黎雯等[2]用鱼肝EROD酶活力诱导作为二噁英的水生态毒理学指标;陈大健等[3]研究了氟苯尼考对鲫CYP2E1活性的影响;韩现芹等[4]评价了磺胺甲基异嗯唑、甘草和连翘对牙鲆CYP2E1活性的影响;吴伟等[5]研究了多溴联苯醚胁迫下鲫肝胰脏微粒体CYP3A1和GST的响应。本研究中,作者以异育银鲫Carassius auratus gibelio为研究对象,优化了异育银鲫各组织微粒体的制备和细胞色素P450酶系相关酶活性的检测方法,并以氨基比林N-脱甲基、红霉素N-脱甲基、苯胺-4-羟化反应分别作为CYP2B、CYP3A和CYP2E的探针反应,对各组织中细胞色素P450亚型药酶活性进行了比较研究,旨在为今后进一步开展药物代谢、药酶以及相互作用关系研究提供基础技术资料。
1 材料与方法
1.1 材料
1.1.1 试验动物 异育银鲫购自上海郊区青浦养鱼场,挑选健康、体表无损伤的5尾鱼用于试验,体重为(225±12)g,体长为(18.6±2.1)cm。将试验鱼养殖于室内100 L的玻璃缸中,试验用水为经脱氯净化的自来水。试验期间,采用增氧机连续充氧,水温为(25±2)℃,每天换水2次,换水量为50%。试验前将鱼驯养2周,每天按鱼体重的3%左右投喂不含抗生素的全价鱼饲料,早晚各一次,试验前24 h停止喂食。
1.1.2 药品与试剂 还原型辅酶Ⅱ(NADPH)、1 -苯基-2-硫脲(PTU)、1,4-二硫苏糖醇(DTT)、α-苯甲硫酰氟(PMSF)购于Sigma公司;考马斯亮蓝G250购于沃凯公司;牛血清白蛋白(AR)、Tris(GR)、红霉素(AR)、氨基比林(AR)购于上海生工生物有限公司;苯胺、苯酚、三氯乙酸、连二亚硫酸钠等均为分析纯,购于国药集团上海化学试剂有限公司。
氯化钾-磷酸盐缓冲液:0.154 mol/L KCl-0.1 mol/L PBS缓冲液(pH为7.4)。
匀浆缓冲液:将体积分数为10%的甘油、1 mmol/L PMSF、1 mmol/L PTU、0.1 mmol/L DTT和1 mmol/L EDTA溶解于氯化钾-磷酸盐缓冲液。
保存缓冲液:将体积分数为20%的甘油、1 mmol/L PMSF、1 mmol/L PTU、0.1 mmol/L DTT和1 mmol/L EDTA溶解于氯化钾-磷酸盐缓冲液中。
1.2 方法
1.2.1 微粒体的制备 参照Lee等[6]的方法制备微粒体。用预冷的氯化钾-磷酸盐缓冲液漂洗组织(其中肠需灌洗以去除内容物),按w(组织)∶w (匀浆缓冲液)=1∶4的比例混匀,用内切式组织匀浆机于冰浴中制成匀浆,再转入预冷离心管中; 4℃下以10 000×g离心20 min,弃去漂浮的脂类物质后,置于超速冷冻离心管中;4℃下以105 000× g离心60 min。弃上清液,沉淀即为微粒体组分,加入适量保存缓冲液充分混匀后,分装于冻存管,置于-80℃下保存。比较以氯化钾-磷酸盐缓冲液和含保护剂的氯化钾-磷酸盐缓冲液作为匀浆缓冲液在制备微粒体时对P450酶的保护作用,并对制备的肝胰脏微粒体P450进行紫外扫描。
1.2.2 微粒体蛋白质含量的测定 采用考马斯亮蓝法[7]测定微粒体蛋白质含量。加入适量保存缓冲液将各样品稀释成1 mg(微粒体蛋白质)/mL (悬液),于-80℃下保存备用。
1.2.3 微粒体细胞色素P450及b5含量的测定参照Omura等[8]的方法测定微粒体细胞色素P450及b5含量。将微粒体样品稀释至0.5 mg微粒体蛋白/mL,取6 mL,加入60 μL 100 g/L连二亚硫酸钠,用玻璃棒小心搅拌混匀,静置1 min,等量分装于光径为1 cm的比色杯中,分别作为对照和样本,于样品杯中缓慢通入CO 1 min,稳定2 min,在波长400~500 nm处调零扫描差示光谱,并记录450 nm和490 nm处的OD值。测定b5时,以少许NADH代替100 g/L连二亚硫酸钠,除不充CO外,其余步骤与P450的测定相同。
A1=(OD450nm-OD490nm)×1000/(91×C),
A2=(OD423nm-OD490nm)×1000/(171×C),
式中:A1为P450(nmol/mg蛋白);A2为b5含量(nmol/mg蛋白);C为检测样本稀释后的蛋白浓度(mg/mL)。
1.2.4 氨基比林N-脱甲基酶(APD)活性的测定 参照Schenkman[9]的方法,制备甲醛标准曲线和测定氨基比林N-脱甲基酶(APD)活性。根据各样品的OD420nm值和甲醛标准曲线计算酶活性。酶活性以每毫克蛋白单位时间内的甲醛生成量表示[nmol/(min·mg)]。
1.2.5 红霉素N-脱甲基酶(ERND)活性的测定 反应体系中,除将底物改为1.4 mmol/L的红霉素外,其余步骤同氨基比林N-脱甲基酶(APD)活性的测定。酶活性以每毫克蛋白单位时间内的甲醛生成量表示[nmol/(min·mg)]。
1.2.6 苯胺4-羟化酶(AH)活性的测定 参照Dupont[10]的方法制备4-氨基酚标准曲线和测定苯胺4-羟化酶(AH)活性。根据各样品的OD630nm值和4-氨基酚标准曲线计算酶活性。酶活性以每毫克蛋白单位时间内的4-氨基酚生成量表示[nmol/(min·mg)]。
2 结果
2.1 异育银鲫各组织器官中微粒体蛋白的含量
异育银鲫肝胰脏、肾、鳃、肠和肌肉等组织器官的微粒体采用差速离心法制备,测得肾组织微粒体中蛋白质含量最高,肌肉微粒体中最低(表1)。
表1 异育银鲫主要组织器官中微粒体蛋白的含量(n=5)
Tab.1 Microsomal protein concentrations in main tissue microsomes from the crucian carp
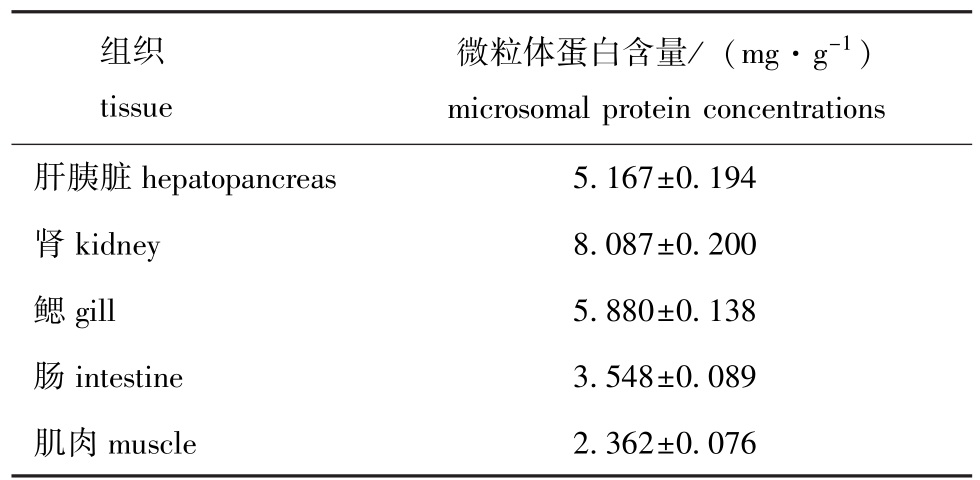
组织tissue微粒体蛋白含量/(mg·g-1) microsomal protein concentrations肝胰脏hepatopancreas5.167±0.194肾kidney8.087±0.200鳃gill5.880±0.138肠intestine3.548±0.089肌肉muscle2.362±0.076
2.2 异育银鲫各组织器官中微粒体细胞色素P450及b5的含量
异育银鲫肝胰脏、肾、鳃、肠和肌肉等组织器
官的微粒体中细胞色素P450和b5的含量见图1。从图1可见:肝胰脏微粒体中细胞色素P450和b5的含量最高,分别为(0.312±0.008)、(0.141± 0.010)nmol/mg;肌肉组织微粒体中最低,分别为(0.008±0.033)、(0.0015±0.0013)nmol/mg;肾、鳃和肠组织较接近,P450含量为0.165~0.191 nmol/mg,b5含量为0.091~0.107 nmol/mg。
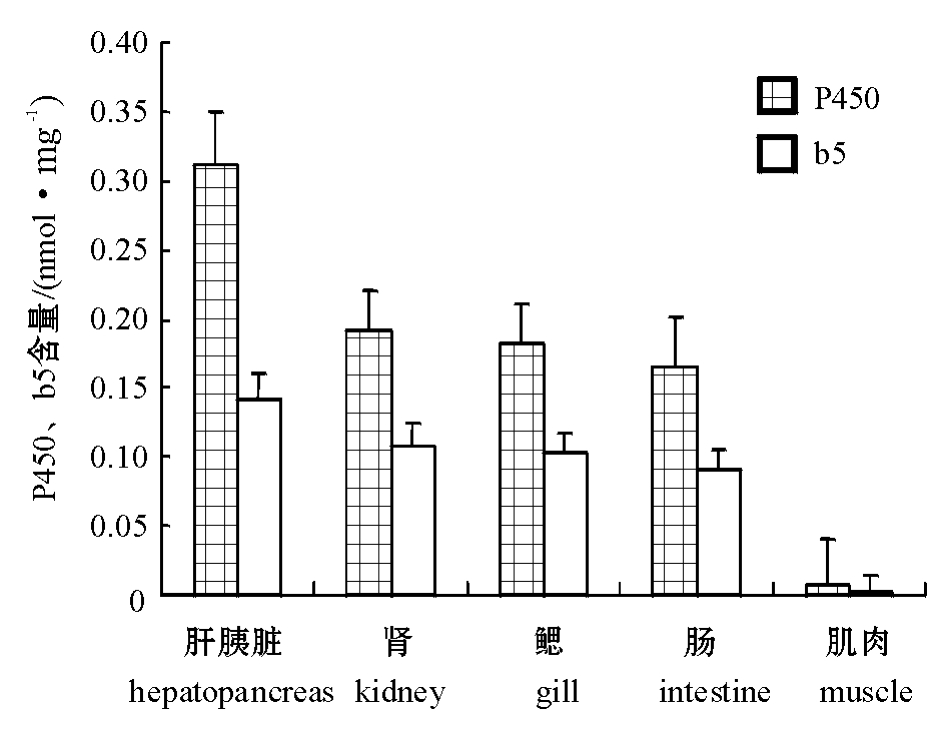
图1 异育银鲫各组织微粒体中细胞色素P450及b5的含量
Fig.1 P450 and b5 concents in main tissue microsomes of the crucian carp
肝胰脏微粒体中P450和b5紫外扫描图谱见图2。从图2可见:肝胰脏微粒体在450 nm处有最高吸收峰,为细胞色素P450,还原形式b5在423 nm处具有吸收峰;采用不添加保护剂的氯化钾-磷酸盐缓冲液制备肝胰脏微粒体时,P450容易失活。
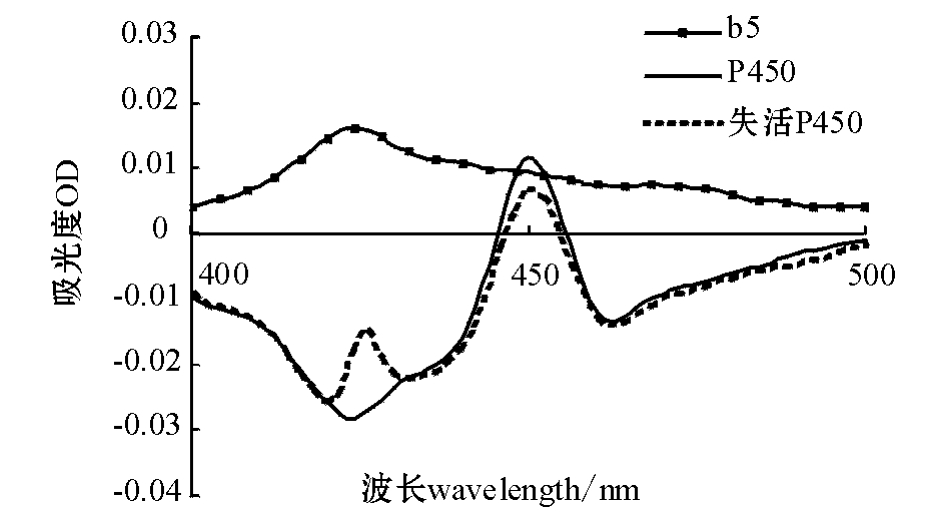
图2 异育银鲫肝胰脏微粒体中细胞色素P450及b5的扫描光谱图
Fig.2 The scanning spectrogram of hepatopancreas microsome CYP450 and b5 in the crucian carp
2.3 异育银鲫主要组织中APD、ERND和AH的活性
从图3可见:在异育银鲫肝胰脏、肾、鳃、肠和肌肉组织中,3种主要药酶活性均以氨基比林N -脱甲基酶(APD)活性为最高,其次是红霉素N -脱甲基酶(ERND),苯胺4-羟化酶(AH)活性最低,肌肉中几乎检测不到;在不同组织间, APD、ERND和AH活性均以肝胰脏微粒体中的最高,分别为(1.668±0.104)、(0.941±0.061)、(0.052±0.009)nmol/(min·mg)。
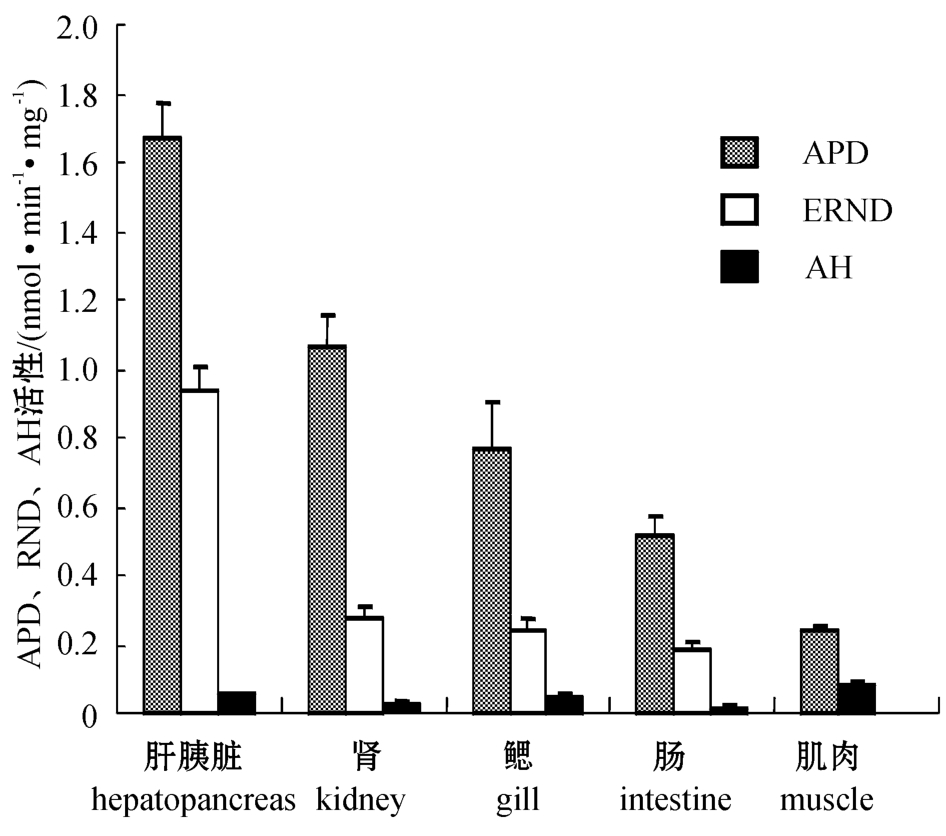
图3 异育银鲫主要组织中APD、ERND及AH的活性
Fig.3 APD,ERND and AH activities in main tissue microsomes from the crucian carp
3 讨论
3.1 微粒体制备方法的优化
本试验中采用差速离心法制备异育银鲫组织微粒体。在制备和保存过程中,使用氯化钾-磷酸盐缓冲液和含保护剂的氯化钾-磷酸盐缓冲液,并比较微粒体制备的效果和对细胞色素P450酶的保护作用。使用氯化钾-磷酸盐缓冲液制备所得微粒体细胞色素P450容易失活,表现为其紫外扫描图谱在420 nm左右常出现一个肩峰(图2)。在添加保护剂的氯化钾-磷酸盐缓冲液中,DTT和PTU对二硫键具有保护作用,PMSF为蛋白酶抑制剂,EDTA具有螯合作用,用该法制备所得的微粒体中细胞色素P450不易失活,实测蛋白含量高于氯化钾-磷酸盐缓冲液制备方法。由此可见,加入保护剂可消除干扰离子的影响,减少因血红素的吸附而造成对光谱测定的干扰。
3.2 鱼类P450、b5含量与组织分布
关于鱼类肝胰脏微粒体中细胞色素P450的研究报道较多。如未经药物诱导的奥尼罗非鱼肝胰脏微粒体中细胞色素P450含量为(0.346±0.042)
nmol/mg[11];虹鳟肝胰脏微粒体细胞色素P450含量为(0.354±0.035)nmol/mg[12];Stegeman等[13]对10种热带鱼的细胞色素P450及亚型活性进行了研究,其中7种鱼细胞色素P450含量为0.1~0.5 nmol/mg,细胞色素b5含量为0.025~0.25 nmol/ mg。本试验中测得异育银鲫肝胰脏微粒体细胞色素P450和b5含量分别为(0.312±0.008)nmol/ mg和(0.142±0.010)nmol/mg,与上述结果接近。这说明本试验中建立的异育银鲫细胞色素P450和b5含量的测定方法真实可靠。细胞色素P450在许多组织和器官中都存在,但其分布具有一定的选择性,主要分布于外源化合物进入体内的主要入口组织,这些组织构成了外源物质进入体内的第一道防线。对于鱼类而言,有研究报道,除了肝胰脏以外,细胞色素P450在鳃、肾、心等组织中也有少量存在。本试验结果显示,异育银鲫肝胰脏中细胞色素P450含量最高,是肾、鳃、肠中细胞色素P450含量的1.5~2.0倍,而肌肉中细胞色素P450的含量则很低,为(0.008±0.032) nmol/mg。关于鱼类微粒体b5的相关研究很少。本试验结果显示,b5的组织分布与P450相似,在肝胰脏中含量最高,肾、鳃、肠中较低,约为肝胰脏中b5含量的2/3,肌肉组织中极低,几乎不能检出。在人和其它哺乳动物中,肝和小肠也是CYP3A表达的主要器官[14-16],可见P450的这种选择性分布使其可以最大限度地发挥作用。
3.3 CYP2B、CYP3A及CYP2E活性的测定及组织分布
CYP1、CYP2和CYP3家族的成员在许多外源物的生物转化中起着非常重要的作用,与这些异构酶一样或者相关的成员在鱼类中也已经被发现。利用探针药物测定相应的P450酶活性,可用于分析比较不同个体以及同一个体不同组织中酶活性的差异。哺乳动物的CYP3A在细胞色素P450中所占比例最高,是参与口服药物首过效应的主要酶系。相关免疫化学比较研究证实,硬骨鱼类中也存在CYP3A基因,且作为肝脏主要的细胞色素P450成分与哺乳动物具有相似性[17]。据Buhler等[18]报道,鱼类肝胰脏微粒体混合功能氧化酶系和哺乳动物的相应酶系相似,可催化氨基比林的N-脱甲基反应和苯胺的羟化反应。本试验中分别以红霉素、氨基比林和苯胺作为研究CYP3A、CYP2B和CYP2E1的探针药物,结果显示:CYP3A在异育银鲫肝胰脏、肾、鳃、肠及肌肉组织中都有所分布,肝胰脏中CYP3A含量最高,是肾、鳃的3.5~4.0倍,约为肠的5倍,肌肉中最低,仅为肝胰脏中的1/12。尽管本试验中测得的异育银鲫肝胰脏微粒体中红霉素N-脱甲基酶活性[(0.941±0.061)nmol/ (min·mg)]低于哺乳动物,但与未经处理的海鲈Dicentrarchus labrax[(1162±200)pmol/(min·mg)]比较接近[19]。由此可以推测,鱼类CYP3A可能和哺乳动物一样,在药物代谢中起着重要作用。Stegeman等[13]报道的大多数热带鱼(如金线仿石鲈等)肝胰脏微粒体中氨基比林N-脱甲基酶活性为0.5~11 nmol/(min·mg);虹鳟肝胰脏中微粒体中苯胺羟化酶活性为0.068 nmol/(min·mg),本试验结果均与之相近。与CYP3A类似,CYP2B与CYP2E1在异育银鲫组织器官中的分布也具有一定的选择性,表现为肝胰脏中CYP2B含量约为肾的1.5倍,鳃的2倍,肠的3倍,肌肉中最低,仅为肝胰脏的1/7左右。本试验中测得异育银鲫的鳃中CYP2E1含量仅次于肝胰脏。研究表明, CYP2E1能够被许多有机小分子化合物诱导,是毒理学方面很重要的代谢系统[20]。鳃是鱼类的主要呼吸器官,CYP2E1在鳃中的较多分布与其参与水环境中外源物质的代谢相适应。
参考文献:
[1] 冷欣夫,邱星辉.细胞色素P450酶系的结构、功能与应用前景[M].北京:科学出版社,2001.
[2] 黎雯,徐盈,吴文忠.鱼肝EROD酶活力诱导作为二噁英的水生态毒理学指标[J].水生生物学报,2000,24(3):201-207.
[3] 陈大健,王加才,张萍,等.氟苯尼考对鲫鱼CYP2E1活性影响的药代动力学评价[J].中国兽医科学,2007,37(3):269-273.
[4] 韩现芹,李健,王群,等.探针药物法评价磺胺甲基异嗯唑、甘草和连翘对牙鲆CYP2E1活性的影响[J].中国海洋大学学报,2009,39(3):404-408.
[5] 吴伟,瞿建宏,聂凤琴,等.多溴联苯醚胁迫下鲫鱼肝脏微粒体CYP3A1和GST的响应[J].生态环境学报,2009,18(3):805 -810.
[6] Lee S S,Scott J G.An improved method for preparation,stabilization and storage of house fly(Diptera muscidae)microsome[J].J Econ Entomol,1989,82(6):1559-1563.
[7] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Anal Biochem,1976,722:248-254.
[8] Omura T,Sato R.The carbon monoxide-binding pigment of liver microsomes.:Ⅰ.Evidence for its hemoprotein nature[J].J Biol Chem,1964,239:2370-2378.
[9] Schenkman J B,Remmer H,Estabrook R W.Spectral studies of drug interaction with hepatic microsomals cytochrome[J].Mol
Pharmacol,1967,3:113-123.
[10] Dupont I.Involvement of cytochromes P450 2E1 and 3A4 in the 5 -hydroxylation of alicylate in humans[J].Drug Metab Dispos, 1999,27:322-326.
[11] Ueng Y F,Ueng T H.Induction and purification of cytochrome P450 1A1 from 3-Methycholanthrene-treated Tilapia,Oreochromis aureus,Oreochromis niloticus[J].Arch Biochem Biophys,1995, 322(2):347-356.
[12] Haasch M L,Graf W K,Quardokus E M,et al.Use of 7-alkoxyphenoxazones,7-alkoxycoumarins and 7-alkoxyquinolines as flurescent substrates for rainbow trout hepatic microsomes after treatment with various inducers[J].Biochem Pharmacol,1994,47 (5):893-903.
[13] Stegeman J J,Woodin B R,Singh H,et al.Cytochromes P450 (CYP)in tropical fishes:catalytic activities,expression of multiple CYP proteins and high levels of microsomal P450 in liver of fishes from Bermuda[J].Comp Biochem Physiol C Pharmacol Toxicol Endocrinol,1997,116(1):61-75.
[14] Lampen A,Christians U,Guengerich F P,et al.Metabolism of the immunosuppressant tacrolimus in the small intestine:cytochrome P450,drug interactions,and interindividual variability[J].Drug Metab Dispos,1995,23(12):1315-1324.
[15] Shimada T,Yamazaki H,Mimura M,et al.Interindividual variations in human liver cytochrome P-450 enzymes involved in the oxidation of drugs,carcinogens and toxic chemicals:studies with liver microsomes of 30 Japanese and 30 Caucasians[J].Pharmacol Exp Ther,1994,270(1):414-423.
[16] Wrighton S A and Stevens J C.The human hepatic cytochromes P450 involved in drug metabolism[J].Crit Rev Toxicol,1992,22 (1):1-21.
[17] Güner S,Colak A.Effect of divalent mental ions on the microsomal aniline hydroxylase system of rainbow trout[J].J Biochem Toxicol,1996,11(5):257-262.
[18] Buhler D R,Buhler-Wang J L.Rainbow trout cytochrome P450s: purification,molecular aspects,metabolic activity,induction and role in environmental monitoring[J].Comp Biochem Physiol C, 1998,121(3):108-110.
[19] Vaccaro E,Giorgi M,Longo V,et al.Inhibition of cytochrome P450 enzymes by enrofloxacin in the sea bass(Dicentrarchus labrax)[J].Aquat Toxicol,2003,62:27-33.
[20] Powell H,Kitteringham N R,Pirmohaned M,et al.Expression of cytochrome P4502E1 in human liver:assessment by mRNA,genotype and phenotype[J].Pharmacogenyics,1998,8(5):411-421.
Comparative Activity of microsomal cytochrome P450 in various tissues and organs in allogynogenesis silver crucian carp Carassius auratus gibelio
JIA Xian1,2,HU Lin-lin1,FANG Wen-hong1,WANG Kai-yu2,HU Xiao1
(1.East China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Key Laboratory of Marine and Estuarine Fisheries Resources and Ecology,Ministry of Agriculture,Shanghai 200090,China;2.Animal Medicine College,Sichuan Agriculture University,Yaan 625014, China)
Abstract:The activities and tissue distribution of cytochrome P450 drug-metabolizing enzyme were studied in liver,kidney,gill and muscle of allogynogenesis silver crucian carp Carassius auratus gibelio.Microsomal P450 and b5 contents were determined by the method of CO differential spectroscopy in liver,kidney,gill,intestine and muscle microsomes.Both cytochrome P450 and cytochrome b5 contents were found to be the maximum in liver microsome,and the minimum in muscle microsome.The activities of CYP2B,CYP3A and CYP2E were evaluated by microsomal N-demethylation of aminopyrine(APD),erythromycin(ERND)and 4-aniline-hydroxylation(AH)as probe specific reactions.The activities of APD(1.668±0.104)and ERND(0.941±0.061)nmol/(min·mg)were the maximum in liver microsome,and the minimum in muscle microsome[(0.245±0.011),and(0.078±0.019) nmol/(min·mg)].The maximal AH activity(0.052±0.009)nmol/(min·mg)was observed in liver microsome,but not be detected in muscle microsome,indicating that the above-mentioned cytochrome P450 isoenzymes were available in main tissue microsoms in the crucian carp,and the APD,ERND and AH activities were different in different tissues,the maximal activities being observed in liver microsome.
Key words:Carassius auratus gibelio;microsome;cytochrome P450;tissue distribution
文章编号:2095-1388(2011)01-0074-05
中图分类号:S948;Q555
文献标志码:A
收稿日期:2010-03-17
基金项目:中央级公益性科研院所基本科研业务费专项资金资助项目(2007M06)
作者简介:贾娴(1983-),女,硕士研究生。E-mail:xianjlz@126.com
通信作者:房文红(1968-),男,博士,研究员。E-mail:whfang06@yahoo.com.cn



