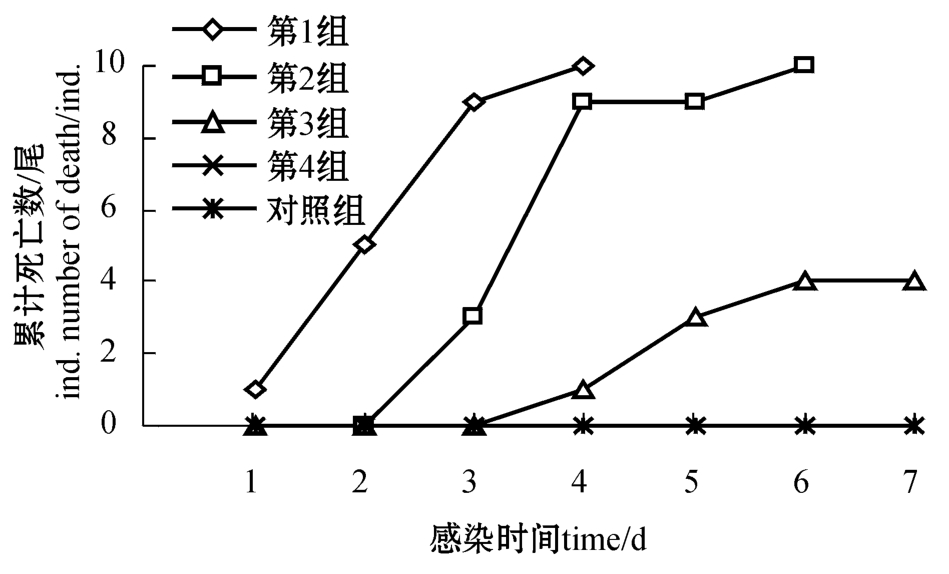
图1 用FY-024菌株注射感染的试验结果
Fig.1 Challenge test of the isolated strain FY-024 by injection
陈福艳,陈明,黄婷,张彬,杨家坚,雷爱莹,王瑞,梁万文
(广西水产研究所,广西南宁530021)
摘要:从患暴发性败血症的六须鲶Silurus soldatovi身上分离到致病菌株(FY-024),用常规细菌培养方法对其观察,并进行生理生化特性测试。结果表明,该致病菌均符合鲶爱德华氏菌Edwardsiella ictaluri特征。为了进一步确认该致病菌的分类地位,对其进行了16S rRNA基因序列分析、遗传距离距阵及系统发育树分析,共扩增出1 417 bp基因片段(GenBank登录号为GQ924477)。系统发育结果显示,菌株FY-024与鲶爱德华氏菌的16S rRNA基因同源性达99.6%~99.9%,聚为同一分支,进一步确认致病菌是鲶爱德华氏菌。药敏试验和毒力试验结果显示,菌株FY-024对环丙沙星、恩诺沙星药物高度敏感,按Reed和Muench氏法计算LD50=1.08×106cfu/尾。
关键词:六须鲶;鲶爱德华氏菌;暴发性败血症;分离与鉴定
六须鲶Silurus soldatovi原产于黑龙江流域,广西水产研究所于2007年引进六须鲶。驯养与繁殖结果表明,该鱼虽为北方品种,但同样适应中国南方地区的养殖环境条件,生长速度甚至比原产地提高50%以上,当年苗种养殖60 d体重可达1.5 kg,养殖1周年体重可达10~13 kg。由于六须鲶生长快,出肉率高,无肌间刺,是鱼片加工出口的上好材料,因而该鱼有望成为未来5~10年内中国产业化养殖开发的主导品种之一,其养殖及加工开发前景非常广阔[1-4]。
2009年6月,某养殖场养殖的六须鲶暴发急性败血症。发病初期,鱼不摄食,游动缓慢,反应迟顿,常静卧,偶尔失去平衡;发病后期,体表溃疡,头部、背鳍及内脏组织严重充血,腹部涨气,肠套叠。病发3 d后鱼开始死亡,5~6 d达到死亡高峰期,死亡率为60%。为了查明病原,作者对濒临死亡的病鱼进行病原菌分离、鉴定、生理生化特性及药物敏感性研究,确定其致病原因,旨在为六须鲶养殖中的病害防治提供参考。
1.1 材料
感染试验用健康鱼来源于广西水产研究所那马淡水养殖基地。将试验鱼运回实验室暂养7 d,期间无病害发生。鲶爱德华氏菌标准菌株是由广西水产研究所鱼病防治研究室(以下简称为本研究室)分离保存的。
血平板购自郑州安国绿科生物公司;TSA培养基按常规方法自配;药敏纸片购于杭州天和试剂有限公司。光学显微镜(GX41型)购于宁波市江东欧亿检测仪器有限公司;PCR仪、核酸蛋白分析仪及凝胶成像仪均购于BIO公司;生化鉴定盒(MID-64、MID-65)购于广东环凯公司,引物由大连宝生物公司合成。
1.2 方法
1.2.1 细菌分离 观察鱼发病与死亡的情况,并分4次对23尾患病鱼进行体征观察,确定病鱼典型症状后,选取最为典型患病活鱼进行细菌分离,无菌接种肝、肾、脑组织于血平板,28℃下恒温培养36~48 h后,挑取生长形态基本一致的单菌落于TSA液体中纯化培养48 h,然后用体积分数为20%的甘油保存于冰箱(-85℃)中。
1.2.2 人工感染试验 为了确定临床分离菌株的致病性,取纯化细菌3 mL,以12 000 r/min离心5 min,弃上清液,再加等量无菌生理盐水振荡制成浓度为7.49×108cfu/mL(第1组)原液,并将原液稀释成7.49×107cfu/mL(第2组)、7.49×106
cfu/mL(第3组)、7.49×105cfu/mL(第4组)。细菌感染试验设4组,每组10尾鱼,分别取各浓度的菌液于腹鳍基部注射,剂量为0.1 mL/尾;对照组注射等量无菌生理盐水。饲养水温为27~30℃。感染试验中连续观察7 d,记录病鱼症状及死亡数量,当感染组出现典型症状时,用上述细菌分离方法再次分离纯化细菌。采用Reed-Muench氏法[5]计算细菌的半致死浓度(LD50)。
1.2.3 药物敏感试验 按常规药敏纸片法,将培养36 h的菌液稀释100倍,均匀涂布于血平板,稍晾干,再将各种药敏纸片贴上,于28℃下培养48 h,测定抑菌圈直径。每种药物作双样对照,取其平均值。
1.2.4 细菌分类鉴定
1)形态观察 经革兰氏染色,在油镜下观察培养菌落的形态特征。
2)生化鉴定 将临床分离菌株从冰箱中取出,用血平板复苏,挑取单菌落用3 mL生理盐水(0.75%)洗脱,加100 μL菌液到生化鉴定孔,置于恒温箱(37℃)中培养36 h,统计生化反应结果。具体操作方法按照环凯生化鉴定盒说明书进行。同时将菌液涂布于血平板作生长对比。
3)PCR诊断 为了便于指导养殖户及时科学用药,采用本研究室建立的“鲶爱德华氏菌PCR快速诊断方法”[6]对初次分离纯化后的致病菌进行初诊。
4)分子鉴定
(1)细菌DNA的制备 取临床分离菌株接种于TSB培养基上,于28℃下振荡培养36 h,取菌液1 mL,以4 000 r/min离心5 min,弃上清液,加入双蒸馏水100 μL,于100℃水浴中煮沸8 min,再以12 000 r/min离心5 min,取上清液作为PCR模板DNA[6-7]。
(2)16S rRNA基因PCR扩增及序列进化分析PCR反应体系:10×PCR缓冲液(含Mg2+)5 μL,dNTP(5 mmol/L)1 μL,引物各1 μL,模板1 μL,Taq酶0.5 μL,加ddH2O至50 μL。引物序列为:f D1,5'-AGA GTT TGA TCC TGG CTC AG-3';r D1,5'-AGA GTT TGA TCC TGG CTC AG-3'。反应程序为:94℃下预变性2 min;94℃下变性5 min,55℃下退火1 min,72℃下延伸1.5 min,共进行35个循环;72℃下再延伸10 min,4℃下结束。样品送上海基康生物技术有限公司进行16S rRNA基因序列测序。用DNAStar软件构建遗传距离距阵和系统发育树。
2.1 病鱼症状与体征
发病初期,六须鲶不进食,游动缓慢,反应迟缓,常静卧,时而失去平衡,时而向水面挣扎;病发后期,病鱼体表严重出血,头部、眼眶、吻端、鳍条基部及肠道出现点状出血,部分病鱼的腹部膨大,有淡黄色透明液体,肝胰脏肿大,肠套叠,头顶(脑组织处)有白点,胸部有轻度糜烂现象。病害发生7 d内死亡率达60%,发病3~4 d达到死亡高峰期。六须鲶发病期间,养殖池塘中的水质已经恶化。
2.2 细菌的形态特征
从患病鱼肝、肾、脑组织分离出菌落形态一致的细菌(编号FY-024),于血平板上和TSA培养基中生长良好。经培养24~36 h后,菌落为乳白色,呈针尖大小,隆起,表面光滑,边缘整齐,有黏性。
2.3 人工感染试验
从图1可见:第1组,试验第1天死亡1尾,第3天达到死亡高峰,死亡率为90%,第4天死亡率为100%;第2组,试验第3天鱼开始死亡,第4天达到死亡高峰,死亡率为90%,第6天死亡率为100%;第3组,试验鱼从第4天开始死亡,第7天死亡率为40%;第4组及空白对照组的试验鱼全部存活。采用Reed和Muench氏法计算出FY-024菌株对六须鲶的半数致死浓度(LD50)为1.08×106cfu/尾。

图1 用FY-024菌株注射感染的试验结果
Fig.1 Challenge test of the isolated strain FY-024 by injection
感染12 h后,第1组鱼游动缓慢,反应迟缓,不进食;刚死的鱼头部、鳍条基部、肛门等部位有
点状出血点,解剖腹部可见肠道严重出血,肠套叠。第3组病鱼,后期头顶(脑组织处)有白点,胸部有轻度糜烂症状;从人工感染濒死鱼分离到的细菌与FY-024菌株基本一致。可判断FY-024菌株是本次六须鲶发病的致病菌。
2.4 生化鉴定
从表1可见:FY-024菌株的主要生化指标与东秀株等[8]的结果一致,即为革兰氏阴性杆菌,第一代有溶血,但传代溶血性差甚至无溶血,试验无动力,不产生硫化氢,V.P.阴性,无哚吲产生,不液化明胶,不利用丙二酸盐、水杨素和柠檬酸盐,T.D.A.阴性,氧化酶阴性,尿素酶阴性,精氨酸和鸟氨酸阴性,赖氨酸阳性,分解葡萄糖,不发酵蔗糖、乳糖、阿拉伯糖、ONPG、棉子糖、木糖、鼠李糖、山梨醇、甘露醇、肌醇和阿东醇。
表1 分离菌株的生化特性
Tab.1 The biochemical characteristics of the isolated strain

注:+示阳性,-示阴性;*示传代溶血性减弱甚至无。
Note:+means positive,-means negative;*represents weaken hemolysis of subculture.
检测项目ItemFY-024鲶爱德华氏菌E.ictaluri[8]革兰氏阴性--Adonitol--溶血性+*+动力Motility--H2S--V.P.--吲哚Indol--明胶Gelatin--丙二酸盐Malonate--T.D.A.--水杨素Salicin--柠檬酸盐Citrate--氧化酶Oxidase--尿素酶Urease--精氨酸Arginine--赖氨酸Lysine++鸟氨酸Ornithine--葡萄糖Glucose++蔗糖Sucrose--乳糖Lactose--阿拉伯糖Arabinose--ONPG--棉子糖Raffinose--木糖Xylose--鼠李糖Rhamnose--山梨醇Sorbitol--甘露醇Mannitol--肌醇Inositol--阿东醇
综合分析分离细菌(FY-024)的形态学特征、生理生化特性的试验结果和病鱼临床症状,初步认为该致病菌是鲶爱德华氏菌Edwardsiella ictaluri。
2.5 药物敏感性试验
FY-024菌株对17种抗菌药物的抑菌试验结果见表2。病原菌对环丙沙星(水产禁用药)、恩诺沙星药物高度敏感;对头孢噻吩、菌必治、头孢呋肟、先锋V中度敏感;对罗红霉素、克拉霉素、链霉素、卡那霉素、头孢克洛、头孢克肟、羧苄青霉素、庆大霉素、先锋必、阿莫西林和利福平不敏感。
表2 分离菌株FY-024的药敏试验结果
Tab.2 The sensitivity of the isolated strain FY-024 to chemotherapentants
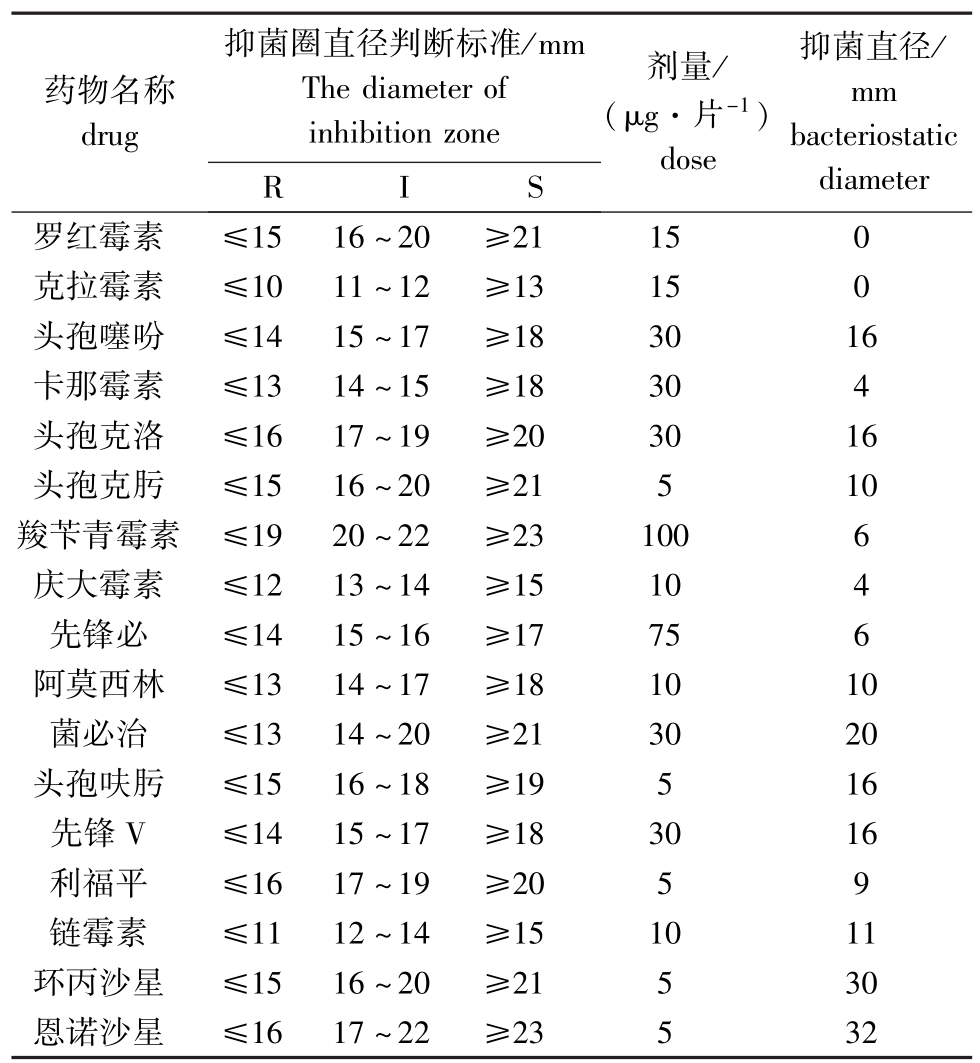
注:R示耐药;I示中度敏感;S示高度敏感。
Note:R,drug resistance;I,medium sensitivity;S,High sensitivity.
药物名称drug抑菌圈直径判断标准/mm The diameter of inhibition zone 23532 RIS抑菌直径/ mm bacteriostatic 21150克拉霉素≤1011~12≥13150头孢噻吩≤1415~17≥183016卡那霉素≤1314~15≥18304头孢克洛≤1617~19≥203016头孢克肟≤1516~20≥21510羧苄青霉素≤1920~22≥231006庆大霉素≤1213~14≥15104先锋必≤1415~16≥17756阿莫西林≤1314~17≥181010菌必治≤1314~20≥213020头孢呋肟≤1516~18≥19516先锋V≤1415~17≥183016利福平≤1617~19≥2059链霉素≤1112~14≥151011环丙沙星≤1516~20≥21530恩诺沙星≤1617~22≥diameter罗红霉素≤1516~20≥剂量/ (μg·片-1) dose
2.6 PCR诊断
采用鲶爱德华氏菌PCR快速诊断方法进行初诊,经PCR扩增和凝胶成像系统观察,结果见图2,扩增片段约276 bp,结果与鲶爱德华氏菌的特异性引物目的条带[6]一致,因此,初步确定为鲶爱德华氏菌。
2.7 16S rRNA基因序列分析与系统发育树的构建
对FY-024菌株的16S rRNA基因序列进行分析,扩增出大小为1 417 bp的基因片段(GenBank登录号为GQ924477)。将结果与GenBank中的相关数据进行比对(图3),发现与爱德华氏菌属的鲶爱德华氏菌、保科爱德华氏菌E.hoshinae、迟缓
爱德华氏菌E.tarda同源性达到97.6%~99.9%,其中与鲶爱德华氏菌的同源性最高。为了进一步确定分类地位,构建了系统发育树(图4),FY-024菌株与来源于广西的E.ictaluri-1菌株(DQ985469)同源性最高,与分别来源于韩国的E.ictaluri-2菌株(AB050826)和美国的E.ictaluri-3菌株(AF310622)的遗传距离相对较远,较直观地反映同一种内不同菌株之间遗传距离的地理差异,确定了FY-024菌株致病菌为鲶爱德华氏菌。
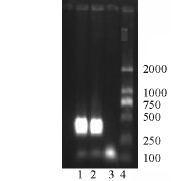
图2 FY-024和鲶爱德华氏菌特异性引物PCR扩增结果
Fig.2 The PCR amplification of the strain FY-024 and Edwardsiella ictaluri
注:1 FY-024菌株, strain FY-024;
2鲶爱德华氏菌, E.ictaluri;
3空白对照,negativ;
4 DNA marker DL2000。
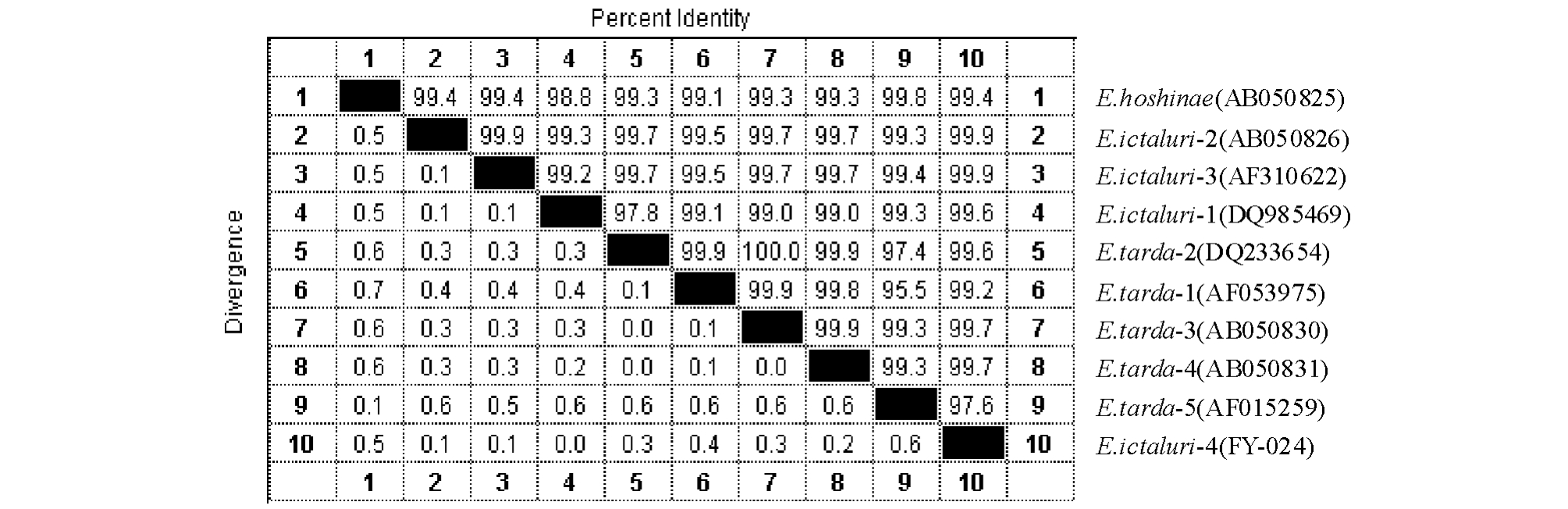
图3 菌株FY-024的16S rRNA基因序列同源矩阵
Fig.3 Homology and genetic relationship of the strain FY-024

图4 不同种类爱德华氏菌16S rRNA基因的系统发育树
Fig.4 Phylogenetic tree of 16S rRNA gene from bacterial Edwardsiella species
人工感染试验结果表明,从自然发病六须鲶中分离到的FY-024菌对健康六须鲶具有较强的致病及致死作用,并且感染鱼的发病症状与自然发病症状相似,都出现体表、内脏严重充血,肠道内有黄色透明液体,肝脾脏肿大等现象。另外,从感染发病鱼及死亡鱼中均能分离到与FY-024菌株完全一致的细菌,这证明FY-024菌株对六须鲶有致病性。同时,为了及时指导养殖户科学有效地用药,本研究室于第一时间采用PCR快速诊断方法对初次分离到的FY-024菌株进行快速诊断,结果表明,FY-024菌株与鲶爱德华氏菌(本研究室保存)的电泳条带相一致,约处于276 bp,因此初步定为鲶爱德华氏菌。为了进一步确定病因,还采用生理生化指标检测和16S rRNA基因序列分析两种方法对FY-024菌株进行分类学鉴定,两种方法的结果一致,进一步确定本次分离到的致病菌为鲶爱德华氏菌。
六须鲶自然发病情况及人工感染试验结果表明,此菌具有较强的致病性,病鱼死亡率高,对六须鲶规模化养殖具有较大的危害。另外,本研究中还用FY-024细菌人工感染斑点叉尾鮰,注射剂量为7.49×106cfu/mL。结果表明:感染第2天,斑点叉尾鮰开始出现死亡,死亡率高达100%,感染组也出现与六须鲶自然发病相似的症状,但斑点叉尾鮰没有腹部鼓起的症状。由此可见,本次分离菌株对斑点叉尾鮰也有一定的致病能力。据报道[6,9-12],鲶爱德华氏菌主要感染鲶形目的一些种
类,如斑点叉尾鮰、蟾胡子鲶和云斑鮰等。另外,也会感染一些非鲶形目鱼类,如鳗鲡、大麻哈鱼、罗非鱼、鳙等。六须鲶属于鲶爱德华氏菌易感染的鱼类之一,但从六须鲶体内分离到鲶爱德华氏菌尚属国内首例。本研究结果将为六须鲶规模化养殖中的病害防治提供有益的借鉴。
从本次发病情况看,六须鲶感染鲶爱德华氏菌后,发病快,传染性强,死亡率高。因此,在六须鲶养殖过程中,要做好鲶爱德华氏菌病的预防工作。主要有以下几点:1)水质管理。放鱼前做好场地消毒,可用30 g/m3生石灰带水清塘或用1~2 g/m3强氯精对水体消毒。养殖期间保持水质清新,定期换水,无换水条件的池塘在发病高峰期(7—9月),每隔15~30 d用强氯精、二氧化氯或溴氯海因对水体消毒,用药一周后使用益生菌调节水质。2)鱼苗消毒。购进鱼苗或倒池时,可用30 g/m3食盐水或用10 g/m3高锰酸钾浸泡鱼苗5~10 min。倒池过程中若鱼苗受伤严重,可对其外泼二氧化氯或强氯精消毒,内服(拌饲)菌毒杀星或恩诺沙星。3)饲料管理。投铒时需投喂鲜活饲料,不可投喂腐败变质饲料。如投喂水蚯蚓等动物性饲料时,可用30 g/m3食盐水浸泡5~10 min后再投喂。4)定期预防。每隔20~30 d投喂鱼病康或大蒜素,预防病害的发生。
致谢:本文得到杨学明博士悉心指导,特此致谢!
参考文献:
[1] 王佳喜,吴琅虎,顾雷,等.多瑙河六须鲶的生物学及其养殖[J].中国水产,1993(3):22-23.
[2] 李庆斋.六须鲶的养殖技术[J].中国农村科技,1996(4):40-41.
[3] 于信勇,刘婉莹,戴朝方,等.池塘养殖六须鲶试验[J].淡水渔业,1999,29(4):34-35.
[4] 郭贵良,闫先春,杨建光.东北六须鲶水花土池发塘技术[J].水产养殖,2006,27(5):32-33.
[5] Huang Z X,Hong T,Liu C B.Basic medico·virology and method [M].Beijing:Science Press,1990:143-144.
[6] 梁万文,陈明,余晓丽,等.斑点叉尾鮰肠败血症PCR诊断方法的建立[J].大连水产学院学报,2007,22(4):264-269.
[7] 张新艳,攀海平,钟全福,等.罗非鱼无乳链球菌的分离、鉴定及致病性研究[J].水产学报,2008(5):772-778.
[8] 东秀株,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:76-77.
[9] Wolters W R,Joknsom M R.Enteric septicaemia resistance in blue catfish and tree channel catfish strains[J].Aquat Anim Health, 1994,6:329-334.
[10] Krieg N R,Holt J G.Bergey's Manual of Systematic Bacteriology (Volume 1)[M].Baltimore:London Williams and Wilkins,1984: 486-491.
[11] Austin B,Austin D A.Bacterial fish pathogens:Disease in farmed and wild fish[M].Third(revised)Edition.Chichester,U K: Praxis Publishing Ltd,1999:22-23,81-84.
[12] 韩先朴,李伟,陈光辉.鳗鲡爱德华氏病的研究[J].水生生物学报,1989,13(3):259-264.
The isolation and identification of pathogen in northern sheatfish Silurus soldatovi suffering from fulminant septicaemia
CHEN Fu-yan,CHEN Ming,HUANG Ting,ZHANG Bin,YANG Jia-jian, LEI Ai-ying,WANG Rui,LIANG Wan-wen
(Guangxi Institute of Fisheries,Nanning 530021,China)
Abstract:The bacteria strain FY-024 was isolated from northern sheatfish Silurus soldatovi suffering from fulminant septicaemia and identified by conventional tests of bacterial culture,and by physiological and biochemical characteristics.The results showed that the strain FY-024 was very likely to be Edwardsiella ictaluri.16S rRNA gene of the strain was amplified,and sequenced to investigate the phylogenetic position.A fragment of 16S rRNA gene consisting of 1 417 bp was obtained,sequenced and submitted to Genbank(Accession No.:GQ924477).Compared with that of other related bacterial species,molecular phylogenetic dendrogram was constructed according to the genetic distance.This strain was found to be shared 99.6%-99.9%of homoeology with Edwardsiella ictaluri and clustered into one clade in phylogenetic dendrogram,confirming that this strain being Edwardsiella ictaluri.In addition,the drug sensitivity showed that this strain had high sensitivity to Ciprofloxacin and Enrofloxacin,and the strain FY-024 had a LD50(50%lethal dose,LD50)of 1.08×106cfu per fish calculated by the method of Reed and Muench in the injection challenge test.
Key words:Silurus soldatovi;Edwardsiella ictaluri;fulminant septicaemia;isolation and identification
文章编号:2095-1388(2011)01-0063-05
中图分类号:S943
文献标志码:A
收稿日期:2010-03-15
基金项目:广西科技计划项目(桂科基0731037,桂科合0718007B-34)
作者简介:陈福艳(1979-),女,工程师。 通信作者:梁万文(1961-),男,研究员。E-mail:nnlww@126.com