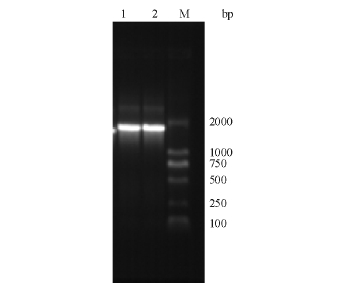
图1 Hsp70基因的PCR扩增结果
Fig.1 The PCR amplification of the Hsp70 gene in Tilapia
注:1、2为以pMD/rtHsp70为模板的PCR产物;M为Marker 2000。
陈明1,王秋华1、2,王瑞1,黄婷1,梁万文1,李超1,雷爱莹1,陈福艳1,余晓丽1,甘西1
(1.广西水产研究所,广西南宁530021;2.广西大学动物科学技术学院,广西南宁530005)
摘要:以尼罗罗非鱼血液mRNA反转录获得编码罗非鱼Hsp70完整cDNA,重组构建罗非鱼真核表达载体pPIC9K/rtHsp70;在毕赤酵母Pichia pastoris KM71中表达重组罗非鱼的热休克蛋白70(rtHsp70),对表达上清液进行SDS-PAGE及Western blot分析;采用亲和层析、HiTrap Desalting预装柱脱盐纯化目的蛋白。结果表明:克隆至pMD载体上的基因与目的基因完整编码区序列完全一致;诱导表达上清液经SDS-PAGE及Western blot分析,上清液中蛋白条带大小与目的蛋白相对分子质量大小一致;每升诱导上清液可以获得约2 mg纯化蛋白。本研究中获得的rtHsp70毕赤酵母工程菌及纯化的rtHsp70为后期rtHsp70-肽疫苗研究奠定了基础。
关键词:重组罗非鱼热休克蛋白70(rtHsp70);基因表达;毕赤酵母
热休克蛋白Hsp70相对分子质量约70 000,具有高度保守序列,在受到环境胁迫后能大量表达。因此,鱼类等水生生物Hsp70在各种应激条件下表达的变化是鱼类热休克蛋白被发现以来的研究热点。有学者曾提出,热休克蛋白可作为一种生物指标,通过检测水生生物Hsp70表达水平,对水环境进行监测。但是,Hsp70的表达水平并不总是与有害因素的作用强度平行,其机制较为复杂,监测水质时不能孤立考虑单项因素,因此利用Hsp70作为水环境污染的监测指标有它的局限性[1-2]。研究表明,Hsp70作为分子伴侣与肿瘤细胞中的内源性多肽结合,经细胞免疫途径发挥抗肿瘤效应, Hsp70与抗原肽结合的Hsp70-肽肿瘤疫苗具有很好的抗肿瘤作用,其可行性在实验动物上已得到证实[3-4]。由于鱼类规模化养殖的发展,鱼类疾病越来越复杂,疫苗免疫将成为防治鱼类疾病的重要途径,但目前鱼类疫苗缺乏有效且使用方便的剂型,实际生产中难以广泛应用。因此,研制高效且使用方便的口服型和浸泡型鱼类疫苗已成为目前急需解决的问题。Hsp70抗原载体和免疫佐剂的特性为研究新型水产疫苗提供了理论基础,同时以Hsp70为鱼类疫苗免疫佐剂进行研究将填补国内外鱼类Hsp70在应用研究领域的空白。本研究中,作者利用毕赤酵母Pichia pastoris大量制备重组罗非鱼热休克蛋白70(rtHsp70),旨在为以热休克蛋白作为免疫佐剂和肠道免疫增强剂用于罗非鱼链球菌病口服型疫苗的研究奠定基础。
1.1 材料
质粒pMD-Hsp70为广西遗传育种与健康养殖重点实验室保存,表达载体pPlC9K及毕赤酵母菌株KM71购于Invitrogen公司;Taq DNA聚合酶、T4 DNA Ligase购自TaKaRa公司;限制性内切酶AvrⅡ、EcoRⅠ、PmeⅠ购自NEB公司;DNA回收试剂盒、质粒提取和纯化试剂盒、酵母基因组抽提试剂盒和蛋白相对分子质量标准购自天根生化科技有限公司;小鼠原性抗His-tag单克隆抗体购自Novagen公司;Ni-NTA agarose购自QIANGEN公司;HiTrap Desalting预装柱购自GE公司;BCA蛋白浓度测定试剂盒购自威格拉斯公司;相对分子质
量为5 000的超滤离心管购自Millipore公司;引物由大连宝生物工程有限公司合成。
1.2 方法
1.2.1 引物设计及PCR扩增
根据Hsp70编码核甘酸序列及分泌型真核表达载体pPIC9K多克隆位点序列,设计了1对引物。上游引物Hspf,5'CGGACGAATTCTCTGCAGCTAAAGGTGTAGCGATC3',含EcoRⅠ酶切点;下游引物Hspr,5'TATTTCCTAGGGTGATGGTGATGGTGATGGTCCACCTCCTCAATAGT3',含AvrⅡ酶切位点,下游插入6个组氨酸标签。以质粒pMD-Hsp70为模板,扩增条件为:95℃下预变性5 min;95℃下变性30 s,55℃下退火30 s,72℃下延伸2 min,共30个循环;72℃下再延伸10 min。将PCR产物电泳后,经回收纯化与pMD18-T载体连接、转化及阳性克隆鉴定,并送大连宝生物工程有限公司验证,获得pMD18/rtHsp70克隆菌株。
1.2.2 表达载体pPIC9K/rtHsp70的构建 用LB液体培养pMD18/rtHsp70克隆菌株,采用质粒小提试剂盒提取质粒pMD18/rtHsp70。用EcoRⅠ和AvrⅡ酶分别消化pMD18/rtHsp70和质粒pPIC9K,以8 g/L琼脂糖凝胶电泳回收特异片段,用T4DNA Ligase连接。
1.2.3 pPIC9K/rtHsp70质粒的扩增及鉴定 连接产物用CaCl2热休克法转化到感受态大肠杆菌JM109中,并涂于含100 μg/mL Ampicillin LB平板上,于37℃下培养16 h。挑取单菌落扩大培养后提取质粒,再用EcoRⅠ和AvrⅡ酶进行双酶切鉴定,质粒送大连宝生物公司测序验证,获得pPIC9K/rtHsp70克隆菌株。
1.2.4 pPIC9K/rtHsp70质粒电转化毕赤酵母菌KM71 毕赤酵母菌株KM71电转化感受态的制备及质粒提取按照Invitrogen公司的Pichia Expression Kit操作说明进行。按PmeⅠ反应体系,在80 μL NEB Buffer反应体系中加入2 μg pPIC9K/rtHsp70,于37℃下酶切4 h。取80 μL酵母感受态细胞与5 μL线性化DNA混合,冰上放置5 min;转入预冷的电转杯中电击转化(1 500 V,5 ms);立即取出电击杯,加入1 mL预冷的山梨醇(1 mol/L)至电转杯中,轻轻混匀,将内容物转入灭菌离心管中。取适量涂于MD平板上,于28℃下培养3~5 d。
1.2.5 阳性工程菌的PCR鉴定 用MD平板培养(28℃)72 h后,挑取10个菌落分别置于含10 mL MD培养液的50 mL锥形瓶中,以250 r/min摇床,28℃下培养至OD600nm值为5~10,离心回收菌体,用酵母基因组抽提试剂盒DNA进行PCR鉴定。
1.2.6 rtHsp70小量诱导表达 挑取PCR鉴定为阳性的转化子,置于含30 mL BMGY(pH 6.0)的三角瓶中,以250 r/min摇床,28℃下培养至OD600nm值为2.0;以1500 g离心5 min,弃上清液,将菌体悬浮于5 mL pH 6.0的BMMY中,每24 h补充一次甲醇至终体积分数为0.5%,分别取甲醇诱导后48、72、96 h的发酵液上清液进行SDSPAGE及Western blot分析。
1.2.7 rtHsp70大量诱导表达 挑取经过小量诱导表达筛选出的较高表达水平的菌株,接种至含10 mL BMGY培养基的小三角瓶中,以260 r/min摇床,28℃下培养至OD600nm=2.0~6.0(16~18 h)。将10 mL培养物接种至含1 L BMGY的3 L摇瓶中,以260 r/min摇床,28℃下培养至对数生长期(OD600nm=2.0~6.0)。室温下以1 500 g离心5 min,收集细胞,将细胞重悬于300 mL BMMY培养基中,置于2 L的摇瓶中,28℃下以260 r/min摇床诱导表达,加入体积分数为0.5%的甲醇诱导至96 h,4℃下以1 500 g离心5 min,收集上清液。
1.2.8 蛋白纯化及浓度测定 诱导表达上清液用Ni-NTA agarose亲和层析柱进行纯化目的蛋白,用40 mmol/L咪唑液进行洗脱,洗脱后采用AKTA蛋白纯化系统,用HiTrap Desalting预装柱对Hsp70进行脱盐,收集目的蛋白组分。用超滤离心管进行超滤浓缩,离心过程中用pH为7.3的PBS更换缓冲液,按照BCA蛋白浓度测定试剂盒说明书测定蛋白浓度。
2.1 rtHsp70基因的克隆
以质粒pMD/rtHsp70为PCR模板进行PCR扩增,得到大小约1960 bp的基因片段(图1)。经克隆得到pMD/rtHsp70载体,挑选其中10个阳性克隆送检,经核酸序列分析证实,所得基因序列与目的基因完整编码区序列完全一致。
2.2 rtHsp70表达工程菌的筛选
构建的表达载体pPIC9K/rtHsp70用AvrⅡ和EcoRⅠ酶消化后,经8 g/L的琼脂糖凝胶电泳,
结果显示大约有9 300 bp和1 960 bp两个片断。经质粒核酸序列分析确证表达载体的阅读框和序列均正确。用重组质粒线性化转化KM71,提取酵母工程菌基因组DNA,Hsp70上游引物和质粒3'AOX引物经PCR法扩增,获得约2 100 bp的片段(图2),而阴性对照无此条带。上述结果证明, rtHsp70基因已整合入酵母菌KM71的基因组中。

图1 Hsp70基因的PCR扩增结果
Fig.1 The PCR amplification of the Hsp70 gene in Tilapia
注:1、2为以pMD/rtHsp70为模板的PCR产物;M为Marker 2000。
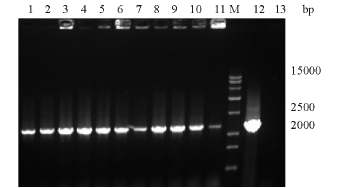
图2 重组菌pPIC9K/rtHsp70/KM71基因组的PCR扩增结果
Fig.2 The PCR amplification of the genomic DNA of pPIC9K/rtHsp70/KM71
注:1~11为1~11号重组菌PCR产物;12为阳性对照pPIC9K/rtHsp70;13为阴性对照pPIC9K/KM71。
2.3 rtHsp70的表达及鉴定
对PCR结果阳性的酵母菌进行诱导表达,上清液经SDS-PAGE电泳分析,诱导72、96 h可见蛋白表达。诱导96 h后,3号菌可见较明显的蛋白表达条带。经Western blot检测,结果显示,在相对分子质量约70 000处出现特异性条带(图3)。
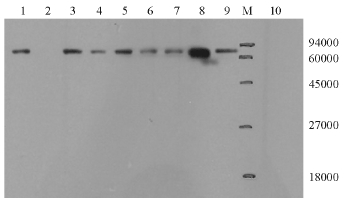
图3 重组菌pPCI9k/rtHsp70/KM71表达产物Westernblotting的检测结果
Fig.3 Western-blot analysision of pPCI9k/rtHsp70/ KM71 expression products
注:1~3为1~3号重组菌诱导48 h表达上清液;4~6为1~3号重组菌诱导72 h表达上清液;7~9为1~3号重组菌诱导96 h表达上清液;10为阴性对照重组菌pPCI9k/KM71诱导72 h表达上清液;M为Marker。
2.4 rtHsp70的纯化及浓度测定
选择表达量高的3号菌进行大量诱导表达,对表达上清液进行Ni-NTA agarose亲和层析纯化后,采用AKTA蛋白纯化系统对洗脱的目的蛋白用Hi-Trap Desalting预装柱进行脱咪唑。由于蛋白浓度较低,咪唑浓度较高,从色谱图(图4)中可见到明显的咪唑峰(A4~A8),蛋白峰(A1~A3)则较平。由于蛋白组分与咪唑较接近,因此,收集蛋白组分超滤浓缩的同时更换缓冲液,最终将蛋白保存在PBS中。用BCA方法对蛋白浓度进行测定,结果每升诱导上清液中可以得到纯化蛋白2 mg。将纯化的目的蛋白经SDS—PAGE电泳分析可见,在相对分子质量为66 200和94 000之间有清晰的目的蛋白条带(图5)。
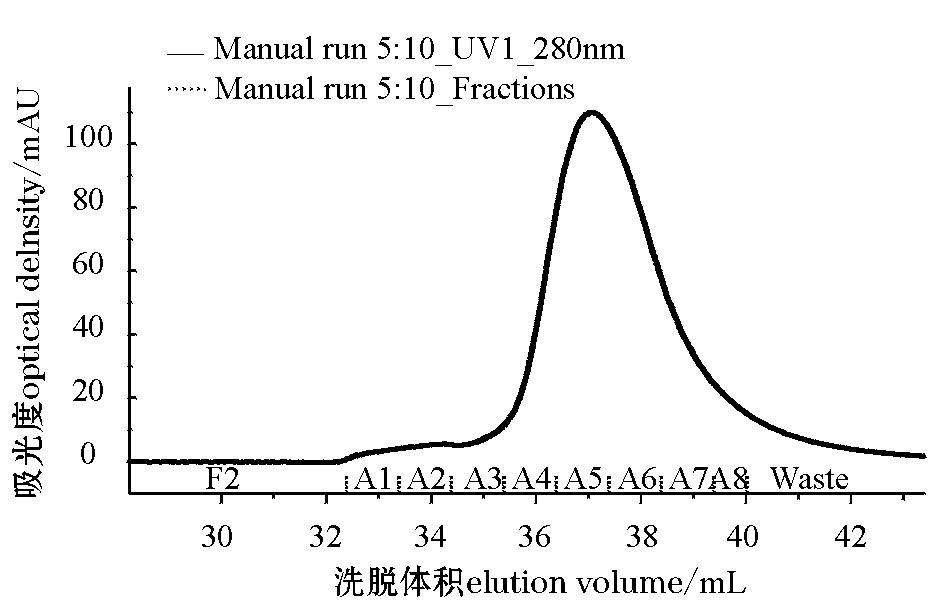
图4 AKTA液相系统脱盐
Fig.4 Desalination by AKTA HPLC system

图5 纯化后rtHsp70 SDS-PAGE电泳
Fig.5 SDS-PAGE analysis of purified rtHsp70
热休克蛋白(heat shock protein,Hsp)的佐剂样效应以及在肿瘤和抗感染免疫中的应用,一直是Hsp研究领域的热点。Hsp70是热休克蛋白家族中最重要的一员,被认为是最具有免疫耐受性的分子,原核生物和真核生物中的Hsp70约有50%的氨基酸具有同源性,不同真核生物有60%~78%氨基酸具有同源性[5-10]。对Hsp70蛋白质晶体的结构生物学研究证明,其具有多肽结合槽位,具备结合多肽的结构特征[11]。目前,采用Hsp70——抗原肽复合物作为疫苗诱导抗肿瘤、抗感染免疫已进入临床试验阶段,并显示了良好的应用前景[12]。但要实现产业化,前提是必须获得大量的Hsp70蛋白。因此对Hsp70进行体外表达是一个重要途径。毕赤酵母是20世纪80—90年代发展起来的酵母表达系统,为甲醇型酵母,能利用甲醇作为唯一的碳源和能源。由于毕赤酵母在蛋白质表达方面具有其它系统所不可比拟的优点,因而得到越来越广泛的应用[13]。毕赤酵母中有两个基因AOX1和AOX2,编码醇氧化酶,两者序列相似,细胞中绝大多数醇氧化酶是AOX1基因产物,甲醇可紧密调节、诱导AOX1高水平的表达,AOX2基因只承担很少一部分活力[14-15]。本研究中采用的KM71宿主菌,其染色体上大部分AOX1基因被删除,本身为Muts,转化后,转化子为Muts,不必进行表型筛选及鉴定。张维延等[16]对毕赤酵母KM71和GS115的发酵工艺进行了研究,结果表明,通过调整发酵工艺中的各种参数,KM71和GSl15均适用于不同性质外源蛋白的表达,而且表达量较高,是一种理想的表达系统。通常认为,转化子中整合目的基因拷贝数越多,表达目的蛋白量越高。本研究中选用的载体pPIC9K含kan基因,可以通过遗传霉素进行多拷贝子的筛选,操作简单方便。
生物活性是基因工程表达重组蛋白的重要指标,研究重组蛋白生物活性的前提是获得纯化的蛋白。目前蛋白纯化主要方法有沉淀法、离子交换色谱法、亲和层析法、凝胶过滤法和电泳分离法等。本研究中采用亲和层析法和凝胶过滤法对重组蛋白进行纯化,每升诱导表达上清液可获得2 mg rtH-sp70。亲和层析是基于目的蛋白与固化的配基特异性结合而滞留,未结合的杂蛋白被洗掉,从而使目标产物得到分离纯化的液相层析方法[17]。近几十年来,亲和层析技术发展十分迅速,广泛用于分离纯化蛋白质、肽、酶及其底物和抑制剂等。凝胶过滤层析是根据蛋白质大小不同而达到分离效果,凝胶过滤填料中含有大量微孔,只允许缓冲液及小分子量蛋白质通过,大分子蛋白及一些蛋白复合物则被阻挡在外。因此,高分子量的蛋白质在填料颗粒间隙中流动,比低分子量蛋白更早的被洗脱下来,通过收集不同时段的洗脱液来得到目的蛋白。本研究中在目的蛋白N端添加6个组氨酸,使目的蛋白与亲和柱载体上的镍离子特异性结合,再用含咪唑缓冲液竞争性置换目的蛋白。为了除去亲和层析纯化后蛋白液中的咪唑,本研究中采用凝胶过滤法进一步纯化目的蛋白,但由于咪唑浓度较高,目的蛋白峰与咪唑峰分离不明显,因此本实验中凝胶过滤纯化rtHsp70各参数还需进一步优化。
常用的蛋白质浓度测定方法有280 nm光吸收法、Bradford检测法、Lowry检测法、BCA检测法、半点滤膜结合法。本研究中采用的BCA检测法是一种改进的Lowry测定法,在碱性环境下蛋白分子中的肽键结构能与Cu2+络合生成络合物,同时将Cu2+还原成Cu+。而BCA试剂可敏感特异地与Cu+结合,形成稳定的有颜色复合物,在562 nm处有最大吸收值。颜色深浅与蛋白质浓度成正比,可根据吸收值大小计算蛋白质的含量[18]。该方法反应简单,终产物稳定,几乎没有干扰物质的影响。本研究中采用BCA方法测定,每升诱导上清液中可获得纯化蛋白约为2 mg。
本研究中从罗非鱼DNA文库中克隆编码Hsp70 DNA,构建了分泌型表达载体,采用毕赤酵母表达系统对罗非鱼热休克蛋白70进行表达,筛选了表达罗非鱼Hsp70水平较高工程菌,为后期罗非鱼Hsp70作为免疫佐剂在罗非鱼疫苗研制中奠定基础。
参考文献:
[1] 祝璟琳,王国良.鱼类Hsp70的研究进展[J].宁波大学学报, 2007,20(4):446-449.
[2] Lin Shengsong,Wu Longtao,Ni Duojiao,et al.The cDNA cloning and mRNA expression of heat-shock protein 70 gene in the haemocytes of bay scallop(Argopecten irradians,Lamarck 1819)responding to bacteria challenge and naphthalin stress[J].Fish&Shellfish Immunology,2006,21(3):335-345.
[3] 王森舟.热休克蛋白的生物功效及与肿瘤热疗的研究进展[J].实用医学杂志,2006,22(8):969-971.
[4] Tamura Y,Peng P,Liu K,et al.Immunotherapy of tumors with autologous tumor-derived heat shock protein preparations[J].Science,1997,278:117-120.
[5] Lindquist S,Craig E A.The heat-shock proteins[J].Annu Rev Genet,1988,22:631-767.
[6] Hartl F U.Molecular chaperones in cellular protein folding[J]. Nature,1996,381:571-579.
[7] Feder M E,Hofmann G E.Heat-shock proteins,molecular chaperones,and the stress response:evolutionary and ecological physiology[J].Annu Rev Physiol,1999,61:243-282.
[8] Jolly C,Morimoto R I.Stress and the cell nucleus:dynamics of gene expression and structural reorganization[J].Gene,1999,7: 261-270.
[9] Feige U,Polla N S.Heat shock protein:the Hsp70 family[J].Experentia,1994,50:979-986.
[10] 孙培明,王志亮.热应激蛋白70-肽疫苗研究进展[J].中国兽医杂志,2006,42(12):43-44.
[11] Zhu X,Zhao X,Burkholder W F,et al.Structural analysis of substrate binding by the molecular chaperone DnaK E[J].Science, 1996,272:1606-1614.
[12] Srivastava P K.Immunotherapy of human cancer:lessons from mice[J].Nature Immunol,2000,1(5):363-366.
[13] Siegel R S.Methylotroyphic yeast Pichia pasteur produced in high -cell-density fermentation with high cell yields as vehide for recombinant protein producdon[J].Biotenchnology and Bioengineering,1989,34:403-404.
[14] Koutz P,Davis G R,Stillman C,et al.Structural comparison of the Pichia pastoris alcohol oxidase genes[J].Yeast,1989,5:167-177.
[15] Waterham H R,Digan M E,Koutz P J,et al.Isolation of the Pichia pastoris glyceraldehyde-3-phosphate deydyogenase gene and regulation and use of its promoter[J].Gene,1997,186:37-44.
[16] 张维延,江阳,许志祥,等.毕氏酵母KM71和GS115发酵工艺的比较[J].苏州医学院学报,2001,21(3):268-270.
[17] 赵永芳.生物化学技术原理及应用[M].北京:科学出版社, 2002:7-82.
[18] Smith P K,Krohn R I,Hermanson G T,et al.Measurement of protein using bicinchoninic acid[J].Anal Biochem,1985,150:76-85.
Expression and purification of recombinant Tilapia heat shock protein 70 in yeast Pichia pastoris
CHEN Ming1,WANG Qiu-hua1,2,WANG Rui1,HUANG Ting1,LIANG Wan-wen1,LI Chao1, LEI Ai-ying1,CHEN Fu-yan1,YU Xiao-li1,GAN Xi1
(1.Guangxi Institute of Fisheries,Nanning 530021,China;2.College of Animal Science and Technology,Guangxi University,Nanning 530005,China)
Abstract:The recombinant cDNA of Tilapia Hsp70 was amplified from blood mRNA and inserted into vector pMD18-T.Sequencing revealed that the cDNA was subcloned into expression vector pPIC9K.The recombinant vector was transformed into the yeast Pichia pastoris KM71 via electroporation after sequencing.The transforming positive clones were screened by PCR and rtHsp70 in culture supernatant induced by methanol was identified by Western blot.Protein purification by the affinity chromatograph and gel filtration showed the sequence of rtHsp70 DNA was correct.It was a protein with relative molecular mass of 70 000 in the culture supernatant by SDS-PAGE and Western blot analysis.Two 2 mg purified rtHsp70 can be obtained in per liter expression supernatant,and Pichia pastoris engineer bacteria of rtHsp70 expression and purified protein were gained.The study is paved the way for further study of using rtHsp70 for immunologic adjuvant in peptide-vaccine application.
Key words:rtHsp70(recombinant Tilapia heat shock protein 70);gene expression;Pichia pastoris
文章编号:2095-1388(2011)01-0058-05
中图分类号:Q813.2
文献标志码:A
收稿日期:2010-03-08
基金项目:国家社会公益研究项目(2060302 GXIF-2008-03);国家科技支撑计划项目(2008BADB9B04)
作者简介:陈明(1979-),男,助理研究员。E-mail:cm990919@163.com
通信作者:甘西(1956-),男,研究员。E-mail:ganxicn@126.com