表1 酸溶性胶原蛋白正交试验因素水平表
Tab.1 The factor and level table in the orthogonal experiment of ASC
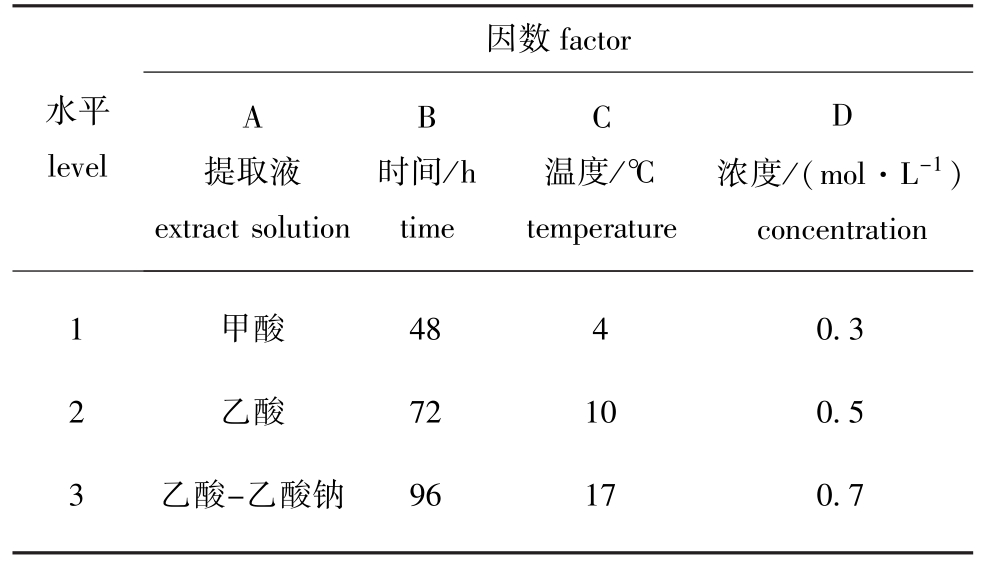
因数factor水平level A提取液extract solution B C D时间/h time温度/℃temperature浓度/(mol·L-1) concentration 1 2 3甲酸乙酸乙酸-乙酸钠48 72 96 4 10 17 0.3 0.5 0.7
刘远平,张琳琳,张慧怡,赵丹,马然,汪秋宽
(大连海洋大学辽宁省水产品加工及综合利用重点开放实验室,辽宁大连116023)
摘要:采用两种不同的方法从海燕Asterina pectinifera体壁中提取出酸溶性胶原蛋白(ASC)和胃蛋白酶促溶性胶原蛋白(PSC)。结果表明:ASC的最佳反应条件是,温度为10℃,提取液种类为乙酸-乙酸钠溶液,提取液浓度为0.5 mol/L,提取时间为72 h,ASC得率为7.93%;PSC的最佳反应条件是,温度为17℃、胃蛋白酶酶加量为4%、提取时间为96 h,PSC得率为49.61%。经紫外光谱和氨基酸组成分析,结果表明,ASC和PSC均为典型的Ⅰ型胶原蛋白。
关键词:海燕;酸溶性胶原蛋白;酶促溶性胶原蛋白;提取工艺
胶原蛋白是动物结缔组织的主要成分,是动物体内含量最多、分布最广的蛋白质。胶原蛋白广泛存在于动物的皮肤、骨骼、牙齿、韧带和血管中,起着支撑器官、保护机体的功能[1]。胶原蛋白现已广泛应用于食品、化妆品、营养保健品、生物肥料以及医用材料等领域[2]。牛、猪的皮和骨中的胶原蛋白一直作为工业用胶原蛋白的主要来源。近年来,由于哺乳动物疫病的爆发和人畜共患病的增加,使其安全性受到了怀疑。世界各国都在积极寻找更安全的胶原蛋白来源,从水生动物中提取安全、卫生、无公害的胶原蛋白已成为各国研究的热门课题。国内外对鱼类胶原蛋白的研究较深入[3-5],关于无脊椎动物如海蛰[6]、海参[7-9]、多棘海盘车[10]胶原蛋白的研究也有报道,但尚未见关于海燕胶原蛋白研究的报道。
海燕Asterina pectinifera俗称海星,属海星纲有棘目海燕科,常见于中国黄海、渤海一带,是分布广泛的海洋生物资源之一[11]。海燕的体壁较宽厚,韧性极强,含有丰富的胶原蛋白。本研究中,作者对海燕体壁胶原蛋白的提取工艺进行了初步研究,旨在为其胶原蛋白的开发利用提供参考。
1.1 材料
将新鲜海燕(大连獐子岛渔业集团提供)去内脏,冲洗干净,冷冻备用。
胃蛋白酶购自Sigma公司,浓盐酸、冰醋酸、乙酸钠均为分析纯。
1.2 主要仪器与设备
主要仪器有:FD-4冷冻干燥机、FJ-300-S高速均质机、GL-21M冷冻离心机、UV-754分光光度计。
1.3 方法
1.3.1 原料预处理 将海燕体壁破碎后浸泡于0.4 mol/L的盐酸溶液中,搅拌,每日更换盐酸一次,至海燕体壁变软后用清水漂洗至pH为5.0。将漂洗后的海燕体壁浸泡于0.3 mol/L的NaOH溶液中,每隔2 h更换一次溶液,搅拌6 h,漂洗至pH为8.0,用高速均质机匀浆,真空冷冻干燥。以上操作均在4℃以下进行。
1.3.2 酸溶性胶原蛋白的提取 准确称取9份同等质量经预处理的海燕体壁,加入提取液进行提取(w(海燕体壁)∶w(提取液)=1∶20),以提取液种类、反应时间、提取液浓度和温度为试验因素进行酸解正交试验。提取完成后,将混合物以5 000 r/min离心30 min;向上清液中加入NaCl使终浓度达到2.5 mol/L,静置24 h后以10 000 r/min离心30 min,将沉淀物透析脱盐后冷冻干燥,
即得酸溶性胶原蛋白(ASC)。ASC正交试验因素和水平如表1所示。
表1 酸溶性胶原蛋白正交试验因素水平表
Tab.1 The factor and level table in the orthogonal experiment of ASC

因数factor水平level A提取液extract solution B C D时间/h time温度/℃temperature浓度/(mol·L-1) concentration 1 2 3甲酸乙酸乙酸-乙酸钠48 72 96 4 10 17 0.3 0.5 0.7
1.3.3 酶促溶性胶原蛋白的提取 准确称取9份同等质量经预处理的海燕体壁,用最佳酸溶性胶原蛋白提取工艺进行提取。离心后分别向沉淀物中加入0.5 mol/L乙酸溶液(w(沉淀物)∶w(乙酸) =1∶20)。以溶液反应时间、温度和酶加量为试验因素进行酶解正交试验,试验操作方法同ASC操作,即得酶促溶性胶原蛋白(PSC)。PSC正交试验因素和水平如表2所示。
表2 酶促溶性胶原蛋白正交试验因素水平表
Tab.2 The factor and level table in the orthogonal experiment of PSC
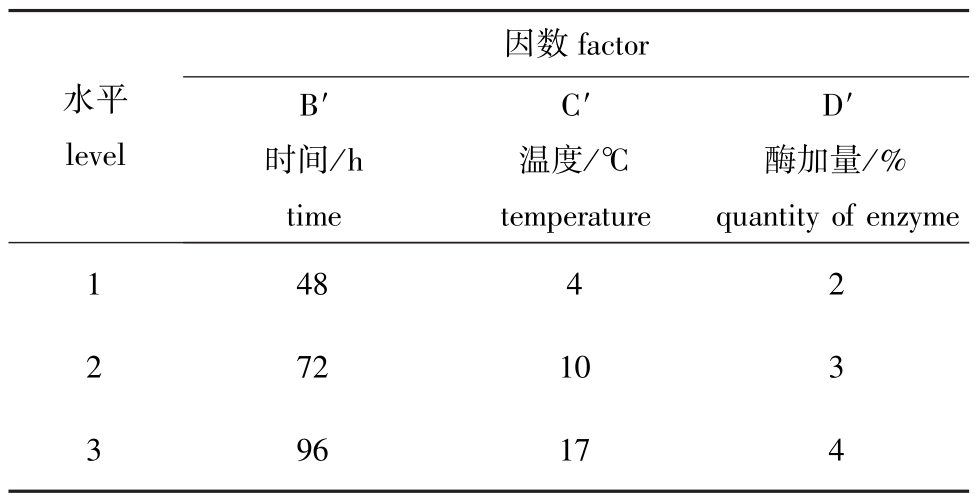
因数factor水平level B′时间/h time C′温度/℃temperature D′酶加量/% quantity of enzyme 1 2 3 48 72 96 4 10 17 2 3 4
1.3.4 胶原蛋白的纯化 将ASC和PSC粗制品溶于0.5 mol/L乙酸溶液中,分别注入透析袋,于4℃下透析,每隔6 h换水1次,透析72 h。透析液以10 000 r/min离心20 min,冷冻干燥,获得ASC和PSC制品。分别对ASC、PSC称重并计算其提取率(相对于预处理后的海燕体壁干重)。
1.3.5 产物分析
1)紫外(UV)扫描分析 将纯化后的样品溶于0.5 mol/L的乙酸溶液中,在波长为200~400 nm下对其进行紫外吸收测定。
2)氨基酸组成分析 取一定量胶原蛋白样品,在减压充氮条件下用6 mol/L HCl于110℃下水解24 h。采用日立835-50型氨基酸分析仪对样品进行检测。
2.1 提取方法的优化
ASC提取的正交试验设计及试验结果见表3。极差分析结果表明:在ASC提取过程中,反应条件对ASC提取率影响的因素主次顺序为提取液种类、提取液浓度、提取时间和提取温度,最佳试验组合为A3B2C2D2,即制备ASC的最佳提取条件是:温度为10℃,提取液种类为乙酸-乙酸钠溶液,提取液浓度为0.5 mol/L,提取时间为72 h。在此最佳试验组合条件下进行验证试验,ASC的提取率为7.93%。
表3 ASC提取的L9(34)正交试验设计及试验结果
Tab.3 The design and results of the orthogonal experiment of ASC
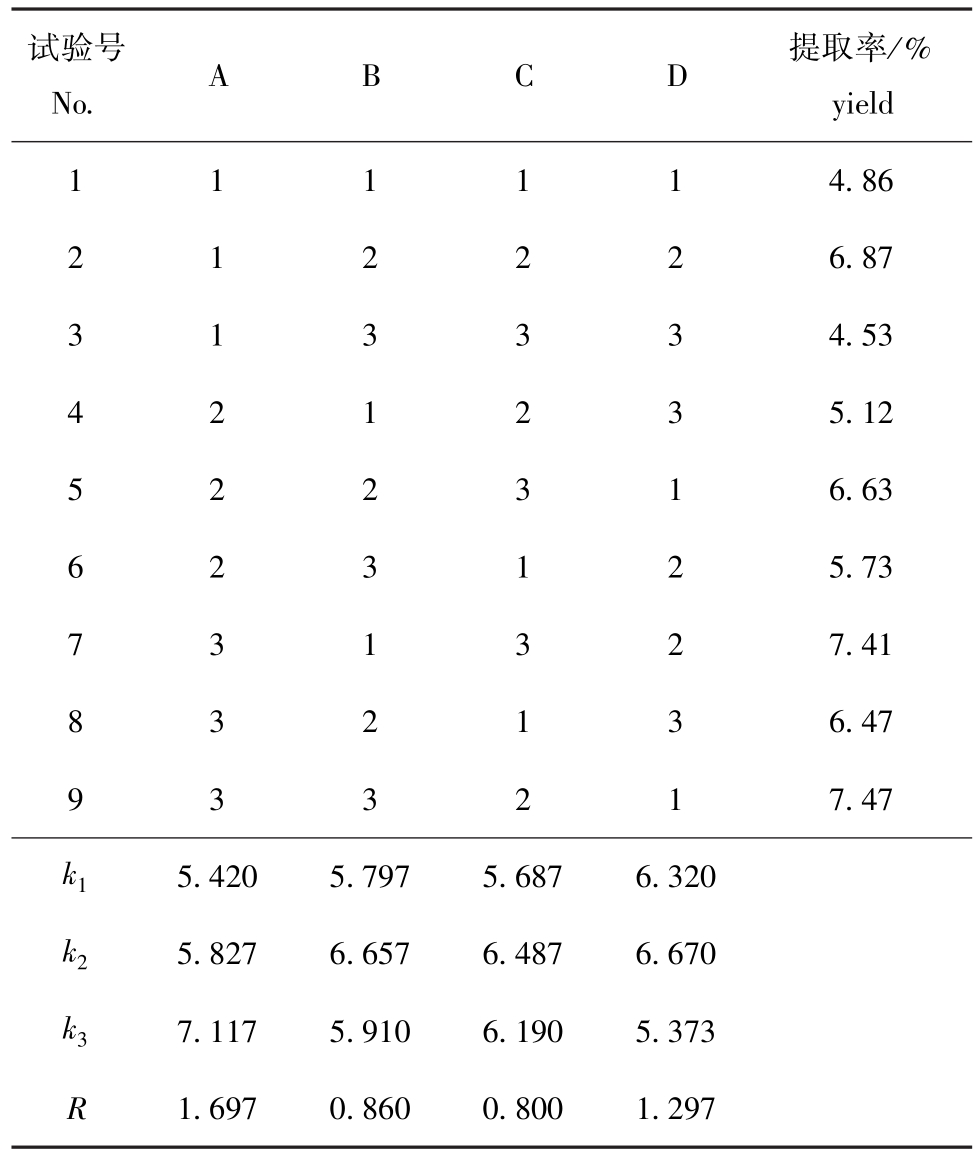
试验号No.ABCD提取率/% yield 111114.86 212226.87 313334.53 421235.12 522316.63 623125.73 731327.41 832136.47 933217.47 k15.4205.7975.6876.320 k25.8276.6576.4876.670 k37.1175.9106.1905.373 R 1.6970.8600.8001.297
PSC提取的正交试验设计及试验结果见表4。极差分析结果表明:在PSC提取过程中,反应条件对PSC提取率影响的因素主次顺序为反应温度、酶加量、反应时间,最佳试验组合为B′3C′3D′3,即制备PSC的最佳提取条件为温度17℃、蛋白酶酶加量4%、提取时间96 h。在此最佳试验组合条件下,PSC的提取率为49.61%。
表4 PSC提取的L9(34)正交试验设计及试验结果
Tab.4 The design and results of the orthogonal experiment of PSC
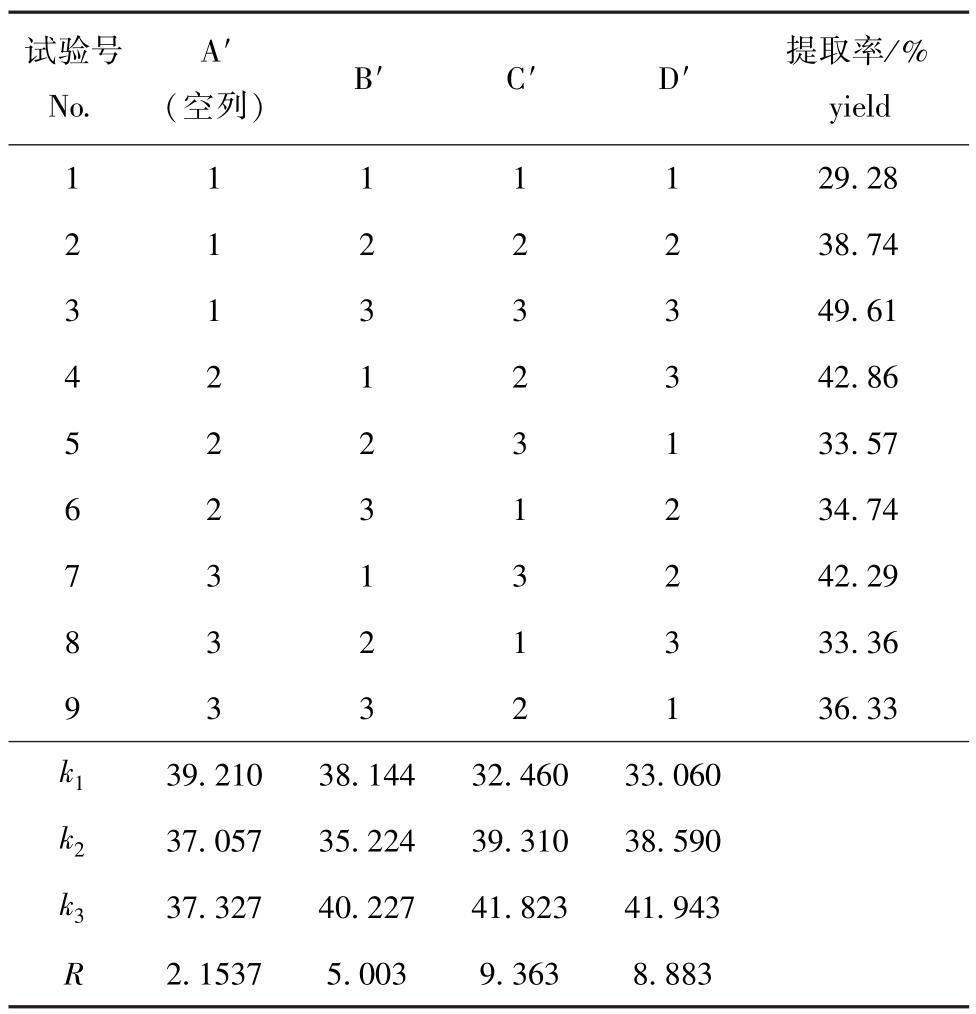
试验号No.(空列)B′C′D′提取率/% A′yield 1111129.28 2122238.74 3133349.61 4212342.86 5223133.57 6231234.74 7313242.29 8321333.36 9332136.33 k139.21038.14432.46033.060 k237.05735.22439.31038.590 k337.32740.22741.82341.943 R 2.15375.0039.3638.883
2.2 紫外扫描分析
对所提取的ASC、PSC在波长为200~400 nm下进行紫外光谱分析,结果见图1。
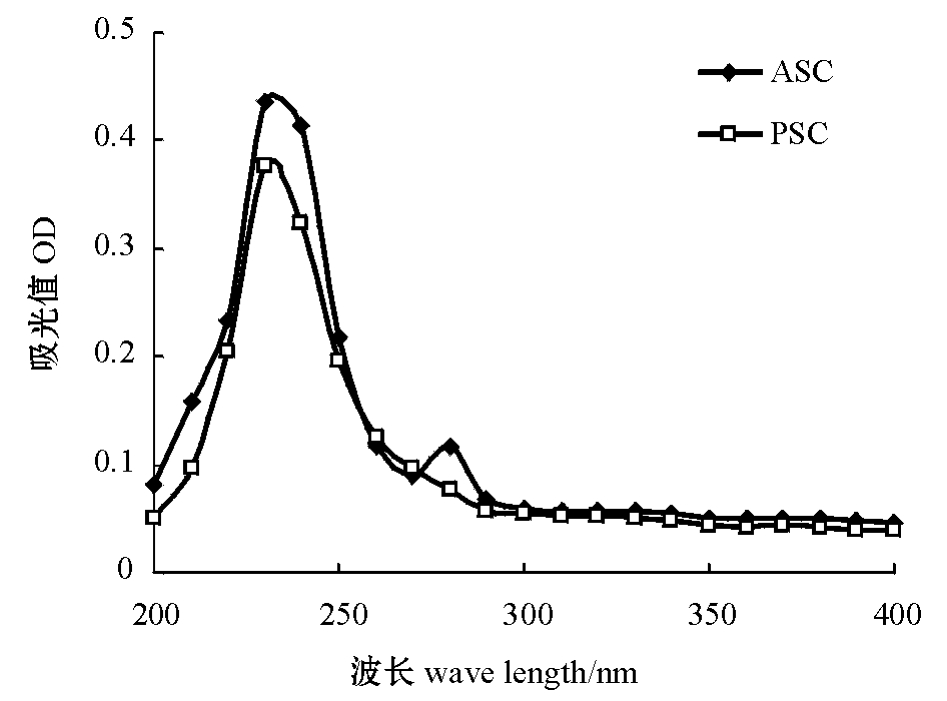
图1 ASC、PSC紫外吸收光谱
Fig.1 UV spectra of ASC and PSC
由图1可知,ASC、PSC的最大吸收波长均在230 nm处,符合Ⅰ型胶原蛋白所特有的吸收峰一般在230 nm左右的特性[12],表明所提取的胶原蛋白为纯度较高的Ⅰ型胶原蛋白。芳香族氨基酸的吸收峰一般在280 nm左右,而ASC在280 nm处存在一处小吸收峰,但PSC不存在。说明该ASC制品中含有少量芳香族氨基酸,而PSC制品中芳香族氨基酸含量较少[9]。
2.3 氨基酸的组成分析
对用最佳提取条件制备的ASC、PSC进行氨基酸的组成分析,结果见表5。
绝大多数蛋白质中脯氨酸含量很少,而胶原蛋白中脯氨酸和羟脯氨酸的含量是各种蛋白质中最高的,可视为胶原蛋白的特征氨基酸[13]。从表5可见,ASC、PSC中甘氨酸、谷氨酸、丙氨酸和脯氨酸的含量均比较高,其中甘氨酸分别占氨基酸总量的25.98%、26.88%,脯氨酸和羟脯氨酸含量之和分别占总量的18.78%、19.54%,符合Ⅰ型胶原蛋白中甘氨酸含量占氨基酸总量的30%左右、羟脯氨酸约占氨基酸总量的10%、羟脯氨酸与脯氨酸之比为0.7~0.8的组成特性[14]。
表5 ASC、PSC氨基酸的组成分析
Tab.5 Amino acid composition of ASC and PSC
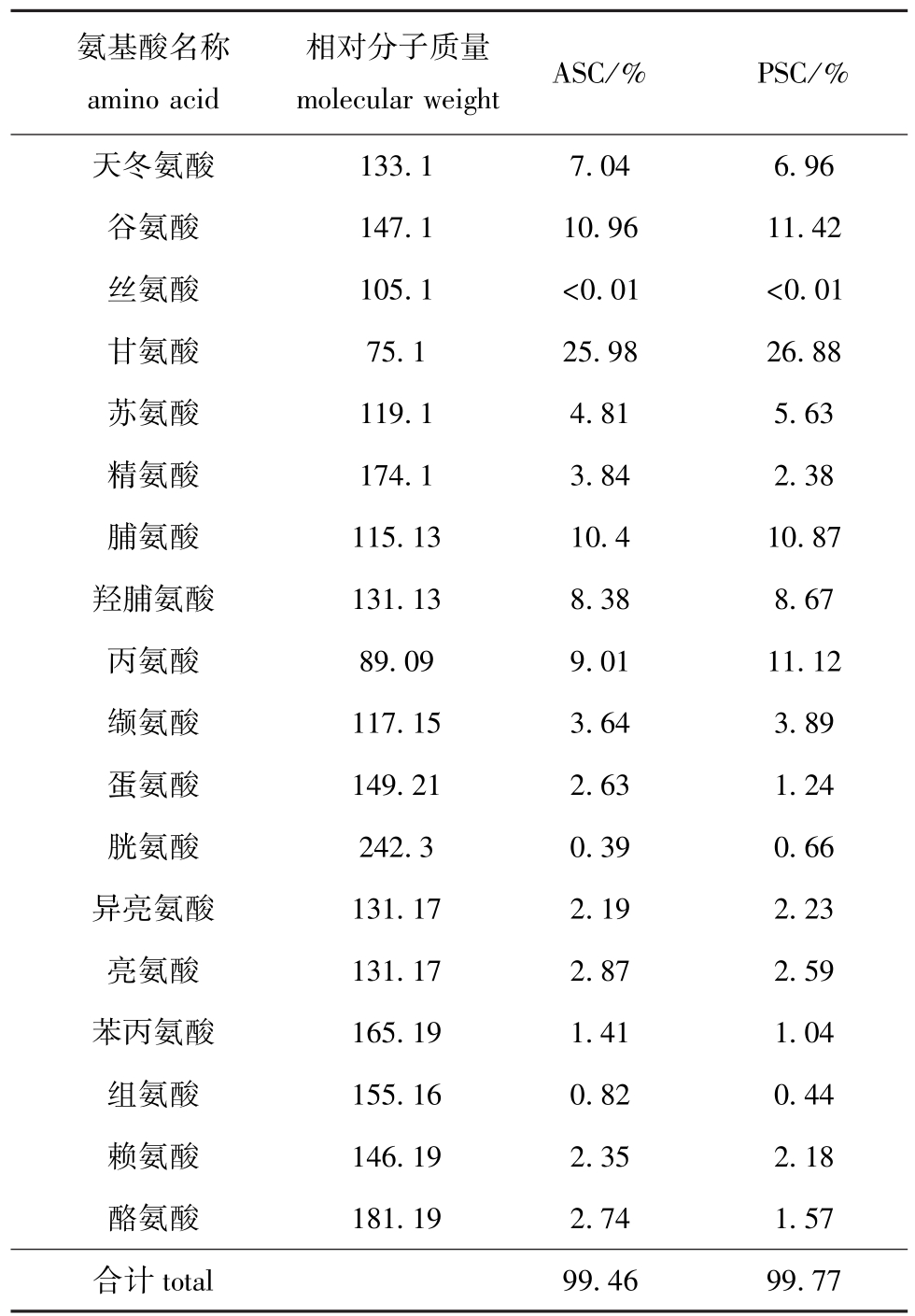
氨基酸名称amino acid相对分子质量molecular weight ASC/%PSC/%天冬氨酸谷氨酸丝氨酸甘氨酸苏氨酸精氨酸脯氨酸羟脯氨酸丙氨酸缬氨酸蛋氨酸胱氨酸异亮氨酸亮氨酸苯丙氨酸组氨酸赖氨酸酪氨酸1.57合计133.1 147.1 105.1 75.1 119.1 174.1 115.13 131.13 89.09 117.15 149.21 242.3 131.17 131.17 165.19 155.16 146.19 181.19 7.04 10.96<0.01 25.98 4.81 3.84 10.4 8.38 9.01 3.64 2.63 0.39 2.19 2.87 1.41 0.82 2.35 2.74 6.96 11.42<0.01 26.88 5.63 2.38 10.87 8.67 11.12 3.89 1.24 0.66 2.23 2.59 1.04 0.44 2.18 total99.4699.77
本试验中,以海燕体壁为试验材料提取胶原蛋白,探讨了制备工艺的具体条件,并对其理化性质进行了研究。通过正交试验对酸溶性胶原蛋白和胃蛋白酶促溶性胶原蛋白的提取方法进行了优化,初步确定了ASC的最佳提取工艺为温度10℃、乙酸
-乙酸钠溶液0.5 mol/L、提取液浓度0.5 mol/L、提取时间72 h;PSC的最佳提取工艺为温度17℃、蛋白酶酶加量4%、提取时间96 h。经紫外光谱和氨基酸组成分析,结果表明,ASC和PSC均为典型的Ⅰ型胶原蛋白。
参考文献:
[1] 任俊莉,付丽红,邱化玉.胶原蛋白的应用及其发展前景[J].中国皮革,2003,23:16-17.
[2] 张慧君,罗仓学.胶原蛋白的应用[J].皮革科学与工程,2003 (6):37-41.
[3] 张俊杰,段蕊,杜修桥.鱼鳞胶原蛋白的提取及其性质研究[J].中国水产,2005(10):68-69.
[4] Nagai T,Suzuki N.Isolation of collagen from fish waste material——skin,bone and fins[J].Food Chemistry,2000,68:277-281.
[5] 赵露,刘海英,袁信华.斑点叉尾鮰鱼皮胶原的提取及其基本特性的研究[J].大连水产学院学报,2009,24(5):423-428.
[6] 金桂芬,裘俊红.海蜇胶原蛋白优化提取条件的研究[J].浙江化工,2008,39(7):5-9.
[7] Saito M,Kunisaki N,Urano N,et al.Collagen as the major edible component of sea cucumber(Stichopus japonicus)[J].Food Chemistry and Toxicology,2002,67(4):1319-1322.
[8] Trotter J A,Lyons-Levy G,Thurmond F A,et al.Covalent composition of collagen fibrils from the dermis of the sea cucumber,Cucumaria frondosa,a tissue with mutable mechanical properties[J]. Comp Biochem Physiol,1995,112(3-4):463-478.
[9] 崔凤霞,薛长湖,李兆杰,等.仿刺参胶原蛋白的提取及理化性质[J].水产学报,2006,30(4):449-553.
[10] 郝林华,李八方.多棘海盘车体壁胶原蛋白的研究[J].中国水产科学,1999,6(2):18-21.
[11] 郭承华,张芳,刘迅,等.黄海产海燕海星皂甙的制备[J].海洋通报,2000,19(2):93.
[12] Rao K P,Alamelu S.Effect of crosslinking agent on the release of an aqueous marker from liposomes,sequestered in collagen and chitosan gels[J].Member Sci,1992,71:161-163.
[13] 蒋挺大.胶原与胶原蛋白[M].北京:化学工业出版社,2006.
[14] 张海彬,王俊玲.鲢鱼鳞片胶原蛋白的提取[J].水利渔业, 2008,28(2):43-45.
Extraction of collagen from body wall of star fish Asterina pectinifera
LIU Yuan-ping,ZHANG Lin-lin,ZHANG Hui-yi,ZHAO Dan,MA Ran,WANG Qiu-kuan
(The Key and Open Laboratory of Fishery Product Processing and Utilization of Liaoning Province,Dalian Ocean University,Dalian 116023,China)
Abstract:Acid-soluble collagen(ASC)and pepsin-solubilized collagen(PSC)were extracted from body wall of star fish Asterina pectinifera by two different methods.The optimum extraction of ASC with the yield of 7.93%were found at hydrolyzing temperature of 10℃,hydrolyzing time of 72 h and the concentration of 0.5 mol/L acetic acid -sodium acetate.The optimum conditions for the extraction of PSC with yield of 49.61%were found as follows:hydrolyzing temperature of 17℃,hydrolyzing time of 96 h,and the pepsin dose of 4%.The UV spectra and Amino Acid Analysis revealed that ASC and PSC from body wall of the star fish were classified as type I collagen.
Key words:Asterina pectinifera;acid-soluble collagen;pepsin-solublized collagen;extraction
文章编号:2095-1388(2011)01-0054-04
中图分类号:S986
文献标志码:A
收稿日期:2010-03-11
基金项目:农业部“948”项目(2006-G44)
作者简介:刘远平(1984-),男,硕士。E-mail:yupylau@126.com
通信作者:汪秋宽(1962-),女,教授。E-mail:wqk320@dlou.edu.cn