王庆奎1、2,姜志强1,王静波1,史会来1,姜海波1
(1.大连海洋大学农业部海洋水产增养殖学重点开放实验室,辽宁大连116023; 2.天津农学院天津市水产生态及养殖重点实验室,天津300384)
摘要:对牙鲆Paralichthys olivaceus(体重5.93 g±1.20 g)继饥饿后的摄食和生长进行了研究。牙鲆饥饿5 d(S5)、10 d(S10)和15 d(S15)后恢复喂食20 d,对照组持续喂食20 d,测定恢复喂食期间牙鲆的摄食率(FR)、食物转化效率(FCE)、吸收率(AE)和排粪率(DR),同时测定饥饿和恢复喂食期间牙鲆的全长、体重、特定生长率(SGR)、比肝重(HSI)、肝胰脏和肌肉中的RNA/DNA。结果表明:恢复喂食过程中,牙鲆的FR先升高后下降,而FCE则均先下降后升高;S5和S10组牙鲆的总吸收率(TAE)高于对照组,而S15组则低于对照组;S5组牙鲆的全长和体重接近对照组,而S10和S15组则不如对照组;饥饿处理组牙鲆的SGR在恢复喂食后先升高后降至对照组水平;饥饿时间越长,牙鲆的HSI越小,在恢复喂食过程中HSI逐渐接近对照组;饥饿时间越长,肝胰脏和肌肉中的RNA/DNA越小,在恢复喂食过程中RNA/DNA迅速升高,接近或超过对照组;在20 d的恢复喂食过程中,S5组出现完全补偿生长,S10和S15组出现部分补偿生长。研究表明,牙鲆在恢复喂食过程中,通过先提高FR后再提高FCE的方式产生补偿生长。
关键词:饥饿;再喂食;补偿生长;牙鲆
自20世纪70年代以来,水生动物的补偿生长现象逐渐受到人们重视,现已成为其营养生理学的研究内容之一[1-5]。牙鲆Paralichthys olivaceus是中国重要的海水养殖鱼类。近年来关于饥饿对牙鲆的影响有不少报道。Miyazaki等[6]研究了牙鲆幼鱼继饥饿后的摄食行为;Hur等[7]研究了长期饥饿条件下牙鲆肝脏的超微结构;吴立新等[8]报道了牙鲆继蛋白质限制后的补偿生长;姜海波等[9]研究了周期性饥饿—再投喂对牙鲆生长和饲料利用的影响;王庆奎等[10]研究了饥饿和恢复投喂对牙鲆代谢的影响。本试验中,作者研究了不同饥饿时间对牙鲆摄食和生长的影响,旨在查明饥饿能否激发牙鲆幼鱼的补偿生长效应,揭示其适应饥饿胁迫的生态对策。
1.1 材料
试验在大连海洋大学流水实验室进行。人工繁殖的牙鲆幼鱼购自大连开发区湾里,体重为(5.93±1.20)g,全长为(8.6±0.4)cm。
1.2 方法
1.2.1 试验条件 将试验鱼先在循环式水族箱(120 L)内驯化1周。驯化期间,使用砂滤的自然海水,水温为(20±1)℃,溶解氧>5 mg/L,盐度为33,pH为7.9,采用自然光周期。每天2次(8: 00、17:00)饱食投喂牙鲆专用配合饲料。正式试验期间水质条件与驯化期间一致。
1.2.2 试验设计 试验设3个饥饿处理组,分别饥饿5 d(S5)、10 d(S10)、15 d(S15)后恢复喂食(达饱食),各饥饿处理组均恢复喂食20 d,对照组(S0)持续喂食20 d。每个处理设3个重复,每个重复(水族箱)放45尾。在试验开始和饥饿结束以及恢复喂食后的第5、10、15、20天,从每箱中随机取5尾鱼,测定其全长、体重、肝胰脏重、鱼体去内脏重。称重前禁食12 h,使其消化道排空。恢复喂食期间每天饱食喂食2次(8:00、17:00)。喂食前收集粪便,喂食后30 min收集残饵,粪便及残饵均在102℃下烘干至恒重后称重。每5 d统计
1次摄食量和粪便量,并计算恢复喂食过程中牙鲆的特定生长率、摄食率、吸收率、食物转化效率和排粪率。肝胰脏和肌肉的RNA/DNA按Robert等[11]的方法测定。
1.2.3 计算公式
体重损失率=(W1-W2)/W1×100%,
特定生长率(SGR)=(ln W2-ln W1)/t×100%,
摄食率(FR)=C/[t×(W2+W1)/2]×100%,
食物转化效率(FCE)=(W2-W1)/C×100%,
吸收率(AE)=(C-F)/C×100%,
排粪率(DR)=F/C×100%,
其中:W1为试验开始时鱼体湿重(g);W2为试验结束时鱼体湿重(g);t为试验时间(d);C为摄食量(g)(102℃下绝对干重);F为排粪量(g) (102℃下绝对干重)。
1.3 数据分析
数据用SPSS 10.0软件作单因素方差分析,差异显著的用Duncan's法作多重比较。试验数据均用平均值±标准差表示。
2.1 摄食量
从图1可见,随着恢复喂食时间的延长,各组摄食量均增加。各饥饿处理组在恢复喂食的1~5 d内,摄食量都非常接近,且均低于对照组。在试验的11~15 d,S10组的摄食量明显低于对照组和S5组(P<0.05);16~20 d,S15组的摄食量明显低于其它试验组(P<0.05)。S5组在试验的11~15 d摄食量达到对照组水平,S10组在试验的26~30 d达到对照组水平,而S15组到试验结束时仍低于对照组水平(P>0.05)。各饥饿处理组在恢复喂食过程中的总摄食量相近,且均低于对照组,其中S10组和S15组与对照组差异显著(P<0.05)。
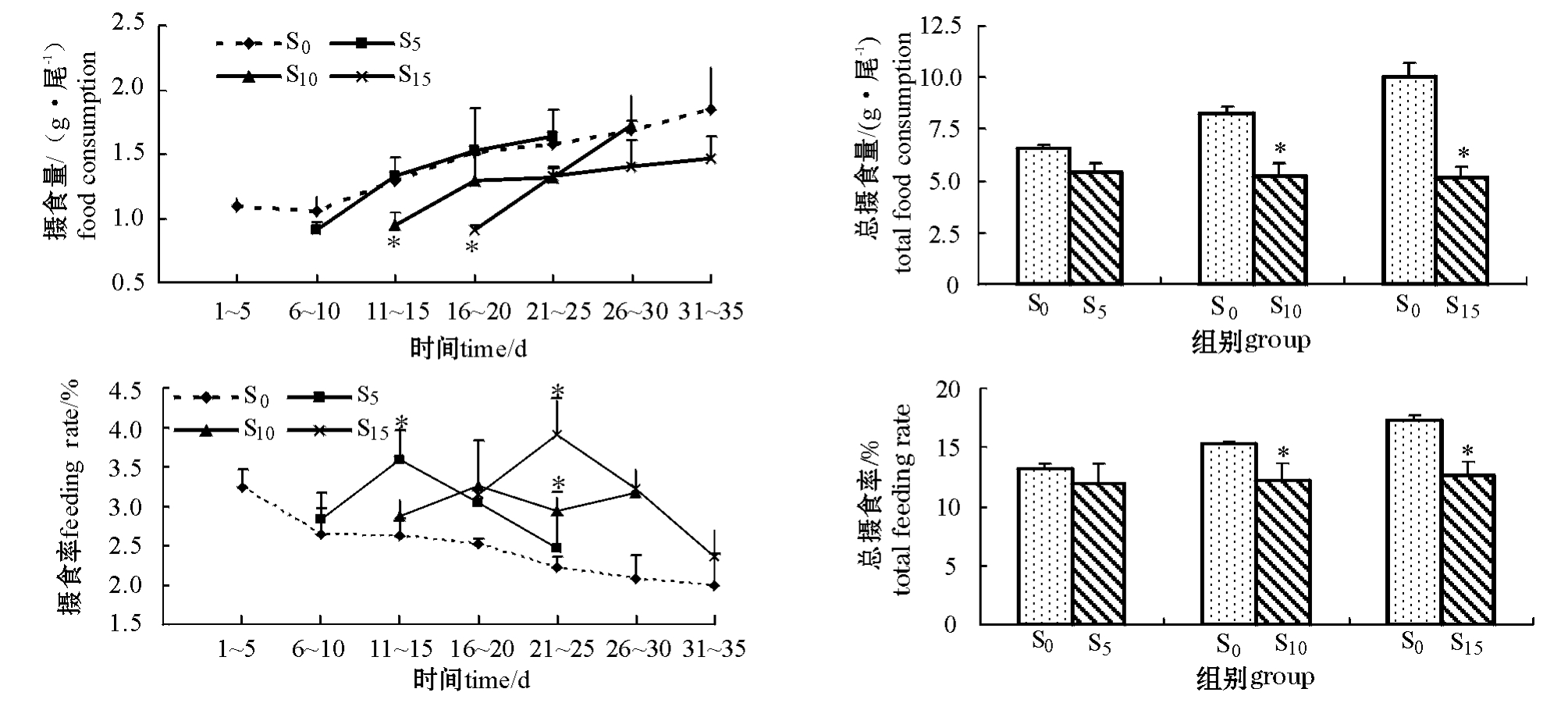
图1 试验过程中牙鲆摄食量、总摄食量、摄食率和总摄食率的变化
Fig.1 Changes in food consumption,total food consumption,feeding rate and total feeding rate in Japanese flounder P.olivaceus during experiment
注:*表示与对照组差异显著(P<0.05),下同。Note:*means significant difference compared with the control(P<0.05),et sequentia.
2.2 摄食率(FR)
从图1可见:对照组牙鲆的FR逐渐下降,而饥饿处理组在恢复喂食过程中FR呈先上升后下降的趋势。在恢复喂食的1~5 d内,牙鲆的FR均稍高于对照组;在试验第11~15天,S5组的FR显著高于S0和S10组(P<0.05);第21~25天,S15组的FR显著高于其它组(P<0.05),S10组的FR也显著高于对照组(P<0.05);试验结束时,S5和S15组的FR均接近对照组,而S10组仍高于对照组(P>0.05)。各饥饿处理组在恢复喂食过程中总摄食率(TFR)相近,且均低于对照组,其中S10和S15组与对照组差异显著(P<0.05)。
2.3 排粪率(DR)
从表1可见:在恢复喂食的1~5 d内,饥饿处理组牙鲆的DR均小于对照组,其中S5和S10组
与对照组差异显著(P<0.05);各饥饿处理组的DR在恢复喂食过程中逐渐接近对照组。S5、S10和 S15组在恢复喂食的20 d内总排粪率(TDR)分别为7.35%、8.02%和11.13%。
表1 试验过程中牙鲆排粪率的变化(n=15)
Tab.1 Changes in dejecta production rate in Japanese flounder P.olivaceus during experiment%

注:同列中标有不同小写字母者表示组间差异显著(P<0.05),标有相同小写字母者表示组间差异不显著(P>0.05),下同。
Note:The means with the different letters within the same column are significant differences at the 0.05 probability level,and the means with the same letters within the same column are not significant differences,et sequentia.
组别group1~5 d6~10 d11~15 d16~20 d21~25 d26~30 d31~35 d S07.34±1.036.63±0.73a5.43±0.04a7.33±1.14a13.01±1.75a13.65±0.29a13.25±0.42aS54.11±0.62b5.50±0.27a7.92±1.42a10.97±0.85aS104.07±0.54b7.73±0.86a10.50±0.33a11.29±0.9aS156.10±0.10a11.80±0.58a12.03±1.48a12.82±1.94a
2.4 食物转化效率(FCE)
从图2可见:饥饿对牙鲆恢复摄食后的FCE影响较大,在恢复喂食后的1~5 d内,饥饿处理组的FCE均接近对照组,之后先下降再上升。试验第16~20天,S5组的FCE显著高于其它组(P<0.05),第21~25天又降到对照组的水平;S10组的FCE在试验第16~20天降到最低,之后逐渐升高,试验结束时高于对照组;S15组的FCE在试验第21~25天降到最低,第26~30天时达最高,试验结束接近对照组。整个试验过程中,S5组的FCE峰值最高,高出对照组96.55%。恢复喂食过程中, S5组的总食物转化效率(TFCE)显著高于对照组(P<0.05),而S10和S15组与对照组接近,但均不显著(P>0.05)。
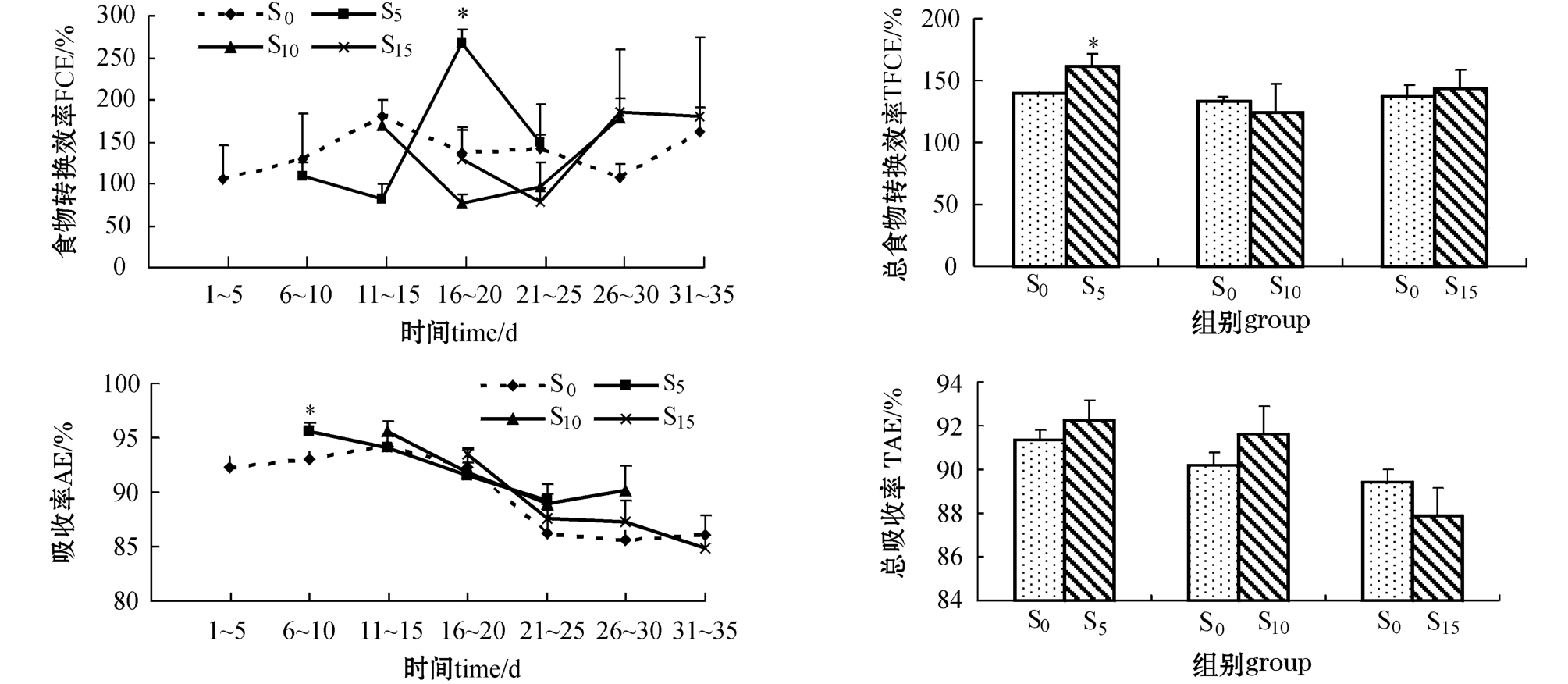
图2 试验过程中牙鲆的食物转化效率、总食物转化效率、吸收率和总吸收率的变化
Fig.2 Changes in feed conversion efficiency,total feed conversion efficiency,absorption efficiency and total absorption efficiency in Japanese flounder P.olivaceus during experiment
2.5 吸收率(AE)
从图2可见,各组的AE呈逐渐降低的趋势。S5组的AE在恢复喂食的1~5 d内显著高于对照组(P<0.05),之后与对照组接近;S10和S15组的AE与对照组无显著差异(P>0.05)。整个试验期间, S0、S5、S10、S15组的AE分别为94.2%~85.6%、95.7%~89.2%、95.7%~88.9%和93.6%~84.8%。牙鲆在恢复喂食过程中的总吸收率(TAE)随饥饿时间的延长而减小。S5、S10和S15组的TAE分别为92.24%、91.60%和87.86%,其中S5和S10组的TAE高于对照组,而S15组则小于对照组,但均与对照组差异不显著(P>0.05)。
2.6 全长和体重
从图3可见,饥饿处理组在恢复喂食过程中,全长和体重均明显增加。在试验的第20 d,S5组的全长和体重接近对照组(P>0.05),而S10和S15组在试验结束时仍低于对照组(P<0.05)。
饥饿结束时,S5、S10、S15组牙鲆体湿重损失率分别为(8.39±2.19)%、(13.77±1.18)%和 (18.82±1.23)%,可以看出,饥饿时间越长体重损失率越高。试验过程中牙鲆的体重增加量见表2。
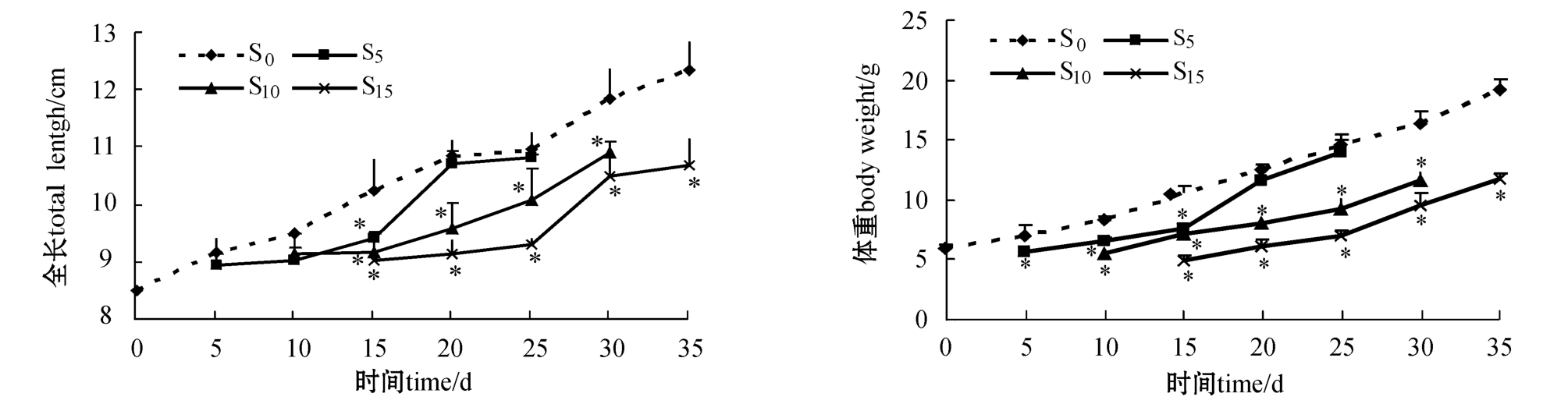
图3 试验过程中牙鲆全长和体重的变化
Fig.3 Changes in total length and body weight in Japanese flounder P.olivaceus during experiment
表2 试验过程中牙鲆体重的变化(n=15)
Tab.2 Changes in body weight gain in Japanese flounder P.olivaceus during experimentg
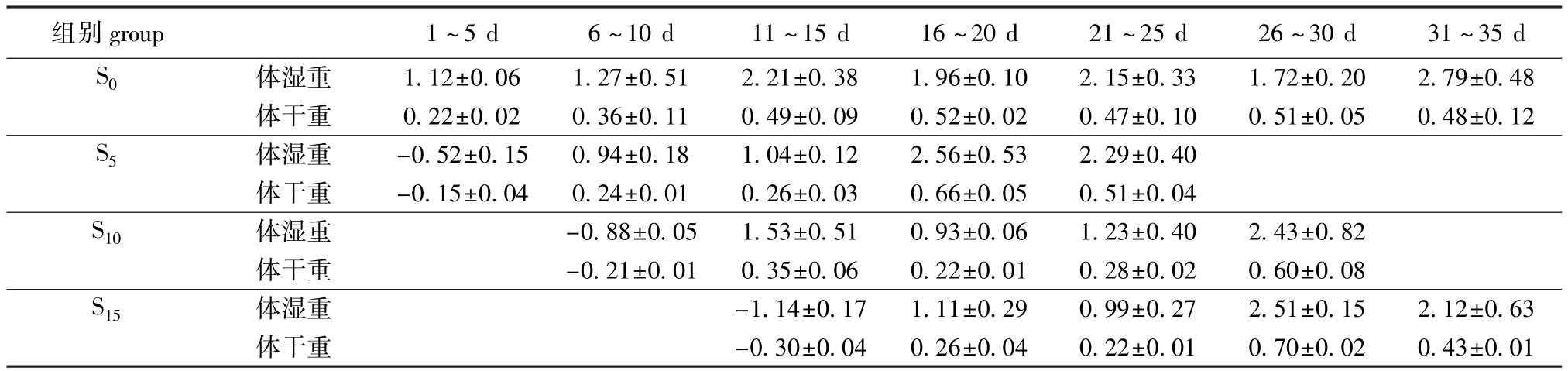
组别group1~5 d6~10 d11~15 d16~20 d21~25 d26~30 d31~35 d S0体湿重1.12±0.061.27±0.512.21±0.381.96±0.102.15±0.331.72±0.202.79±0.48体干重0.22±0.020.36±0.110.49±0.090.52±0.020.47±0.100.51±0.050.48±0.12 S5体湿重-0.52±0.150.94±0.181.04±0.122.56±0.532.29±0.40体干重-0.15±0.040.24±0.010.26±0.030.66±0.050.51±0.04 S10体湿重-0.88±0.051.53±0.510.93±0.061.23±0.402.43±0.82体干重-0.21±0.010.35±0.060.22±0.010.28±0.020.60±0.08 S15体湿重-1.14±0.171.11±0.290.99±0.272.51±0.152.12±0.63体干重-0.30±0.040.26±0.040.22±0.010.70±0.020.43±0.01
2.7 特定生长率(SGR)
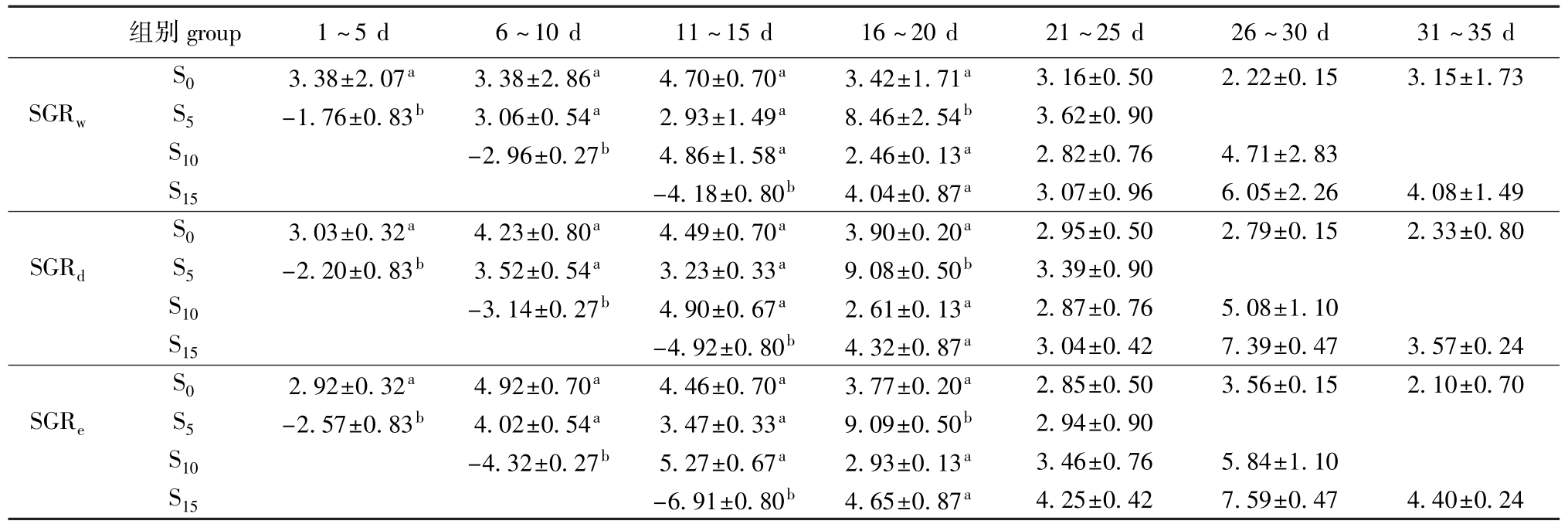
从表3可见,对照组的SGR在整个试验期间比较稳定,而饥饿处理组的SGR在恢复喂食过程中变化较大。饥饿处理组的SGR在恢复喂食后明显升高,在恢复喂食的1~5 d,SGR接近或超过对照组(P>0.05);在试验的16~20 d,S5组的SGR显著高于其它组(P<0.05),之后恢复到对照组水平;在恢复喂食过程中,S10和S15组的SGR也是先升高后降至对照组水平。
表3 试验过程中牙鲆特定生长率的变化(n=15)
Tab.3 Changes in special growth rate in Japanese flounder P.olivaceus during experiment%/d
注:SGRw、SGRd、SGRe分别为湿重特定生长率、干重特定生长率、能量特定生长率。
Note:SGRw,SGRdand SGRewere calculated in terms of wet weight,dry weight and energy.
组别group1~5 d6~10 d11~15 d16~20 d21~25 d26~30 d31~35 d S03.38±2.07a3.38±2.86a4.70±0.70a3.42±1.71a3.16±0.502.22±0.153.15±1.73 SGRwS5-1.76±0.83b3.06±0.54a2.93±1.49a8.46±2.54b3.62±0.90 S10-2.96±0.27b4.86±1.58a2.46±0.13a2.82±0.764.71±2.83 S15-4.18±0.80b4.04±0.87a3.07±0.966.05±2.264.08±1.49 S03.03±0.32a4.23±0.80a4.49±0.70a3.90±0.20a2.95±0.502.79±0.152.33±0.80 SGRdS5-2.20±0.83b3.52±0.54a3.23±0.33a9.08±0.50b3.39±0.90 S10-3.14±0.27b4.90±0.67a2.61±0.13a2.87±0.765.08±1.10 S15-4.92±0.80b4.32±0.87a3.04±0.427.39±0.473.57±0.24 S02.92±0.32a4.92±0.70a4.46±0.70a3.77±0.20a2.85±0.503.56±0.152.10±0.70 SGReS5-2.57±0.83b4.02±0.54a3.47±0.33a9.09±0.50b2.94±0.90 S10-4.32±0.27b5.27±0.67a2.93±0.13a3.46±0.765.84±1.10 S15-6.91±0.80b4.65±0.87a4.25±0.427.59±0.474.40±0.24
2.8 比肝重(HSI)
从图4可见:试验期间对照组的HSI变化幅度不大(3.01%~3.89%);饥饿对牙鲆的HSI影响显著(P<0.05),饥饿结束时S5、S10、S15组的HSI分别下降了57.56%、65.89%、69.79%;饥饿处理组的HSI在恢复喂食的第10 d恢复到对照组水平。
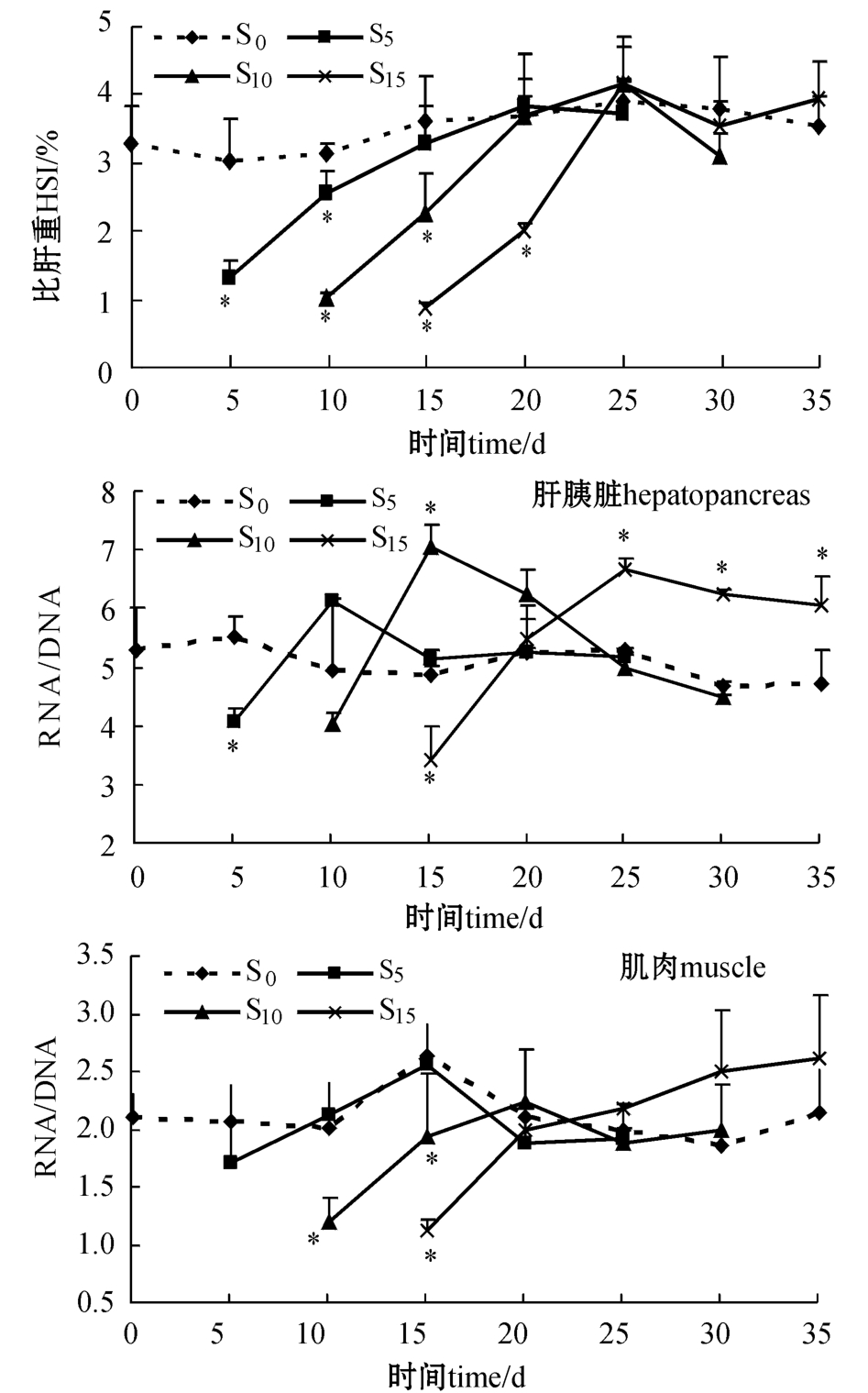
图4 牙鲆比肝重及肝胰脏、肌肉中RNA/DNA值的变化
Fig.4 Chages in hepatosomatic index,and RNA/DNA in hepatopancreas and muscle in Japanese flounder P.olivaceus during experiment
2.9 肝胰脏和肌肉中的RNA/DNA
饥饿会导致牙鲆肝胰脏和肌肉中的RNA/DNA值减小,且饥饿时间越长RNA/DNA值越小(图4)。S5和S10组肝胰脏中的RNA/DNA值在恢复喂食的第5 d就远高于对照组,且S10组与对照组差异显著(P<0.05);S15组肝胰脏中的RNA/DNA值在恢复喂食的第5 d接近对照组;随着恢复喂食时间的延长,饥饿处理组肝胰脏中的RNA/DNA值逐渐减小,S5和S10组逐渐恢复到对照组水平,而S15组仍高于对照组(P<0.05)。S5和S10组肌肉中的RNA/DNA值分别在恢复喂食的第5 d、第10 d恢复到对照组水平,之后一直维持在对照组水平; S15组肌肉中的RNA/DNA值在恢复喂食过程中逐渐升高,但未达显著性水平(P>0.05)。
吴立新等[2]综述了水产动物继饥饿或营养不足后补偿生长的试验结果。本研究中旨在了解不同饥饿处理时间对牙鲆恢复生长的影响,采用饥饿处理不同时间后恢复喂食时间相等,但总持续时间不等的方案。研究表明,鱼类在饥饿后的恢复生长过程中,SGR经历一个先上升一段时间再恢复到对照组水平的过程[12-15],即补偿生长效应只产生于一定的时段。因此,若将“饥饿处理时间+恢复喂食时间”设计为一个定值,可能会造成饥饿处理时间较短的组因记录生长结果的时间太长,使计算出的恢复生长的补偿效应被“冲淡”而掩盖;饥饿时间较长的组则因恢复生长时间太短而使鱼生长的补偿效应不能充分发挥,导致各饥饿处理组恢复生长的可比性降低。本试验中各饥饿处理组牙鲆均恢复喂食20 d,每5 d取样一次,既提高了试验结果的可比性,又能反映出各饥饿处理组在恢复喂食过程中SGR的变化趋势。本试验中也发现SGR的这一规律性变化:各饥饿处理组在恢复喂食初期SGR接近或超过对照组,之后逐渐上升,最后又逐渐下降至对照组水平。
DR和AE是表示鱼类利用食物的两个指标。本试验中饥饿处理组在恢复喂食的1~5 d内,对食物的利用程度较高,DR均小于对照组,而AE均高于对照组,两者正好相互验证。在恢复喂食的6~20 d内,各组对食物的利用程度与对照组一致。S5和S10组的TAE高于对照组,而S15的TAE低于对照组,但均不显著(P>0.05)。
饥饿状态下鱼类首先利用贮存于性组织中的物质,然后才利用重要器官和运动系统中的结构物质,这是鱼类对饥饿的一种适应性对策[16]。欧洲鳗鲡Anguilla anguilla在饥饿开始至第47天主要利用肝脏和肌肉内的甘油三酯;饥饿47~96 d,血液葡萄糖和肌糖原含量下降;饥饿96~164 d,肝糖原和血浆蛋白含量显著下降[17]。黄鲈Macquaria ambigua在禁食期间首先利用肝脏内的贮能物质,然后利用肠系膜脂肪及肌糖原,最后动用肌蛋白[18]。冬鲽Pleuronectes americanus在饥饿时首先消耗皮下脂肪,这是因为冬鲽肝脏体积较小,脂肪主要贮存于躯体[19]。本试验中发现,牙鲆的HSI随着饥饿时间的延长显著降低,饥饿10 d和15 d的HSI比较接近,说明肝胰脏是牙鲆的主要贮能器官。各饥饿处理组HSI恢复时间较快,均能在恢复喂食的第10 d达到对照组水平。
组织中RNA/DNA值可以作为衡量生长的指标[20-21],特别是在仔鱼和幼鱼阶段[22-25]。组织中RNA/DNA值在饥饿或限食期间降低[12,26-27],恢复
喂食后则迅速升高[12,28]。本试验中也发现同样的现象:饥饿导致肝胰脏和肌肉中的RNA/DNA值减小,且饥饿时间越长,RNA/DNA值越小;恢复喂食后,肝胰脏中的RNA/DNA值先显著高于对照组(P<0.05),后逐渐恢复到对照组水平;而肌肉中的RNA/DNA值逐渐升高并恢复到对照组水平。
饥饿对牙鲆恢复摄食后的FCE影响较大。本试验中,饥饿导致牙鲆在恢复喂食过程中FCE先下降后升高,最后恢复到对照组水平,其中S5组的FCE升高幅度最大(图2)。鱼类继饥饿后的恢复喂食过程中FCE的变化有3种模式:1)FCE无明显变化,如北极红点鲑Salvelinm alpinus[12]、斑点叉尾鮰Ictalurus punctatus[13]、罗非鱼Oreochromis mossambicus×O.niloticus[15]和南方鲇Silurus meridionalis[29];2)FCE明显升高,如红大麻哈鱼Oncorhynchus nerka[1]、虹鳟Salmo gairdneri[30]、北极红点鲑[12]、欧洲鲦Phoxinus phoxinus[31]、大西洋鲑Salmo salar[32]、真鲷Pagrosomus major[14]等;3) FCE明显降低,如周期性饥饿的虹鳟在恢复喂食期间FCE下降[33]。由于饵料系数和FCE是倒数关系,所以从FCE的变化中也能看出饵料系数的变化。在整个喂食过程中,S5组的饵料系数最小, S10和S15组的饵料系数与对照组接近,说明饥饿5 d的牙鲆在恢复喂食的20 d内饵料系数比连续喂食25 d的小,饥饿提高了牙鲆对饵料的利用率。各饥饿处理组试验期间的总摄食量小于对照组。养殖生产中可对(5.93±1.20)g的牙鲆采取饥饿5 d恢复喂食20 d的处理,既节约饵料,又不降低其生长速度。
谢小军等[34]从量的角度将补偿生长分为4类:超补偿生长、完全补偿生长、部分补偿生长和不能补偿生长。本试验结果表明,在水温(20±1)℃下,体重为(5.93±1.20)g的牙鲆饥饿5 d后,在随后20 d的饱食喂食过程中出现完全补偿生长,而饥饿10 d和15 d的牙鲆在随后20 d的饱食喂食过程中只出现部分补偿生长。关于鱼类补偿生长的机制仍存在争议,目前主要有3种观点[2]:1)仅通过提高食物转化率来实现[30,32,35];2)仅通过增强食欲、提高摄食率来实现[12-13,29];3)通过提高食物转化率和摄食率来共同实现[14,31]。本试验中,牙鲆在恢复喂食初期FR明显高于对照组(图2),而FCE却明显低于对照组(图3);恢复喂食后期,FR下降至对照组水平,而FCE却明显高于对照组,说明牙鲆在恢复喂食过程中是通过先提高FR,后提高FCE的方式产生补偿生长。
参考文献:
[1] Bilton H T,Robins G L.The effect of starvation and subsequent feeding on survival and growth of Fulton Channel sockeye salmon fry,Oncorhynchus nerka[J].J Fish Res Board Can,1973,30(1): 1-5.
[2] 吴立新,董双林.水产动物继饥饿或营养不足后的补偿生长研究进展[J].应用生态学报,2000,11(6):943-946.
[3] Tian X L,Qin J G.A single phase of food deprivation provoked compensatory growth in barramundi Lates calcarifer[J].Aquaculture,2003,224(2):169-179.
[4] Heide A,Foss A,Stefansson S O,et al.Compensatory growth and fillet crude composition in juvenile Atlantic halibut:Effects of short term starvation periods and subsequent feeding[J].Aquaculture,2006,261(1):109-117.
[5] Montserrat N,Gabillard J C,Capilla E,et al.Role of insulin,insulin-like growth factors,and muscle regulatory factors in the compensatory growth of the trout(Oncorhynchus mykiss)[J].General and Comparative Endocrinology,2007,150(3):462-472.
[6] Miyazaki T,Masuda R,Furuta S,et al.Feeding behaviour of hatchery-reared juveniles of the Japanese flounder following a period of starvation[J].Aquaculture,2000,190(1-2):129-138.
[7] Hur J W,Jo J H,Park I S.Effects of long-term starvation on hepatocyte ultrastructure of olive flounder Paralichthys olivaceus[J]. Ichthyological Research,2006,53(3):306-310.
[8] 吴立新,邓宏相,耿志孚,等.蛋白质限制后恢复投喂对牙鲆幼鱼生长的影响[J].生态学报,2006,26(11):3711-3717.
[9] 姜海波,姜志强.周期性饥饿—再投喂对牙鲆幼鱼生长和饲料利用的影响[J].大连水产学院学报,2007,22(3):231-234.
[10] 王庆奎,姜志强,王静波,等.饥饿和恢复投喂对牙鲆代谢的影响[J].大连水产学院学报,2004,19(4):248-251.
[11] Robert C S,Gordon E H.The Age and Growth of Fish[M].Iowa: The Iowa State University Press,1987:345-353.
[12] Miglavs I,Jobling M.Effects of feeding regime on food consumption,growth rates and tissue nucleic acids in juvenile Arctic charr, Salvelinus alpinus,with particular respect to compensatory growth [J].J Fish Biol,1989,34(6):947-957.
[13] Kim M K,Lovell R T.Effect of restricted feeding regimes on compensatory weight gain and body tissue changes in channel catfish Ictalurus punctatus in ponds[J].Aquaculture,1995,135(4):285 -293.
[14] 张波,孙耀,王俊,等.真鲷在饥饿后恢复生长中的生态转换效率[J].海洋水产研究,1999,20(2):38-41.
[15] Wang Y,Cui Y,Yang Y,et al.Compensatory growth in hybrid tilapia,Oreochromis mossambicus×O.niloticus,reared in seawater [J].Aquaculture,2000,189(1-2):101-108.
[16] Zamal H,Ollevier F.Effect of feeding and lack of food on growth, gross biochemical and fat acid composition of juvenile catfish[J]. J Fish Biol,1995,46(3):404-414.
[17] Dave G,Johansson-Sjobeck M L,Larsson A,et al.Metabolic and hematological effects of starvation in the European eel,Anguilla anguilla L.-I.Carbohydrate,lipid,protein and inorganic iron metabolism[J].Comp Biochem Physiol,1975,52A(3):423-430.
[18] Collins A L,Anderson T A.The regulation of endogenous energy stores during starvation and refeeding in the somatic tissues of the golden perch[J].J Fish Biol,1995,47(6):1004-1015.
[19] Maddock D M,Burton M P M.Some effects of starvation on the lipid and skeletal muscle layers of the winter flounder,Pleuronectes americanus[J].Can J Zool,1994,72:1672-1679.
[20] Wilder I B,Stanley J G.RNA-DNA ratio as an index to growth in salmonid fishes in the laboratory and in streams contaminated by carbaryl[J].J Fish Biol,1983,22(2):165-172.
[21] Mathers E M,Houlihan D F,Cunningham M J.Nucleic acids concentrations and enzyme activites as correlates of growth rate of the saithe Pollachius virens:growth-rate estimates of open-sea fish [J].Mar Biol,1992,112(3):363-369.
[22] Buckey L J.RNA-DNA ratio:an index of larval fish growth in the sea[J].Mar Biol,1984,80(3):291-298.
[23] Wright D A,Martin F D.The effect of starvation on RNA:DNA ratios and growth of larval striped bass,Morone saxatalis[J].J Fish Biol,1985,27(4):479-485.
[24] 宋昭彬,何学福.鱼类饥饿研究现状[J].动物学杂志,1998, 33(1):48-52.
[25] 殷名称.鱼类早期生活史研究与其进展[J].水产学报,1991, 15(4):348-358.
[26] Pelletier D,Blier P U,Lambert Y,et al.Deviation from the general relationship between RNA concentration and growth rate in fish [J].J Fish Biol,1995,47(5):920-922.
[27] Duntil J D,Lambert Y,Guderley H,et al.Nucleic acids and enzymes in Atlantic cod(Gadus morhua)differing in condition and growth rate trajectories[J].Can J Fish Aquat Sci,1998,55(4): 788-795.
[28] Arndt S K A,Benfey T J,Cunjak R A.Effect of temporary reduction in feeding on protein synthesis is an energy storage of juvenile Atlantic salmon[J].J Fish Biol,1996,49(2):257-276.
[29] 邓利,张波,谢小军.南方鲇继饥饿后的恢复生长[J].水生生物学报,1999,23(2):167-173.
[30] Dobson S H,Holmes R M.Compensatory growth in the rainbow trout,Salmo gairdneri Richardson[J].J Fish Biol,1984,25(6): 649-656.
[31] Russell N R,Wootton R J.Appetite and growth compensation in European minnows,Phoxinus phoxinus(Cyprinidae),following short periods of food restriction[J].Environ Biol Fish,1992,34 (3):277-285.
[32] Reimers E,Kjorrejord A G,Stavostrand S M.Compensatory growth and reduced maturation in second sea winter formed Atlantic salmon following starvation in February and March[J].J Fish Biol, 1993,43(5):805-810.
[33] Quinton J C,Blake R W.The effect of feed cycling and ration level on the compensatory growth response in rainbow trout,Oncorhynchus mykiss[J].J Fish Biol,1990,37(1):33-41.
[34] 谢小军,邓利,张波.饥饿对鱼类生理生态学影响的研究进展[J].水生生物学报,1998,22(2):181-188.
[35] 姜志强,贾泽梅,韩延波.美国红鱼继饥饿后的补偿生长及其机制[J].水产学报,2002,26(1):67-72.
The effects of starvation on refeeding and growth in Japanese flounder Paralichthys olivaceus
WANG Qing-kui1,2,JIANG Zhi-qiang1,WANG Jing-bo1,SHI Hui-lai1,JIANG Hai-bo1
(1.Key Laboratory of Mariculture,Agriculture Ministry,PRC,Dalian Ocean University,Dalian 116023,China; 2.Tianjin Key Laboratory of Aqua-ecology and Aquaculture,Tianjin Agricultural University,Tianjin 300384,China)
Abstract:Starvation on refeeding and growth of juvenile Japanese flounder Paralichthys olivaceus(body weight 5.93±1.20 g,body length 8.6±0.4 cm)was investigated at(20±1)℃.The juveniles were starved for 0(S0),5 (S5),10(S10)or 15(S15)days and then refed to satiation for 20 days.Feeding rate(FR),food conversion efficiency(FCE),absorption efficiency(AE)and dejecta production rate(DR)during refeeding and total body length,body weight,specific growth rate(SGR),hepatosomatic index(HSI),and RNA/DNA ratio in hepatopancreas and muscle during starvation and refeeding were monitored.Results showed that FR increased first and then decreased.FCE decreased first and then increased.Total AE in S5and S10was higher than that in S0while AE in S15was lower than that in S0during 20 days refeeding.The total length and body weight in S5was consistency with that in S0but was not consistency with that in S10or S15.SGR in starvation groups was found to increase first and then decrease to that in S0during refeeding.The HSI had negative relationship with starvation time.HSI in starvation groups gradually was consistency with that in S0during refeeding.The longer period the fish was starved for, the lower the RNA/DNA rario in hepatopancreas and muscle was.RNA/DNA ratio in hepatopancreas and muscles increased during refeeding,similar or surpass that in control group.Complete compensatory growth was observed in S5and partial compensatory growth occurred in S10and S15during 20 day refeeding.Compensatory growth was attributed in increase in FR first and in FCE later during refeeding.
Key words:starvation;refeeding;compensatory growth;Paralichthys olivaceus
文章编号:2095-1388(2011)01-0047-07
中图分类号:S965.399
文献标志码:A
收稿日期:2010-03-17
基金项目:国家“十一五”科技支撑计划项目(2006BAD09A01);辽宁省科技厅重大项目(2008203002);辽宁省教育厅高等学校重点实验室项目(20060180)
作者简介:王庆奎(1978-),男,讲师,博士生。E-mail:wqkmail@yahoo.com.cn
通信作者:姜志强(1960-),男,教授。E-mail:zhqjiang@dlou.edu.cn