
李君丰1,张丛尧1,杨辉2,王华1,王伟1
(1.大连海洋大学农业部海水增养殖学重点开放实验室,辽宁大连116023;2.辽宁省丹东市水产研究所,辽宁丹东118000)
摘要:采用静水试验法,在水温10~13℃条件下,研究了仿刺参Apostichopus japonicus幼参暴露于Zn(Ⅱ)浓度为0.050、0.150、0.500 mg/L的海水中75 d时,Zn(Ⅱ)在幼参体内的蓄积情况以及对其生长、存活的影响。结果表明:Zn(Ⅱ)浓度为0.050 mg/L和0.150 mg/L的试验组幼参没有出现中毒及死亡的现象,存活率均为100%,体长增长率分别为(60.10±17.11)%、(50.37±6.29)%,体重增长率分别为(145.305±14.671)%、(100.949±40.471)%,与空白对照组(自然海水)幼参的体长(60.34%± 17.11%)和体重(146.354%±14.671%)相比,增长率均没有显著差异(P>0.05);但0.150 mg/L浓度组的幼参体长、体重的增长率偏低,且随暴露时间的延长趋势更加明显;而0.500 mg/L浓度组的幼参在Zn(Ⅱ)的长期胁迫下,由缓慢生长、个别死亡转变为中毒萎缩、大量死亡,出现了负增长的现象(体长增长率为-24.94%±13.21%,体重增长率为-23.776%±17.706%),存活率仅为(38.67±15.53)%。Zn(Ⅱ)的毒性效应表现为慢性的、持续的,幼参对Zn(Ⅱ)的蓄积量和蓄积速率与暴露时间、Zn(Ⅱ)浓度呈显著正相关(P<0.05)。试验结束时,空白对照组、0.050、0.150、0.500 mg/L浓度组幼参体内Zn(Ⅱ)的蓄积量分别为开始时的1.4、2.0、2.3、3.8倍,各组的蓄积速率分别为(0.4022±0.1260)、(1.0160± 0.0215)、(1.3245±0.0807)、(2.8000±0.0185)mg/(g·d)。高浓缩系数表明,幼参对Zn(Ⅱ)的蓄积能力很强,暴露于自然海水中的幼参就可以蓄积足够的Zn(Ⅱ),可防止Zn(Ⅱ)缺乏产生的不良影响。
关键词:仿刺参幼参;Zn(Ⅱ);蓄积;生长;存活
仿刺参Apostichopus japonicus是中国记载的21种食用海参中唯一分布于黄渤海的温带种类,在连云港、山东半岛、大连、北戴河等沿海均有分布,具有极高的营养价值,为“海产八珍”之一[1]。海洋生物对Zn(Ⅱ)的富集能力很强,海水中Zn(Ⅱ)浓度过高会对生物产生一定的毒害作用,影响其生长和存活。仿刺参是重要的海洋经济物种,研究Zn(Ⅱ)对仿刺参的影响,对于改善养殖水环境,维持养殖业的可持续发展具有重要的意义[2]。
关于Zn(Ⅱ)对水生生物的毒性效应及蓄积、分布和排放规律的研究报道较多[3-9]。随着人们对仿刺参消费量的增大,以仿刺参为研究对象的毒性试验、蓄积试验也越来越为广大学者所关注[10-15]。已有的试验报道因试验生物暴露时间较短,多为急性毒性试验,而对于仿刺参幼参受Zn(Ⅱ)长期胁迫的研究还未见报道。本试验中,作者以仿刺参幼参为试验对象,探讨在Zn(Ⅱ)慢性胁迫下,幼参体内的Zn(Ⅱ)蓄积及对其生长和存活的影响,旨在为仿刺参的养殖环境监测、水质管理和资源保护等提供科学依据,同时为重金属污染水域的生物监测及生态毒理学研究提供一定参考依据。
1.1 材料
仿刺参幼参取自大连金瑞水产养殖有限公司育苗场,体长为(4.01±0.32)cm,体重为(2.002± 0.210)g。试验前在水槽中暂养驯化7 d,每日全量换水,投喂适量配合饲料。试验时选择刺突明显、
无化皮、无外伤、伸展自如的幼参随机分组。
化学试剂ZnSO4·7H2O为国产分析纯,试验前用双蒸馏水配成50 mg/L的贮备液待用。
1.2 方法
试验设3个Zn(Ⅱ)浓度试验组和1个空白对照组,每组设3个重复。根据适宜养殖的二类海水、毒物安全浓度海水和不宜养殖的三类海水中Zn(Ⅱ)的含量,将试验组Zn(Ⅱ)浓度设为0.050、0.150 mg/L[16]和0.500 mg/L;空白对照组不加任何试剂,Zn(Ⅱ)浓度为自然海水中的本底值。试验采用以35 L水槽为饲养容器的静水试验法[17],每个水槽中饲养幼参50头。试验期间遮光培养,间歇充气,保持光照强度为40~400 lx,水温为10~13℃,溶氧>5.0 mg/L,pH为7.8~8.2,盐度为30~31,自然海水中Zn(Ⅱ)本底值为0~0.54 μg/L。试验期间,每隔24 h全量换水1次,换水后定量加入贮备液,保持各试验组Zn(Ⅱ)浓度不变,投喂适量配合饲料。
暴露试验在大连海洋大学农业部海水增养殖学重点开放实验室进行。样品中Zn(Ⅱ)含量的测定在辽宁省海洋水产科学研究院中心实验室进行。暴露试验持续75 d,每隔25 d取样(即第25、50、75天),测定幼参的体长、体重及体内Zn(Ⅱ)的含量,并计算此期间幼参的存活率、体长增长率、体重增长率、Zn(Ⅱ)浓缩系数和蓄积速率。测定时,每组随机取幼参6头测量其体长、体重,然后随机取2头于低温(50℃)下烘干,制成混合样本后硝化,用原子吸收石墨炉法分析Zn(Ⅱ)含量。有关计算公式如下:

1.3 数据处理
试验数据用Microsoft Excel 2003作初步处理,用SPSS 16.0进行统计分析,采用单因素方差分析法(One-Way ANOVA Analysis)进行显著性分析,采用最小显著差数法(LSD)进行多重比较。
2.1 Zn(Ⅱ)对仿刺参幼参生长和存活的影响
通过75 d的暴露试验发现,除Zn(Ⅱ)浓度为0.500 mg/L的试验组幼参出现中毒、体长萎缩外,其它各组幼参体长持续增长,体长增长率均达50%以上(表1)。
表1 不同试验阶段Zn(Ⅱ)对幼参体长的影响
Tab.1 Effect of Zn(Ⅱ)on body length in juvenile sea cucumber Apostichopus japonicus
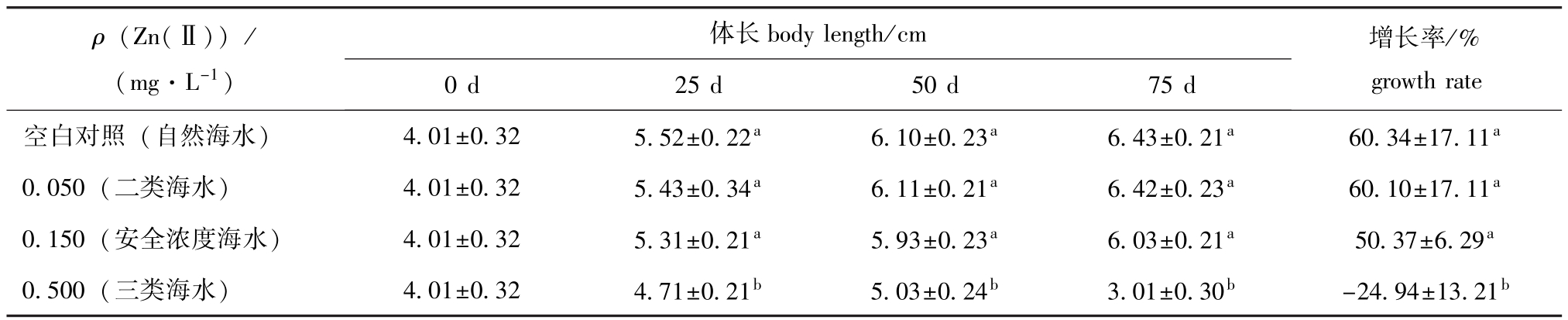
注:同列中标有不同小写字母者表示组间差异显著(P<0.05),标有相同小写字母者表示组间差异不显著(P>0.05),下同。
Note:The means with different letters are significantly different at the 0.05 probability level,and the means with the same letters within the same column are not significant differences,et sequentia.
growth rate空白对照(自然海水)4.01±0.325.52±0.22a6.10±0.23a6.43±0.21a60.34±17.11 ρ(Zn(Ⅱ))/ (mg·L-1)体长body length/cm 增长率/% 0 d25 d50 d75 d a 0.050(二类海水)4.01±0.325.43±0.34a6.11±0.21a6.42±0.23a60.10±17.11a0.150(安全浓度海水)4.01±0.325.31±0.21a5.93±0.23a6.03±0.21a50.37±6.29a0.500(三类海水)4.01±0.324.71±0.21b5.03±0.24b3.01±0.30b-24.94±13.21b
从表1可见:空白对照组和0.050 mg/L浓度组的幼参体长增长情况基本相同,试验结束时两组幼参的体长增长率分别为(60.34±17.11)%和(60.10±17.11)%;而0.150 mg/L浓度组幼参的体长及增长率虽然与前两组无显著差异(P>0.05),但结果偏低,试验结束时体长增长率为(50.37±6.29)%;0.500 mg/L浓度组从第25天开始,幼参体长显著低于其它3组(P<0.05),前 50 d幼参生长缓慢,在试验进行到50~75 d时出现中毒现象,身体严重萎缩,试验结束时体长增长率为(-24.94±13.21)%。
从表2可见:幼参在体重增长率方面所表现出来的增长规律与体长增长率的基本一致,但所不同的是0.150 mg/L浓度组从第50天开始,幼参的体重就显著低于空白对照组和0.050 mg/L浓度组(P<0.05),而试验结束时,其体重增长率仅为
(100.949±40.471)%,虽然均低于空白对照组和0.050 mg/L浓度组,但差异均不显著(P>0.05)。
表2 不同试验阶段Zn(Ⅱ)对幼参体重的影响
Tab.2 Effect of Zn(Ⅱ)in body weight of juvenile sea cucumber Apostichopus japonicus
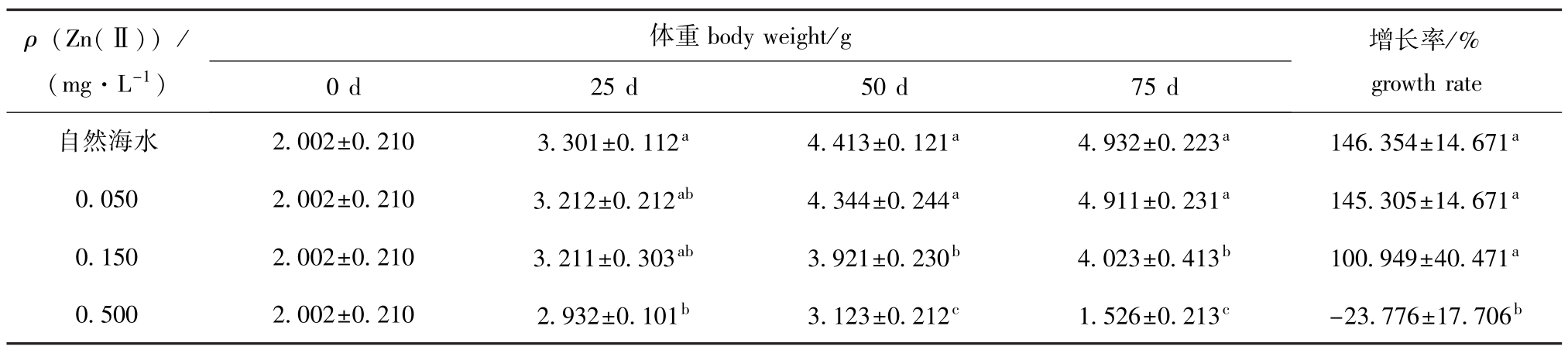
ρ(Zn(Ⅱ))/ (mg·L-1)体重body weight/g增长率/% growth rate自然海水2.002±0.2103.301±0.112a4.413±0.121a4.932±0.223a146.354±14.671 0 d25 d50 d75 d a 0.0502.002±0.2103.212±0.212ab4.344±0.244a4.911±0.231a145.305±14.671a0.1502.002±0.2103.211±0.303ab3.921±0.230b4.023±0.413b100.949±40.471a0.5002.002±0.2102.932±0.101b3.123±0.212c1.526±0.213c-23.776±17.706b
图1 为Zn(Ⅱ)对幼参存活率的影响,可以看出:对照组、0.050 mg/L和0.150 mg/L浓度组幼参在暴露试验的75 d中均没有出现死亡现象,存活率为100%;而0.500 mg/L浓度组幼参在试验的前25 d中出现个别死亡现象,但无明显中毒症状,其体长、体重继续增加,处于一个缓慢生长的状态;试验进行到25~50 d时,幼参活动能力下降,吸附力减弱,死亡量继续增加,存活率为(85.33±10.26)%;持续暴露50 d后,幼参大量死亡,且存活个体也出现体色发黑、身体细长萎缩和体重减轻等明显的中毒症状。试验结束时,幼参的存活率仅为(38.67±15.53)%。
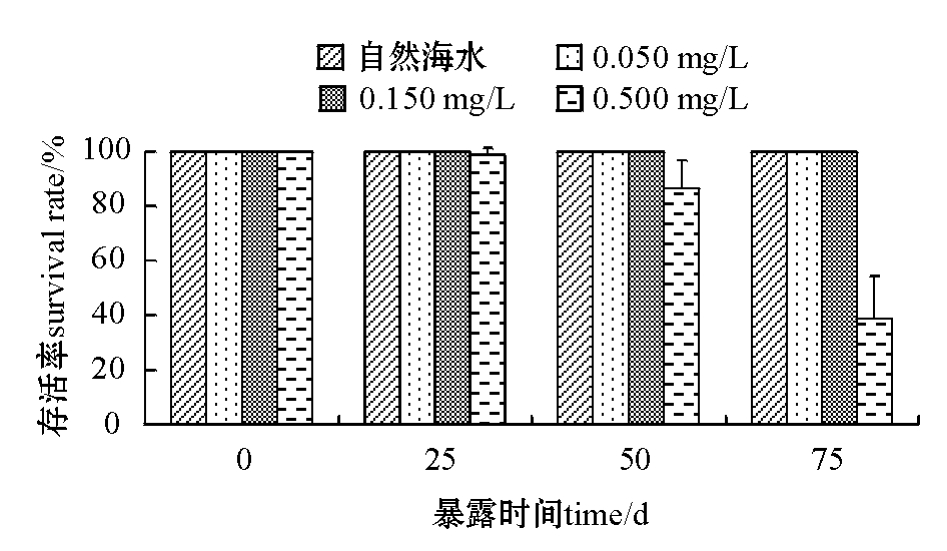
图1 Zn(Ⅱ)对幼参存活率的影响
Fig.1 Effect of Zn(Ⅱ)on survival rate in juvenile sea cucumber Apostichopus japonicus
2.2 仿刺参幼参对Zn(Ⅱ)的蓄积
幼参对Zn(Ⅱ)的蓄积量与暴露时间、海水中Zn(Ⅱ)的浓度呈显著正相关(P<0.05),即暴露时间越长,海水中Zn(Ⅱ)浓度越高,幼参对Zn(Ⅱ)的蓄积就越多。从表3可见:在暴露试验的75 d中,包括空白对照组在内的各试验组幼参体内Zn(Ⅱ)含量均呈上升趋势,但各Zn(Ⅱ)浓度试验组幼参在25、50、75 d时蓄积量均有显著的差异(P<0.05),而空白对照组在不同试验阶段则无显著差异(P>0.05);根据海水中Zn(Ⅱ)浓度的高低,Zn(Ⅱ)蓄积量和平均蓄积速率表现出相同的规律,空白对照组、0.050、0.150、0.500 mg/L浓度组试验结束时的蓄积速率分别为(0.4022±0.1260)、(1.0160±0.0215)、(1.3245± 0.0807)、(2.8000±0.0185)mg/(g·d);而Zn (Ⅱ)浓缩系数则呈相反的规律,即海水中Zn(Ⅱ)浓度越高,浓缩系数越小,暴露于自然海水中的幼参Zn(Ⅱ)浓缩系数为[(197.22±19.77)× 106]%,高于其它组几个数量级。
从图2可见:在不同试验阶段,空白对照组、0.050 mg/L和0.150 mg/L浓度组的蓄积速率较小且波动平缓;而0.500 mg/L浓度组的蓄积速率波动较大,第0~25天为4.5826 mg/(g·d),第25~50天为0.6360 mg/(g·d),第50~75天为3.1824 mg/(g·d)。在25~50 d这段时间里,由于Zn(Ⅱ)的长期胁迫,Zn(Ⅱ)对幼参的毒性效应已经逐渐表现出来,在幼参缓慢生长的同时蓄积速率也在减小,0.500 mg/L浓度组Zn(Ⅱ)的蓄积量只增加了0.159 mg/g,与空白对照组增加的0.157 mg/g十分接近;而50~75 d这段时间,0.500 mg/L浓度组幼参出现了明显的中毒症状,蓄积量和蓄积速率快速升高。
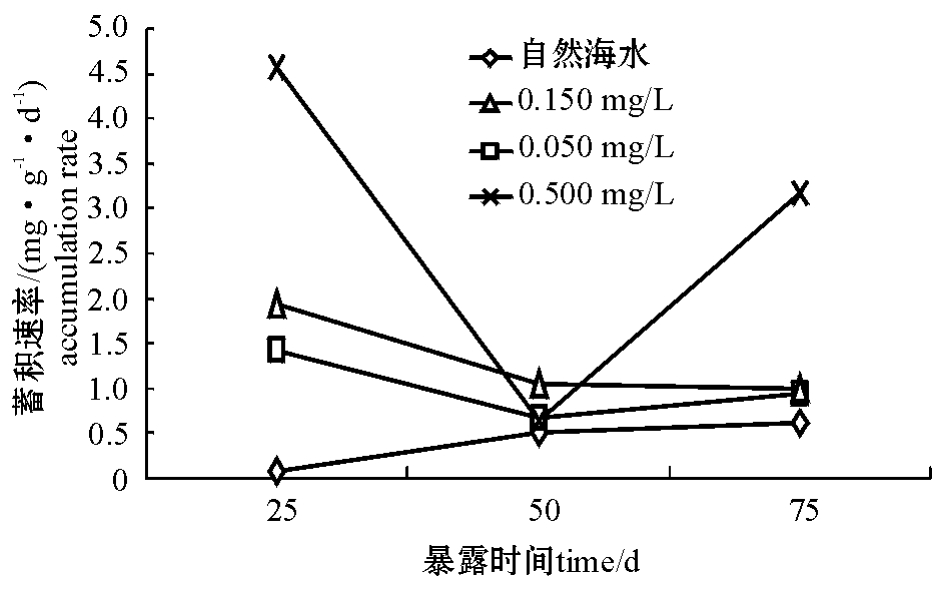
图2 仿刺参幼参对Zn(Ⅱ)的蓄积速率
Fig.2 Accumulation rate in juvenile sea cucumber Apostichopus japonicus
表3 不同试验阶段幼参对Zn(Ⅱ)的蓄积量(干重)、蓄积速率和浓缩系数
Tab.3 Accumulation(dry matter),accumulation rate and concentrated ratio of Zn(Ⅱ)in juvenile sea cucumber Apostichopus japonicus
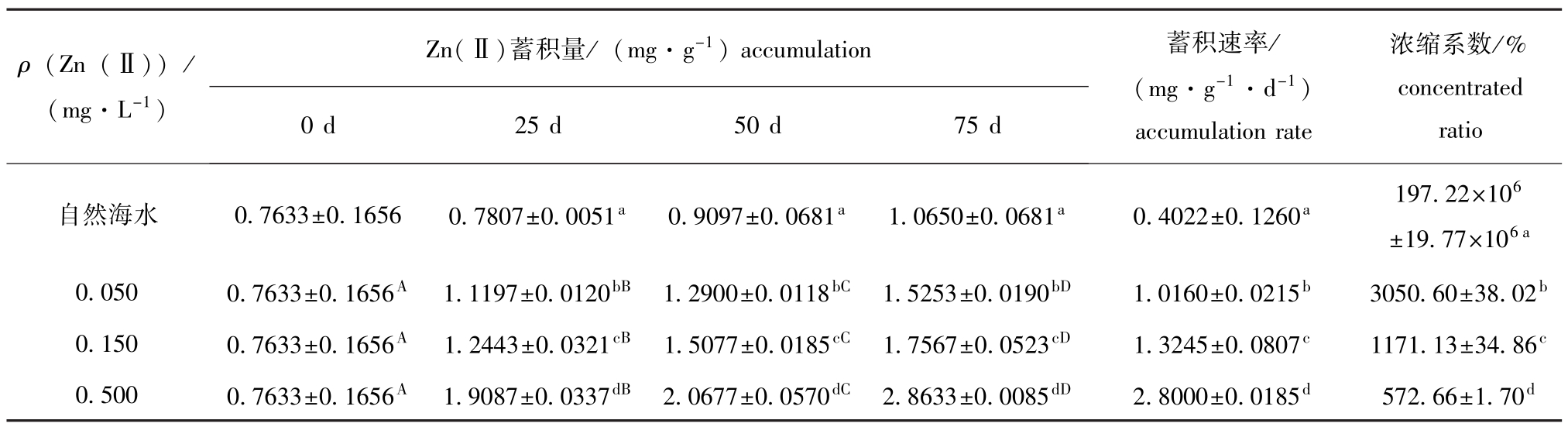
注:1)同一列中标有不同小写字母表示组间差异显著(P<0.05),标有相同小写字母表示组间差异不显著(P>0.05);
2)同一行中标有不同大写字母表示组间差异显著(P<0.05),标有相同大写字母表示组间差异不显著(P>0.05)。
Note:1)The means with the different letters within the same column are significant differences at the 0.05 probability level,and the means with the same letters within the same column are not significant differences;
2)The means with the different capital letters within the same line are significant differences at the 0.05 probability level,and the means with the same capital letters within the same line are not significant differences.
ρ(Zn(Ⅱ))/ (mg·L-1) Zn(Ⅱ)蓄积量/(mg·g-1)accumulation 浓缩系数/% concentrated ratio自然海水0.7633±0.16560.7807±0.0051a0.9097±0.0681a1.0650±0.0681a0.4022±0.1260a197.22×106±19.77×10 0 d25 d50 d75 d蓄积速率/ (mg·g-1·d-1) accumulation rate 6 a 0.0500.7633±0.1656A1.1197±0.0120bB1.2900±0.0118bC1.5253±0.0190bD1.0160±0.0215b3050.60±38.02b0.1500.7633±0.1656A1.2443±0.0321cB1.5077±0.0185cC1.7567±0.0523cD1.3245±0.0807c1171.13±34.86c0.5000.7633±0.1656A1.9087±0.0337dB2.0677±0.0570dC2.8633±0.0085dD2.8000±0.0185d572.66±1.70d
3.1 Zn(Ⅱ)对仿刺参幼参生长和存活的影响
试验期间幼参的体长、体重及存活率的变化反映了在Zn(Ⅱ)长期胁迫下幼参的生长和存活情况,直观地表现出幼参对Zn(Ⅱ)的耐受能力。孙振兴等[12]在Zn(Ⅱ)对仿刺参幼参的急性毒性试验中发现,Zn(Ⅱ)对幼参的毒性作用较为平缓持久,低浓度组随着暴露时间的延长,幼参出现陆续死亡的现象,存活个体大多活动能力微弱、反应迟缓,表明Zn(Ⅱ)对幼参具有持续的毒性效应。方展强等[18]在重金属对唐鱼的急性毒性试验中也发现, Zn(Ⅱ)毒性较弱,经过较长暴露时间唐鱼才出现异常状况。而本试验结果显示,生活在自然海水(空白对照)、二类海水(Zn(Ⅱ)浓度为0.050 mg/L)和Zn(Ⅱ)安全浓度海水(Zn(Ⅱ)浓度为0.150 mg/L)中幼参的体长、体重持续增长,没有表现出中毒和死亡的现象,但持续暴露在Zn(Ⅱ)安全浓度海水中的幼参体长、体重的增长情况不如自然海水和二类海水好,并随暴露时间的延长表现出显著差异(P<0.05)。说明幼参在Zn(Ⅱ)安全浓度范围内的海水中可以生长、存活,但安全浓度海水的Zn(Ⅱ)已经对幼参的生长产生了慢性的、持续的影响。生活在三类海水(Zn(Ⅱ)浓度为0.500 mg/L)中的幼参在试验初期,并没有出现大量死亡的现象,但生长缓慢,与其它试验组有显著差异(P<0.05);但随着暴露时间的持续,幼参出现中毒和大量死亡的现象。这说明幼参在三类海水中可以生长和存活一段时间,但随着暴露时间的持续,Zn(Ⅱ)便会对幼参产生慢性的、持续的毒性效应,进而导致幼参中毒及死亡。
3.2 仿刺参幼参对Zn(Ⅱ)的蓄积
幼参对Zn(Ⅱ)蓄积的试验结果显示,幼参对Zn(Ⅱ)的蓄积量与暴露时间、Zn(Ⅱ)浓度呈显著正相关(P<0.05),暴露在自然海水中的幼参对Zn(Ⅱ)的蓄积量也是持续升高的。这说明在幼参的生长过程中始终伴随着对Zn(Ⅱ)的蓄积,空白对照组、0.050、0.150、0.500 mg/L浓度组幼参在试验结束时,Zn(Ⅱ)蓄积量分别为开始时的1.4、2.0、2.3和3.8倍。软体动物由于具有高滤水速率及对重金属较强的富集能力,而常被用于进行重金属水体的污染生物监测研究。马藏允等[19]认为:海洋环境中污染物的浓度较低,与生物作用的时间较漫长,研究在污染物浓度较低情况下生物的长期累积效应,对指示生物的选择尤为重要。他在持续5个月对几种大型底栖动物积累重金属的研究中发现:栉孔扇贝和菲律宾蛤对Zn(Ⅱ)的耐受能力较差,而紫贻贝和褶牡蛎对Zn(Ⅱ)的耐受能力则较强,但两者的积累规律不同。紫贻贝在Zn(Ⅱ)浓度较低时体内蓄积量变化不大,在海水Zn(Ⅱ)浓度为1.00 mg/L时,开始表现为积累而后逐渐死亡;褶牡蛎在体内Zn(Ⅱ)含量本底水平就很高的情况下,蓄积量仍随海水中Zn(Ⅱ)浓度的增加而增加。褶牡蛎对Zn(Ⅱ)的蓄积情况和本试验中幼参对Zn(Ⅱ)的蓄积情况相似。
Zn(Ⅱ)参与核酸和蛋白质代谢,有促进角质生成、胃肠黏膜修复、增强机体免疫力和有利于精子生成等重要作用,也是酶(特别是金属酶)发挥作用不可或缺的因子[20]。幼参对Zn(Ⅱ)表现出很强的代谢调节能力。一方面,幼参对Zn(Ⅱ)的蓄积能力很强,暴露在自然海水中的幼参并没有因为海水中较低浓度的Zn(Ⅱ)而出现缺乏的症状;另一方面,暴露在二类海水中的幼参尽管对Zn (Ⅱ)的蓄积量和蓄积速率与空白对照组均有显著差异(P<0.05),但并没因此出现对其生长和生理功能的不良影响。这一点可以由两组的浓缩系数清楚的表现出来,说明在一定浓度范围内,幼参会根据自身生长需要和耐受能力等情况对Zn(Ⅱ)进行蓄积和排放调节,防止缺乏或中毒现象的发生。吴坚[21]和Roesijadi[22]的研究表明,软体动物的解毒机制在于其体内金属硫蛋白的作用,而重金属能诱导体内金属硫蛋白的合成,其作用是调节重金属在体内的平衡。笔者认为,幼参对Zn(Ⅱ)的代谢调节很可能与体内金属硫蛋白的调节作用有关,其机理还有待于进一步研究。
王志铮等[23]在对黄姑鱼幼鱼的急性毒性试验中提出,当生物受到重金属离子如Hg(Ⅱ)、Zn (Ⅱ)、Cr(Ⅵ)等污染时,会诱导其体内合成一定数量的金属结合蛋白(MT),而当这些重金属离子在生物体内积累到一定程度以后,进入细胞的金属离子超过生物合成MT速率对它的需求时,多余的金属离子就会与其体内的其它生物分子,包括酶和核酸等大分子相互作用,引起中毒现象。暴露在三类海水中的幼参蓄积速率波动较大,在25~50 d这段时间里,幼参受Zn(Ⅱ)的长期胁迫,体内蓄积了大量Zn(Ⅱ),幼参为抑制中毒现象的产生而进行积极的代谢调节,消耗大量的能量,这可能是此期间幼参生长缓慢、蓄积速率减小的原因。但随着持续暴露时间的延长,幼参对Zn(Ⅱ)的蓄积量已经超出了其耐受能力,因而出现明显的中毒症状;其体内Zn(Ⅱ)的蓄积量和蓄积速率的快速升高,也说明幼参自身的调节能力丧失,已经蓄积的Zn(Ⅱ)并没有及时排出体外。
本试验中采用Zn(Ⅱ)的安全浓度为0.150 mg/L,高于国家标准渔业水质标准(GB11607-1989)[24]规定的0.100 mg/L。结果表明,在0.150 mg/L Zn(Ⅱ)的长期胁迫下,幼参的生长情况已经受到了影响。这种慢性的、持续的影响会对幼参带来多大的危害,能否引起幼参的中毒现象,还需要进一步试验研究。在75 d的暴露试验期间,幼参本身处于一个有机物积累且快速生长的阶段,这可能与各组Zn(Ⅱ)的蓄积量逐渐增加有关。幼参对Zn(Ⅱ)的耐受和调节能力会随着个体的逐渐成熟而有所变化,至于成体仿刺参对Zn(Ⅱ)的蓄积情况还需要更多的试验研究。另外,国家食品中锌限量卫生标准(GB13106-1991)[25]中虽然没有关于仿刺参的限量规定,但对鱼类中锌含量的规定是不高于50 mg/kg。从本试验结果可以发现,即便生活在自然海水中的幼参,Zn(Ⅱ)在其干重中的含量也高于这个限量,所以仿刺参的食品安全问题也是值得特别关注的。
参考文献:
[1] 常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004:1-30.
[2] 朱丽岩,吕建发,唐学玺.锌对虾夷扇贝和刺参幼体的毒性效应[J].海洋通报,1999,18(4):34-37.
[3] Mcgeer J C,Szebedinszky C,Mcdonalde D G,et al.Effects of chronic sublethal exposure to waterborne Cu,Cd or Zn in rainbowtrout:2.tissue specific metal accumulation[J].Aquatic Toxicology,2000,50:245-256.
[4] CHAN H M.Accumulation and tolerance to cadmium,copper, lead and zinc by the green mussel Perna viridis[J].Mar Ecol Prog Ser,1988,48:295-303.
[5] Elliott N G,Swain R,Ritz D A.Metal interaction during accumulation by the mussel Mytilus edulis planulatus[J].Mar Biol,1986, 93(3):395-399.
[6] 夏天翔,刘雪华,赵孟彬.2种淡水蚌类对水环境中Cu、Zn和Cd的去除与累积[J].水产科学,2009,28(4):183-187.
[7] 戴家银,刘琼玉,洪华生.铅和锌混合液在菲律宾蛤仔体内的积累及其致毒效应[J].南京大学学报:自然科学版,1998,32 (6):712-718.
[8] 谢瑞文,吴恩应,肖周业,等.Zn和I在鲮鱼体内的积累与分布[J].中山大学学报:自然科学版,2005,44:224-228.
[9] 庄树宏,刘雪梅,李晖.烟台海域无脊椎动物对Pb、Cd、Cu、Zn的富集作用[J].海洋通报,1998,17(2):42-50.
[10] 张晓燕.Cu2+,Zn2+,Pb2+,Cd2+对刺参幼虫的毒性试验[J].海洋科学,1994(2):9-12.
[11] 孙振兴,王慧恩,王晶,等.汞、镉、硒对刺参(Apostichopus japonicus)幼参的单一毒性与联合毒性[J].海洋与湖沼,2009, 40(2):228-234.
[12] 孙振兴,陈书秀,陈静,等.四种重金属对刺参幼参的急性致毒效应[J].海洋通报,2007,26(5):80-85.
[13] 孙振兴,杨立红,张晓梅,等.铜和锌对刺参幼参的联合毒性作用[J].海洋通报,2009,28(4):112-115.
[14]丁君,张学辉,丁鸣,等.幼刺参不同部位对Zn2+、Cu2+的蓄积动力学研究[J].海洋环境科学,2008,27(4):359-362.
[15]赵元凤,吴益春,吕景才,等.重金属铅在刺参组织的蓄积、分配、排放规律研究[J].农业环境科学学报,2008,27(4):1677 -1680.
[16]张晓燕.Zn(Ⅱ)对剌参幼体的毒性试验[J].海洋科学,1989, 2:62-64.
[17]周永欣,章宗涉.水生生物毒性试验方法[M].北京:农业出版社,1989:75-156.
[18]王瑞龙,马广智,方展强.铜、镉、锌对唐鱼的急性毒性及安全浓度评价[J].水产科学,2006,25(3):117-120.
[19]马藏允,刘海,姚波,等.几种大型底栖生物对Cd、Zn、Cu的积累实验研究[J].中国环境科学,1997,17(2):151-155.
[20]杨健,尹君,许海伦,等.长江江豚锌、铜、铅、镉和砷的摄入与累积[J].水生生物学报,2005,29(5):557-563.
[21]吴坚.微量金属对海洋生物的生物化学效应[J].海洋环境科学,1991,10(2):58-64.
[22] Roesijadi G.Behavior of metallothionein-bound metals in a natural population of an estuarine mollusca[J].Mar Environ Res, 1994,38(4):147-168.
[23]王志铮,刘祖毅,吕敢堂,等.Hg2+、Zn2+、Cr6+对黄姑鱼幼鱼的急性致毒效应[J].中国水产科学,2005,12(6):745-750.
[24]国家环境环保总局.GB11607-89.中华人民共和国国家标准渔业水质标准[S].
[25]国家质量监督检验检疫总局.GB13106-1991.食品中锌限量卫生标准国家标准[S].
Accumulation of Zn(Ⅱ)in the body and effect of Zn(Ⅱ)on growth and survival in juvenile sea cucumber Apostichopus japonicus
LI Jun-feng1,ZHANG Cong-yao1,YANG Hui2,WANG Hua1,WANG Wei1
(1.Key Laboratory of Mariculture,Agriculture Ministry,PRC,Dalian Ocean University,Dalian 116023,China;2.Dandong Fisheries Institute, Dandong 118000,China)
Abstract:The accumulation of Zn(Ⅱ)in juvenile sea cucumber(Apostichopus japonicus)with body weight of (2.002±0.210)g and effect of Zn(Ⅱ)on the growth and survival were determined in the sea cucumber exposed to zinc at Zn(Ⅱ)concentrations of 0.050,0.150 mg/L and 0.500 mg/L in static water at water temperature of 10 -13℃for 75 days.The results showed that there were no toxicity and death in the sea cucumber juveniles exposed to Zn(Ⅱ)concentrations of 0.050 mg/L,and 0.150 mg/L,with growth rates of(60.10±17.11)%and(50.37± 6.29)%in body length,the growth rates of(145.305±14.671)%and(100.949±40.471)%in body weight,no significant different with the control group(the body length growth rate of(60.34±17.11)%and body weight growth rate of(146.354±14.671)%)(P>0.05).The sea cucumber juveniles exposed to Zn(Ⅱ)concentrations of 0.500 mg/L,however,had lower growth rates in body length and weight than the juveniles in other group did, and then turned into the toxic,degrowth(-24.94%±13.21%in body length,-23.776%±17.706%in body weight),even death(survival rate of was(38.67±15.53)%.The Zn(Ⅱ)showed chronic and sustained toxicity. There was a positive relationship between accumulation quantity and rate and exposure period and the concentrations of Zn(Ⅱ)(P<0.05).The accumulation of Zn(Ⅱ)were found to be 1.4 time in the juveniles exposed to zinc at concentrations of 0.000 mg/L,2.0 times in the juveniles exposed to zinc at concentrations of 0.050 mg/L, 2.3 times in the juveniles exposed to zinc at concentrations of 0.150 mg/L,and 3.8 times in the juveniles exposed to zinc at concentrations of 0.500 mg/L compared to those at the beginnings,and the accumulation rates were(0. 4022±0.1260),(1.0160±0.0215),(1.3245±0.0807)mg/(g·d)and(2.8000±0.0185)(g·d),respectively.The concentration coefficient indicated that the juveniles had great accumulation ability of Zn(Ⅱ),accumulation of Zn(Ⅱ)when they were exposed to natural sea water.
Key words:juvenile Apostichopus japonicus;Zn(Ⅱ);accumulation;growth;survival
文章编号:2095-1388(2011)01-0035-06
中图分类号:X174
文献标志码:A
收稿日期:2001-11-01
基金项目:国家“十一五”科技支撑计划项目(2006BAD09A01);海洋公益性行业科研专项(200905020)
作者简介:李君丰(1954-),男,讲师。E-mail:lijunfeng@dlou.edu.cn
通信作者:王伟(1978-),男,副教授。E-mail:wangwei@dlou.edu.cn