Costaria costata常温人工育苗的研究
由学策,曹淑青,王含茹,张泽宇,李晓丽
(大连海洋大学农业部海洋水产增养殖学重点开放实验室,辽宁大连116023)
摘要:以浮筏栽培的Costaria costata成熟种藻为材料,采用阴干刺激方法获得大量孢子并采集在维尼纶绳苗帘上,研究了孢子萌发、配子体生长发育和幼孢子体生长与水温的关系。结果表明:胚孢子在水温16℃下24 h后开始萌发形成配子体;16~22℃是配子体生长的适宜温度,经过近1个月培育,雌雄配子体藻团直径分别可达50 μm和45 μm;雌雄配子体在水温达到22℃后生长速度明显减慢,超过23℃后生长停止进入休眠期;当水温降至23℃以下时配子体恢复生长,22℃时雌雄配子体开始发育,形成卵囊和精子囊,21.5~20.5℃是雌雄配子体成熟高峰期,其间雌雄配子体大量排出卵和放出精子,其卵囊和精子囊形成率分别达到70%和62%;卵受精后形成的幼孢子体在21.5~20℃间生长很快,受精20 d时测定藻体长度达到200 μm以上,经过1个月海区暂养培育成藻体长度为0.3 cm的幼苗,经海区栽培后生长成为长为3 m、宽为35 cm的C.costata成体。
关键词:Costaria costata;采孢子;人工育苗;海区暂养;浮筏栽培
Costaria costata在分类上属于海带目Laminariales、海带科Laminariaceae、Costaria属,在亚洲主要分布在日本列岛和朝鲜半岛的中高纬度地区沿海,是经济价值较高的一年生大型褐藻[1]。C.costata在日本主要分布于北海道和本土北部的青森县、岩手县等沿海地区,藻体长为1~2 m,宽约30 cm,叶片的两面各具3条或2条突出于藻体表面的“筋”,被称之为“筋布”[1-2]。C.costata幼嫩时可以食用,成体是鲍、海胆等经济动物的饲料[2]。据报道,用C.costata投喂皱纹盘鲍Haliotis discus hannai,其壳长和重量增长分别是投喂Eisenia bicyclis的1.56倍和2.12倍,表明该藻明显优于其它海带目种类和其它藻类,具有高饲料价值,现已被列入日本中北部地区鲍、海胆增殖场和海洋牧场建设的主要增殖藻类[3]。近年来,由于工业和生活污水的过量排放,日本近岸藻场荒漠化日趋加剧,C.costata因其繁殖能力强,孢子放散量大,在较短的时间内能形成大的藻场而被应用于荒漠化藻场恢复和海底森林建设[4-6]。最近研究发现, C.costata中的多糖含量较高,从C.costata中提取多糖的研究已引起人们的关注。C.costata在中国没有分布,仅张泽宇等[7]进行了C.costata的室内培养与栽培试验。在日本关于C.costata的研究有一些报道,但多数集中在对其分类及生态学方面的研究[8-10],有关在室内常温条件下进行人工育苗的研究尚未见报道。
基于鲍、海胆增养殖业发展和海洋牧场建设及多糖产业的实际需求,作者于2008年从日本引进C.costata的雌雄配子体,采用配子体采苗及育苗的方式在室内培育成C.costata幼苗,并在浮筏上栽培为成体。本试验中,作者以浮筏栽培的C.costata成体为材料,采用阴干刺激的方法从成熟种藻获得孢子并采集在维尼纶绳附着基上,研究了雌雄配子体生长、发育和幼孢子体生长与水温的关系,在室内常温条件下培育出C.costata幼苗,经过海区暂养后在浮筏上栽培为C.costata成体。
1 材料与方法
1.1 材料
供试材料为2008年采用配子体采苗方法培育出的C.costata幼苗并在海区浮筏上栽培为成体的种藻(图1-A)。采孢子时间为2009年7月3日。
取浮筏栽培的种藻20余棵,在海上洗净后运回室内采孢子。
1.2 方法
1.2.1 种藻阴干刺激及采孢子 将种藻摆放在育苗池的池沿上阴干2 h后,移到玻璃钢水槽(长1.5 m、宽1.0 m、高0.5 m)内,添加过滤海水后搅拌促进孢子放散。当观察孢子水变为浅褐色时,捞出种藻,放入附着基采孢子。附着基是用直径为3.0 mm的维尼纶绳缠绕在80 cm×60 cm聚乙烯框架上制成的苗帘,同时放入检查孢子附着密度的载玻片,孢子附着时间为3 h。当载玻片上有大量胚孢子附着时,将苗帘移到玻璃钢水槽(长2.0 m、宽1.2 m、高1.0 m)内培育。
1.2.2 配子体生长与成熟 附着后的胚孢子萌发为雌雄配子体。雌雄配子体生长阶段,每5 d测定1次,每次测定20个个体的长度,取其平均值。雌雄配子体成熟(从雌配子体形成卵囊并排出卵,雄配子体形成精子囊并放出精子开始)后,每3 d测定1次,每次各测定50个个体,按排出卵和排出精子个体数占测定总数的百分比计算排卵率和排精率。
1.2.3 幼孢子体的生长 卵受精后形成幼孢子体。幼孢子体生长阶段,每5 d测定1次,每次测定20个藻体的长度,取其平均值。当幼孢子体长度达到200 μm以上时下海暂养。
以上培养在大连海洋大学裙带菜人工育苗室内进行。光源为自然光,配子体生长阶段,光强为1 000~1 500 lx;度夏阶段(水温高于23℃),光强为300 lx;幼孢子体生长阶段,光强为2 000~2 500 lx。培养用水为当地自然海水,经沉淀过滤后供试验使用。营养盐的添加量为:NaNO310 g/m3,NaH2PO4·12H2O 2 g/m3。培养液每天全量更换1次。
1.2.4 幼苗暂养 幼苗下海暂养时间为2009年9月24日。暂养前将苗帘上端用细绳固定,下端切断,拆掉下端和两侧的框架,将上端连同苗绳垂挂在大连旅顺柏岚子水产养殖场海区的浮筏上暂养。暂养期间,每5 d测定1次幼苗的长度,每次测定50个个体,取其平均值。
1.2.5 海区栽培 分苗时间为2009年10月25日。具体方法是:将生长幼苗的苗种绳切成3 cm小段,按30 cm的间距夹在长为8 m、直径为3 cm的聚乙烯栽培苗绳上,然后平挂在浮筏上栽培,栽培海区同上。每个月测定1次藻体的长度和宽度,每次测定20个藻体,取其平均值。
1.3 数据分析
所有试验数据以平均值±标准差(Means± S.E.)表示,采用SPSS 15.0软件进行单因素方差分析。
2 结果
2.1 孢子放散、附着与萌发
阴干刺激后的种藻经搅拌后孢子囊吸水破裂,囊内孢子被大量放出。放散10 min后观察孢子水呈浅褐色。经显微镜检查,孢子水中孢子的密度已达到30个/视野(×100)以上。刚放出的孢子呈梨形,为(11.5~8.5)μm×(6.5~5.0)μm,下腹部有一盘状色素体,腹部凹陷处侧生两条不等长的鞭毛,前长后短,依靠鞭毛摆动快速游动(图1-B),30 min后,孢子开始陆续附着。孢子附着时,长鞭毛与基质接触并快速旋转将鞭毛收回体内,随后旋转速度减慢并逐渐停止。孢子前端附着在基质上成为胚孢子,随着附着时间的延长,胚孢子与基质附着面逐渐增大并附着牢固。放散1 h后,绝大部分孢子已附着。经显微镜观察,水中仅剩个别孢子在游动,载玻片上胚孢子附着密度达到40个/视野(×100)以上。
胚孢子呈圆形,直径为8~10 μm,内含一个盘状色素体,在16℃水温下附着24 h后开始萌发。萌发时圆形胚孢子先产生突起状萌发管,萌发管在向外延伸拉长的同时前端膨大,形成一个前端膨大的长圆形透明细胞与胚孢子相连,且呈哑铃状。随后,胚孢子内的原生质开始向透明细胞前端膨大处移动。随着细胞内原生质数量的增多,透明细胞逐渐变为浅褐色。当胚孢子内的原生质全部移动到细胞前端膨大处后,在细胞膨大处基部产生隔阂并与胚孢子壳分隔,形成褐色单细胞配子体,依靠与透明萌发管连接的胚孢子壳附着在基质上,此时进入配子体生长阶段。
2.2 配子体的生长与成熟
刚形成的配子体呈长圆形,内含一个盘状色素体,呈褐色。配子体生长时细胞先拉长,然后细胞一分为二形成两个细胞。随后,配子体开始性分化,约50%配子体通过旺盛的细胞分裂增加细胞数量,最后形成具有十余个细小细胞的雄配子体。显微镜下可见多个细胞堆积在一起形成大的藻团,
约50%配子体只增加细胞体积,细胞分裂很慢,形成3~4个粗大细胞的雌配子体。
雌雄配子体生长与水温的关系见图2。可以看出,配子体形成后至水温上升至22℃前属于配子体生长阶段,在此温度下雌雄配子体处于良好的生长状态。显微镜下可见,配子体呈浅褐色,雄配子体进行旺盛的细胞分裂,雌配子体细胞体积逐渐增大,雌雄配子体藻体长度快速增加。当水温达到22℃以上时,雌雄配子体生长明显减慢;水温超过23℃时生长停止,进入休眠阶段。此时在显微镜下观察,雌雄配子体细胞增厚、硬化且呈褐色,藻体易脱落。
9月上旬,水温降低至23℃以下时,雌雄配子体从休眠状态中恢复生长,部分藻体开始发育并逐渐成熟。雌配子体发育时细胞逐渐拉长呈棒状,细胞内的色素体连同原生质向细胞顶端移动使细胞顶端逐渐膨大,形成深褐色椭圆形卵囊并排出卵,挂在透明的卵囊袋上等待受精(图1-C)。雄配子体则在细胞表面产生多个乳状精子囊并放出精子(图1-D),卵受精后形成幼孢子体。

图1 Costaria costata的生活史
Fig.1 Life cycle of sea weed Costaria costata
注:A Costaria costata种藻,Mature sporophyte of Costaria costata;B游孢子,Zoospores;C雌配子体及形成的卵,Female gametophytes with eggs;D雄配子体及形成的精子囊,Male gametophytes with antheridia;E受精10 d后的幼孢子体,10-day-old sporophytes;F受精20 d后的幼孢子体,20-day-old sporophytes;G暂养30 d的幼苗,Sporelings in 30 days'holding cultivation;H 3月25日采的藻体,Sporophytes on 25 March;I 4月25日采的藻体,Sporophytes on 25 April。
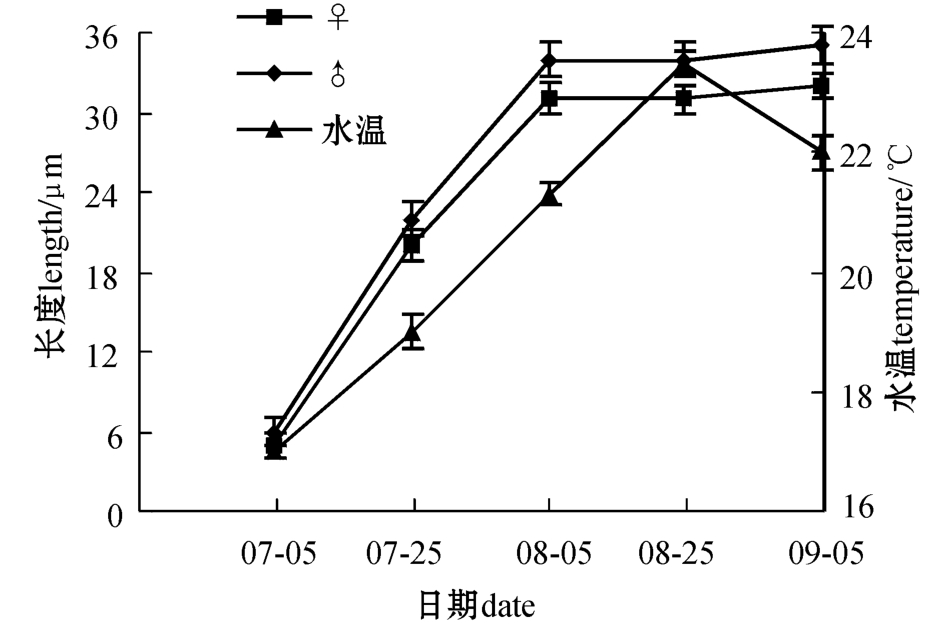
图2 雌雄配子体的生长与水温的变化
Fig.2 Changes in growth of female and male gametophytes at ambient sea water temperature
雌雄配子体的成熟与水温的关系见图3。可以看出,雌雄配子体开始成熟时,水温约为22℃,其中雄配子体成熟略早于雌配子体。在21℃和20℃下是配子体成熟的高峰期,此期间雌雄配子体的卵囊和精子囊形成率可达70%左右,在水温为20.2℃下测定(9月22日),卵囊和精子囊形成率均达到90%以上。
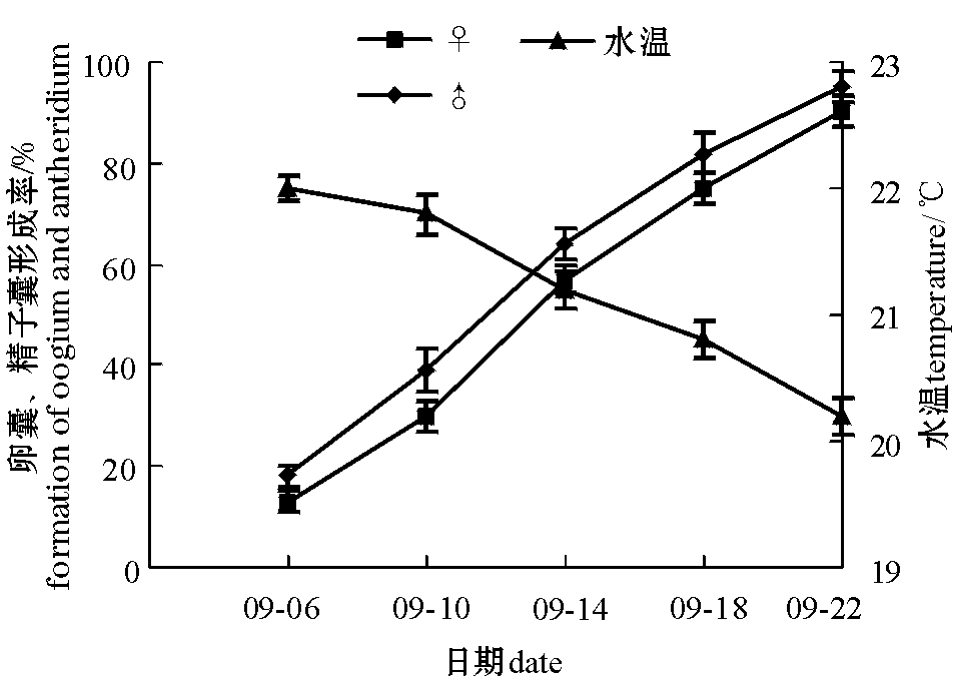
图3 雌雄配子体的成熟与水温的变化
Fig.3 Changes in maturation of female and male gametophytes at ambient sea water temperature
2.3 幼孢子体的生长
卵受精后刚形成的幼孢子体呈椭圆形,第一次分裂为横分裂,形成上下两个细胞;再经过3次横分裂,成为7个细胞的单列细胞幼孢子体;随后经过多次细胞纵横分裂,形成由20余个细胞组成的多列细胞幼孢子体。幼孢子体在适宜的培养条件下生长很快,培养20 d后藻体平均长度超过200 μm,少数藻体长度接近300 μm。显微镜下可见藻体基部细胞生出透明的假根丝替代卵囊袋附着在基质上。幼孢子体生长与水温的关系见图4。可以看出,在水温为22℃左右时,形成的幼孢子体因水温偏高初期生长缓慢,受精5 d后藻体长度仅为(60±8.2)μm。随着水温的下降,幼孢子体的生长速度逐渐加快。培养10 d后,藻体长度达到(120±9.1)μm(图1-E);培养15 d后,藻体的长度为(180±11.2)μm;培养20 d后,藻体长度为(225±12.3)μm(图1-F),达到暂养标准,可以下海暂养。
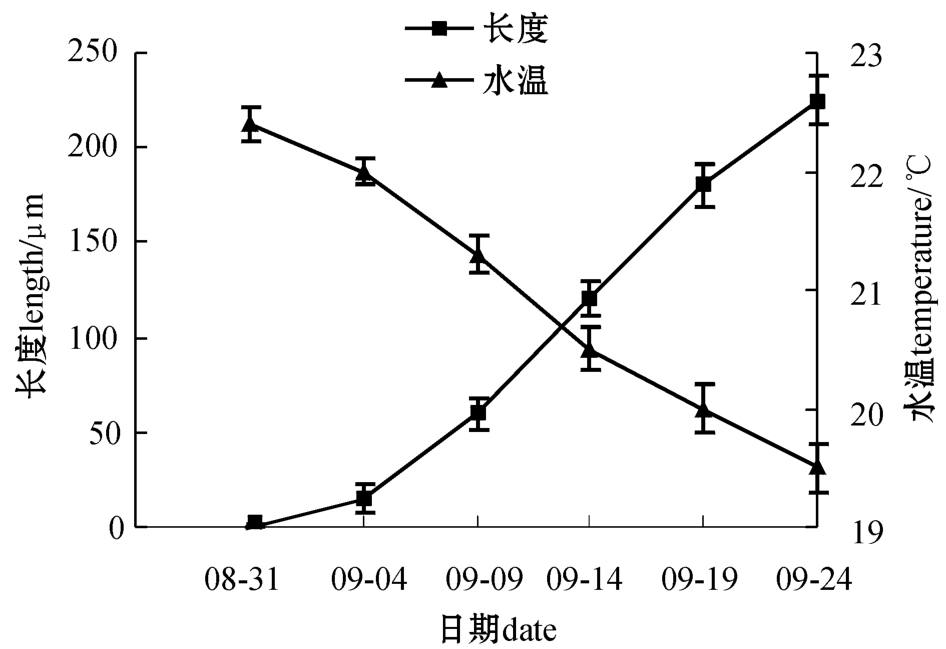
图4 室内培养期间幼孢子体生长与水温的变化
Fig.4 Changes in growth of juvenile sporophytes at ambient sea water temperature during the indoor culture
2.4 幼苗暂养及栽培
下海后的幼孢子体因对海区条件不适应生长缓慢。一周后,显微镜下可见苗绳上有大量杂藻、薮枝螅Obelia gracilis和浮泥附着,藻体密度明显减少。藻体长度虽有所增加,但生长状态较差,叶片中下部有相当数量杂藻附着。随着水温的下降和对海区条件的逐渐适应,幼孢子体生长速度明显加快。当藻体长度达到0.5 mm时,可见叶片基部中间细胞呈条状突起并向下延伸形成短柄,柄基部生出多条透明的假根丝,成为叶片、柄、假根丝区分明显的幼孢子体;当藻体长度达到1 mm以上时,随着叶片基部细胞层数的增加,叶片变得坚挺,柄拉长呈圆柱状,基部形成圆形假根。当藻体长度达到3 mm以上时,假根、柄和叶片已肉眼清楚可见,成为幼苗。
暂养期间幼苗生长与水温的关系见图5。暂养初期,幼苗生长缓慢,暂养5 d(9月29日)后测定,幼苗长度仅为(380±20)μm。随着水温下降,幼苗生长速度逐渐加快,暂养10 d后达到(780±50)μm,15 d后长度增加至(1.3±0.17)
mm,20 d后幼苗长度已达到(2.1±0.15)mm。暂养30 d(10月24日)后测定,幼苗长度已经超过3 mm(图1-G),可分苗栽培。
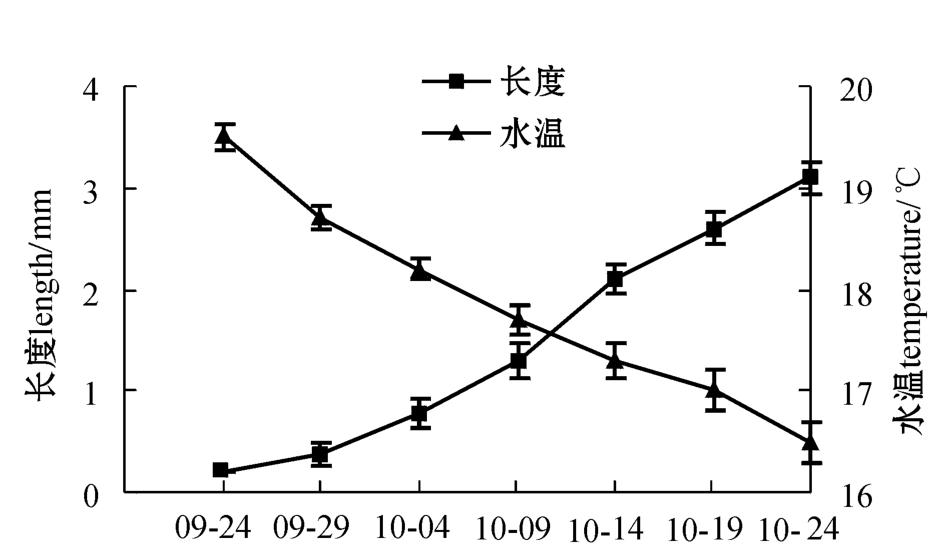
图5 暂养期间幼苗生长与水温的变化
Fig.5 Changes in growth of sporelings at ambient sea water temperature during holding sea cultivation
C.costata在海区栽培期间其藻体生长与水温的关系见表1。从表1可见:栽培初期(10月25日至11月25日),因幼苗个体较小,相对生长较慢;随着藻体的增大,其生长速度明显加快。即使在低温期(水温为0℃左右)内,幼苗的生长也保持较快的生长速度,显示出耐低温的优良特性。3月下旬(水温为3℃左右)测定,藻体长度达到(2.50±0.15)m,宽度为(30.0±2.9)cm(图1-H);到4月25日(水温为4.2℃),藻体长度已增至(3.5±0.2)m,宽度达到(40.0±4.5)cm,均达到相关资料介绍的最大值,成为C.costata成体(图1-I)。
表1 栽培期间藻体的生长情况及水温的变化
Tab.1 Growth of sea weed C.costata and changes in natural sea water temperature during the sea cultivation
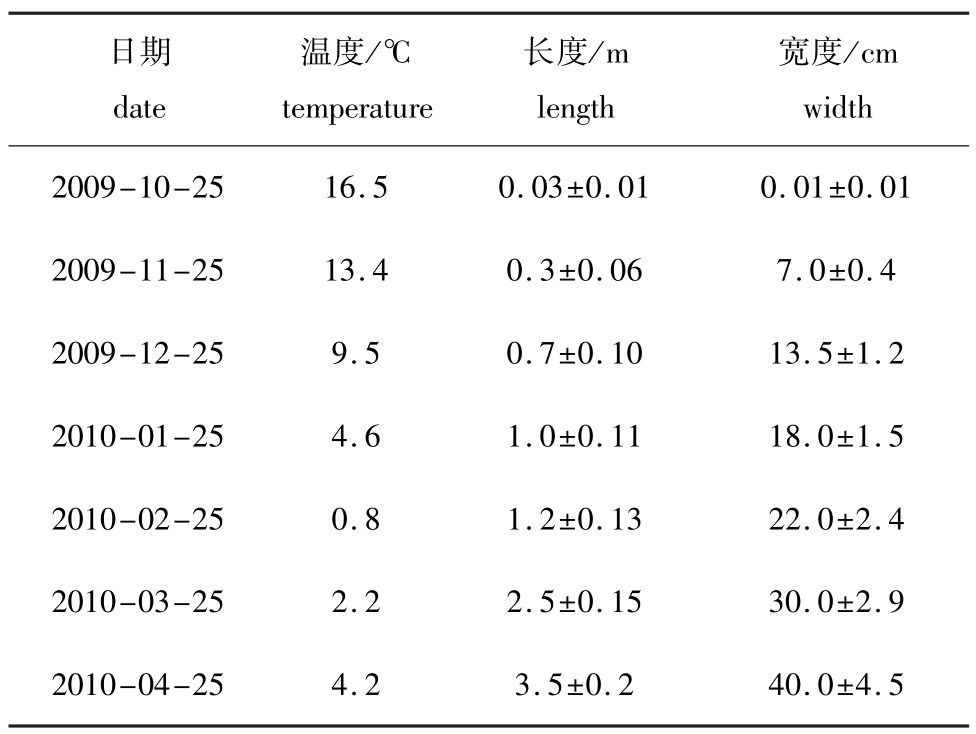
日期date温度/℃temperature长度/m length宽度/cm width 2009-10-2516.50.03±0.010.01±0.01 2009-11-2513.40.3±0.067.0±0.4 2009-12-259.50.7±0.1013.5±1.2 2010-01-254.61.0±0.1118.0±1.5 2010-02-250.81.2±0.1322.0±2.4 2010-03-252.22.5±0.1530.0±2.9 2010-04-254.23.5±0.240.0±4.5
3 讨论
3.1 配子体休眠及其温度
海带目藻类是以配子体阶段度过夏季高温期,当海水温度升高至某一值时,配子体生长停止,藻体细胞增厚,以休眠方式度过夏季高温期,在生产上被称之为“度夏”,这在海带、裙带菜等相关研究中已有报道[11]。因此,在海带目藻类育苗生产技术研究中,准确掌握配子体度夏的起始温度并采取相应的技术措施,对提高育苗的成功率是非常重要的。
本试验结果表明,当培育水温达到或超过配子体生长适温的上限时,C.costata配子体停止生长,细胞质膜明显增厚,藻体硬化,细胞由浅褐色逐渐变为深褐色,表现出明显的休眠度夏特征。当培育水温达到22℃时,C.costata雌雄配子体的生长速度明显减慢;当水温升至22.5℃时基本生长停止,细胞颜色逐渐加深;当水温达到23℃时,配子体藻团变为深褐色,进入休眠状态。因此,C.costata配子体进入休眠期的起始温度应为23℃左右。关于配子体结束休眠的温度,本试验中发现,当水温降至23℃时,配子体仍处于休眠状态;当水温降至22.5℃左右时,配子体细胞的颜色开始逐渐变浅,22℃左右时才恢复为正常配子体的浅褐色并开始生长或发育。这表明配子体结束休眠的温度应为22.5℃,略低于休眠期的起始温度。
C.costata配子体休眠度夏这一特性为其人工育苗提供了极其便利的条件。借鉴裙带菜配子体度夏期间的管理技术[12],在室内进行C.costata的人工育苗时,水温升至22.5℃需开始降低光强,23℃时光强降至300 lx;当秋季水温降低至23℃以下时,配子体从逐渐休眠状态复苏,此时通过调整光照、营养盐添加量和更换培养海水等措施促进配子体发育,使其在短时间内大量成熟,形成卵囊和精子囊,从而获得大量的幼孢子体,取得了良好的育苗效果。
3.2 幼苗海区暂养
暂养是利用自然海区的优越条件促进幼苗快速生长,尽快达到分苗标准的培育过程。关于海带目藻类幼苗暂养海区的选择条件在海带、裙带菜的相关研究中已有许多报道,但多数集中在对温度、营养盐、透明度、水流等暂养海区自身条件的要求以及水云Ectocarpus siliculosus、石莼Ulva pertusa等杂
藻附着对幼苗生长的影响[11-12],有关附着动物的影响尚未见报道。本试验中,在旅顺柏岚子海区C.costata幼苗暂养期间恰逢薮枝螅繁殖期内,幼苗下海暂养5 d后观察,显微镜下可见大量透明薮枝状的薮枝螅附着在苗绳上,C.costata幼苗生长在薮枝螅间。暂养10 d后,肉眼可见薮枝螅在苗绳表面形成密密的一层白色绒毛。显微镜下可见大量薮枝螅已产生多节叉状分枝及多个触手(呈伞状),除部分个体较大的幼苗外,个体较小的幼苗被覆盖在下面已经陆续死亡,苗绳上幼苗密度明显降低。试验期间使用50 g/L的NaNO3溶液可以把薮枝螅杀死,但陆续仍有新的薮枝螅附着。
本试验中发现,苗绳上幼苗密度不同对薮枝螅的附着数量有明显的影响。幼苗密度越小,苗绳上附着薮枝螅的数量越多;反之,苗绳上幼苗密度越大,其上面附着薮枝螅的数量越少。其原因可能是因为幼苗密度小的苗绳空余的区域大,导致薮枝螅大量附着,因此,增加苗绳上幼苗密度可以在一定程度上降低薮枝螅的危害,但无法从根本上解决问题。本试验中幼苗暂养区域也是大连市裙带菜幼苗的重要暂养区,薮枝螅的大量繁衍极大地影响了裙带菜的出苗率,也给企业带来了重大损失,因此,深入开展薮枝螅生物量、繁殖期及幼虫附着温度和水层的调查,研究防止或避开薮枝螅大量附着的技术措施势在必行。
参考文献:
[1] 殖田三郎,岩本康三,三浦昭雄.水産植物 [M].東京:疭星社厚生閣,1978:408-412.
[M].東京:疭星社厚生閣,1978:408-412.
[2] 德田広,大野正夫,小河久郎.海藻資源養殖 [M].東京:緑書房,1987:201-203.
[M].東京:緑書房,1987:201-203.
[3] 日本增殖場造成指針作成委員仝.增殖場造成指針[M].東京:地球社,1985:89-104.
[4] 能登谷正浩.藻場の海藻と造成技術[M].東京:成山堂書社, 2003:90-144.
[5] 谷口和也.アラメ海中林の造成[J].水産の研究,1984,2(3): 81-85.
[6] 中久喜昭.アラメ,ヵジメ場,藻場,海中林[M].東京:疭星社厚生閣,1981:116-129.
[7] 张泽宇,陈树科,蒋晖.Costaria costata的室内培养与栽培试验[J].大连水产学院学报,1992,7(2-3):39-48.
[8] 崛輝三.藻類の生活史集成第2蜅:褐藻、紅藻類[M].東京:内田老鶴圃,1993:125-137.
[9] 新崎盛敏.アラメ,ヵジメの分類[M].東京:海洋科 ,1985: 760-765.
,1985: 760-765.
[10] 喜田和四郎,前川行幸.アラメ,ヵジメ群落に関する研究Ⅱ[J].三重大水産宓験所研報,1983(10):57-69.
[11] 曾呈奎,王素娟,刘思俭,等.海藻栽培学[M].上海:上海科技出版社,1985:11-15.
[12] 刘焕亮.水产养殖学概论[M].青岛:青岛出版社,2000:22-33.
Artificial seeding of sea weed Costaria costata at ambient temperature
YOU Xue-ce,CAO Shu-qing,WANG Han-ru,ZHANG Zhe-yu,LI Xiao-li
(Key Laboratory of Mariculture,Agriculture Ministry,PRC,Dalian Ocean University,Dalian 116023,China)
Abstract:Mass zoospores were induced to release from sea weed Costaria costata collected from culture rafts by drying in air and were spread on nylon strings.The germination of zoospores,development of gametophytes and growth of juvenile sporophytes were studied in natural seawater temperature.The zoospores were found to germinate into gametophytes over 24 h at 16℃.The female and male gametophytes developed rapidly into clusters in diameter of 50 μm and 45 μm from 16℃to 20℃,but developed slowly at 22℃,even stopped developing over 23℃. The mature female and male gametophytes produced oogonia and antheridia with formation rate of 70%for oogonia and 62%for antheridia,from which released eggs and sperm from 21.5℃to 20.5℃.The juvenile sporophytes had good growth from 21.5℃to 20℃.The sporelings had length of over 200 μm after germination,0.3 cm after one month holding cultivation,and mature sporophytes length of 3 m and width of 35 cm in sea cultivation.
Key words:Costaria costata;zoospore collection;artificial seeding;holding sea cultivation;raft cultivation
文章编号:2095-1388(2011)01-0017-06
中图分类号:S968.42
文献标志码:A
收稿日期:2010-06-02
基金项目:国家“863”计划项目(2006AA10A412);海洋公益性行业科研专项经费资助项目(200805030)
作者简介:由学策(1954-),男,高级工程师。E-mail:yxc@dlou.edu.cn






 [M].東京:疭星社厚生閣,1978:408-412.
[M].東京:疭星社厚生閣,1978:408-412. [M].東京:緑書房,1987:201-203.
[M].東京:緑書房,1987:201-203. ,1985: 760-765.
,1985: 760-765.