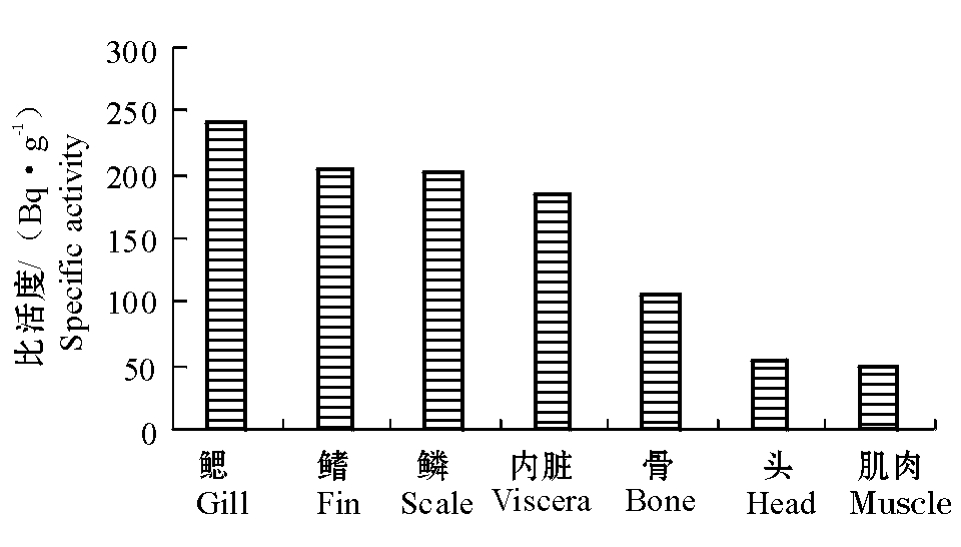
图1 45 d时甲磺隆在鱼体各部分的分布
Fig.1 The distribution of metsulfuron-methyl residues in different parts of the fish at 45 days
邢殿楼,王华,王丽,王伟,雷衍之
(大连海洋大学生命科学与技术学院,辽宁大连116023)
摘要:在室外人工水生生态试验装置中,采用放射性同位素示踪技术研究了14C标记的甲磺隆在尼罗罗非鱼Oreochromis niloticus体内的蓄积过程。结果表明:尼罗罗非鱼不同组织器官对甲磺隆的蓄积量存在一定差异,虽然鱼体肌肉中的放射性比活度在各器官中最低,但肌肉对放射性标记物的蓄积量最高;甲磺隆在鱼体不同组织器官内的蓄积与排出达到动态平衡所需的时间不同,鱼内脏中达到平衡时所需时间最短,而鱼躯干部所需时间最长,鱼内脏对甲磺隆表现为清除排出,而鱼头部和躯干部对甲磺隆均表现为先吸收蓄积,然后再逐渐转化为清除排出。
关键词:14C-甲磺隆;尼罗罗非鱼;蓄积
随着新品种除草剂的不断开发和大量使用,除草剂对生态环境及生物的影响已引起人们的关注[1]。甲磺隆(Metsulfuron-methyl)是一种高效的磺酰脲类除草剂,在世界各地被广泛使用于小麦、玉米、水稻等作物种植中阔叶杂草的防治[2]。虽然人们对甲磺隆在环境中的行为和降解机制已有了一些研究[3-6],但在使用过程中发现,甲磺隆在土壤中极低的残留量就可能影响后茬作物(如油菜等)的生长[7]。除此之外,甲磺隆还具有淋溶性,有较强的随水迁移能力[8],特别是将甲磺隆施用于农田后,可能有部分甲磺隆在天然降水、农业灌溉等因素的作用下进入到农田附近的池塘中,或是随地表径流进入到河流、水库或湖泊中。虽然甲磺隆属低毒类除草剂,但Wendt-Rasch等[9]和Cedergreen等[10]发现,水环境中的甲磺隆会对水生生态系统结构的稳定性产生影响,Miron等[11]的研究也证实,甲磺隆会明显影响鱼脑组织中乙酰胆碱酶(AChE)的活性,特别是水产品中高浓度甲磺隆的蓄积可能会影响水产品的质量。
目前甲磺隆除草剂主要在中国长江流域及其以南地区使用,这些地区的农田附近多有一些池塘,随着降水等地表径流导致甲磺隆进入池塘中,从而对池塘中的水生动物产生影响。本研究中,作者采用人工模拟的池塘水生生态体系,利用14C标记的甲磺隆作为示踪剂,以尼罗罗非鱼Oreochromis niloticus作为模式生物,考察进入到水体中的甲磺隆在尼罗罗非鱼体内的蓄积过程,旨在为甲磺隆除草剂在使用过程中的环境风险性评价以及水产品的食品安全监测提供一些依据。
1.1 材料与试验装置
尼罗罗非鱼取自浙江杭州华家池农场,经驯养后放入在试验系统中,共计50尾,平均干重为0.5 g。
14C-甲磺隆(14C标记在三嗪4位杂环碳上)由中国农业科学院北京原子能利用研究所提供,放射性比活度为4.55×104Bq/mg,放射化学纯度为97.3%,化学纯度为96.2%。
水生生态试验装置是一个玻璃水族箱(95 cm ×70 cm×45 cm),内装150 kg浙江华家池地区的小粉土(pH为6.8,有机质为19.5 g/kg,交换性总酸为0.05 cmol/kg,交换性钙为11.8 cmol/kg,交换性镁为1.5 cmol/kg,黏粒12.5 g/kg)作为底泥。在试验装置内加入自来水,控制底泥上覆水的体积为100 L,并放入适量金鱼藻Bellamya purificata和紫背浮萍Spirodela polyrhiza。
1.2 方法
称取105.5 mg14C-甲磺隆固体溶于少量甲醇中,然后均匀加入试验系统中。试验过程中不充气,不投饵,每隔两天加入少量水,以使上覆水的体积保持在100 L。在加入14C-甲磺隆后2、4、12 h和1、2、4、6、10、15、20、30、45 d时随机取尼罗罗非鱼3尾。每次取出的尼罗罗非鱼样品先在自来水中充分冲洗至水中无放射性物质检出,然后将鱼体解剖为头部、躯干部和内脏三部分。所有生物样品均在60℃下干燥至恒重后,用分析天平称重,然后采用生物氧化燃烧仪(Harvey Biological Oxidizer,OX-400)燃烧制样。燃烧生成的14CO2用自制的闪烁液(PPO 5 g+POPOP 0.4 g+二甲苯475 mL+乙醇胺175 mL+乙二醇乙醚350 mL)吸收,并用液体闪烁计数器(Wallac Winspectral 1414)测量吸收液的放射性活度。
将45 d时取出的尼罗罗非鱼样品分为头、鳃、鳞片、鳍、骨、肉和内脏,分别置于液体闪烁计数瓶中,称重后在闪烁计数瓶中加入体积分数为60%的HClO40.2 mL和H2O20.2 mL,于60℃下消化12 h,然后加入固体NaOH调整pH至中性,加入自制闪烁液后测定放射性活度,经校正,计算甲磺隆在尼罗罗非鱼体各部分的蓄积。
试验结束时,取水样1 mL,置于闪烁计数瓶中,加入2 mL乙二醇乙醚助溶,再加入5 mL自制闪烁液,充分摇匀后用液体闪烁计数器测量放射性活度,计算水中甲磺隆的总放射性活度。取0~3 cm表层底泥样品少许,置于通风橱内风干,干燥后经粉碎称重,采用生物氧化燃烧仪燃烧制样,经校正,计算底泥中甲磺隆的含量。每次测定设3个重复。
2.1 甲磺隆在尼罗罗非鱼体内的分布
45 d时甲磺隆在尼罗罗非鱼体内各部分的放射性比活度的平均值如图1所示。放射性物质在鱼体各部分中的比活度大小依次为:鳃>鳞、鳍>内脏>骨>头>肌肉。生物蓄积是有机污染物进入鱼体内最主要的一种方式,大约有67%的有机污染物在鱼体内会出现生物放大的现象[12]。鳃是尼罗罗非鱼的主要呼吸器官,鱼鳃的特定结构增加了鳃与水的接触面积,鱼在呼吸过程中大量的水不停地流过鱼鳃,导致水中放射性标记物进入鱼鳃。Randall等[13]的研究证实,鱼鳃是鱼体吸收水中农药的重要器官,大部分的1,2,3,4-四氯苯是通过鳃进入鲑鳟Salmo trutta的体内。尼罗罗非鱼鳞和鳍的放射性比活度也较高,可能是由于鳍和鳞直接与外界水环境接触所致,鱼的表皮中分布有大量的单细胞黏液腺,能不断向体表分泌黏液,甲磺隆可能部分被吸附在黏液中。虽然尼罗罗非鱼内脏中的放射性比活度低于鳃、鳍和鳞片,但明显高于鱼体其它部分。内脏是鱼体新陈代谢最活跃的器官,进入鱼体中的物质主要通过内脏进行吸收和再分配。Cazenave等[14]认为,鱼体对微囊藻毒素的吸收主要是利用鳃和消化道,通过鳃的呼吸作用或食物链进入鱼体内,再通过血液循环进入到鱼躯体的其它部分。作者在前期的研究中也发现,尼罗罗非鱼的内脏对进入水环境中的甲磺隆具有极高的生物富集系数,这与Edginton等[15]的研究结果相似。Edginton等[15]认为,白鲑、鲤和罗非鱼主要通过内脏中的胆囊、消化道和肝脏来富集水中的除草剂——阿特拉津。本试验中,虽然肌肉中的放射性比活度是鱼体各部分中最低的,但仍高于45 d时水中的放射性比活度,说明进入水体中的甲磺隆已在尼罗罗非鱼体内蓄积。

图1 45 d时甲磺隆在鱼体各部分的分布
Fig.1 The distribution of metsulfuron-methyl residues in different parts of the fish at 45 days
图2 为45 d时甲磺隆在鱼体各部分蓄积量的相对比例,其大小依次为:肌肉>内脏>头部>鳞、鳃>骨>鳍,可见尼罗罗非鱼鱼体各部分的质量对甲磺隆残留物蓄积量的影响比较明显。尼罗罗非鱼肌肉的总质量明显高于鱼体其它各组成部分,虽然肌肉中的放射性比活度是鱼体各部分中含量最低的(图1),但其蓄积放射性标记物的总量却是最高的。这说明如果进入到池塘水生生态系中的甲磺隆除草剂被鱼体吸收,鱼体肌肉将是甲磺隆的最大蓄积库。甲磺隆在鱼内脏中的蓄积量低于肌肉,但明
显高于鱼体其它部分,特别是鱼的内脏便于取样,因此可以将尼罗罗非鱼内脏作为鱼体受到甲磺隆除草剂污染的指示器官。尼罗罗非鱼头部、鳞、鳃等鱼体其它组织器官对甲磺隆的蓄积量大致相当。
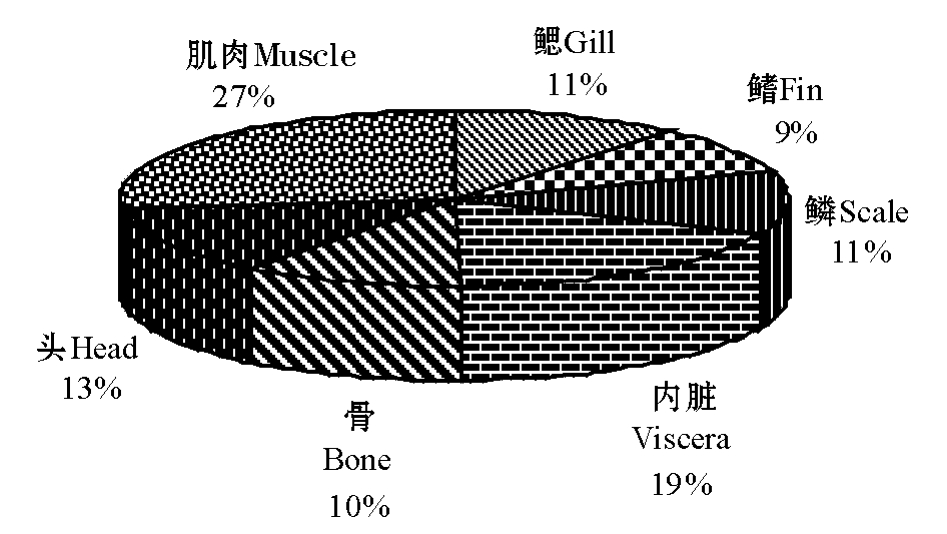
图2 45 d时甲磺隆残留物在鱼体各部分积累量的相对比例
Fig.2 Relative percentages of metsulfuron-methyl residues in different parts of the fish at 45 days
2.2 甲磺隆在尼罗罗非鱼体内的蓄积过程
甲磺隆属于磺酰脲类除草剂,其分子结构是由苯环、磺酰脲桥及均三嗪杂环组成。进入到天然水体中的甲磺隆会发生化学降解,在降解过程中,甲磺隆分子中脲桥键上的羰基碳易受水分子等带电基团的亲核进攻,导致脲桥键断裂,使母体化合物分解为氨磺酰和氨基杂环化合物。特别是在酸性条件下,甲磺隆母体化合物更易受氢质子的进攻,水解就更为强烈。甲磺隆降解半衰期与水环境条件(温度、pH、光照强度等)有关,并且在降解过程中可能有部分甲磺隆降解物以CO2形式进入到大气中[4]。本试验结果表明,14C-甲磺隆及其放射性降解物在水和底泥中的总量与14C的加入量基本相同,说明甲磺隆及其降解产物未从试验系统中明显流失。由于14C标记在甲磺隆分子的均三嗪杂环上,所以本试验中检测到的放射性总量应包括甲磺隆母体化合物和均三嗪杂环等进一步降解产物,是甲磺隆及其含14C标记的放射性降解产物的总量。
甲磺隆进入到人工水生生态系统后,会由水向系统中的底泥、水生动物和水生植物等其它环境介质迁移。Clark等[16]认为,对农药在环境中迁移的各种描述都是在用不同的方法解释相同的问题,常用的分析农药在环境介质中蓄积的数学模型是库系统模型。室外人工模拟的池塘水生生态试验系统应属于开放式多库系统,但试验系统中14C放射性标记物的总量未发生变化,因此可以将甲磺隆存在的人工水生生态系统简化为封闭系统。此外,由于尼罗罗非鱼体内放射性标记物的蓄积总量与体系中14C标记物的总量相比可以忽略,所以可以把尼罗罗非鱼个体从多库系统中独立出来,认为在外部系统中放射性标记物总量未变的条件下,尼罗罗非鱼个体可归属于一个单库系统,这样有利于探讨甲磺隆在鱼体内的蓄积过程。鱼体对甲磺隆的蓄积作用取决于水中甲磺隆的含量、蓄积时间及鱼体对甲磺隆的排出能力等因素。甲磺隆在尼罗罗非鱼各组织器官内的蓄积速度与单位时间内鱼体吸收甲磺隆的速度以及清除速度有关。当水环境中的甲磺隆在鱼体内蓄积的同时,也存在着甲磺隆在鱼体内代谢转化与清除的过程。为了进一步阐明甲磺隆在尼罗罗非鱼体内各部分的蓄积过程,考虑到水中甲磺隆浓度变化和鱼体各部分蓄积甲磺隆含量的变化,可建立如下甲磺隆在尼罗罗非鱼体内的蓄积动力学模型:
式中:M为鱼体各部分的重量(mg);d c/d t为单位时间内生物体所蓄积甲磺隆的放射性活度(Bq/g·d);Ci代表甲磺隆在鱼体各部分中的放射性活度(Bq/g);Co代表鱼体排出甲磺隆的放射性活度(Bq/g);R是单位时间内鱼体所蓄积甲磺隆的量(Bq/d);α和β分别代表单位时间内进入鱼体内和从鱼体内排出的甲磺隆的迁移系数(d-1)。
将式(1)两边除以M得
设r=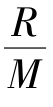 ,则式(2)变为
,则式(2)变为
式中:d c/d t在一定的相邻时间段内可变换为Δc/ Δt,则
式中:ti和ci指在ti时刻鱼体内蓄积甲磺隆的放射性活度ci;ti+1和ci+1指在ti+1时刻鱼体内蓄积甲磺隆的放射性活度ci+1。对于ci、ci+1和Ci,可由试验数据直接代入,Co是鱼体外甲磺隆的放射性活度,可用水中甲磺隆的放射性活度来代替。对于甲磺隆在同一尼罗罗非鱼体内相邻时间段内迁移过程的差异可以忽略,系数α和β值可认为是1。这样将试验结果代入式(4),可以计算出r值。如果r值为正,表示尼罗罗非鱼对甲磺隆的吸收速率超过清除速率,鱼体对甲磺隆的吸收过程占主导趋势;如果
r值为负,表示鱼体对甲磺隆的排出速率超过吸收速率,排出过程占主导趋势;如果r值为零,表示此时甲磺隆在鱼体内的吸收速率和排出速率相等,吸收过程与排出过程达到相对平衡。因此,r值既可用来反映甲磺隆在尼罗罗非鱼体内吸收速率与排出速率间的关系,也可以代表甲磺隆在鱼体内蓄积速率的变化。甲磺隆在尼罗罗非鱼的内脏、头部和躯干部的r值随时间变化如图3所示。
从图3可见,甲磺隆在尼罗罗非鱼不同组织器官内的蓄积过程存在差异。虽然均存在以吸收趋势为主变成以排出为主,但两个过程所需的时间却不同,且蓄积速率的大小也不同。尼罗罗非鱼内脏对刚进入水中的甲磺隆的蓄积速率非常高,然后在6 h内就迅速变成以代谢排出为主,且在以后的试验时间内r值均保持为负值,表明鱼内脏先吸收积累大量甲磺隆,然后再排出,以适应外界水质的改变。同时,鱼内脏在6 h后的蓄积速率的绝对值随时间延长逐渐降低,表明鱼内脏已适应甲磺隆的影响。
从图3还可见,尼罗罗非鱼头部和躯干部对甲磺隆残留物在试验前期表现为以吸收积累为主,在试验后期表现为以代谢排出为主,但鱼头部的代谢排出能力明显高于鱼体躯干部。鱼头部在10 d后表现为由吸收积累转化为代谢排出,鱼体躯干部则在20 d后才由吸收积累为主转化为代谢排出为主。这表明鱼体躯干部作为环境污染物的蓄积库,在水生生态系统中14C的总量未发生明显变化的条件下,鱼体躯干部对甲磺隆的蓄积能力更强,甲磺隆在鱼体内的蓄积会更持久。
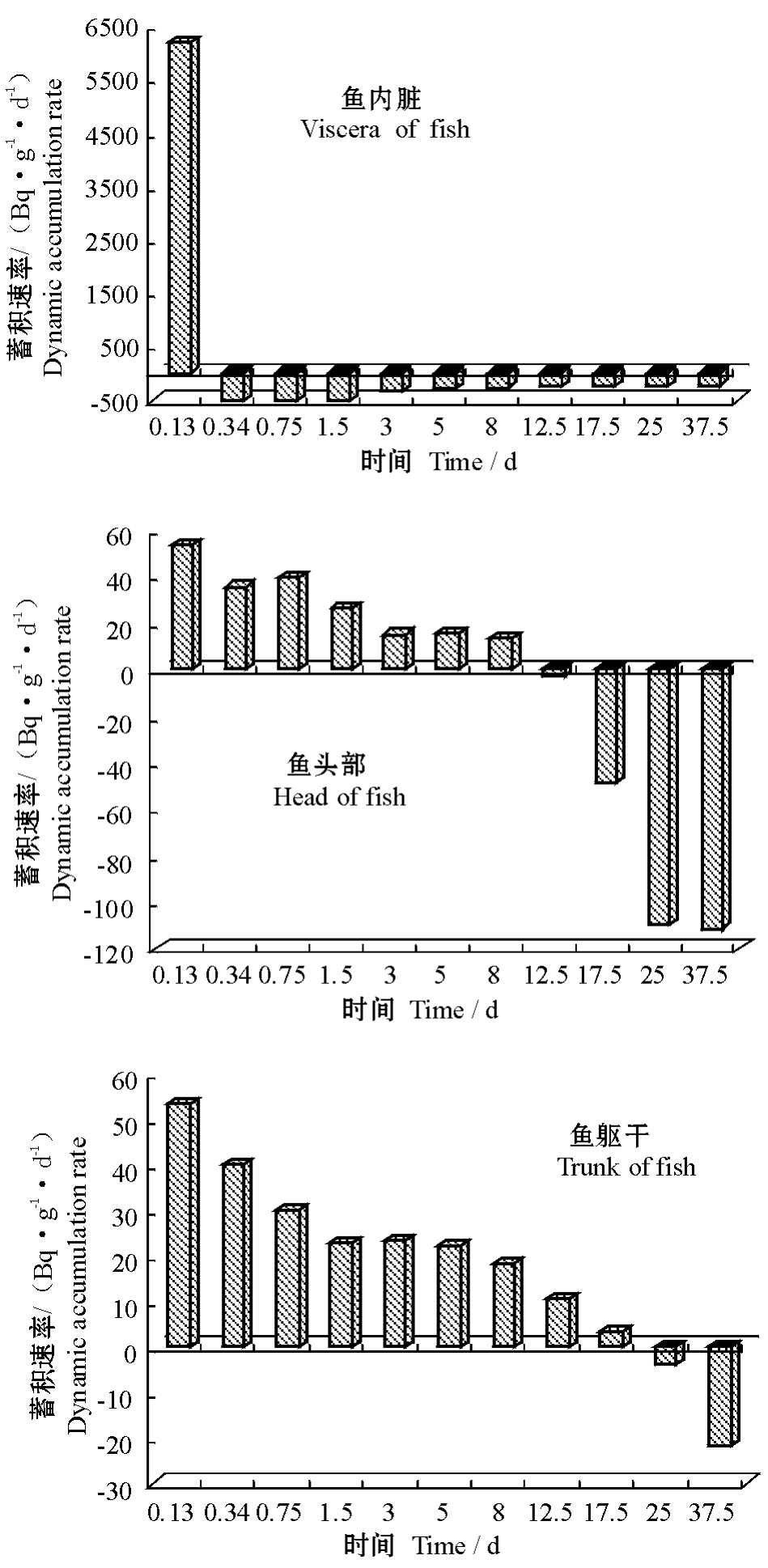
图3 甲磺隆在鱼内脏、头部、躯干中蓄积速率的变化
Fig.3 Dynamic accumulation rates of metsulfuron residues in viscera,head,and trunk of the fish
甲磺隆可在尼罗罗非鱼体内形成生物蓄积,其在鱼体内的分布是不均匀的。尼罗罗非鱼内脏对甲磺隆的蓄积量较高,可作为甲磺隆除草剂污染的生物指示器官。虽然尼罗罗非鱼肌肉中的放射性比活度是鱼体各部分中最低的,但其对甲磺隆残留物的蓄积量却是最高的。
对甲磺隆在尼罗罗非鱼体内蓄积过程的分析结果表明,鱼体不同组织器官对甲磺隆的蓄积存在一定差异。尼罗罗非鱼内脏可在极短时间内对甲磺隆表现为以代谢排出为主,但鱼头部和躯干部对甲磺隆残留物均先表现为以吸收积累为主,再转化为以代谢排出为主,而鱼躯干部对甲磺隆的蓄积能力则更强。
参考文献:
[1] Gevao B,Semple K T,Jones K C.Bound pesticide residues in soils:a review[J].Environmental Pollution,2000,108:3-14.
[2] Zanini G P,Maneiro C,Waiman C,et al.Adsorption of metsulfuron -methyl on soils under no-till system in semiarid Pampean Region,Argentina[J].Geoderma,2009,149:110-115.
[3] Hemmamda S,Calmon M,Calmon J P.Kinetics and hydrolysis mechanism of chlorsulfuron and metsulfuron-methyl[J].Pesticide Science,1994,40:71-76.
[4] 汪海珍,徐建民,谢正苗,等.土壤环境中除草剂甲磺隆降解的研究:I.土壤性质的影响应用[J].应用生态学报,2003,14 (1):79-84.
[5] Caselli M.Light-induced degradation of metsulfuron-methyl in water[J].Chemosphere,2005,59:1137-1143.
[6] 潘慧云,李小路,徐小花,等.甲磺隆对沉水植物伊乐藻的生理生态效应研究[J].环境科学,2008,29(7):1844-1848.
[7] Ye Q F,Sun J H,Wu J M.Causes of phytotoxicity of metsulfuronmethyl bound residues in soil[J].Environmental Pollution,2003, 126:417-423.
[8] Sondhia S.Leaching behaviour of metsulfuron in two texturally different soils[J].Environmental Monitoring and Assessment,2009, 154:111-115.
[9] Wendt-Rasch L,Pirzadeh P,Woin P.Effects of metsulfuron methyl and cypermethrin exposure on freshwater model ecosystems[J].A-quatic Toxicology,2003,63:243-256.
[10] Cedergreen N,Streibig J C,Spliid N H.Sensitivity of aquatic plants to the herbicide metsulfuron-methyl[J].Ecotoxicology and Environmental Safety,2004,57:153-161.
[11] Miron D S,Crestani M,Shettinger M R,et al.Effects of the herbicides clomazone,quinclorac,and metsulfuron methyl on acetylcholinesterase activity in the silver catfish(Rhamdia quelen)(Heptapteridae)[J].Ecotoxicology and Environmental Safety,2005, 61:398-403.
[12] Gray J S.Biomagnification in marine systems:the perspective of an ecologist[J].Marine Pollution Bulletin,2002,45:46-52.
[13] Randall D W,Connell D S,Yang R,et al.Concentration of persistent lipophilic compounds are determined by exchange across the gills and not through the food chain[J].Chemosphere,1998,37: 1263-1280.
[14] Cazenave J,Wunderlin D A,Bistoni M A,et al.Uptake,tissue distribution and accumulation of microcystin-RR in Corydoras paleatus,Jenynsia multidentata and Odontesthes bonariensis:A field and laboratory study[J].Aquatic Toxicology,2005,75:178-190.
[15] Edginton A N,Rouleau C.Toxicokinetics of14C-Atrazine and its metabolites in stage-66 Xenopus laevis[J].Environmental Science and Technology,2005,39:8083-8089.
[16] Clark K E,Gobas F A P C,Mackay D.Model of organic chemical uptake and clearance by fish from food and water[J].Environmental Science and Technology,1990,24:1203-1213.
Accumulation of metsulfuron-methyl residues in Nile tilapia Oreochromis niloticus
XING Dian-lou,WANG Hua,WANG Li,WANG Wei,LEI Yan-zhi
(School of Life Science and Technology,Dalian Ocean University,Dalian 116023,China)
Abstract:Accumulation of metsulfuron-methyl residues in Nile tilapia Oreochromis niloticus was studied under simulated pond conditions by14C isotopic tracer technique.The quantity of metsulfuron-methyl residues were found different in the fish tissues.Compared with other tissues of fish,the maximal amount of accumulated metsulfuronmethyl was observed in the flesh,even though the minimal concentration of metsulfuron-methyl residues in the same tissue.The dynamic of metsulfuron-methyl residues in the fish tissues demonstrated that the duration for reaching the balance between the accumulation and elimination was found different.The less required duration was found in the fish viscera and more required duration in the truck for the balance.The tendency of metsulfuronmethyl residues in fish viscera was expressed as elimination,whereas the fish head and truck showed accumulation at the initial stages of the experiment,and then it gradually changed to elimination.
Key words:C14-metsulfuron-methyl;Nile tilapia;accumulation
文章编号:2095-1388(2011)01-0012-05
中图分类号:X174
文献标志码:A
收稿日期:2010-05-05
基金项目:辽宁省教育厅高等学校科研计划项目(2009A175)
作者简介:邢殿楼(1953-),男,高级实验师。E-mail:xingdianlou@dlou.edu.cn
通信作者:王华(1973-),男,博士,副教授。E-mail:wanghua@dlou.edu.cn