笼目海带Kjellmaniella crassifolia Miyabe是一种可食用、药用型经济藻类,广泛分布于日本北海道南部水域,因其含有高于普通海带3~4倍的岩藻多糖(Fucoidan)[1],被国内外学者广泛关注。目前,本研究团队已实现了笼目海带在大连海域的育种栽培。研究表明,笼目海带中除含有大量糖类外,还含有具有消炎、清除自由基、降血压等多种生物活性功能的酚类物质[2-3]。
褐藻多酚是褐藻藻体中特有的次级代谢产物。由于水生生物与陆生生物有着不同的生物习性和结构,可能有不同的代谢产物,故褐藻类多酚有着比陆生生物多酚更高的抗氧化活性[4]。多酚结构复杂[5-6],对其分离纯化难度较大,目前,对多酚分离纯化的研究主要目的是得到活性高的粗多酚提取物、简单的粗多酚组分,或是证明该多酚化合物中含有某种已知的简单结构酚类物质,尚未见明确表明多酚化合物具体成分组成及结构的研究。分离纯化多酚的方法包括有机溶剂萃取法、大孔树脂吸附法、色谱柱层析法(HPLC)、凝胶柱层析法、膜技术法和高速逆流色谱制备技术(HSCCC)[7],其中,大孔树脂吸附分离纯化应用较为普遍。Buran等[8]研究发现,通过FPX 66大孔树脂吸附蓝莓多酚,能有效地去除多糖成分,实现多酚的有效纯化。也有学者研究了大孔树脂对羊栖菜Sargassum fusiforme[9]、海带Laminaria japomica Aresch[10]、巨藻Macrocystis pyrifera[11]等褐藻多酚吸附解吸的影响,结果表明,大孔树脂分离纯化褐藻多酚的效果存在差异,目前并未发现一种万能的大孔树脂对不同种类多酚均有较强的纯化作用。
笼目海带作为中国一种新型的褐藻资源,目前对其多酚的分离纯化研究还鲜有报道。本研究中,以大连海域栽培的笼目海带为研究对象,利用乙醇提取粗多酚,通过不同大孔树脂分离纯化笼目海带多酚,对其分离纯化工艺进行优化,并通过考察其对DPPH自由基与羟基自由基的清除能力、总抗氧化能力,以及氧化自由基吸收能力,对粗多酚及分离纯化各组分的抗氧化活性进行研究,以期为笼目海带多酚的开发利用提供科学依据。
1 材料与方法
1.1 材料
笼目海带于2018年7月收获于大连旅顺柏岚子海域,晒干后带回辽宁省水产品加工及综合利用重点实验室备用。
试剂:大孔树脂ADS-7(强极性)、ADS-8(非极性)、ADS-21(极性)、D101(弱极性)、AB-8(弱极性)、NKA-9(极性)均为天津南开和成公司产品;HP-20(非极性)(日本三菱公司)、XDA-1(非极性)均为西安蓝晓科技新材料股份有限公司产品;没食子酸(天津市光复精细化工研究所)(纯度99.0%)、福林酚(北京市索莱宝科技有限公司)、1,1-二苯基-2-苦基肼自由基(DPPH)、水溶性维生素E(Trolox)(东京化成工业株式会社)、三吡啶三吖嗪(TPTZ)(梯希爱(上海)化成工业发展有限公司(TCI))、荧光素钠、2,2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)(北京百灵威科技有限公司)。所用各种试剂及药品均为分析纯。
仪器:SynergyH1酶标仪(美国博腾仪器有限公司);SHZ-B水浴恒温振荡器(上海龙跃仪器设备有限公司);RE52CS旋转蒸发器(上海亚荣生化仪器厂);BT100-2J恒流泵(保定兰格恒流泵有限公司);SBS-160数控计滴自动部分收集器(上海沪西分析仪器有限责任公司)。
1.2 方法
1.2.1 笼目海带前处理 将笼目海带淡干品表面的沙子、贻贝及甘露醇等物质刷去,在60 ℃下恒温烘干,用高速粉碎机粉碎,粉末置于密封袋中,干燥避光保存备用。经测定,该笼目海带的岩藻聚糖硫酸酯含量为4%,其中,硫酸基团含量为25.14%,多糖含量为63.33%。
1.2.2 笼目海带多酚提取 根据实验室前期研究确定笼目海带多酚的提取工艺条件为:取16 g笼目海带粉,以1∶50(g∶mL)的料液比加入60%(体积分数,下同)的乙醇,在75 ℃条件下提取70 min,离心取上清液,沉淀以相同条件重复提取2次,合并上清液,旋转蒸发除去乙醇溶液后冷冻干燥得到粗多酚,真空密封避光保存备用。
1.2.3 大孔树脂活化与再利用 使用前将8种大孔树脂分别在密封条件下用无水乙醇浸泡24 h,使树脂充分溶胀,然后用蒸馏水洗至无乙醇气味且上清液澄清,再用体积分数为5%的稀盐酸浸泡12 h,用蒸馏水洗至中性,再用质量浓度为50 g/L的氢氧化钠溶液浸泡12 h,用蒸馏水洗至中性备用。
1.2.4 分离笼目海带多酚大孔树脂类型的确定
1) pH对大孔树脂静态吸附的影响。将预处理好的8种大孔树脂分别抽滤,称取5 g树脂于锥形瓶中,分别加入pH为3、4、5、6、7、8的一定质量浓度(C0)的多酚样液50 mL,于25 ℃恒温振荡器中震荡24 h,充分吸附后,抽滤取上层清液测定多酚质量浓度(C1)。吸附率计算公式为
吸附率![]()
(1)
其中: C0为吸附前样液中多酚质量浓度(mg/mL);C1为吸附后上层清液中多酚质量浓度(mg/mL)。
2) 乙醇对大孔树脂静态解吸的影响。将预处理好的8种大孔树脂分别抽滤,称取5 g树脂于锥形瓶中,加入50 mL一定质量浓度(C0)的多酚样液,于25 ℃恒温振荡器中震荡24 h,充分吸附后,取上层清液测定多酚质量浓度(C1)。取吸附饱和的树脂分别加入体积分数为30%、40%、50%、60%、70%、80%、90%、100%的乙醇溶液50 mL,于25 ℃恒温振荡器中震荡24 h,抽滤取上层清液,测定多酚质量浓度(C2)。解吸率和纯度计算公式为
解吸率![]()
(2)
纯度![]()
(3)
其中: C0为吸附前样液中多酚质量浓度(mg/mL);C1为吸附后上层清液中多酚质量浓度(mg/mL);C2为解吸后上层清液中多酚质量浓度(mg/mL)。
3)不同树脂对多酚静态吸附性能比较。分别称取预处理后的大孔树脂5 g,在其最适浓度的吸附(pH)、解吸(乙醇体积分数)条件下按式(1)和式 (2),计算各种大孔树脂的吸附率、解吸率及纯度。
1.2.5 XDA-1树脂的动态洗脱
1) 进样质量浓度及进样体积。将一定量预处理的XDA-1型大孔树脂湿法装入直径为2.6 cm×30 cm的玻璃柱中(上柱高度为20 cm),蒸馏水平衡12 h,以1 mL/min恒定的进样速度分别将不同进样质量浓度(15、30、45 mg/mL)的粗多酚样液(pH 6.5)过柱子,每5 mL收集一管,测定流出液中的多酚质量浓度。比较不同质量浓度的样液对该树脂吸附多酚能力的影响,根据泄漏曲线确定进样体积和进样质量浓度。
2) 进样流速。XDA-1型大孔树脂装柱填充方法同上。以不同流速(0.5、1.0、2.0 mL/min)将30 mg/mL的粗多酚样液(pH 3)持续进样,每5 mL收集一管,测定流出液中的多酚含量,比较不同进样流速对吸附的影响,并确定最佳进样流速。
3) 样液pH。XDA-1型大孔树脂装柱填充方法同上。以1 mL/min恒定的进样速度将不同pH(3.0、3.5、4.0)的15 mg/mL粗多酚样液持续进样,每5 mL收集一管,测定流出液中的多酚含量,比较不同进样pH对吸附的影响,并确定最佳样液pH。
4) 洗脱体积及洗脱液体积分数。XDA-1型大孔树脂装柱填充方法同上。进样液100 mL(15 mg/mL粗多酚样液、pH为3),以1 mL/min的流速冲一个柱体积的蒸馏水,使多酚样液完全吸附。以不同体积分数(60%、70%、80%)的乙醇洗脱,并确定最佳乙醇洗脱液体积分数及洗脱体积。
1.2.6 笼目海带多酚的抗氧化活性
1)笼目海带多酚对DPPH自由基的清除能力。根据Tohidi等[12]和Chen等[13]试验方案稍做修改。在96孔酶标板中,分别加入不同浓度的VC、粗多酚及纯化后的多酚样液40 μL,再加入160 μL 0.1 mmol/L DPPH醇溶液,于25 ℃下避光反应30 min后在517 nm波长下测定其吸光度,以VC为阳性对照并做空白试验和平行对照,计算各样液对DPPH自由基的清除率,计算公式为
DPPH清除率![]()
(4)
其中: A0为DPPH与水溶剂混合后的吸光度;A1为样液与DPPH混合后的吸光度;A2为样液与乙醇溶液混合后的吸光度。
2) 笼目海带多酚对羟基自由基的清除能力。将笼目海带粗多酚、分离纯化组分P1、P2配制成适宜浓度的水溶液,如有沉淀可以8 000 r/min离心5 min取上清液。向试管中分别加入0.5 mL 9 mmol/L的水杨酸醇溶液、0.5 mL 9 mmol/L的FeSO4溶液、0.5 mL样液及0.5 mL 8.8 mmol/L 的H2O2溶液,于37 ℃下恒温浴15 min,测定其在510 nm波长处的吸光度,计算各样液对·OH自由基的清除率,计算公式为
·OH清除率![]()
(5)
其中: A0为不加样液的吸光度;A1为加入样液的吸光度;A2为不加H2O2的吸光度。
3) 笼目海带多酚的铁离子还原力 (FRAP)。在96孔酶标板中分别加入5 μL不同浓度(0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mmol/L)的FeSO4溶液和150 μL三吡啶三吖嗪TPTZ工作液(TPTZ工作液现用现配),以蒸馏水作为空白对照,37 ℃条件下温育40 min,测定其593 nm处的吸光度,以FeSO4浓度为横坐标,其在593 nm处的吸光度为纵坐标绘制标准曲线,得到曲线方程y=0.405 1x - 0.001 4(R2=0.996 8)。将样品溶液代替FeSO4溶液进行上述操作,样品的抗氧化活性(FRAP值)以达到相同吸光度所需的FeSO4量(mmol)表示。
4) 氧自由基吸收能力(ORAC)。依次在96孔酶标板中加入25 μL的各多酚样液,再加入150 μL 荧光素钠盐溶液,标准曲线分别以浓度为6.25、12.5、25、50、100 μmol/L的水溶性维生素E(Trolox)绘制。空白组用75 mmol/L磷酸缓冲液代替。酶标仪中37 ℃下温育10 min,立即加入25 μL的AAPH溶液,在激发波长485 nm、发射波长538 nm条件下进行持续检测,测定时间为3 h。初始的荧光强度记为F0,之后每2 min检测一次,记为F1,F2,F3,…,Fn。相对荧光强度为各时间点绝对荧光强度F与初始绝对荧光强度之比,记为f0,f1,f2,…,fn。以Trolox浓度为横坐标,保护面积NetAUC为纵坐标绘制标准曲线[14],得到标准曲线方程为y=0.367 5x-1.639 6 (R2=0.977 36)。将样品物质在自由基作用下的荧光衰退曲线的保护面积NetAUC带入标准曲线方程得到与各个样品组分多酚的氧自由基吸收能力等价的Trolox浓度,最后ORAC值以μmol Trolox/g多酚干质量表示。计算公式为
AUC=2×(f0+f1+…+fn-1+fn)-f0-fn,
(6)
保护面积NetAUC=AUC抗氧化剂-AUC+AAPH。
(7)
1.2.7 笼目海带多酚含量的测定 采用Flion-Ciocalteu法[15]测定总多酚的含量,并做部分修改。取200 μL反应液于96孔板中,在760 nm处测定其吸光度值,得到没食子酸标准曲线方程为Y=0.042 2+0.054 2X (R2=0.999 6),以没食子酸(GA)标准曲线计算相应的总酚含量(mg GA/g样品提取物干质量)。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示,采用SPSS 17.0软件对数据进行单因素方差分析,采用Duncan法进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 大孔树脂的筛选
从图1可见,ADS-7、ADS-21型大孔树脂吸附的最适pH为4,其他大孔树脂的最适吸附pH均为3,该结果表明,氢离子在一定程度上促进了多酚在大孔树脂上的吸附。这可能是多酚呈弱酸性,在酸性条件下多以分子形式存在,而在碱性环境中发生电离以离子形式存在,不易被吸附。但酸性过强(pH<3)时,多酚纯化液颜色明显呈现出不同的绿色,考虑到对样品的保护及试验安全性,不宜采用强酸条件进行试验。
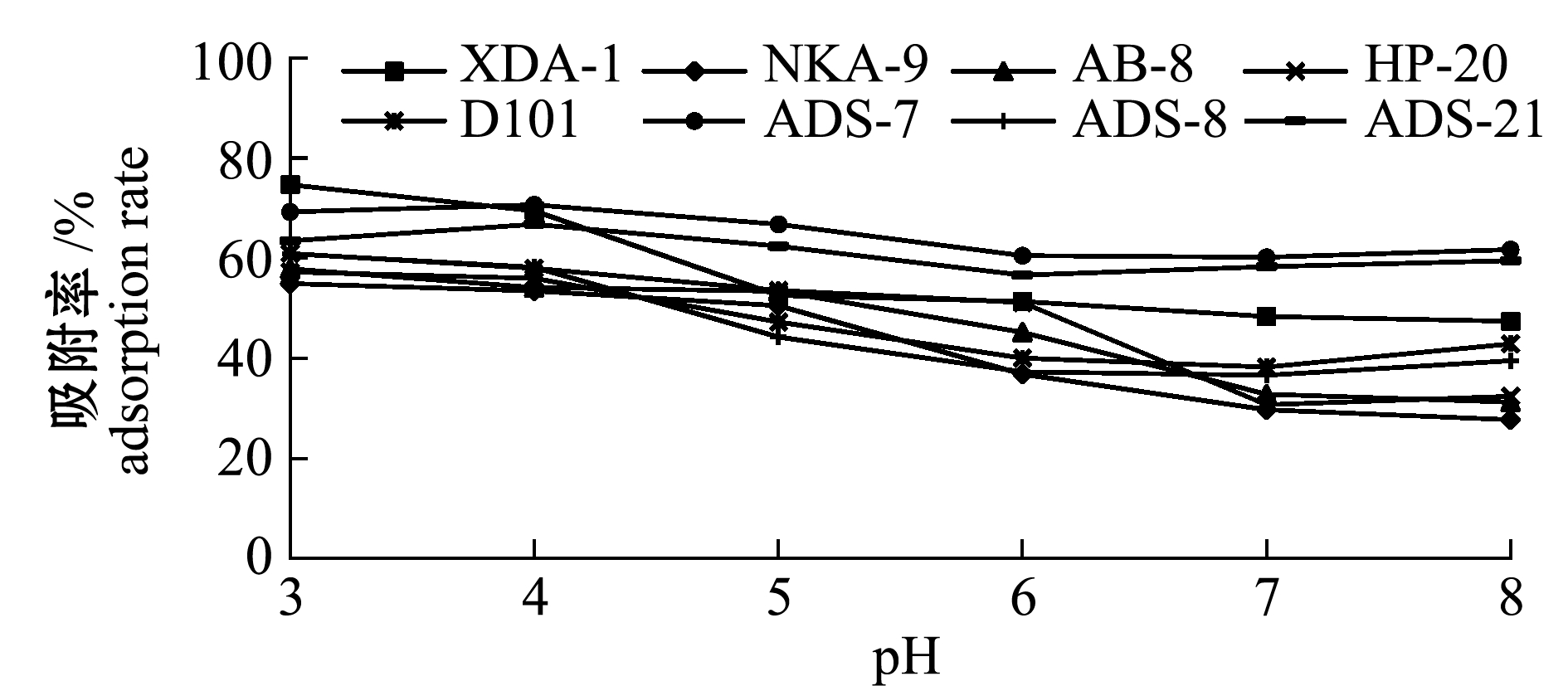
图1 pH对不同大孔树脂吸附率的影响
Fig.1 Effects of pH on adsorption rate of differentmacroporous absorbent resins
从图2可见,随着乙醇体积分数的增加,各种大孔树脂的解吸率均呈现先上升后下降的趋势,但各种大孔树脂的最适乙醇洗脱体积分数有所不同,其中D101最适的乙醇洗脱体积分数为60%,ADS-7为90%,其余树脂最适的乙醇洗脱体积分数均为70%。
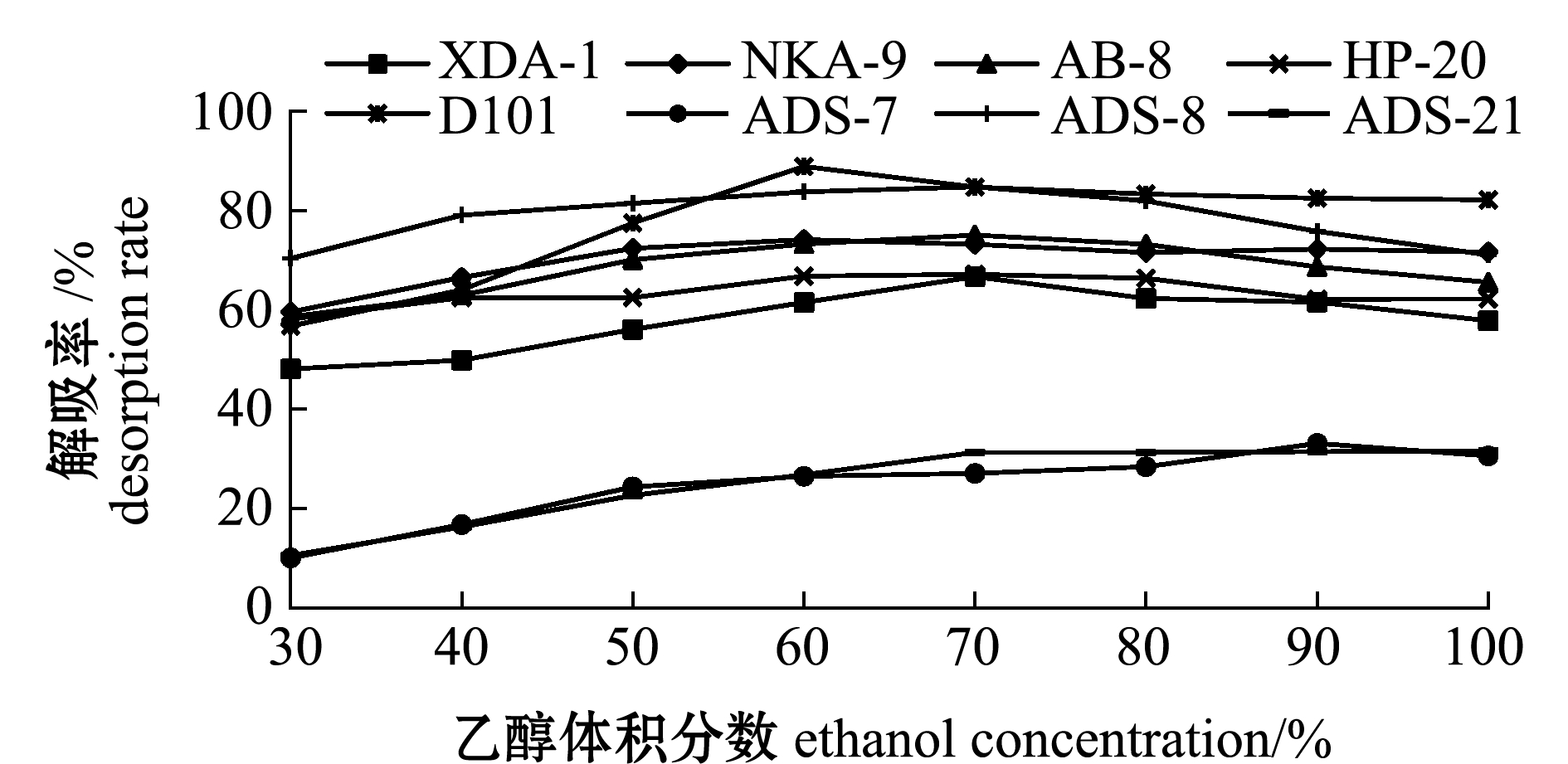
图2 乙醇对不同大孔树脂解吸率的影响
Fig.2 Effects of ethanol on desorption rate of different macroporous absorbent resins
在上述各种大孔树脂最适样液pH和乙醇洗脱条件下,进行静态吸附试验。从图3可见:各种大孔树脂对笼目海带多酚均具有较好的吸附性能;XDA-1型大孔树脂的吸附率最高(平均为73.38%), 与其他大孔树脂存在显著性差异(P<0.05),ADS-7的吸附率次之(平均为72.44%),再次为ADS-21(平均为63.67%)、ADS-8(平均为62.55%)。综合考虑吸附率、解吸率及纯度,后期选择XDA-1型大孔树脂对笼目海带多酚进行动态吸附试验。
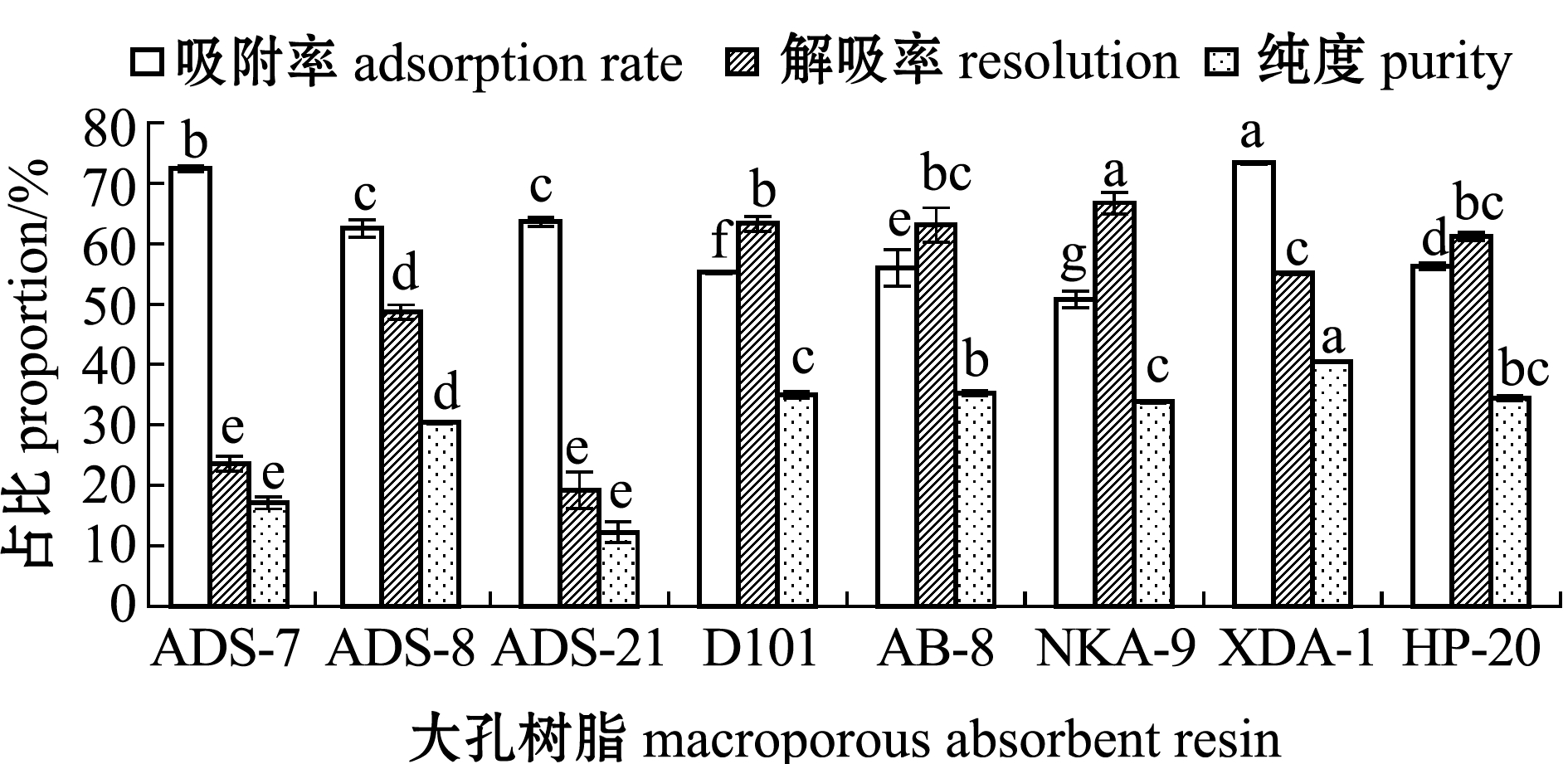
同一指标中,标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P<0.05)。 The means with different letters within the same index are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same index are not significant differences.
图3 不同大孔树脂最适条件下对笼目海带多酚静态吸附性能的比较
Fig.3 Absorbed ability of different macroporous absorbent resins under optimum conditions
2.2 XDA-1型树脂分离条件优化
2.2.1 进样流速的确定 从图4可见,进样流速小时,有利于其吸附,较慢流速使多酚在层析柱中停留时间较长,能够让树脂与多酚充分接触。总的来看,进样流速对大孔树脂吸附率影响较小,考虑到实际分离纯化的效率和对分离柱的稳定性,本试验中选择1.0 mL/min的流速进样。
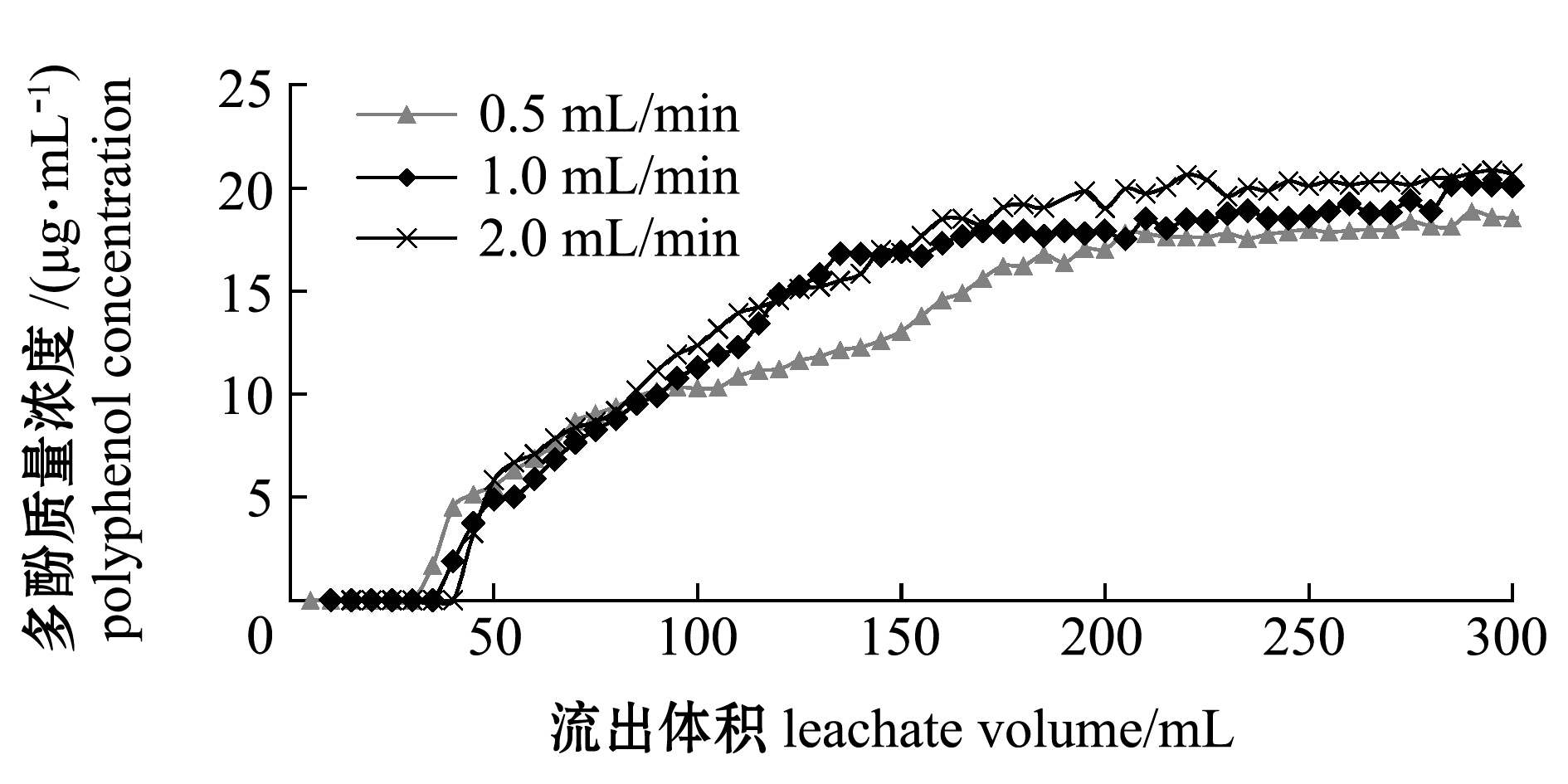
图4 不同进样流速多酚在XDA-1树脂上的泄漏曲线
Fig.4 Leakage curve of polyphenols in different rates on XDA-1 resin
2.2.2 进样质量浓度及进样体积的确定 从图5A和表1可见:当进样体积达到45 mL时,多酚开始出现泄露,当进样液质量浓度为15 mg/mL时,其流出液体积为100 mL时达到吸附动态平衡,平衡时吸附率与对其他质量浓度样液的吸附率存在显著性差异(P<0.05),其吸附率平均为71.21%;当进样液质量浓度为30、45 mg/mL时,泄漏点也为45 mL,但在130~150 mL时达到动态平衡,平均吸附率分别为53.59%和38.49%。因此,选择进样液质量浓度为15 mg/mL时效果最佳。本研究中考虑到实际生产分离的效率,未选取泄漏点时的体积为进样体积,而是选取进样量达到动态吸附平衡时的体积为进样体积,即为100 mL。
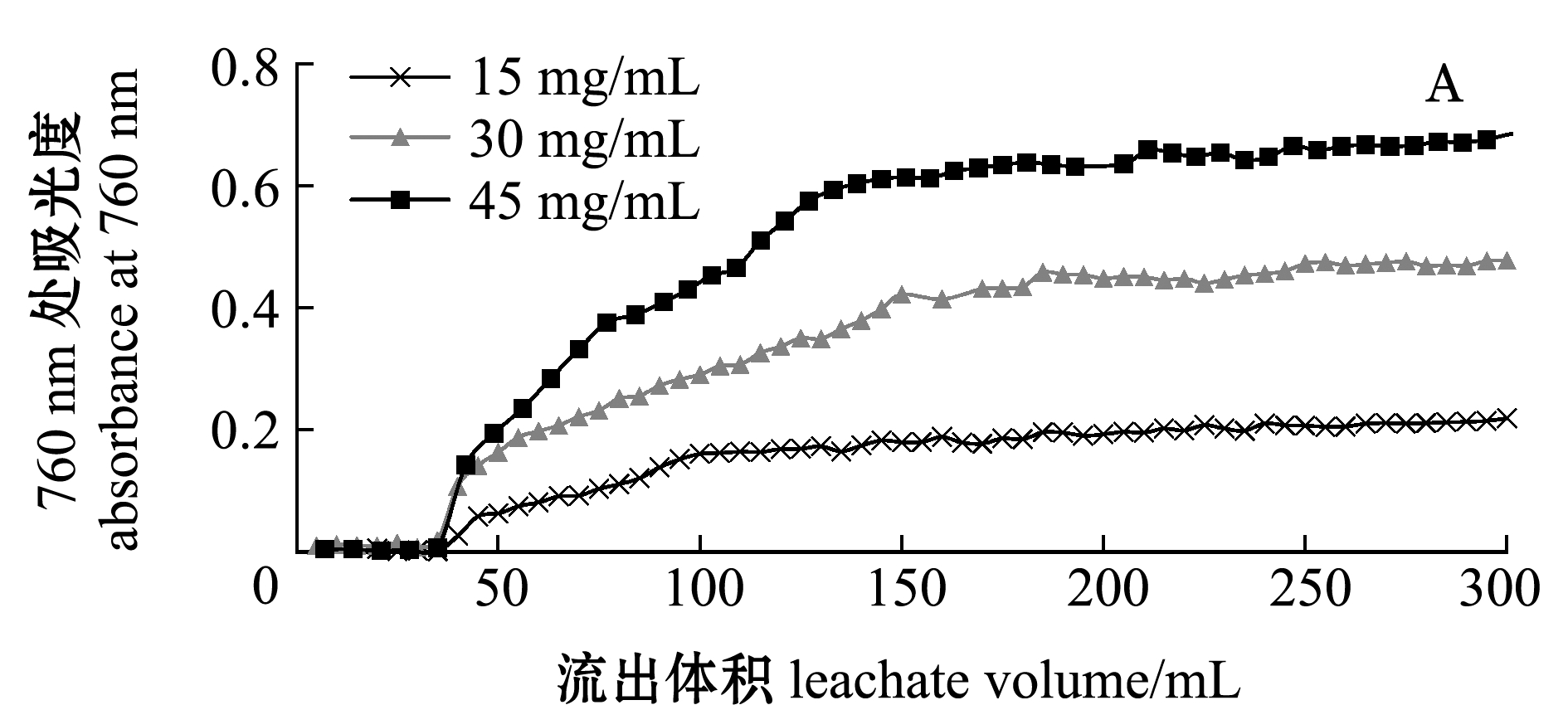
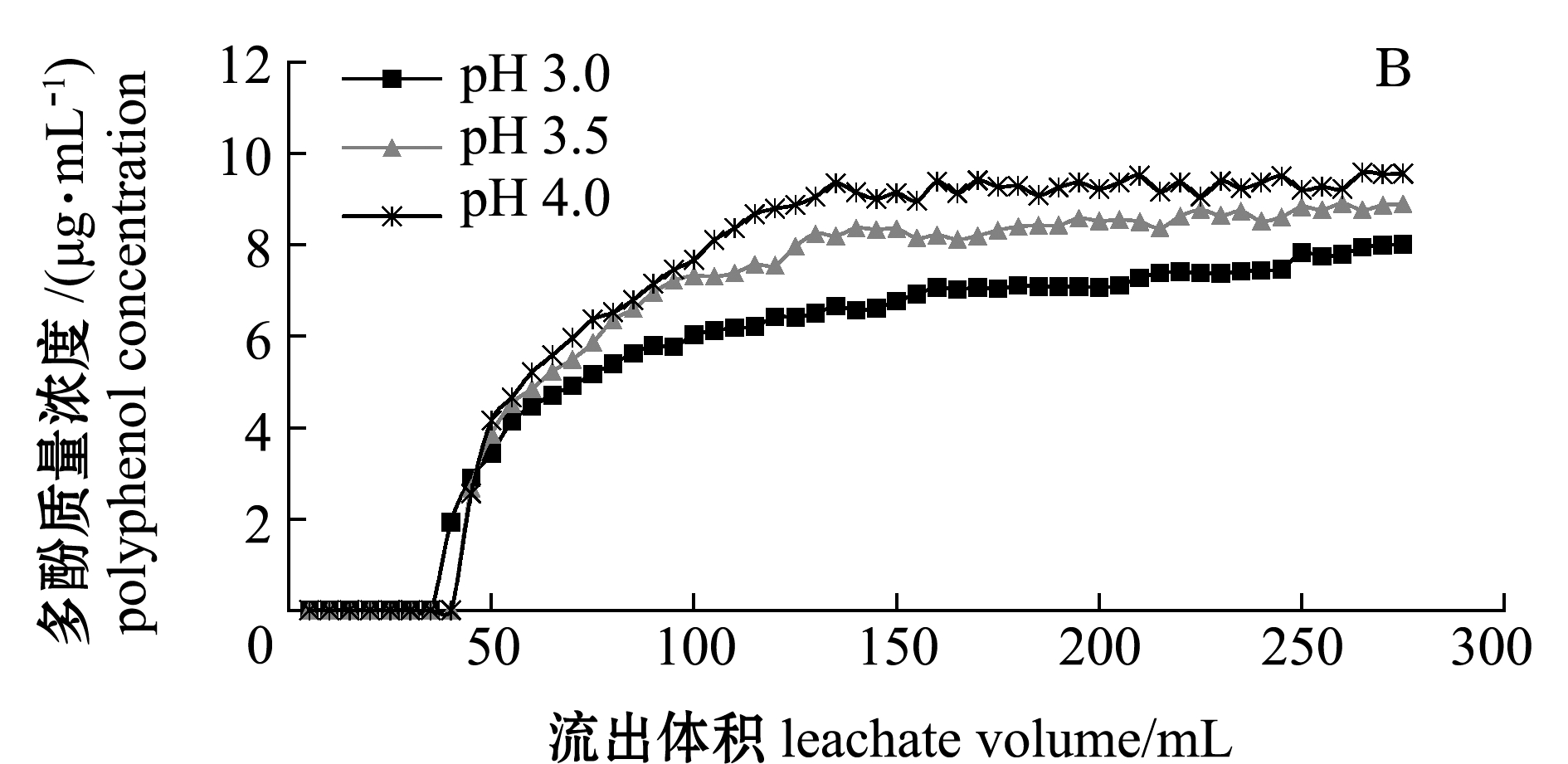
图5 不同进样质量浓度、pH下笼目海带多酚的泄露曲线
Fig.5 Leakage curve of polyphenols of brown alga Kjellmaniella crassifolia Miyabe in different concentrations of sample injection and pH
表1 不同进样质量浓度、pH下笼目海带多酚的吸附率
Tab.1 Adesorption rate of polyphenols in brown alga Kjellmaniella crassifolia Miyabe in different concentrations of sample injection and pH
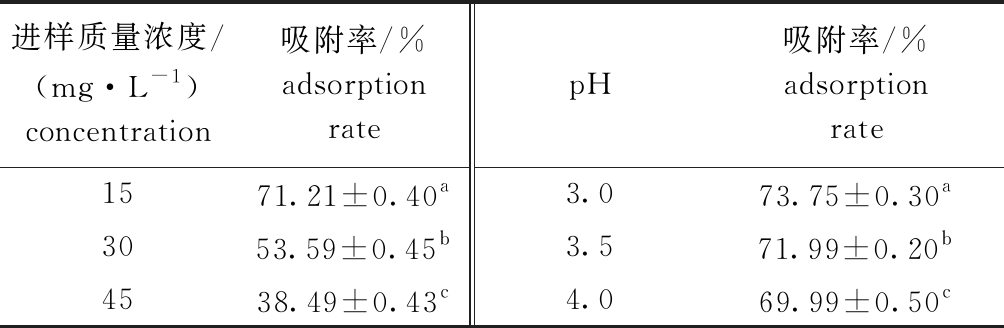
进样质量浓度/(mg·L-1) concentration吸附率/%adsorption ratepH吸附率/%adsorption rate1571.21±0.40a3.073.75±0.30a3053.59±0.45b3.571.99±0.20b4538.49±0.43c4.069.99±0.50c
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia.
2.2.3 进样液pH的确定 从图5B和表1可见:进样液的pH在3.0~4.0范围时,随着pH的增大,多酚的吸附率逐渐降低,可能是由于多酚大量的羟基呈弱酸性,在酸性条件下更容易被树脂吸附;当pH为3.0时多酚的吸附率与pH为3.5和4.0时存在显著性差异(P<0.05),考虑到分离的得率,选择pH为3时样品进样最佳,此时的吸附率最高,为73.75%。
2.2.4 洗脱体积及乙醇体积分数的确定 由静态解吸试验可知,70%的乙醇解吸的多酚含量最高,因此,本试验中选取60%、70%、80%的乙醇解吸XDA-1树脂,不同体积分数乙醇对笼目海带多酚的洗脱曲线如图6所示,从整体上看,洗脱75 mL时出峰,洗脱液达到115 mL时第一个峰(P1)洗脱完毕,洗脱液达到200 mL时第二个峰(P2)洗脱完毕,之后无明显峰。由此,确定洗脱体积为200 mL(即2 BV)。洗脱曲线与x轴围成的面积即为洗脱面积,其大小可表示洗脱量,因此,比较60%、70%、80%乙醇的洗脱曲线面积,可知60%乙醇洗脱出的两个峰面积较小,即多酚含量相对较低,70%乙醇洗脱P1峰形尖锐,且峰面积较大,P2组分峰形与80%乙醇洗脱曲线面积相当,综合考虑选取体积分数较低的70%乙醇为洗脱剂较佳。
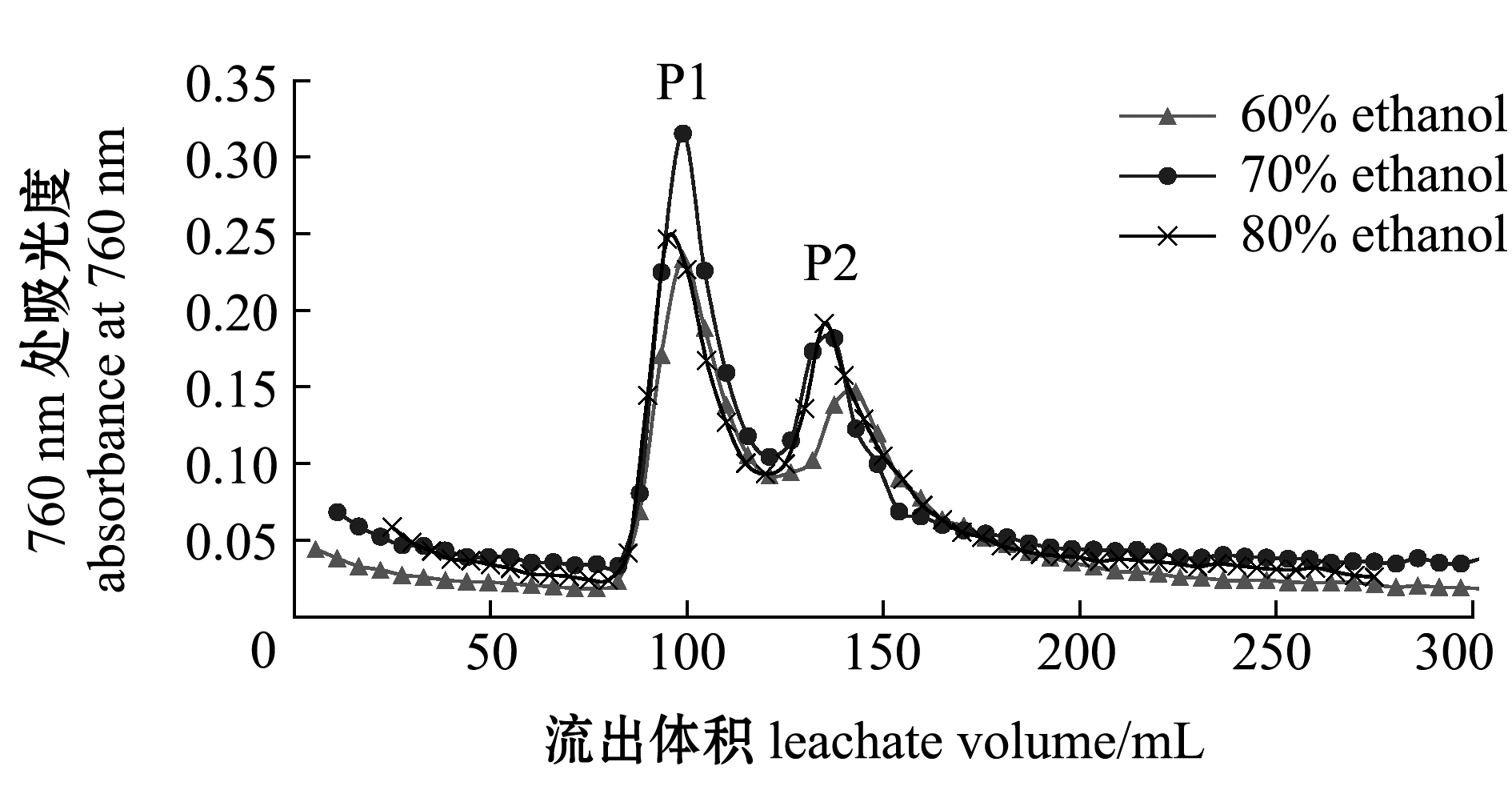
图6 不同体积分数乙醇的洗脱曲线
Fig.6 Elution curve of different concentrations of ethanol
2.2.5 笼目海带多酚含量 本研究中,最终确定XDA-1型大孔树脂为笼目海带多酚最佳洗脱树脂,其最适洗脱条件为pH为3的15 mg/mL样液以1 mL/min的流速进样100 mL,70%乙醇洗脱200 mL(2 BV)。在此条件下,经XDA-1型大孔树脂分离纯化得到组分P1、P2,其多酚含量分别为(44.62±6.61)、(10.45±0.02)mg GA/g,而笼目海带未纯化的粗多酚含量仅为(2.84±0.15) mg GA/g。经大孔树脂分离纯化后其多酚含量有显著提高(P<0.05)。
2.3 笼目海带多酚的体外抗氧化活性
笼目海带粗多酚及其分离纯化的各组分均有一定的抗氧化活性,笼目海带多酚对DPPH自由基的清除能力不如抗氧化剂VC;多酚各组分之间相比,粗多酚与P2组分无显著性差异(P>0.05),但二者均与P1组分有显著性差异(P<0.05),其中,P1组分清除DPPH自由基的IC50比粗多酚低23.5%(表2)。
笼目海带多酚对羟自由基的清除能力明显优于VC;笼目海带粗多酚清除羟自由基的IC50为(148.77±5.26)μg/mL,XDA-1型大孔树脂分离纯化的P1与P2组分的IC50与VC组分间存在显著性差异(P<0.05)(表2)。
笼目海带粗多酚、P1、P2组分和VC在铁离子还原力FRAP测定中均显示出一定的抗氧化活性,纯化后的P2多酚组分比粗多酚的抗氧化活性有显著性提高(P<0.05);P2组分的FRAP值为(16.43±0.89)mmol FeSO4/g,P1组分的铁离子还原力与VC相当(P>0.05)(表2)。
笼目海带粗多酚的氧化自由基吸收能力ORAC与VC能力相当(P>0.05),分离纯化的P1、P2组分,其氧化自由基吸收能力与粗多酚存在显著性差异(P<0.05),其中P2组分的ORAC值为VC的35.6倍,显示出良好的抗氧化活性(表2)。
表2 笼目海带多酚的体外抗氧化活性
Tab.2 Antioxidant activities in vitro of polyphenols from brown alga Kjellmaniella crassifolia Miyabe
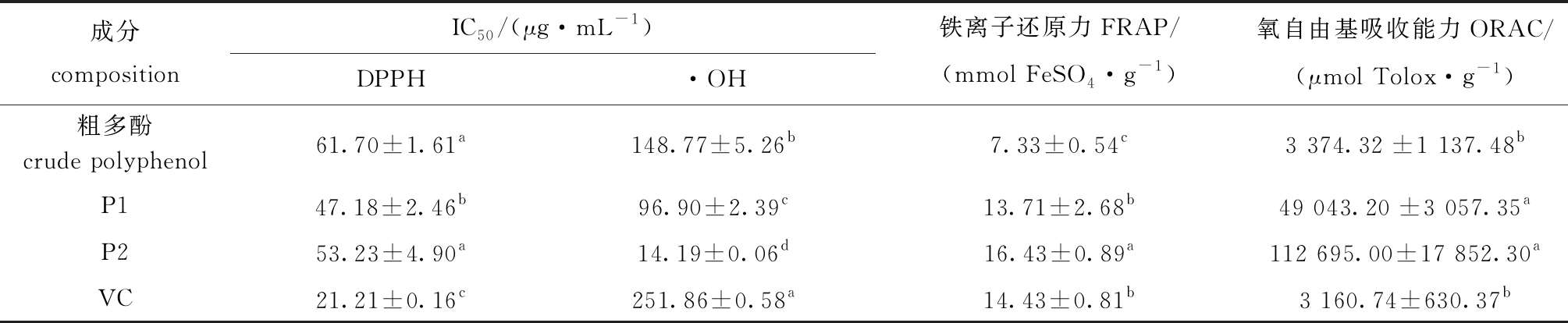
成分compositionIC50/(μg·mL-1)DPPH·OH铁离子还原力FRAP/(mmol FeSO4·g-1 )氧自由基吸收能力ORAC/(μmol Tolox·g-1 )粗多酚crude polyphenol61.70±1.61a148.77±5.26b7.33±0.54c3 374.32±1 137.48bP147.18±2.46b96.90±2.39c13.71±2.68b49 043.20±3 057.35aP253.23±4.90a14.19±0.06d16.43±0.89a112 695.00±17 852.30aVC21.21±0.16c251.86±0.58a14.43±0.81b3 160.74±630.37b
3 讨论
3.1 大孔树脂的分离纯化
本研究中,利用XDA-1树脂有效分离纯化了笼目海带多酚,在动态吸附过程中,综合考虑到较慢流速能使多酚在层析柱中停留较长时间,可与树脂充分接触[16],进样浓度低可减少杂质竞争性吸附和避免样品絮状悬浮或沉淀[17],进样体积少(泄漏点时为进样体积)会减少实际生产效率[18]等因素的影响,确定分离纯化条件,得到两个分离组分P1、P2,P1冻干粉为红棕色,P2为黄绿色。本研究中推测组分的差异可能与溶剂极性相关,这与Sun 等[19]的研究结果相似。当加入70%乙醇洗脱时,其体系中乙醇体积分数的逐渐增加,P1可能为低浓度醇洗脱组分,极性比P2组分大。
目前,研究报道的褐藻多酚组分通常为混合组分[20]。大孔树脂是分离纯化多酚类物质的常用手段,后期可将HPLC、HPLC-MS等技术应用于大孔树脂分离纯化多酚组分的分析,为进一步分析多酚结构提供帮助。童鑫等[21]通过HPLC技术将HPD-300大孔树脂分离纯化前后的米糠酚类提取物的总酚含量、已知各种酚单体含量及总黄酮类含量进行比对,结果显示,大孔树脂HPD-300对米糠酚类物质分离效果显著,但HPLC技术只能在确定是否含有及含有量上提供多酚相关数据变化,不能检测出多酚全部单体种类。Abolulla等[6]通过HPLC-QTOF-MS技术在不同碰撞能量(CE)值下以负电喷雾电离(ESI)模式定性分析了多酚化合物,在研究的石榴皮提取物中共检测出35种可水解单宁和15种类黄酮,并首次在石榴皮中鉴定出六羟基二苯甲酰基-戊烯酰基-葡糖苷(HHDP-戊烯酰基-葡萄糖苷)。因此,今后还需结合多种分析手段探索笼目海带多酚的结构,以明确其具体结构信息。
3.2 笼目海带多酚及各组分的抗氧化活性
Akowuah 等[22]研究了不同极性萃取剂提取的酚类物质对DPPH自由基清除能力的影响,研究发现,5种提取剂(水、50%甲醇、甲醇、70%丙酮和氯仿)提取肾茶Orthosiphon stamineus 多酚,其中,70%丙酮提取物表现出最高的DPPH自由基清除能力,检测丙酮提取物中含有较高的3′-羟基-5,6,7,4′-四甲氧基黄酮(3′-hydroxy-5,6,7,4′-tetramethoxyflavone, TMF),其次为甲醇提取物中有较高含量的迷迭香酸(rosmarinic acid, RA)。本研究中考虑到笼目海带中多糖对多酚提取的影响及提取产率等因素,选取了60%乙醇溶液提取多酚,推测可能与甲醇提取物相似。相比其他藻类多酚,笼目海带P1组分对DPPH自由基清除能力比龙须菜Gracilaria lemane Ubrmis粗酚[23]高20%。笼目海带多酚对羟自由基的清除能力明显优于VC,这与杨小青[24]的研究结果一致,有力地证明了在清除羟基自由基方面褐藻多酚有着较强的能力。本研究结果还发现,多酚含量高的P1组分,其清除羟基自由基的能力远不及P2组分,P1可能是由于低浓度醇洗脱组分,因此,其分子量大或极性较大,多酚聚合度较高,其空间构象影响了羟基活性,随着多酚聚合度的增加,其抗氧化能力减弱[25-26]。而极性较弱的P2对羟自由基的IC50仅为VC的5%,其可作为极具潜力的天然抗氧化剂。笼目海带粗多酚的ORAC值比Wang 等[27]测得的墨角藻、泡叶藻、北方海带等8种藻多酚的氧化自由基清除能力强,显示出良好的抗氧化活性。
4 结论
1)本研究中确定了XDA-1型大孔树脂为笼目海带多酚的最适纯化树脂,并通过大孔树脂动态分离得到P1、P2两个组分。
2)通过体外抗氧化试验发现,笼目海带多酚分离组分具有较强的抗氧化活性,其中,P2抗氧化活性显著优于多酚其他组分。
3)与其他褐藻相比,新品种笼目海带多酚抗氧化活性较高,具有一定的开发价值。分离纯化的笼目海带多酚可作为天然抗氧化剂应用于实际生产中。
[1] LIU S,WANG Q K,SONG Y F,et al.Studies on the hepatoprotective effect of fucoidans from brown algae Kjellmaniella crassifolia[J].Carbohydrate Polymers,2018,193:298-306.
[2] AMAROWICZ R,ESTRELLA I,HERN NDEZ T,et al.Free radical-scavenging capacity,antioxidant activity,and phenolic composition of green lentil (Lens culinaris)[J].Food Chemistry,2010,121(3):705-711.
NDEZ T,et al.Free radical-scavenging capacity,antioxidant activity,and phenolic composition of green lentil (Lens culinaris)[J].Food Chemistry,2010,121(3):705-711.
[3] TABART J,KEVERS C,PINCEMAIL J,et al.Comparative antioxidant capacities of phenolic compounds measured by various tests[J].Food Chemistry,2009,113(4):1226-1233.
[4] KANG K,PARK Y,HWANG H J,et al.Antioxidative properties of brown algae polyphenolics and their perspectives as chemopreventive agents against vascular risk factors[J].Archives of Pharmacal Research,2003,26(4):286-293.
[5] 王琪,唐惠儒.黑果枸杞和宁夏枸杞果实中多酚类物质组成的差异研究[J].上海交通大学学报(医学版),2019,39(1):39-46.
WANG Q,TANG H R.Composition differences of polyphenolic compounds in fruits of Lycium ruthenicum Murr. and Lycium barbarum L.[J].Journal of Shanghai Jiaotong University(Medical Science),2019,39(1):39-46.(in Chinese)
[6] ABDULLA R,MANSUR S,LAI H Z,et al.Qualitative analysis of polyphenols in macroporous resin pretreated pomegranate husk extract by HPLC-QTOF-MS[J].Phytochemical Analysis,2017,28(5):465-473.
[7] 张丽斌,熊何健,吴靖娜,等.褐藻多酚的生物活性及提取技术研究进展[J].福建水产,2013,35(6):480-484.
ZHANG L B,XIONG H J,WU J N,et al.Study on biological activity and extract technology of phlorotannins[J].Journal of Fujian Fisheries,2013,35(6):480-484.(in Chinese)
[8] BURAN T J,SANDHU A K,LI Z,et al.Adsorption/desorption characteristics and separation of anthocyanins and polyphenols from blueberries using macroporous adsorbent resins[J].Journal of Food Engineering,2014,128:167-173.
[9] 曾帅,周德庆,刘楠,等.几种因素对大孔树脂纯化羊栖菜多酚效果的影响[J].食品工业科技,2016,37(18):297-301.
ZENG S,ZHOU D Q,LIU N,et al.Factors affecting polyphenol purification of macroporous resin from Sargassum fusiforme[J].Science and Technology of Food Industry,2016,37(18):297-301.(in Chinese)
[10] 刘晓丽,吴克刚,柴向华,等.大孔树脂对海带多酚的吸附研究[J].食品研究与开发,2010,31(4):1-5.
LIU X L,WU K G,CHAI X H,et al.Adsorption of polyphenols from Laminaria japomica by macropous absorbent resins[J].Food Research and Development,2010,31(4):1-5.(in Chinese)
[11] LEYTON A,VERGARA-SALINAS J R,P REZ-CORREA J R,et al.Purification of phlorotannins from Macrocystis pyrifera using macroporous resins[J].Food Chemistry,2017,237:312-319.
REZ-CORREA J R,et al.Purification of phlorotannins from Macrocystis pyrifera using macroporous resins[J].Food Chemistry,2017,237:312-319.
[12] TOHIDI B,RAHIMMALEK M,ARZANI A.Essential oil composition,total phenolic,flavonoid contents,and antioxidant activity of Thymus species collected from different regions of Iran[J].Food Chemistry,2017,220:153-161.
[13] CHEN X M,TAIT A R,KITTS D D.Flavonoid composition of orange peel and its association with antioxidant and anti-inflammatory activities[J].Food Chemistry,2017,218:15-21.
[14] 常强,苏明华,陈清西,等.基于ORAC评价多酚类化合物抗氧化活性[J].亚热带植物科学,2016,45(3):225-229.
CHANG Q,SU M H,CHEN Q X,et al.The evaluation of antioxidant activity of polyphenol compounds using ORAC[J].Subtropical Plant Science,2016,45(3):225-229.(in Chinese)
[15] 康静,李萌,冯冲,等.海带多酚的分离提取及对小鼠抗氧化能力的影响[J].食品科技,2011,36(7):178-181,186.
KANG J,LI M,FENG C,et al.Isolation of phlorotannins from Laminaria japonica and antioxidative effects on mice[J].Food Science and Technology,2011,36(7):178-181,186.(in Chinese)
[16] CHEN Y,ZHANG W J,ZHAO T,et al.Adsorption properties of macroporous adsorbent resins for separation of anthocyanins from mulberry[J].Food Chemistry,2016,194:712-722.
[17] XI L S,MU T H,SUN H N.Preparative purification of polyphenols from sweet potato (Ipomoea batatas L.) leaves by AB-8 macroporous resins[J].Food Chemistry,2015,172:166-174.
[18] KONG Y,YAN M M,LIU W,et al.Preparative enrichment and separation of astragalosides from Radix Astragali extracts using macroporous resins[J].Journal of Separation Science,2010,33(15):2278-2286.
[19] SUN R,FU K,FU Y J,et al.Preparative separation and enrichment of four taxoids from Taxus chinensis needles extracts by macroporous resin column chromatography[J].Journal of Separation Science,2009,32(9):1284-1293.
[20] 陶莎,黄英,康玉凡,等.大孔吸附树脂分离纯化红小豆多酚工艺及效果[J].农业工程学报,2013,29(23):276-285.
TAO S,HUANG Y,KANG Y F,et al.Technology of separation and purification and its efficiency of adzuki bean polyphenols with macroporous adsorption resins[J].Transactions of the Chinese Society of Agricultural Engineering,2013,29(23):276-285.(in Chinese)
[21] 童鑫,张瑞芬,邓媛元,等.米糠酚类物质的大孔树脂分离纯化工艺[J].中国农业科学,2016,49(19):3818-3830.
TONG X,ZHANG R F,DENG Y Y,et al.Separation and purification of polyphenols in rice bran by macroporous resins[J].Scientia Agricultura Sinica,2016,49(19):3818-3830.(in Chinese)
[22] AKOWUAH G A,ISMAIL Z,NORHAYATI I,et al.The effects of different extraction solvents of varying polarities on polyphenols of Orthosiphon stamineus and evaluation of the free radical-scavenging activity[J].Food Chemistry,2005,93(2):311-317.
[23] 陈洪彬,杨敏,宋露露,等.龙须菜多酚提取工艺优化及其体外抗氧化活性[J].食品与机械,2017,33(4):139-143,194.
CHEN H B,YANG M,SONG L L,et al.Optimization on extraction of polyphenols and its antioxidant activity in vitro from Gracilaria lemaneiformis[J].Food & Machinery,2017,33(4):139-143,194.(in Chinese)
[24] 杨小青.半叶马尾藻褐藻多酚的分离纯化及抗氧化活性研究[D].湛江:广东医学院,2013.
YANG X Q.Purification and antioxidant activity of the Sargasso brown algae polyphenols[D].Zhanjiang:Guangdong Medical University,2013.(in Chinese)
[25] HERMUND D B,PLAZA M,TURNER C,et al.Structure dependent antioxidant capacity of phlorotannins from Icelandic Fucus vesiculosus by UHPLC-DAD-ECD-QTOFMS[J].Food Chemistry,2018,240:904-909.
[26] 杨玉莹,王倩,郝豪奇,等.海带多酚的提取分离纯化及其体外活性[J].生物加工过程,2018,16(6):52-56.
YANG Y Y,WANG Q,HAO H Q,et al.Separation and purification of Laminaria japonica polyphenols and its biological activity in vitro[J].Chinese Journal of Bioprocess Engineering,2018,16(6):52-56.(in Chinese)
[27] WANG T,J NSD
NSD TTIR R,
TTIR R, LAFSD
LAFSD TTIR G.Total phenolic compounds,radical scavenging and metal chelation of extracts from Icelandic seaweeds[J].Food Chemistry,2009,116(1):240-248.
TTIR G.Total phenolic compounds,radical scavenging and metal chelation of extracts from Icelandic seaweeds[J].Food Chemistry,2009,116(1):240-248.