欧洲舌齿鲈Dicentrarchus labrax, Linnaeus 1758隶属于鲈形目Perciform狼鲈科Moronidae family舌齿鲈属Dicentrarchus,又名欧洲海鲈、地中海海鲈,是地中海最具代表性的商业养殖和休闲鱼类之一。欧洲舌齿鲈属于广温性(5~28 ℃)和广盐性(3~33)鱼类,具有生长速度快、抗病力强、肉质鲜美等特点,在欧洲地区深受养殖者和消费者的欢迎。
动物福利(welfare)是指动物享有免受饥渴、生活舒适自由,享有良好的饲养和标准化的生活环境等基本生存权利。有研究表明,鱼对惊吓、不利条件的生存环境可以做出相应的生存策略[1]。在水产养殖中,鱼类在引入新栖息地或改变自然栖息地后,其福利可能会受到影响,如循环水养殖池、海上网箱和池塘等人工环境会对养殖鱼类的摄食活动、生长、健康和福利产生负面影响[2],其中生存环境背景颜色是影响鱼类存活和生长的关键要素之一[3-4]。
在工厂化水产养殖中,养殖池背景色通常是根据生产实际经验或养殖池涂料种类来进行选择的。以往对鱼类偏好背景色的研究主要集中在养殖池背景色与养殖生物生长速率或应激反应之间的关系上,通常是根据养殖生物生长速率评估最佳背景色[3-6]。一般认为,动物具有采用“行为背景匹配”或“隐蔽着色”策略来选择最适合隐藏颜色以减少被捕食的概率[5-6],鱼类通过选择颜色适宜的栖息水环境,不但可以最大限度地减少自身颜色变化的能源成本和被捕食风险,而且能使自身得到更好的生长和改善机体生理的状况[5-7]。另外,鱼类对环境的自然适应也可能影响其在人工养殖条件下的反应。许多鱼类能够通过控制其皮肤中的色素沉着来改变其颜色。当鱼类被放入新的环境时,其以消耗能量来分散身体色素去适应新的环境背景色。Rodgers等[7]认为,鱼能够改变其体色以适应环境背景色,适应黑色背景的鱼表现出对黑色背景的偏好,对于适应白色背景的鱼类,表现出对白色背景色的选择偏好。
本研究中,通过在同一养殖水槽内设置成粉色、蓝色、红色、白色、绿色、紫色、橙色、黑色8个扇形养殖区域,进行欧洲舌齿鲈幼鱼对养殖水池背景色的偏好性试验,旨在为提高欧洲舌齿鲈工厂化循环水养殖的福利提供科学依据。
1 材料与方法
1.1 材料
1.1.1 试验用鱼 欧洲舌齿鲈幼鱼来自大连海洋大学水产设施养殖与装备工程技术中心循环水养殖系统,其在蓝色背景色的循环水养殖池中饲养2个月,饲养期间日粮投喂量为鱼体质量的3%,饲养期间全光照,养殖用水pH为 7.0~8.0,溶氧>5 mg/L,盐度为28~30,水温为20~22 ℃。选取健康活泼的欧洲舌齿鲈幼鱼作为试验用鱼。
1.1.2 八扇形颜色选择装置 参考Li等[8]的研究方法,设置八扇形背景色选择装置。具体如下:颜色选择装置为直径100 cm、高30 cm的灰色PPC圆桶,桶中心设直径30 cm、高20 cm的相同材质圆柱体,用PPC板把桶壁与圆柱体之间的环形道分隔成8个均等的扇形养殖单元,PPC板与桶底留有10 cm的间隙,其目的一是保持各养殖单元水质一致,二是让试验鱼在养殖单元间自由游动。各养殖单元的内壁分别粘贴橙色、黑色、粉色、蓝色、红色、白色、绿色和紫色8种不同颜色的防水贴纸,形成8个不同背景色的养殖区域。中间圆柱形区域为灰色PPC材质的原色,此装置命名为M1八扇形颜色选择装置,其颜色分布如图1(a)所示。
为了观察试验鱼是否会基于生理本能选择偏好的颜色,避免定时定点调节试验系统对试验鱼惊吓的差异带来的影响,将试验背景色选择装置(M1)的颜色位置逆时针旋转90°改变颜色分布,此装置命名为M2八扇形颜色选择装置,其颜色分布如图1(b)所示,重新进行试验。
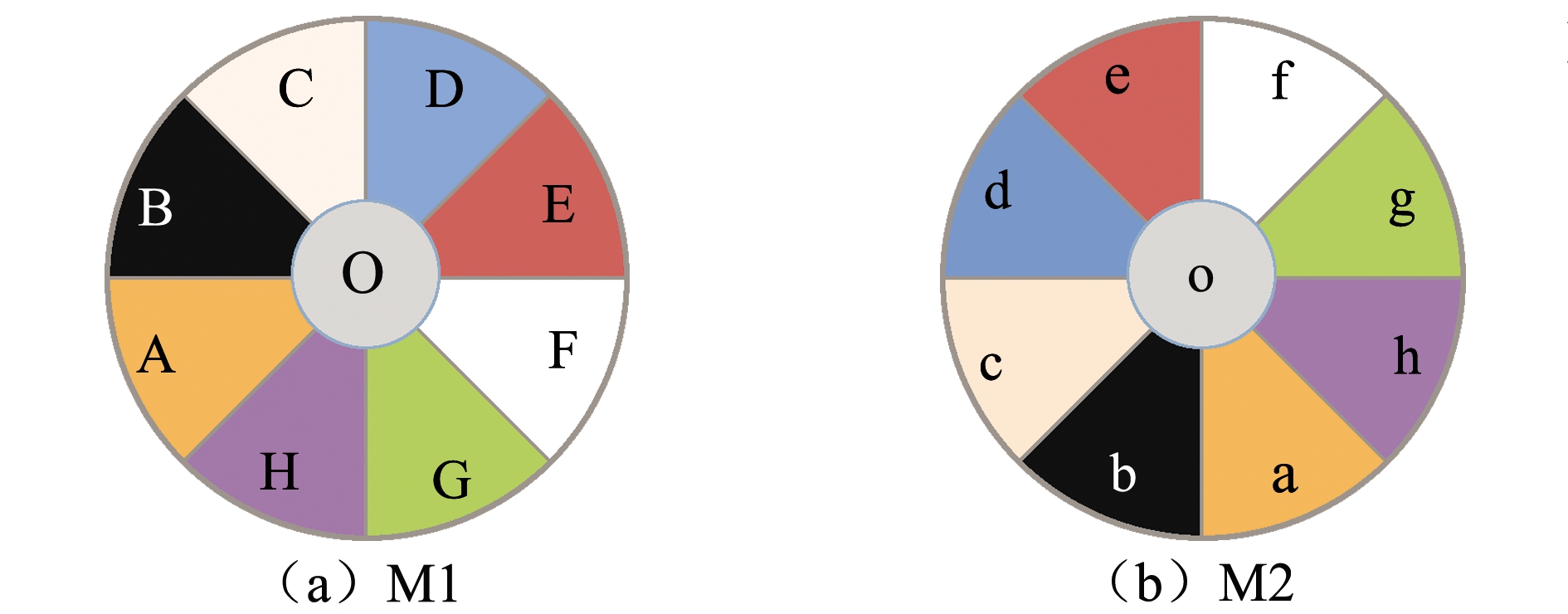
A、a—橙色;B、b—黑色;C、c—粉色;D、d—蓝色;E、e—红色;F、f—白色;G、g—绿色;H、h—紫色;O、o—原色。 A and a—orange; B and b—black; C and c—pink; D and d—blue; E and e—red; F and f—white; G and g—green; H and h—purple; O and o—the primary color.
图1 八扇形颜色选择装置颜色分布图
Fig.1 Color distribution map of eight fan-shaped color selection device
试验装置用高锰酸钾溶液、海水依次消毒清洗后,用海水冲洗浸泡一周以上备用。
1.2 方法
1.2.1 计算机视觉系统的搭建与分析算法 计算机视觉系统包括BASLER工业相机(acA1300-60gc,德国)、水产养殖水上LED灯[9](GK5A-1,自然白5 000 K,中国深圳)和计算机。为了排除外界日光环境的影响,计算机视觉系统安装在封闭的暗室中,采用水产养殖水上LED灯为光源,从1.25 m顶部直射90°水面中心采光,辐射照度为(1 852.065±15.382)mW/m2,摄像头用机械臂固定在八扇形颜色选择装置的正上方和光源的正下方之间。录制视频为MPG文件。
分析算法:首先使用摄像机进行试验视频的录制和存储;然后通过 SolveigMM Video Splitter Business Edition 软件对录制的视频进行剪辑,得到理想的视频区段;最后将剪辑得到的试验视频采用运动轨迹跟踪系统 EthoVision XT 12(Noldus 公司)进行分析处理。
运动轨迹跟踪系统 EthoVision XT 12的分析原理:1)设定观察区和分析区,确保预定义观察区和分析区的大小和形状正确;2)调整检测设置,确定正确的分析设置;3)确定观察区和分析区的数量和需要分析的试验鱼(本试验有9个颜色分析区和8尾试验鱼);4)确定视频跟踪的特征(本试验以试验鱼的中心点为 EthoVision XT 12软件检测点);5)调整试验鱼跟踪的要素(本试验以试验装置背景与试验鱼灰度值变化差异作为区分试验对象);6)确定试验分析的视频源;7)进行试验视频分析。
视频分析是以观察区的中心点建立坐标系,试验鱼的中心点确定为X和Y坐标,每秒采集15个样本,数据用Lowess(局部加权散点图平滑)方法进行处理,实现对试验鱼的轨迹跟踪,达到绘制试验鱼轨迹的目的。图2为试验装置示意图和视频分析流程图。
1.2.2 M1八扇形颜色选择系统选择试验
1) M1八扇形颜色选择系统试验Ⅰ。在M1八扇形颜色选择系统中加入海水,使水深为25 cm,接入曝气头充分曝气2 h后撤去。用抄网小心从循环水养殖系统(RAS)中选取试验用鱼,放入用MS-222配制的海水溶液中进行麻醉和选鱼,选取体质量为(75.5±2.5)g、体长为(18.5±0.2)cm且健康活泼的试验鱼8尾,分别记为fish1~fish8,测量其体长、体质量并拍照存储作为原始图像资料,后放入M1系统适应2 h,使用录制系统进行试验视频的录制,时长大于24 h,对录制的视频进行剪辑,选取20 min视频用于 EthoVision XT 12软件分析。采用同样的操作标准重复试验一次。
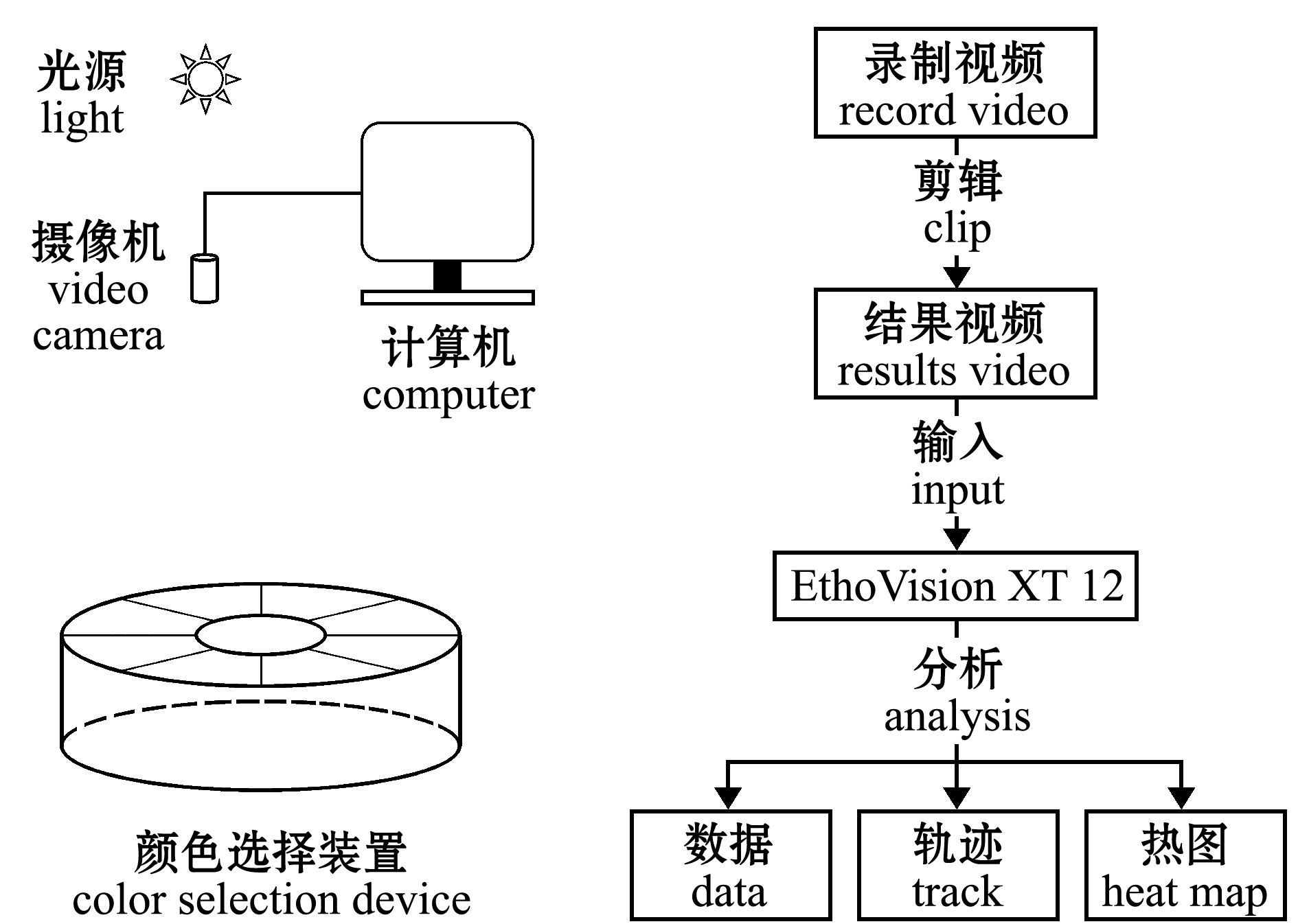
图2 试验装置示意图和视频分析流程
Fig.2 Experimental device schematic diagram and video analysis flow chart
2)M1八扇形颜色选择系统试验Ⅱ。从循环水养殖系统(RAS)中选取体质量为(35.5±0.5)g、体长为(13.6±0.4)cm且健康活泼的试验鱼8尾,分别记为fish1~fish8。其余试验内容及试验过程均同试验Ⅰ。
3) M1八扇形颜色选择系统试验Ⅲ。从循环水养殖系统(RAS)中选取体质量为(30.5±3.5)g、体长为(13.25±0.05)cm且健康活泼的试验鱼4尾,以及体质量为(76.5±0.5)g、体长为(18.1±0.1)cm且健康活泼的试验鱼4尾,分别记为fish1~fish8。其余试验内容及试验过程均同试验Ⅰ。目的是观察在实际生产中同一养殖池中出现体形差异的养殖欧洲舌齿鲈对养殖水池的背景色偏好是否发生改变。
1.2.3 M2八扇形颜色选择系统选择试验 在M2八扇形颜色选择系统中进行试验Ⅰ、Ⅱ、Ⅲ,所采用试验操作标准与在M1八扇形颜色选择系统试验Ⅰ、Ⅱ、Ⅲ相同,进行重复试验。目的是考察试验鱼是否基于生理本能选择偏好的颜色,避免定时定点调节试验系统对试验鱼惊吓的差异带来的影响,故逆时针旋转90°以改变试验背景色选择装置的颜色位置分布,以增加试验结果的科学性。
2 结果与分析
2.1 M1八扇形颜色选择系统试验Ⅰ、Ⅱ、Ⅲ的结果
对M1八扇形颜色选择系统试验Ⅰ、Ⅱ、Ⅲ录制的视频进行分析可得:试验Ⅰ、Ⅱ、Ⅲ中采集视频的分析原始数据,在此略(见电子版附录A表A1~表A3);试验Ⅰ、Ⅱ、Ⅲ中的每尾试验鱼在观察区和分析区内的运动轨迹见图3,各试验鱼的轨迹组合图见图4,各试验鱼的轨迹组合热区图见图5。
对相关数据的标准偏差结果及正态性分析得出:试验鱼中心点移动的全部距离、其速度的平均值、试验鱼中心点到观察区的平均距离、试验鱼中心点到观察区的全部距离和到分析区、观察区的频率均无显著性差异(P>0.05)。这表明在每次试验中8尾试验鱼在生理状况上无明显差异。
对试验Ⅰ、Ⅱ、Ⅲ单独试验鱼的轨迹图、各试验的全部试验鱼轨迹进行组合后的轨迹图和试验的热区图像分析得出:试验Ⅰ、Ⅱ的试验鱼对养殖池背景色的偏好与试验鱼体长和体质量无明显关系,试验Ⅲ中,不同体质量的试验鱼在对养殖池背景色的偏好上与试验Ⅰ和Ⅱ无明显差异(图3);试验鱼轨迹主要集中的背景色为黑色和粉色等深色,说明试验鱼在黑色和粉色等深色区域范围停留时间较长(图4、图5)。
2.2 M2八扇形颜色选择系统试验Ⅰ、Ⅱ、Ⅲ的结果
对M2八扇形颜色选择系统试验Ⅰ、Ⅱ、Ⅲ录制的视频进行分析可得:试验Ⅰ、Ⅱ、Ⅲ中采集视频的分析原始数据,在此略(见电子版附录A表A4~表A6);试验Ⅰ、Ⅱ、Ⅲ中的每尾试验鱼在观察区和分析区的运动轨迹见图6,各试验鱼的轨迹组合图见图7,各试验鱼的轨迹组合热区图见图8。
对相关数据的标准偏差结果及正态性分析得出:试验鱼中心点移动的全部距离、其速度的平均值、试验鱼中心点到观察区的平均距离、试验鱼中心点到观察区的全部距离和到分析区、观察区的频率无显著性差异(P>0.05)。这表明在每次试验中8尾试验鱼在生理状况上无明显差异。
对试验Ⅰ、Ⅱ、Ⅲ单独试验鱼的轨迹图、各试验的全部试验对象轨迹进行组合的轨迹图和试验的热区图像分析得出:试验Ⅰ、Ⅱ的试验鱼对养殖池背景色的偏好与试验鱼体长和体质量无明显关系,试验Ⅲ中不同体质量的试验鱼在对养殖池背景色的选择偏好上与试验Ⅰ和Ⅱ无明显差异(图6);试验鱼轨迹主要集中的背景色为黑色、粉色和橙色等深色区域,说明试验鱼在黑色、粉色和橙色区域范围停留时间最长(图7、图8)。

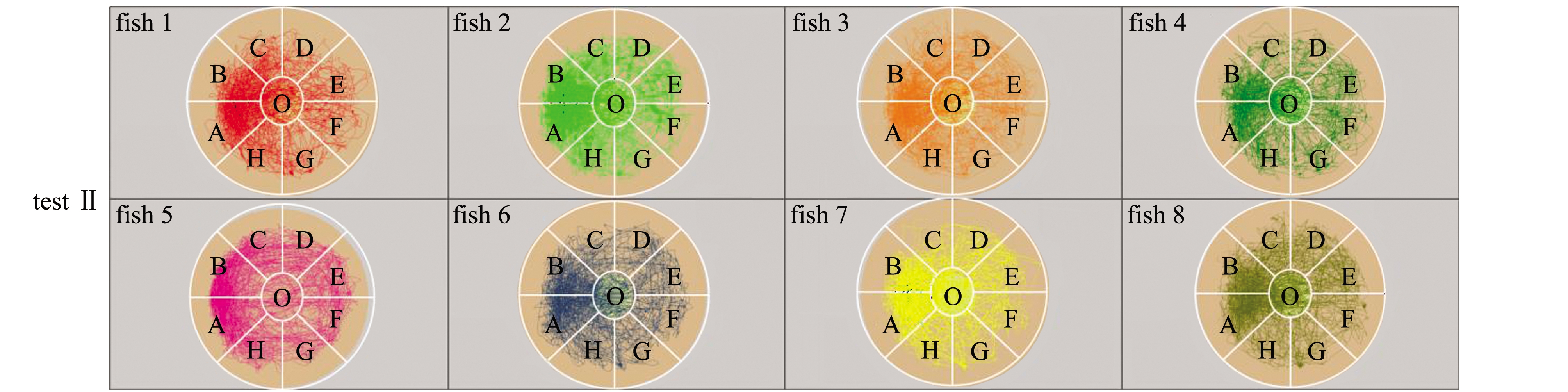
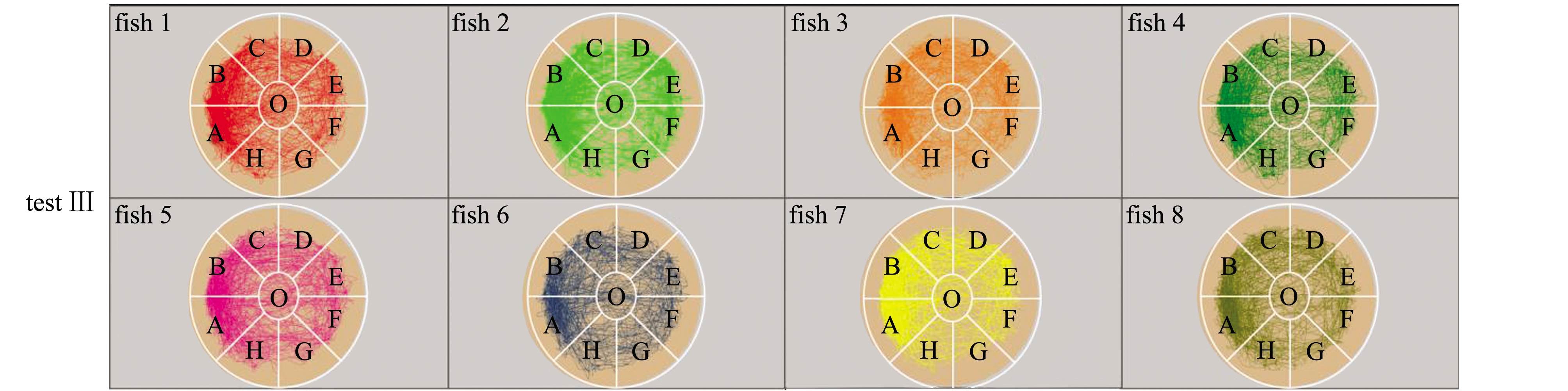
图3 M1八扇形颜色选择系统试验Ⅰ、Ⅱ、Ⅲ中各试验鱼的轨迹图
Fig.3 Trajectory diagram of each test fish in M1 eight fan-shaped color selection device in tests Ⅰ,Ⅱ, and Ⅲ

图4 M1八扇形颜色选择系统试验Ⅰ、Ⅱ、Ⅲ中各试验鱼轨迹的组合图
Fig.4 Combination diagram of the trajectories of each test fish in M1 eight fan-shaped color selection device in tests Ⅰ, Ⅱ, and Ⅲ
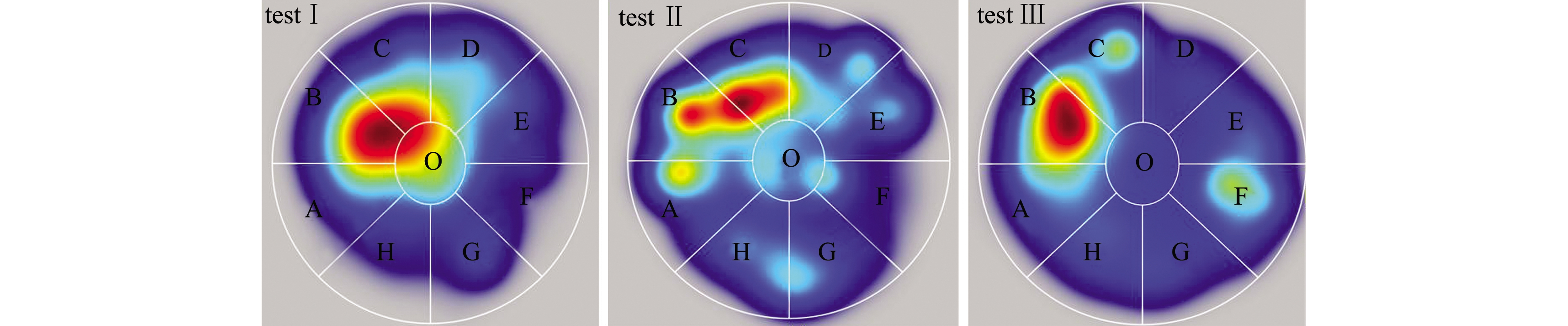
图5 M1八扇形颜色选择系统试验Ⅰ、Ⅱ、Ⅲ中各试验鱼轨迹的热区图
Fig.5 Hot zone diagrams of the trajectories of each test fish in M1 eight fan-shaped color selection device in tests Ⅰ,Ⅱ,and Ⅲ
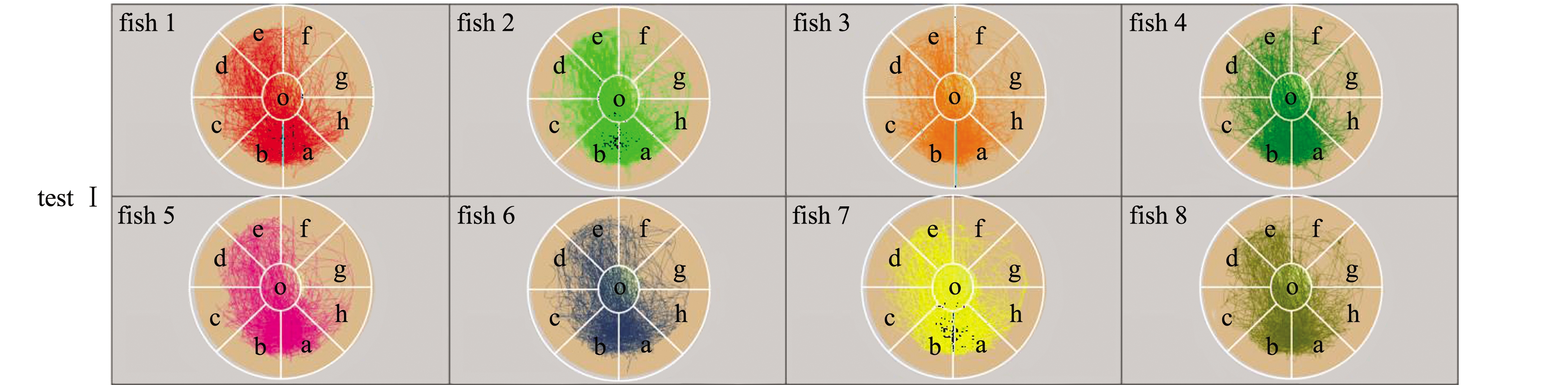

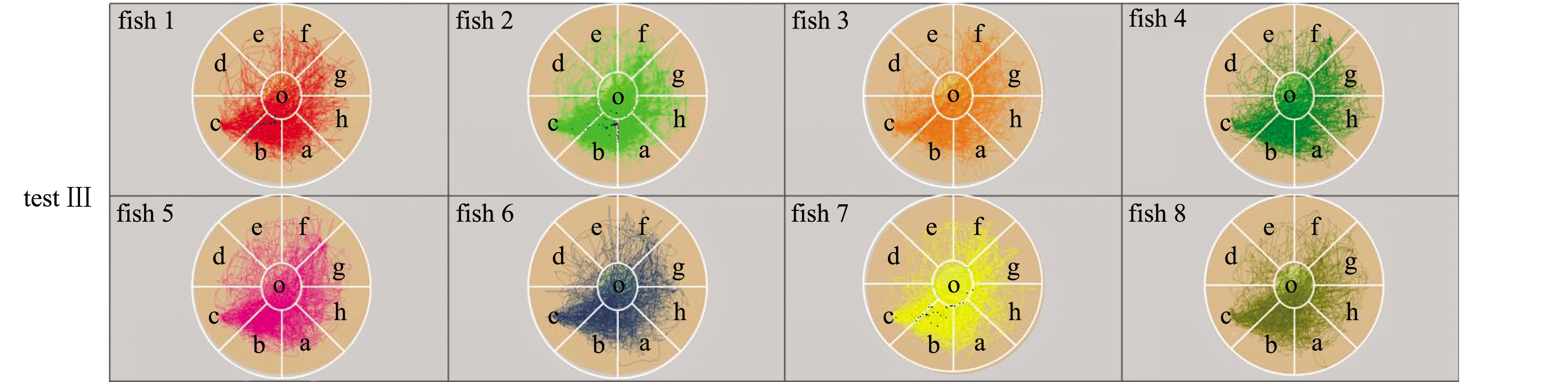
图6 M2八扇形颜色选择系统试验Ⅰ、Ⅱ、Ⅲ中各试验鱼的轨迹图
Fig.6 Trajectory diagram of each test fish in M2 eight fan-shaped color selection device in tests Ⅰ,Ⅱ,and Ⅲ

图7 M2八扇形颜色选择系统试验Ⅰ、Ⅱ、Ⅲ中各试验鱼轨迹的组合图
Fig.7 Combination diagram of the trajectories of each test fish in M2 eight fan-shaped color selection device in tests Ⅰ, Ⅱ, and Ⅲ

图8 M2八扇形颜色选择系统试验Ⅰ、Ⅱ、Ⅲ中各试验鱼轨迹的热区图
Fig.8 Hot zone diagrams of the trajectories of each test fish in M2 eight fan-shaped color selection device in tests Ⅰ, Ⅱ, and Ⅲ
3 讨论
3.1 不同种类鱼偏好的背景色不同
目前尚不清楚鱼类能够识别多少种颜色,但已有研究发现,鱼类对背景颜色具有偏好性。如大菱鲆Scophthalmus maximus幼鱼总是偏爱白色背景色[8],斑马鱼Danio rerio偏好红色[10],尼罗罗非鱼Oreochromis niloticus偏好黄色[11],虹鳟Oncorhynchus mykiss偏爱绿色[12],而尖吻鲈Lates calcarifer则偏好蓝色[13]。
本研究表明,不同大小的欧洲舌齿鲈幼鱼均对黑色等深色背景色区域表现出明显的偏好选择,而对白色等浅色背景色区域表现为排斥现象。同时,在M1、M2选择系统试验Ⅲ中,不同体质量与体长的试验鱼对养殖池背景色的选择无明显关系。
通过测定与压力相关的激素水平得出,与灰色或黑色背景相比,红色鲷Pagrus pagrus在白色背景下显示出更小的压力胁迫[14]。此外,包括罗非鱼和大菱鲆在内的许多鱼类可以改变其体色以适应背景或对环境做出相应的体色适应[15]。一般来说,有两类机体颜色变化:第一种是在短时间内发生的生理颜色变化,并涉及黑色素浓缩激素(MCH)和α-黑色素细胞刺激激素(α-MSH)两种激素[16];第二种是在较长时间内发生的形态颜色变化,其中特定激素的作用改变了真皮细胞中黑色素的形态、密度和分布[17]。对大菱鲆的研究发现,黑色和红色背景色下鱼体的亮度变化速率比在较浅的背景下更剧烈和强烈,这表明大菱鲆需要通过增加能量消耗来做出更大的生理响应以适应黑色或红色背景[18]。而在本试验中也发现类似的情况,养殖观察中,欧洲舌齿鲈在白色等浅色背景色下鱼体的亮度变化比在黑色等深色背景下更快,行为更剧烈,从侧面证明在白色等浅色背景下,欧洲舌齿鲈对背景色胁迫更大,其机体可能需要消耗更多的机体能量来对所处环境做出生理的响应。
3.2 欧洲舌齿鲈基于生理本能偏好背景色
本研究显示,在M1、M2不同的颜色选择系统中,欧洲舌齿鲈幼鱼对颜色的选择都表现出对黑色背景色的偏好,对白色等浅色背景色表现出排斥现象,说明欧洲舌齿鲈幼鱼对颜色的选择性与其装置的背景色位置无明显关系,排除定时定点调节试验系统对试验鱼惊吓的差异带来的影响,这表明在养殖池背景色区域中,欧洲舌齿鲈幼鱼对养殖池的黑色等深色背景保持了生理本能的选择偏好性。因此,在深色的背景色,如黑色养殖池背景色更适用于欧洲舌齿鲈幼鱼的工厂化循环水养殖。
4 结论
1)本试验中设计了M1、M2八扇形颜色选择系统来研究欧洲舌齿鲈幼鱼对养殖池背景色的选择偏好性,结果表明,欧洲舌齿鲈幼鱼对试验装置中黑色等深色背景色表现出偏好性,对白色等浅色背景色表现为“厌恶性”。
2)欧洲舌齿鲈幼鱼对背景色的偏好与个体大小无关,是基于生理本能的选择偏好。
本试验中未能探究欧洲舌齿鲈幼鱼对以黑色等深色背景色偏好的生物学机理。下一步建议开展欧洲舌齿鲈幼鱼在黑色等深色和白色等浅色为养殖池背景色下的养殖,对其生长速率、代谢率、耗氧率、皮质醇等生理指标的差异进行研究;同时,通过代谢组学(metabolomic)手段对不同养殖池背景色的欧洲舌齿鲈血液、肝脏等组织进行组学分析,进一步研究欧洲舌齿鲈在偏好深色背景色下代谢谱的变化,从而筛选出标志差异代谢物,了解其内在的代谢机理。
[1] WARD A J W,HOLBROOK R I,KRAUSE J,et al.Social recognition in sticklebacks:the role of direct experience and habitat cues[J].Behavioral Ecology and Sociobiology,2005,57(6):575-583.
[2] STRAND Å,ALAN R
R A,STAFFAN F,et al.Effects of tank colour and light intensity on feed intake,growth rate and energy expenditure of juvenile Eurasian perch,Perca fluviatilis L.[J].Aquaculture,2007,272(1/2/3/4):312-318.
A,STAFFAN F,et al.Effects of tank colour and light intensity on feed intake,growth rate and energy expenditure of juvenile Eurasian perch,Perca fluviatilis L.[J].Aquaculture,2007,272(1/2/3/4):312-318.
[3] BARCELLOS L J G,KREUTZ L C,QUEVEDO R M,et al.Influence of color background and shelter availability on jundiá (Rhamdia quelen) stress response[J].Aquaculture,2009,288(1/2):51-56.
[4] KANG D Y,KIM H C.Importance of bottom type and background color for growth and blind-side hypermelanosis of the olive flounder,Paralichthys olivaceus[J].Aquacultural Engineering,2013,57:1-8.
[5] GARCIA T S,SIH A.Color change and color-dependent behavior in response to predation risk in the salamander sister species Ambystoma barbouri and Ambystoma texanum[J].Oecologia,2003,137:131-139.
[6] MERILAITA S,TUOMI J,JORMALAINEN V.Optimization of cryptic coloration in heterogeneous habitats[J].Biological Journal of the Linnean Society,1999,67(2):151-161.
[7] RODGERS G M,GLADMAN N W,CORLESS H F,et al.Costs of colour change in fish:food intake and behavioural decisions[J].Journal of Experimental Biology,2013,216(14):2760-2767.
[8] LI X,CHI L,TIAN H Q,et al.Colour preferences of juvenile turbot (Scophthalmus maximus)[J].Physiology & Behavior,2016,156:64-70.
[9] 宋昌斌,刘立莉,卢鹏志,等.水产养殖车间LED光环境设计研究[J].大连海洋大学学报,2018,33(2):145-150.
SONG C B,LIU L L,LU P Z,et al.Design of artificial LED lighting in aquaculture workshop[J].Journal of Dalian Ocean University,2018,33(2):145-150.(in Chinese)
[10] SPENCE R,SMITH C.Innate and learned colour preference in the zebrafish,Danio rerio[J].Ethology,2008,114(6):582-588.
[11] LUCHIARI A C,DO AMARAL DUARTE C R,DE MORAIS FREIRE F A,et al.Hierarchical status and colour preference in Nile tilapia (Oreochromis niloticus)[J].Journal of Ethology,2007,25(2):169-175.
[12] LUCHIARI A C,PIRHONEN J.Effects of ambient colour on colour preference and growth of juvenile rainbow trout Oncorhynchus mykiss (Walbaum)[J].Journal of Fish Biology,2008,72(6):1504-1514.
[13] ULLMANN J F P,GALLAGHER T,HART N S,et al.Tank color increases growth,and alters color preference and spectral sensitivity,in barramundi (Lates calcarifer)[J].Aquaculture,2011,322/323:235-240.
[14] ROTLLANT J,TORT L,MONTERO D,et al.Background colour influence on the stress response in cultured red porgy Pagrus pagrus[J].Aquaculture,2003,223(1/2/3/4):129-139.
[15] XU J Y,LIU Y,CUI S R,et al.Behavioral responses of tilapia (Oreochromis niloticus) to acute fluctuations in dissolved oxygen levels as monitored by computer vision[J].Aquacultural Engineering,2006,35(3):207-217.
[16] BURTON D,VOKEY J E.The relative in vitro responsiveness of melanophores of winter flounder to α-MSH and MCH[J].Journal of Fish Biology,2000,56(5):1192-1200.
[17] SUGIMOTO M.Morphological color changes in fish:regulation of pigment cell density and morphology[J].Microscopy Research and Technique,2002,58(6):496-503.
[18] 李贤,范良忠,刘子毅,等.基于计算机视觉的大菱鲆对背景色选择习性研究[J].农业工程学报,2012,28(10):189-193.
LI X,FAN L Z,LIU Z Y,et al.Preference habit of juvenile turbot for different color backgrounds based on computer vision[J].Transactions of the Chinese Society of Agricultural Engineering,2012,28(10):189-193.(in Chinese)