生物被膜是附着在物体外侧或相互接触面的具备结构的微生物群体[1],由微生物及其分泌的胞外基质组成,为顺应生活环境而形成在活性或惰性材质外层[2]。在水体环境中,绝大部分固体附着基质的表层都存在着生物被膜。细菌附着到基质表层并产生胞外产物形成了生物被膜,这是生物被膜形成的重要部分[3]。影响生物被膜形成的因素有很多,如温度和盐度[4]、培养基中的营养盐[5]、不同种细菌[6]等。生物被膜能影响贻贝、藤壶等幼虫的附着变态[7-9],该现象是海洋经济贝类养殖和海洋防污损的研究热点。
钙离子是高度通用的细胞内信号,可以调节多种不同细胞的功能[10]。在海洋环境中,钙是一种经常在物体表面富集的元素,既可以是沉积的钙沉积物,也可以与其他海洋生物结合在一起[11]。钙能影响生物被膜的形成,特别是钙参与了细胞与基质之间的特异性和非特异性相互作用[12-13]。已有试验证实,钙离子能够促进大肠杆菌生物被膜和铜绿假单胞菌生物被膜形成[14-15],抑制霍乱弧菌生物被膜形成[16]。
钙离子是如何影响海洋细菌生物被膜形成,是否影响生物被膜对海洋无脊椎动物附着的调控,为了解释以上这些问题,本试验中以典型的大型污损生物厚壳贻贝Mytilus coruscus为研究对象,使用不同钙离子浓度的人工海水(artificial seawater,ASW)来培养生物被膜,观察其生物被膜密度、膜厚及稚贝附着率的变化,并使用共聚焦显微镜技术对不同钙离子浓度影响下生物被膜的胞外多糖、胞外脂类和胞外蛋白进行分析,旨在明确钙离子浓度对生物被膜形成的影响,及其在海洋无脊椎动物附着过程中的作用,为海洋污损生物的防治研究提供理论依据。
1 材料与方法
1.1 材料
试验用海假交替单胞菌Pseudoalteromonas marina(ECSMB14103) 为上海海洋大学贝类分子生物学实验室(以下简称本实验室)的保种菌株(保藏号为MCCC 1K03544)。该菌株来自浙江省嵊泗县枸杞岛(122°46′E、30°43′N)的自然生物被膜表面,使用Zobell 2216E平板划线进行培育,再分离菌株得到单一菌株,利用甘油-生理盐水保种液保种,在-80 ℃超低温冰箱中保存。
自然海水(nature seawater,NSW)取自浙江省嵊泗县枸杞岛附近,经测定钙离子浓度为11.78 mmol/L。考虑到要调节海水中的钙离子含量,用自然海水无法减少其中钙离子的含量,故本试验中配制与自然海水成分最为相似的人工海水(artificial seawater,ASW),以此来达到人为调控海水钙离子浓度的目的。试验设置钙离子浓度为10 mmol/L的对照组,以及钙离子浓度为0、1、5、20、50 mmol/L的5个试验组。人工海水的配方如下:蒸馏水、NaCl、MgSO4·7H2O、MgCl2·6H2O、KCl、CaCl2、NaNO3、K3PO4、β-五水甘油磷酸二钠盐、Na2SiO3·9H2O、维生素、pⅡMetals、S2Metals、Tris、氨基三乙酸。
试验用厚壳贻贝稚贝取自浙江省舟山市嵊泗县(122°46′E、30°69′N),在本实验室用自然海水暂养一周后使用。挑选壳长为(0.56±0.03)mm、壳高为(0.38 ± 0.02)mm的稚贝用于附着试验。
试验用激光共聚焦显微镜由Leica公司生产(×630倍镜)。
1.2 方法
1.2.1 海假交替单胞菌的分离 参考Yang等[17]的方法,将附着在载玻片上的自然生物被膜(浙江省嵊泗县枸杞岛)从载玻片表面刮到过滤过的海水中,将混有细菌的海水均匀涂在Zobell 2216E平板上,平板倒置在温度25 ℃且黑暗的条件下培育48 h,从中挑取目的菌落。再将选取出来的菌株反复分离纯化,最后将确定的纯种海假交替单胞菌(经Adapt Noise Immunity分析,上海美吉生物医药科技有限公司)用0.9%生理盐水配制成30%的甘油保种液保种,再放入-80 ℃超低温冰箱中保存。
1.2.2 生物被膜的制备 参考Yang等[17]的方法,用Zobell 2216E液体培养基培育纯种海假交替单胞菌,在25 ℃、黑暗条件下扩大培育16 h。用无菌海水洗涤培养的菌液3次,最后定容至50 mL悬浊菌液。使用Olympus BX-51荧光显微镜确定菌液细胞密度并在培养皿(直径64 mm×19 mm)中加入相应的菌液,再加入无菌海水使得培养皿终体积为20 mL。在18 ℃、黑暗条件下培育48 h形成试验用生物被膜。
菌液的初始细胞密度分别设定为1×106、1×107、1×108、5×108 cells/mL,自然海水(NSW)与人工海水(ASW)形成生物被膜的比较试验中使用这4组密度,其余试验均选用最佳密度1×108 cells/mL。
1.2.3 生物被膜细菌密度的计算 参考Yang等[17]的方法,将5%福尔马林溶液固定过的生物被膜用0.1%的吖啶橙溶液染色5 min后,晾干制片,在1 000倍荧光显微镜(Olympus BX-51)下选择30个区域计算细菌个数。计算公式为
生物被膜细胞密度(cells/cm2)=区域内细菌数(cells)/(区域个数×区域面积10-4 cm2)。
1.2.4 厚壳贻贝稚贝附着试验 在培养皿中加入载有生物被膜的玻片,加入20 mL灭菌海水,放入10枚稚贝,每组设9个重复。在18 ℃、黑暗环境下培育,依据放入稚贝的时间分别观察12、24、48 h的附着情况,并计算附着率(%),即
附着率=载玻片上附着个数/总稚贝数×100%。
因12、24、48 h附着率结果基本相似,故本试验中仅出示24 h时的附着率结果。
1.2.5 激光共聚焦显微镜标本染色 参考González-Machado等[18]的方法,用表1的染料进行共聚焦避光染色,染色20 min,染色前后分别用0.9%生理盐水清洗生物被膜,并计算生物量体积(μm3),即
生物量体积=生物量总面积(Image J软件处理)×层厚0.2 μm。
1.3 数据处理
所有数据均使用JMP 10.0.0软件进行统计分析及相关性检验。在统计分析前,对所有数据进行正态性检测,满足正态分布,则使用单因素方差分析。通过多元分析方法验证稚贝附着率和钙离子浓度与细菌密度、膜厚、胞外产物生物量之间是否具有相关性,显著性水平设为0.05。用Image J软件处理共聚焦图像,计算胞外产物共聚焦的面积。
2 结果与分析
2.1 自然海水和人工海水形成的生物被膜细菌密度及稚贝附着率
从图1A可见:在初始菌液浓度为1×106 cells/mL条件下,自然海水形成的生物被膜细菌密度为1.24×106 cells/cm2,人工海水形成的生物被膜细菌密度为1.19×106 cells/cm2,二者间无显著性差异(P>0.05);随着初始菌液密度的增加,自然海水和人工海水培养的生物被膜的细菌最终密度均呈现显著增加的趋势(P<0.05),且二者间终密度并无显著性差异(P>0.05)。
表1 激光共聚焦显微镜标本染料成分及染色对象
Tab.1 Dye composition and targets for confocal laser scanning microscopy

染料dye染色目标target浓度concentration激光波长/nmlaser wavelength检测波长/nmdetection wavelength碘化丙啶 propidium iodide (PI)死细菌5 μg/mL561560~700四甲基罗丹明共轭物刀豆蛋白Aconcanavalin A,tetramethylrhodamine conjugate(ConA-TMR)α多糖944.8 μg/mL561400~700卡尔科弗卢尔荧光增白剂M2R calcofluor white M2R (CFW)β多糖189 μL/mL405400~5601,1'-双十八烷基-3,3,3',3'-四甲基吲哚二碳花菁高氯酸盐 DiIC18(5) oil,1,1'-dioctadecyl-3,3,3',3'-tetram-ethylindodicarb-ocyanine perchlorate(DiD’oil)脂类7.94 μL/mL640645~700异硫氰酸荧光素 fluorescein isothiocyanate isomer I(FITC)蛋白质46.6 μg/mL488400~700
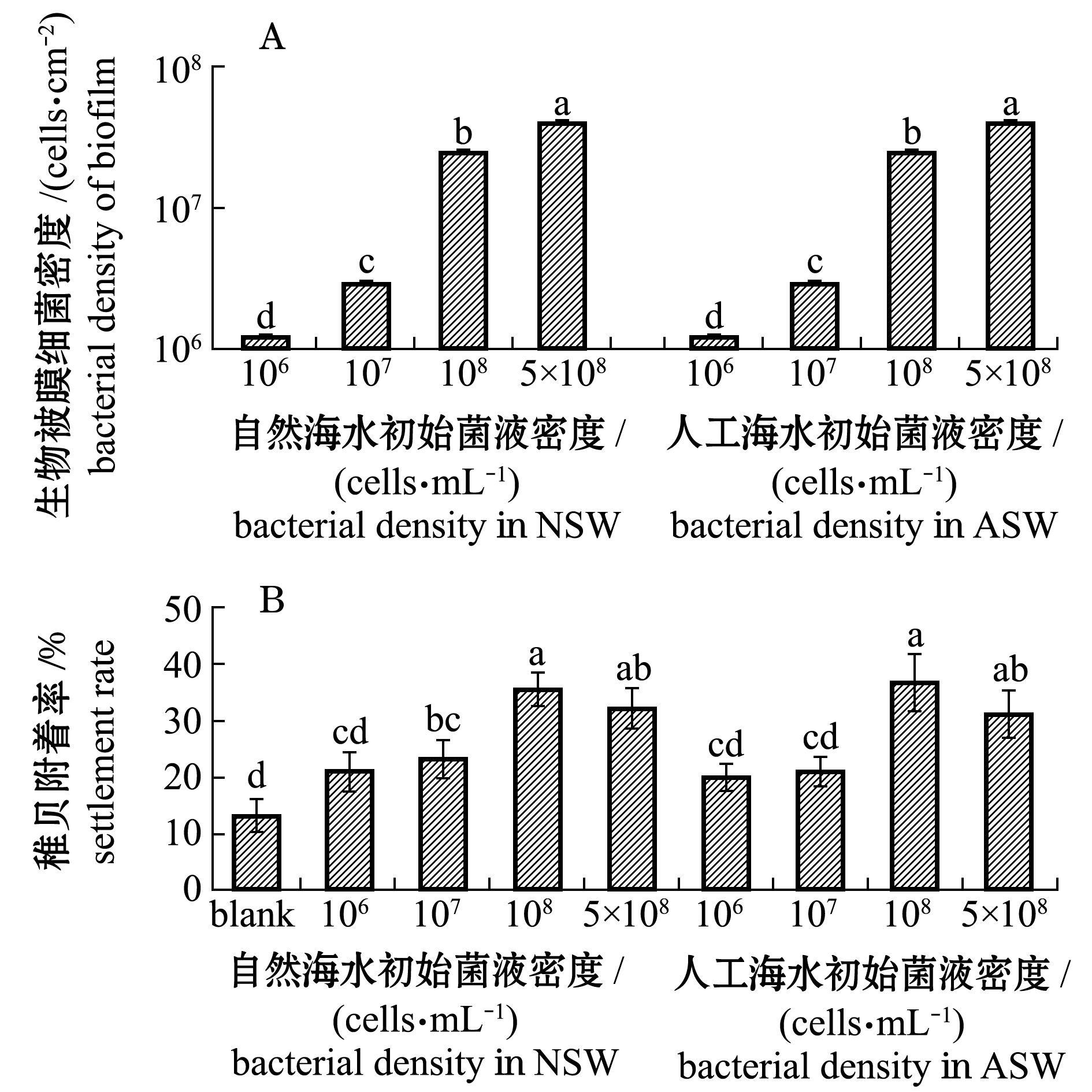
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。 The means with different letters are significantly different in the groups at the 0.05 probability level, and the means with the same letter are not significant differences, et sequentia.
图1 自然海水与人工海水分别形成的生物被膜细菌密度和稚贝附着率
Fig.1 Density and settlement rate of plantigrades in natural seawater biofilm compared with artificial seawater biofilm
从图1B可见:初始菌液密度为1×106、1×107 cells/mL条件下,加入稚贝24 h后自然海水和人工海水培养的生物被膜诱导的厚壳贻贝稚贝附着率与空白组的稚贝附着率(13.33%)相比,均无显著性差异(P>0.05);在初始菌液浓度为1×108 cells/mL条件下,自然海水生物被膜的稚贝附着率为35.56%,人工海水生物被膜的稚贝附着率为36.67%,均显著高于前两个初始密度组(P<0.05),但自然海水与人工海水两组间稚贝附着率并无显著性差异(P>0.05);在初始菌液密度为5×108 cells/mL条件下,自然海水和人工海水两组间稚贝附着率并无明显差异(P>0.05),且与1×108 cells/mL密度组也无显著性差异(P>0.05)。
2.2 不同钙离子浓度下生物被膜的细菌密度
从图2可见:人工海水形成的生物被膜在菌液初始密度全部为1×108 cells/mL时,海假交替单胞菌生物被膜的细菌终密度在钙离子浓度为10 mmol/L时最高,为2.53×107 cells/cm2;当钙离子浓度升高或降低时,生物被膜的终密度分别呈现显著下降趋势(P<0.05),钙离子浓度为50 mmol/L时生物被膜的细菌终密度最低,仅为1.63×107 cells/cm2。
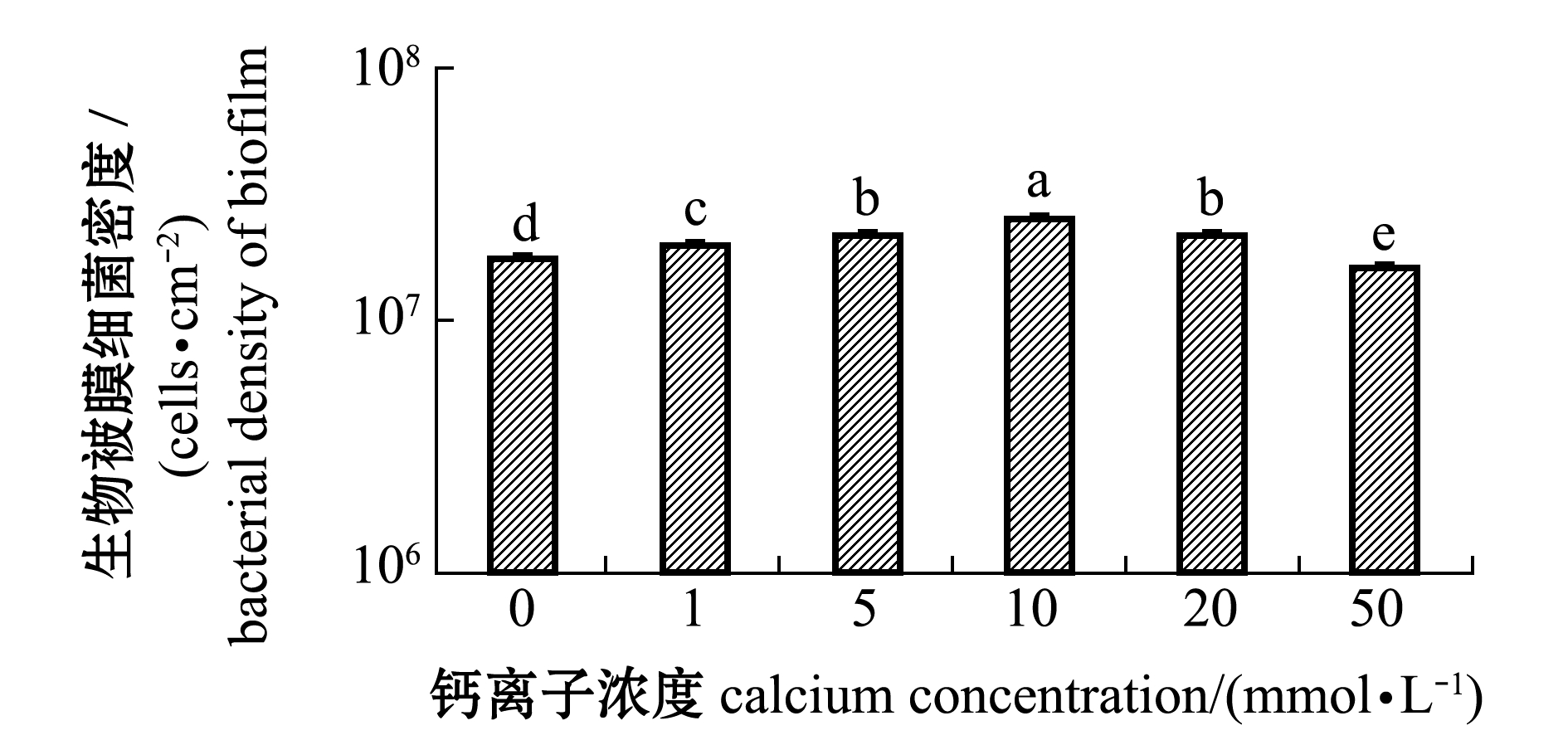
图2 钙离子浓度对生物被膜细菌密度的影响
Fig.2 Effects of different concentrations of calcium on the cell density of biofilm
2.3 不同钙离子浓度下生物被膜的稚贝附着率
从图3可见:人工海水形成的生物被膜在菌液初始密度为1×108 cells/mL条件下,加入稚贝24 h后,在钙离子浓度为0、1 mmol/L时,稚贝附着率均为22.22%,与空白对照相比并无明显差异(P>0.05);随着钙离子浓度增加,稚贝附着率也呈现上升趋势,在钙离子浓度为10 mmol/L时稚贝附着率达到最大值(35.56%),随后稚贝附着率开始下降,在钙离子浓度为50 mmol/L时稚贝附着率仅为23.33%。
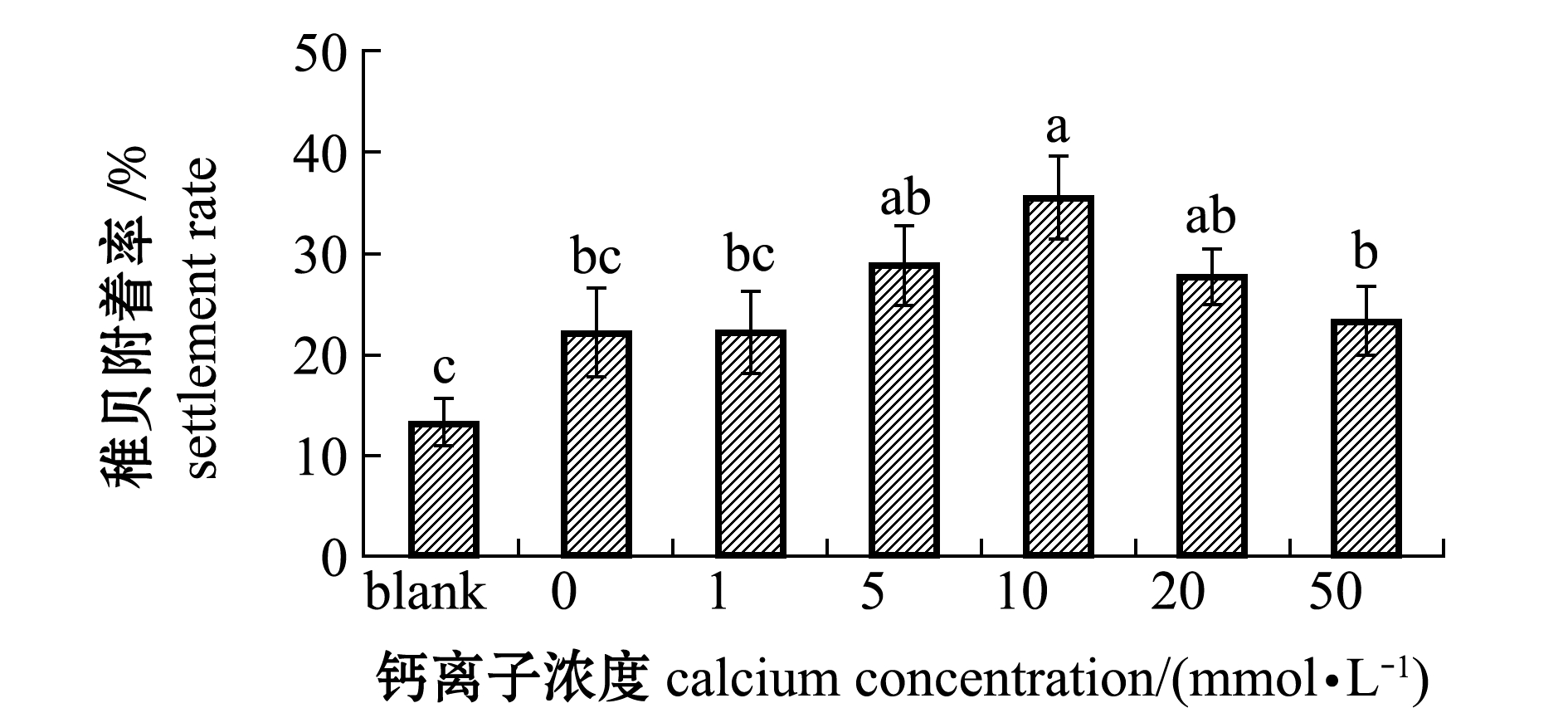
图3 钙离子浓度对生物被膜诱导稚贝附着的影响
Fig.3 Effects of different concentrations of calcium on plantigrade induced by biofilms
2.4 不同钙离子浓度下生物被膜的形态与厚度
通过用共聚焦显微镜对不同钙离子浓度下培养48 h的海假交替单胞菌生物被膜上细菌的分布形态进行观察(图4A),在钙离子浓度为0 mmol/L时,细菌的分布最为稀疏,膜厚也较薄,仅有4.00 μm;当钙离子浓度增加到10 mmol/L时,细菌开始聚集,细菌密度逐渐增加,此时膜厚达到最大值,为5.62 μm;当钙离子浓度增加到50 mmol/L时,细菌数量逐渐减少至稀疏的状态,生物被膜的厚度呈现显著降低的趋势(P<0.05)(图4B)。
2.5 不同钙离子浓度对生物被膜胞外多糖的影响
通过共聚焦显微镜观察不同钙离子浓度下培养48 h的生物被膜的胞外多糖(图5A、图6A),海假交替单胞菌生物被膜的胞外α多糖和β多糖的生物量在钙离子浓度为0 mmol/L时最少,分别为32.28、34.55 μm3;在钙离子浓度为10 mmol/L时,胞外多糖的生物量增加至最多,其中胞外α多糖的生物量为258.35 μm3,胞外β多糖的生物量为174.74 μm3;随着钙离子浓度继续升高,生物被膜的胞外多糖生物量呈现显著下降趋势(P<0.05)(图5B、图6B)。


图4 共聚焦显微镜下不同钙离子浓度的生物被膜形态及膜厚
Fig.4 Confocal laser scanning microscope images and thickness of biofilm under different concentrations of calcium

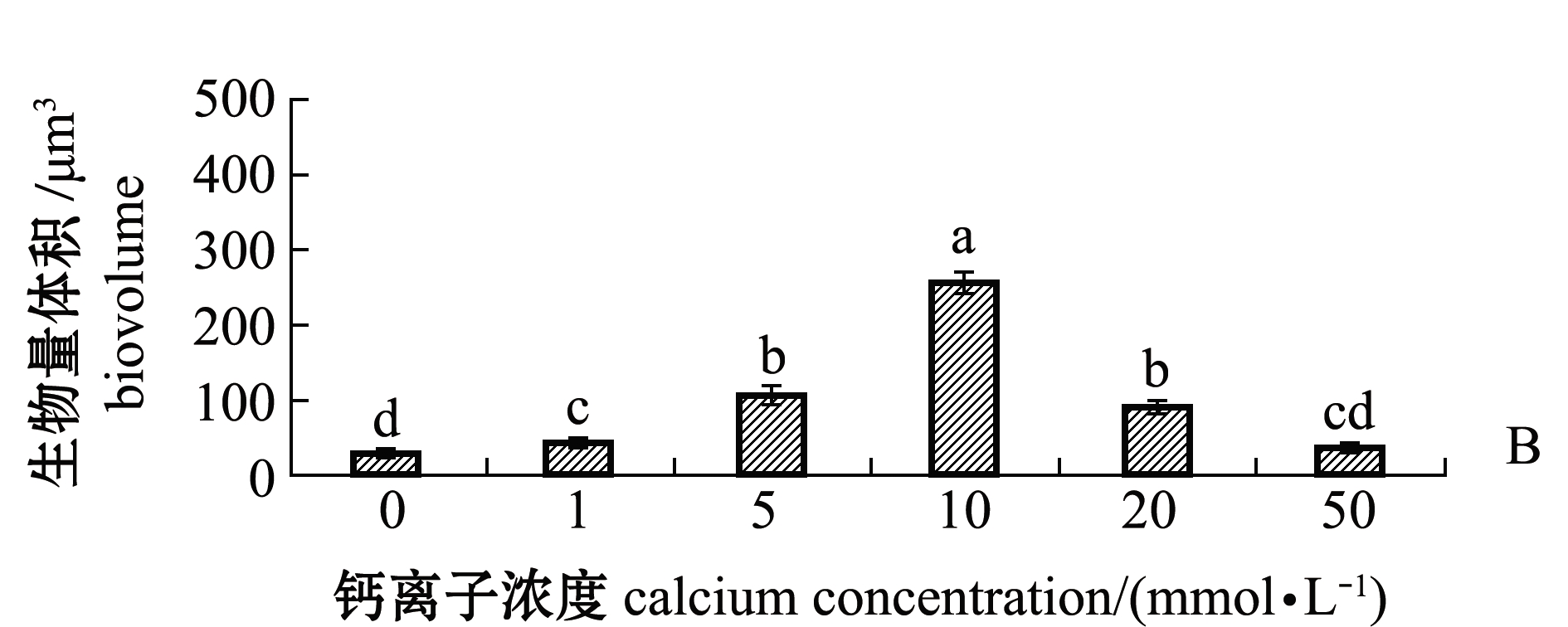
图5 不同钙离子浓度下胞外α多糖激光共聚焦图及其生物量
Fig.5 Confocal laser scanning microscope images and biovolume of extracellular α-polysaccharides under different concentrations of calcium
2.6 不同钙离子浓度对生物被膜胞外蛋白的影响
通过共聚焦显微镜观察不同钙离子浓度下培养48 h的生物被膜的胞外蛋白(图7A),海假交替单胞菌生物被膜胞外蛋白的生物量在钙离子浓度为0 mmol/L时最少,为117.47 μm3;在钙离子浓度为 10 mmol/L时,胞外蛋白的生物量升高至最多,为334.15 μm3;随着钙离子浓度继续升高,生物被膜的胞外蛋白生物量呈现显著下降趋势(P<0.05),并且除钙离子浓度为10 mmol/L外,其余浓度下生物量均无显著性差异(P>0.05)(图7B)。

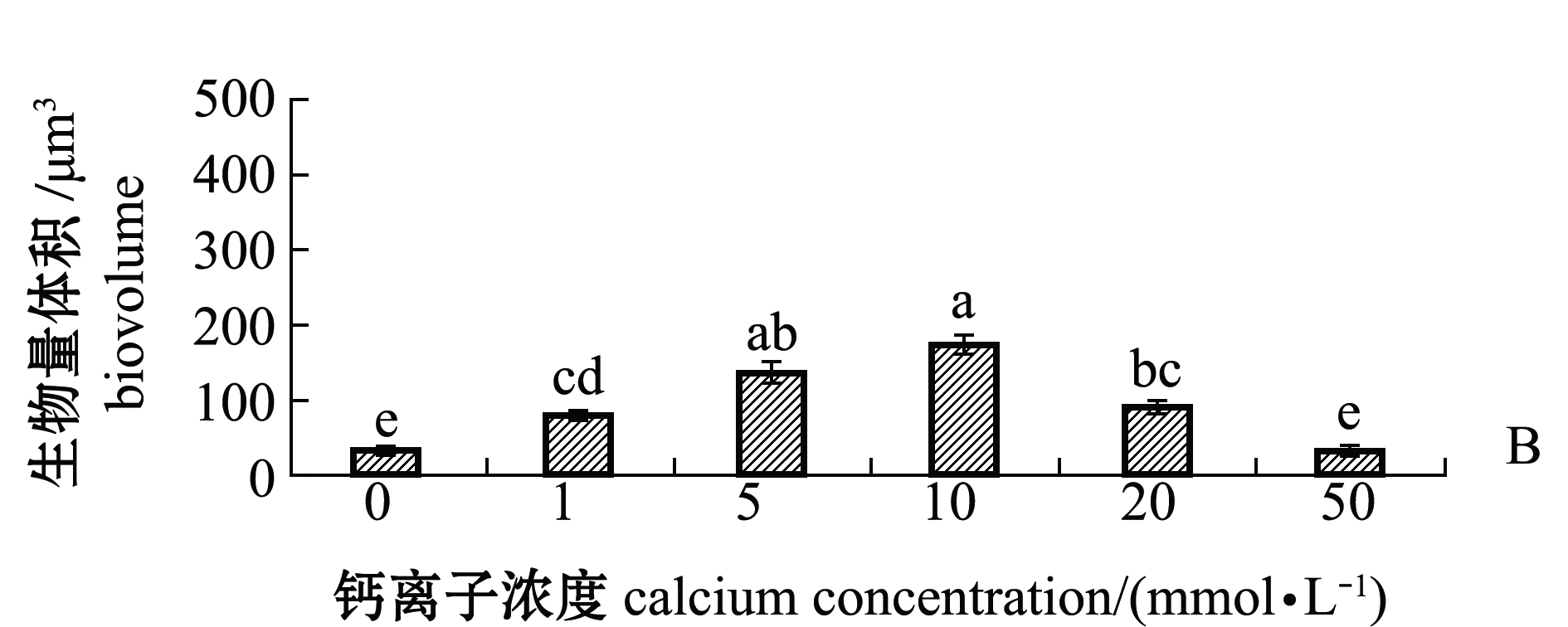
图6 不同钙离子浓度下胞外β多糖激光共聚焦图及其生物量
Fig.6 Confocal laser scanning microscope images and biovolume of extracellular β-polysaccharides under different concentrations of calcium
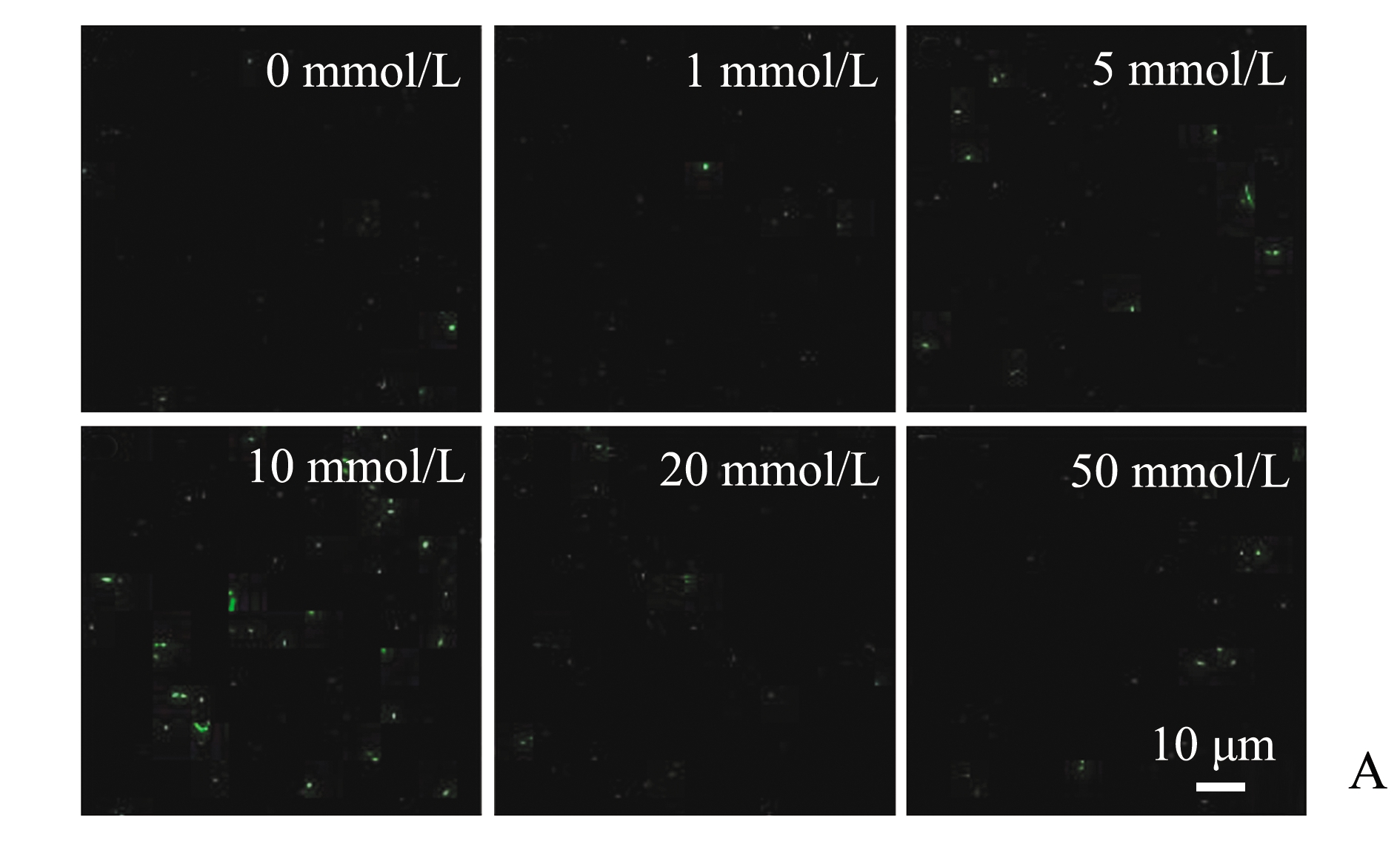
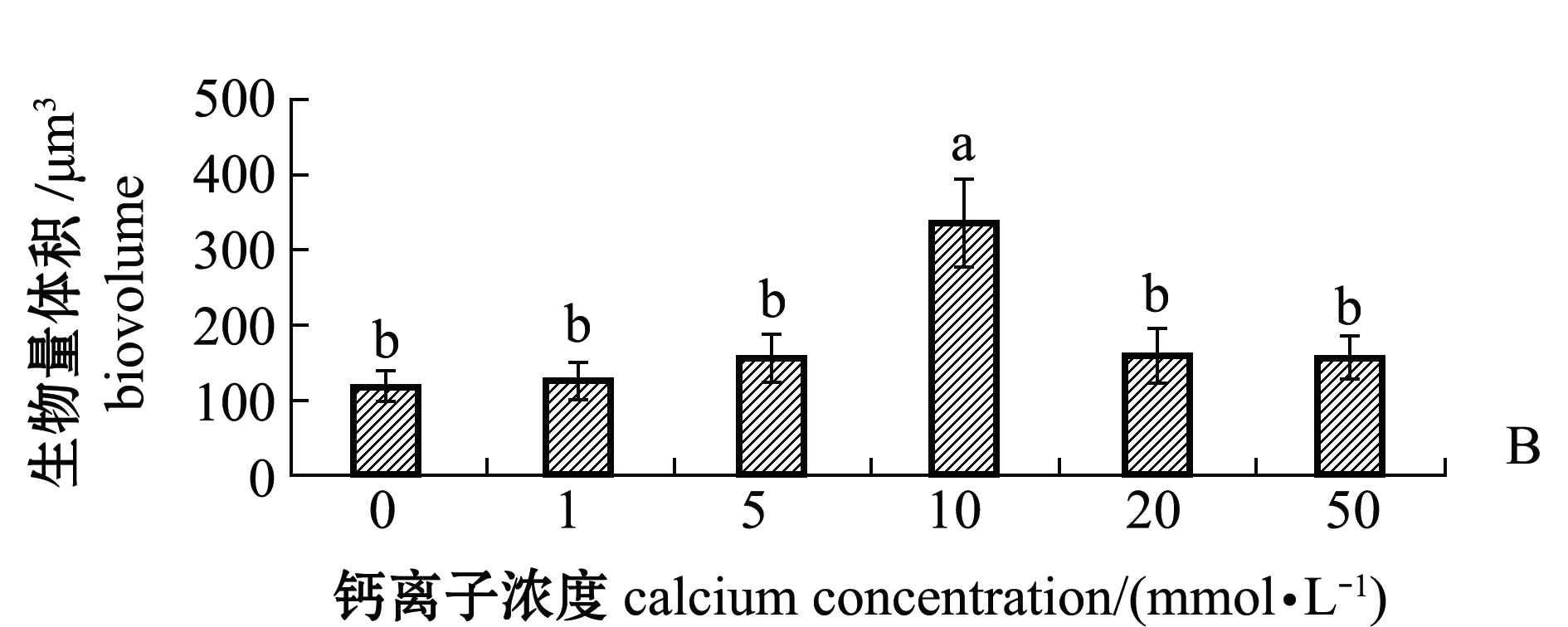
图7 不同钙离子浓度下胞外蛋白激光共聚焦图及其生物量
Fig.7 Confocal laser scanning microscope images and biovolume of extracellular proteins under different concentrations of calcium
2.7 不同钙离子浓度对生物被膜胞外脂类的影响
通过共聚焦显微镜观察不同钙离子浓度下培养48 h生物被膜的胞外脂类(图8A),海假交替单胞菌生物被膜胞外脂类的生物量在钙离子浓度为0 mmol/L时最少,仅为11.52 μm3;在钙离子浓度10 mmol/L时,胞外脂类的生物量上升至最多,为22.02 μm3;随着钙离子浓度的继续升高,生物被膜的胞外脂类生物量呈显著下降趋势(P<0.05),并且除钙离子浓度为10 mmol/L外,其余浓度下的生物量均无显著性差异(P>0.05)(图8B)。


图8 不同钙离子浓度下胞外脂类激光共聚焦图及其生物量
Fig.8 Confocal laser scanning microscope images and biovolume of extracellular lipid under different concentrations of calcium
2.8 相关性分析
从表2可见:稚贝附着率与生物被膜细菌密度、膜厚、胞外多糖和胞外蛋白呈显著相关(P<0.05);钙离子浓度仅与生物被膜膜厚呈显著相关(P<0.05),与其他因子均无显著相关性(P>0.05)。
3 讨论
低钙离子浓度能显著诱导莫桑比克罗非鱼的黏液细胞增殖,以抵抗外界胁迫[19]。同时,钙离子浓度能显著影响三角帆蚌的生长[20]。但是,目前尚未有试验验证钙离子浓度对海假交替单胞菌生物被膜和厚壳贻贝稚贝附着的影响。
表2 生物被膜生物学特征与稚贝附着率、钙离子浓度的相关性分析
Tab.2 Correlation analysis among biofilm characteristics, settlement rate of juvenile mussel and calcium concentration
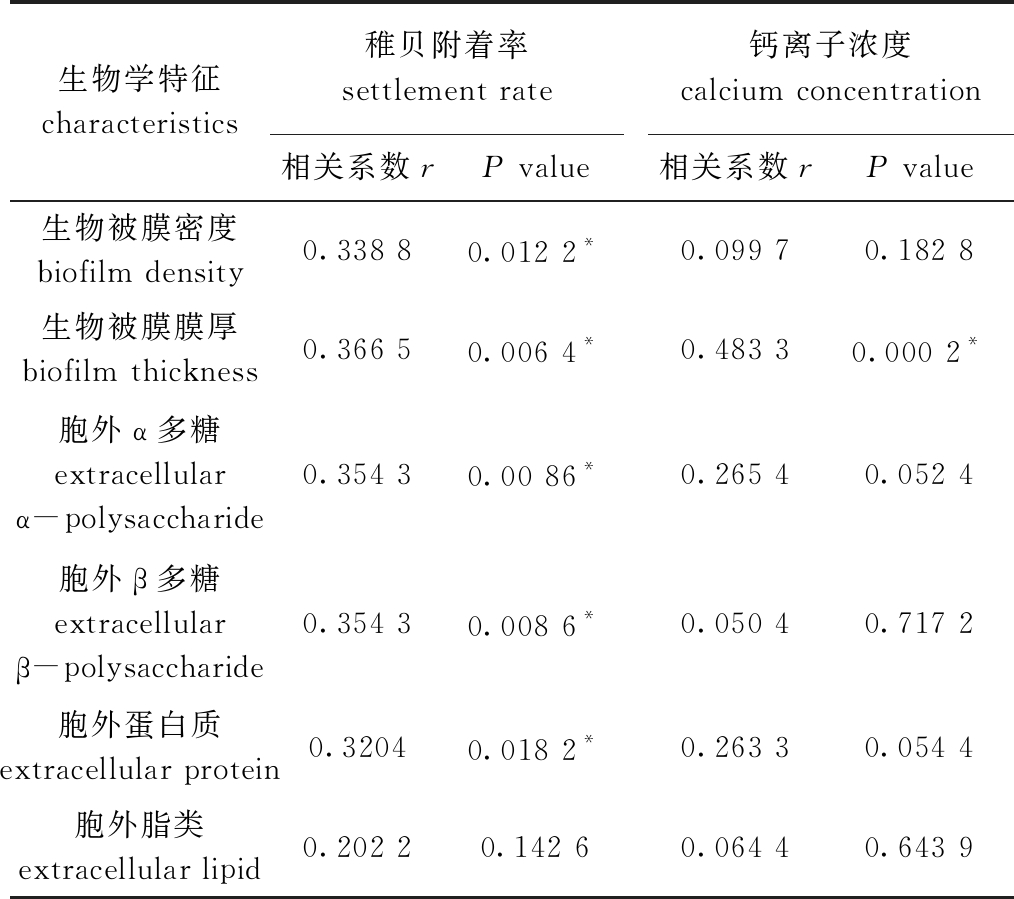
生物学特征characteristics稚贝附着率 settlement rate相关系数rP value钙离子浓度 calcium concentration相关系数rP value 生物被膜密度biofilm density0.338 80.012 2*0.099 70.182 8生物被膜膜厚biofilm thickness0.366 50.006 4*0.483 30.000 2*胞外α多糖extracellular α-polysaccharide0.354 30.00 86*0.265 40.052 4胞外β多糖extracellular β-polysaccharide0.354 30.008 6*0.050 40.717 2胞外蛋白质extracellular protein0.32040.018 2*0.263 30.054 4胞外脂类extracellular lipid0.202 20.142 60.064 40.643 9
注: *表示显著相关(P<0.05)。
Note: * means significant correlations(P<0.05).
3.1 自然海水和人工海水的比较
由于本试验中要研究钙离子浓度变化对海假交替单胞菌生物被膜和稚贝附着的影响,需要调节钙离子的浓度,故使用人工海水来调节钙离子浓度。与自然海水相比较,本试验中使用的人工海水在培养4个不同初始菌液密度下的海假交替单胞菌生物被膜形成中未产生任何显著性影响。在4个不同初始菌液密度下,人工海水培养的细菌生物被膜的细菌密度与自然海水培养的生物被膜相比无显著性的差异,两种海水分别培养的细菌生物被膜对稚贝附着的诱导活性也均无显著性差异。多次重复试验所得到的结果相同,表明该人工海水对于细菌生物被膜的形成具有极强的稳定性。说明该人工海水可用于本试验中替代自然海水进行试验。另一方面,人类活动会造成海水中氮元素、磷元素和石油类物质超标等污染问题[21],海水养殖的品质和效益受到海水水体污染影响,海洋环境污染会导致养殖品种的质量降低。因此,未来可以考虑使用人工海水替代天然海水进行陆基人工养殖。
3.2 不同钙离子浓度对生物被膜形成的影响
通过试验可以观察到生物被膜细菌密度和生物被膜厚度在钙离子浓度为10 mmol/L时达到最大值,而在其他钙离子浓度下均降低。依据共聚焦显微镜拍摄结果观察,生物被膜在钙离子浓度为10 mmol/L时细菌呈现聚集状态,在其余钙离子浓度下细菌分散且密度减少,生物被膜形成能力变差。对假交替单胞菌Pseudoalteromonas sp.的研究也有相似的结果,在钙离子浓度为10 mmol/L时,Pseudoalteromonas sp.生物被膜最厚,在其余浓度下生物被膜厚度均降低[11],该试验结果与本试验结果一致。
本研究中,依据相关性分析,钙离子浓度仅与生物被膜膜厚显著相关,生物被膜膜厚受到胞外产物生物量的影响。生物被膜的形成是连续的进程,通过浮游细菌附着到表面上,然后形成生物被膜,其中细菌被包埋在由核酸、蛋白质和多糖组成的基质中[22-24]。在生物被膜中生长的细菌产生一种或多种胞外产物,它们会充当支架,将生物被膜群落的细菌维持在一起;多糖是生物被膜基质的主要组分,其有助于生物被膜的整体结构及抗性[23, 25-26]。钙离子对微生物各方面的影响,最终主要体现在生物被膜及其胞外产物的变化上[27]。在本试验中,将培养48 h的胞外产物进行共聚焦显微镜拍摄,以验证钙离子是否也影响胞外产物。生物被膜的3种胞外产物包括多糖、脂质和蛋白质,多糖和蛋白质在胞外产物中占主导地位。在钙离子浓度10 mmol/L时,海假交替单胞菌生物被膜形成的胞外产物最多,而在其余浓度下,胞外产物减少。这些试验结果可以证实,过高或过低的钙离子浓度均能影响生物被膜的形成。
3.3 不同钙离子浓度培养的生物被膜对厚壳贻贝稚贝附着的影响
许多海洋无脊椎动物幼虫的附着变态可以被生物被膜影响[7]。皱纹和半透明两个突变菌形成的假交替单胞菌生物被膜诱导厚壳贻贝幼虫的附着变态的活性显著降低,这表明具有较强的防污损能力[28]。本试验中,除10 mmol/L钙离子浓度以外,其他钙离子浓度培养的海假交替单胞菌生物被膜均抑制了厚壳贻贝稚贝的附着,即增加或减少钙离子浓度,形成的生物被膜均可以减少稚贝的附着。
依据相关性分析,稚贝附着率与生物被膜密度、膜厚、胞外多糖和胞外蛋白显著相关。参考Yang等[17]的方法,希瓦氏菌会促进厚壳贻贝幼虫的附着变态,可能与其释放的信号分子和胞外产物有关。胞外产物主要是多糖、蛋白质、核酸和脂质,其提供了生物被膜的机械稳定性,介导了与表面的黏附,构成了一个内聚的三维聚合物网络[29]。生物被膜的胞外产物在除10 mmol/L钙离子浓度以外的其他浓度下均减少,与稚贝附着率的变化趋势一致,胞外产物的减少与稚贝附着率的减少有一定相关性。
对Pseudoalteromonas sp.的研究发现,10 mmol/L钙离子浓度导致其鞭毛蛋白表达量减少,外膜蛋白表达量增加,生物被膜形成能力增强[11]。大肠杆菌外膜蛋白OmpA已被证明可以结合非生物表面,OmpA在非生物表面上的生物被膜形成中起作用[30]。大肠杆菌ompA基因缺失突变菌形成的生物被膜厚度大大降低[31]。结合本试验结果推测,钙离子可能影响了海假交替单胞菌外膜蛋白的表达量,从而抑制了胞外产物的分泌,进而影响了生物被膜的形成和稚贝附着。
4 结论
1)钙离子浓度高于或低于与自然海水最接近的浓度10 mmol/L时,均抑制了海假交替单胞菌生物被膜的形成。
2)过高或过低钙离子浓度抑制了生物被膜密度、膜厚的形成,以及胞外多糖、胞外蛋白的分泌,进而抑制了厚壳贻贝稚贝的附着。
[1] COSTERTON J W,LEWANDOWSKI Z,CALDWELL D E,et al.Microbial biofilms[J].Annual Review of Microbiology,1995,49(1):711-745.
[2] 陈波曼,余加林,刘官信,等.SYTO9/PI荧光探针标记的铜绿假单胞菌PAO1菌株生物被膜形成的动态观察[J].第三军医大学学报,2008,30(5):390-392.
CHEN B M,YU J L,LIU G X,et al.Sequential development of biofilm spatial structure of Pseudomonas aeruginosa tagged with SYTO9/PI[J].Acta Academiae Medicinae Militaris Tertiae,2008,30(5):390-392.(in Chinese)
[3] 周轩,郭行磐,陈芋如,等.低湿度表面的海洋附着细菌对厚壳贻贝附着的影响[J].大连海洋大学学报,2015,30(1):30-35.
ZHOU X,GUO X P,CHEN Y R,et al.Effects of bacterial biofilms formed on low surface wettability on settlement of plantigrades of the mussel Mytilus coruscus[J].Journal of Dalian Ocean University,2015,30(1):30-35.(in Chinese)
[4] 高伟,郭行磐,徐嘉康,等.微生物被膜形成因子及其对厚壳贻贝附着的影响[J].大连海洋大学学报,2017,32(4):405-409.
GAO W,GUO X P,XU J K,et al.Effects of environmental factors on formation of bacterial biofilms and settlement of plantigrades of mussel Mytilus coruscus[J].Journal of Dalian Ocean University, 2017,32(4):405-409.(in Chinese)
[5] 孙俊杰,梁箫,郭行磐,等.培养基对微生物被膜形成和厚壳贻贝附着的影响[J].水产学报,2016,40(8):1229-1238.
SUN J J,LIANG X,GUO X P,et al.Effects of culture media on the biofilm formation and subsequent settlement of Mytilus coruscus[J].Journal of Fisheries of China,2016,40(8):1229-1238.(in Chinese)
[6] 黄道芬,梁箫,彭莉华,等.不同来源海洋弧菌微生物被膜对厚壳贻贝稚贝附着的影响[J].水产学报,2017,41(7):1140-1147.
HUANG D F,LIANG X,PENG L H,et al.Effects of Vibrio biofilms of different sources on settlement of plantigrades of the mussel Mytilus coruscus[J].Journal of Fisheries of China,2017,41(7):1140-1147.(in Chinese)
[7] 杨金龙,王冲,顾忠旗,等.微生物膜对海洋无脊椎动物幼体附着变态的影响研究[J].海洋科学,2012,36(8):116-121.
YANG J L,WANG C,GU Z Q,et al.A review on the role of marine biofilms on larval settlement and metamorphosis of marine invertebrates[J].Marine Sciences,2012,36(8):116-121.(in Chinese)
[8] BAO W Y,YANG J L,SATUITO C G,et al.Larval metamorphosis of the mussel Mytilus galloprovincialis in response to Alteromonas sp. 1:evidence for two chemical cues?[J].Marine Biology,2007,152(3):657-666.
[9] MAKI J S,RITTSCHOF D,COSTLOW J D,et al.Inhibition of attachment of larval barnacles,Balanus amphitrite,by bacterial surface films[J].Marine Biology,1988,97(2):199-206.
[10] BERRIDGE M J,LIPP P,BOOTMAN M D.The versatility and universality of calcium signalling[J].Nature Reviews Molecular Cell Biology,2000,1(1):11-21.
[11] PATRAUCHAN M A,SARKISOVA S,SAUER K,et al.Calcium influences cellular and extracellular product formation during biofilm-associated growth of a marine Pseudoalteromonas sp.[J].Microbiology,2005,151(9):2885-2897.
[12] K LLSTRÖM H,HANSSON-PALO P,JONSSON A B.Cholera toxin and extracellular Ca2+ induce adherence of non-piliated Neisseria:evidence for an important role of G-proteins and Rho in the bacteria-cell interaction[J].Cellular Microbiology,2000,2(4):341-351.
LLSTRÖM H,HANSSON-PALO P,JONSSON A B.Cholera toxin and extracellular Ca2+ induce adherence of non-piliated Neisseria:evidence for an important role of G-proteins and Rho in the bacteria-cell interaction[J].Cellular Microbiology,2000,2(4):341-351.
[13] MATSUMOTO M,YOSHIDA E,TAKEYAMA H,et al.Floating cultivation of marine cyanobacteria using coal fly ash[J].Applied Biochemistry and Biotechnology,2000,84/85/86:51-57.
[14] ARES M A,ABUNDES-GALLEGOS J,RODR GUEZ-VALVER- DED,et al.The coli surface antigen CS3 of enterotoxigenic Escherichia coli is differentially regulated by H-NS,CRP,and CpxRA global regulators[J].Frontiers in Microbiology,2019,10:1685.
GUEZ-VALVER- DED,et al.The coli surface antigen CS3 of enterotoxigenic Escherichia coli is differentially regulated by H-NS,CRP,and CpxRA global regulators[J].Frontiers in Microbiology,2019,10:1685.
[15] SARKISOVA S,PATRAUCHAN M A,BERGLUND D,et al.Calcium-induced virulence factors associated with the extracellular matrix of mucoid Pseudomonas aeruginosa biofilms[J].Journal of Bacteriology,2005,187(13):4327-4337.
[16] BILECEN K,YILDIZ F H.Identification of a calcium-controlled negative regulatory system affecting Vibrio cholerae biofilm formation[J].Environmental Microbiology,2009,11(8):2015-2029.
[17] YANG J L,SHEN P J,LIANG X,et al.Larval settlement and metamorphosis of the mussel Mytilus coruscus in response to monospecific bacterial biofilms[J].Biofouling,2013,29(3):247-259.
[18] GONZ LEZ-MACHADO C,CAPITA R,RIESCO-PEL
LEZ-MACHADO C,CAPITA R,RIESCO-PEL EZ F,et al.Visualization and quantification of the cellular and extracellular components of Salmonella agona biofilms at different stages of development[J].PLoS One,2018,13(7):e0200011.
EZ F,et al.Visualization and quantification of the cellular and extracellular components of Salmonella agona biofilms at different stages of development[J].PLoS One,2018,13(7):e0200011.
[19] BONGA S E W,VAN DER MEIJ J C A.Effect of ambient osmolarity and calcium on prolactin cell activity and osmotic water permeability of the gills in the teleost Sarotherodon mossambicus[J].General and Comparative Endocrinology,1981,43(4):432-442.
[20] 周子睿,施志仪,李文娟,等.不同Ca2+养殖条件下三角帆蚌外套膜和内脏团组织细胞的钙含量及其对碳酸酐酶的影响[J].海洋渔业,2017,39(1):76-84.
ZHOU Z R,SHI Z Y,LI W J,et al.Calcium content of mantle and visceral tissue cells from Hyriopsis cumingii and its effect on carbonic anhydrase in different Ca2+ culture conditions[J].Marine Fisheries,2017,39(1):76-84.(in Chinese)
[21] 谢丽凤,吴卫飞.海洋环境现状及生物修复技术研究[J].环境与发展,2019,31(4):93-95.
XIE L F,WU W F.Research on marine environment status and bioremediation technology[J].Environment and Development,2019,31(4):93-95.(in Chinese)
[22] ALLESEN-HOLM M,BARKEN K B,YANG L,et al.A characterization of DNA release in Pseudomonas aeruginosa cultures and biofilms[J].Molecular Microbiology,2006,59(4):1114-1128.
[23] BRANDA S S,VIK Å,FRIEDMAN L,et al.Biofilms:the matrix revisited[J].Trends in Microbiology,2005,13(1):20-26.
[24] O’TOOLE G,KAPLAN H B,KOLTER R.Biofilm formation as microbial development[J].Annual Review of Microbiology,2000,54(1):49-79.
[25] MAH T F,PITTS B,PELLOCK B,et al.A genetic basis for Pseudomonas aeruginosa biofilm antibiotic resistance[J].Nature,2003,426(6964):306-310.
[26] MATSUKAWA M,GREENBERG E P.Putative exopolysaccharide synthesis genes influence Pseudomonas aeruginosa biofilm development[J].Journal of Bacteriology,2004,186(14):4449-4456.
[27] GARRISON-SCHILLING K L,GRAU B L,MCCARTER K S,et al.Calcium promotes exopolysaccharide phase variation and biofilm formation of the resulting phase variants in the human pathogen Vibrio vulnificus[J].Environmental Microbiology,2011,13(3):643-654.
[28] ZENG Z S,GUO X P,LI B Y,et al.Characterization of self-generated variants in Pseudoalteromonas lipolytica biofilm with increased antifouling activities[J].Applied Microbiology and Biotechnology,2015,99(23):10127-10139.
[29] FLEMMING H C,WINGENDER J.The biofilm matrix[J].Nature Reviews Microbiology,2010,8(9):623-633.
[30] LOWER B H,YONGSUNTHON R,VELLANO Ⅲ F P,et al.Simultaneous force and fluorescence measurements of a protein that forms a bond between a living bacterium and a solid surface[J].Journal of Bacteriology,2005,187(6):2127-2137.
[31] BARRIOS A F G,ZUO R J,REN D C,et al.Hha,YbaJ,and OmpA regulate Escherichia coli K12 biofilm formation and conjugation plasmids abolish motility[J].Biotechnology and Bioengineering,2006,93(1):188-200.