罗氏沼虾Macrobrachium rosenbergii的头胸甲内具有近似于蟹黄的独特风味[1],且活体虾的营养和经济价值更高,因此,其活体的储运显得尤为重要。保活运输过程中为降低虾体的应激反应及物理损伤等,往往通过麻醉法以镇静活体[2]。目前,报道使用的麻醉剂有MS-222、乙二醇苯醚、丁香酚、苯唑卡因等[3],但使用这些化学药物均存在安全隐患,且对虾体的麻醉效果不佳。Coyle等[4]研究表明,仅丁香酚对罗氏沼虾有效;李全[5]用乙醇麻醉罗氏沼虾发现,高浓度乙醇极易造成虾体死亡,而较低浓度的乙醇麻醉时间较长。已有研究表明,CO2对水产动物具有麻醉作用,且无药物残留和休药期,可直接在市场销售[6],具有安全、高效、经济等特点。目前,CO2麻醉法已广泛应用于鱼类活运研究,但在虾类(甲壳类)的研究中鲜有报道,尤其对影响虾体保活运输因素的探究及保活工艺等基础原理性方面尚待进一步研究。
本研究中,采用CO2麻醉法保活运输罗氏沼虾,通过确定罗氏沼虾麻醉与复苏阶段分期,研究了CO2麻醉浓度、保活温度、虾水质量比对其保活效果的影响,并通过检测水质指标及虾体不同组织部位指标的变化,研究了影响罗氏沼虾保活的机理,以期为罗氏沼虾保活运输提供科学参考。
1 材料与方法
1.1 材料
罗氏沼虾购于上海市浦东新区新芦苑集贸市场,充氧水运至实验室后,于暂养池中饥饿暂养24 h,水温为(25±1)℃,体质量为20~30 g,体长为10~15 cm。其中,暂养及保活用水均为充分曝气后的自来水。
试验仪器:JPB-607型便携式溶解氧测定仪(上海精密科学仪器有限公司);FE28型pH计(梅特勒-托利多仪器上海有限公司);5B-3N型便携式氨氮测定仪(上海连华实业有限公司);UV-1800PC紫外可见分光光度计(上海美谱达仪器有限公司);WS60CO2035二氧化碳电极(上海水仪科技有限公司)。
1.2 方法
1.2.1 罗氏沼虾麻醉与复苏程度 根据相关研究并结合罗氏沼虾在不同浓度CO2麻醉液中的实际行为反应,将麻醉程度分为A1~A4阶段,复苏程度分为R1~R3阶段(表1、表2)。将麻醉处理后的罗氏沼虾放入正常充空气的试验用水中复苏,一段时间后用玻璃棒触碰,有应激反应者视为活体,经反复刺激仍然无反应者视为死亡。
表1 麻醉阶段分期及其行为特征
Tab.1 Stages and anaesthesia behavioral characteristics during anesthesia
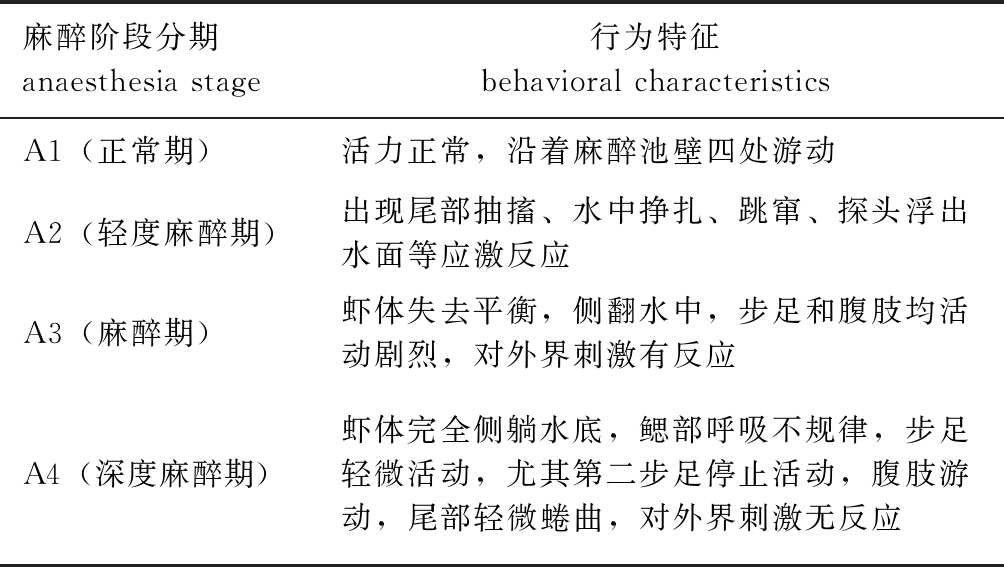
麻醉阶段分期 anaesthesia stage行为特征 behavioral characteristicsA1(正常期)活力正常,沿着麻醉池壁四处游动A2(轻度麻醉期)出现尾部抽搐、水中挣扎、跳窜、探头浮出水面等应激反应A3(麻醉期)虾体失去平衡,侧翻水中,步足和腹肢均活动剧烈,对外界刺激有反应A4(深度麻醉期)虾体完全侧躺水底,鳃部呼吸不规律,步足轻微活动,尤其第二步足停止活动,腹肢游动,尾部轻微蜷曲,对外界刺激无反应
表2 复苏阶段分期及其行为特征
Tab.2 Stages and behavioral characteristics during recovery

复苏阶段分期 recovery stage行为特征 behavioral characteristicsR1虾体侧躺水底,处于静止状态,步足和腹肢恢复活动,对外界刺激反应迟钝R2虾体逐渐平衡,步足和腹肢活动剧烈,对外界刺激有反应R3虾体完全恢复平衡,步足和腹肢正常游动,对外界刺激反应强烈,活力完全恢复
1.2.2 CO2质量浓度、保活温度和保活虾水质量比对虾体存活时间与存活率的单因素试验 根据预试验结果,在CO2质量浓度180 mg/L、保活温度20 ℃和保活虾水质量比1∶12条件下,固定其中两个因素,分别进行不同CO2质量浓度、不同保活温度和不同保活虾水质量比对虾体麻醉及保活的影响试验。每个试验组均设3个平行,每个平行用虾25尾,分别在试验的第0、12、24、36、48 h进行观察,计算其保活时间和存活率。
存活率=存活虾数量/试验虾总数量×100%。
1)麻醉过程中CO2质量浓度选择试验。试验设60、120、180、240、300 mg/L 5个CO2质量浓度组,将暂养24 h后活力正常的虾体放入不同质量浓度的CO2麻醉液中,麻醉全程处于密封状态,待虾体达到A4深度麻醉阶段时,及时转移至保活箱中。观察不同质量浓度CO2的虾体麻醉和复苏效果,以及对虾体存活时间及存活率的影响效果。
麻醉液的配制:在常温状态下向水体充入纯氧(5 min),再通入混合气体(CO2∶O2=1∶1),通过控制气体流速和通入时间,得到不同质量浓度的CO2麻醉液(CO2浓度采用CO2气敏选择性电极测定),密封状态下静置5 min后进行虾体麻醉试验。
2)保活过程中虾水质量比选择试验。试验设1∶3、1∶6、1∶9、1∶12共4个虾水质量比组,采用静态保活法,将麻醉后的虾体迅速转移至不同虾水质量比的保活箱内。
3)保活过程中温度选择试验。试验设12、16、20、25 ℃ 4个温度组,以1~2 ℃/h降温或升温速率控制保活箱内的温度。
1.2.3 正交试验 采用正交试验考察CO2麻醉质量浓度(150、180、210 mg/L)、保活温度(18、20、22 ℃)、保活虾水质量比(1∶8、1∶9、1∶10)对罗氏沼虾保活效果的影响,分别以保活48 h罗氏沼虾的存活率和保活24 h水体总氨氮质量浓度为考核指标,确定最佳条件并进行验证试验。
1.2.4 最佳麻醉及保活条件下水体理化、细菌总数及虾体能量、酶活性指标的变化试验 以正交优化后的最佳条件(CO2麻醉质量浓度为150 mg/L、保活温度为18 ℃、虾水质量比为1∶10)进行试验,从保活水质环境、虾体本身生理生化等方面探究CO2麻醉处理对罗氏沼虾保活的影响,并设置在常温下未经CO2麻醉处理的保活组为试验对照组。
1)保活过程中水体指标的测定。麻醉组和对照组在保活过程中48 h内的不同时间段从保活箱中随机取水样,采用5B-3N便携式氨氮测定仪、pH计、溶氧测定仪分别测定氨氮质量浓度、pH和溶解氧含量,根据标准GB4789.2—2016《食品卫生微生物检验:菌落总数测定》的平板计数法(APC)测定细菌总数。
2)保活过程中虾体生理生化指标的测定。麻醉组和对照组在保活过程中48 h内的不同时间段随机取虾样20尾,采集血液、肝脏和肌肉进行指标测定。
血液生化指标的测定:虾血液谷草转氨酶(AST)、谷丙转氨酶(ALT)、肝脏糖原、丙二醛(MDA)、总超氧化物歧化酶(T-SOD)活力、肌肉糖原、乳酸含量均采用南京建成生物工程研究所试剂盒测定。
肌肉pH测定:称取5 g虾肌肉样品,加入45 mL蒸馏水,均质2 min后冷冻离心10 min(5 000 r/min、4 ℃),过滤后取上清液进行pH测定。
肌肉核苷酸(ATP)含量测定:参照杨阳[7]的方法略有改动。采用Waters2695高效液相色谱仪测定。称取5 g肌肉样品,加入10 mL的10%高氯酸(PCA),均质、配平,冷冻离心15 min(4 ℃、10 000 r/min),取上清液,再加入5 mL的5%PCA溶液分两次洗涤沉淀物,离心,合并3次上清液,用KOH溶液调节pH至6.5,定容至50 mL,用0.22 μm滤膜过滤,-20 ℃保存,待上机。
高效液相色谱条件:流动相,A为色谱级甲醇溶液,B为0.05 mol/L的磷酸氢二钾与磷酸二氢钾(1∶1)混合溶液,使用磷酸溶液调节pH至6.5;等梯度洗脱,流速为1.0 mL/min,柱温为25 ℃,进样量为10 μL,检测波长为254 nm。
1.3 数据处理
试验数据均以平均值±标准差(mean±S.D.)表示,试验结果采用SPSS 24.0进行单因素方差分析(ANOVA),采用Duncan法进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 不同CO2质量浓度对罗氏沼虾的麻醉效果
从表3、表4可见,随着CO2质量浓度的增加,麻醉时间逐渐缩短,而复苏时间相应增加,但在17 min内均能达到100%复苏。
表3 罗氏沼虾在不同CO2质量浓度麻醉液中的麻醉情况
Tab.3 Anesthesia condition of giant freshwater prawn Macrobrachium rosenbergii exposed to different concentrations of CO2 anaesthetic fluid
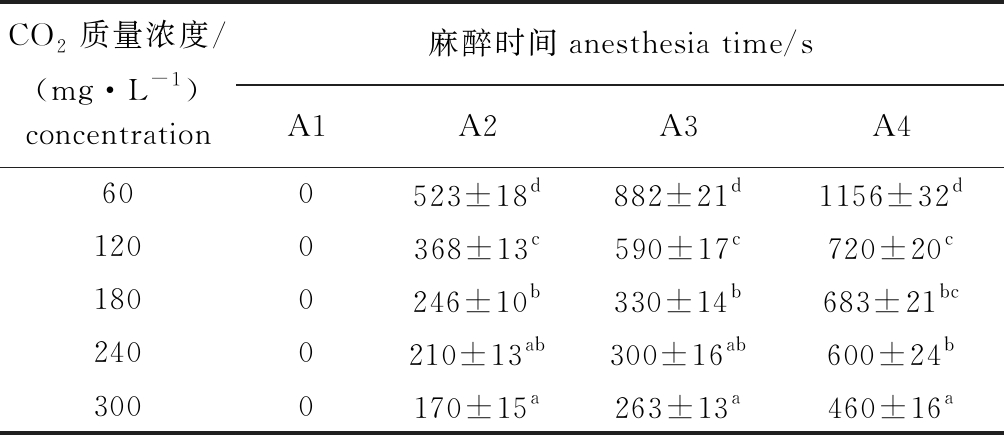
CO2质量浓度/(mg·L-1)concentration麻醉时间anesthesia time/sA1A2A3A4600523±18d882±21d1156±32d1200368±13c590±17c720±20c1800246±10b330±14b683±21bc2400210±13ab300±16ab600±24b3000170±15a263±13a460±16a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences, et sequentia.
2.2 不同CO2麻醉质量浓度下罗氏沼虾的存活率
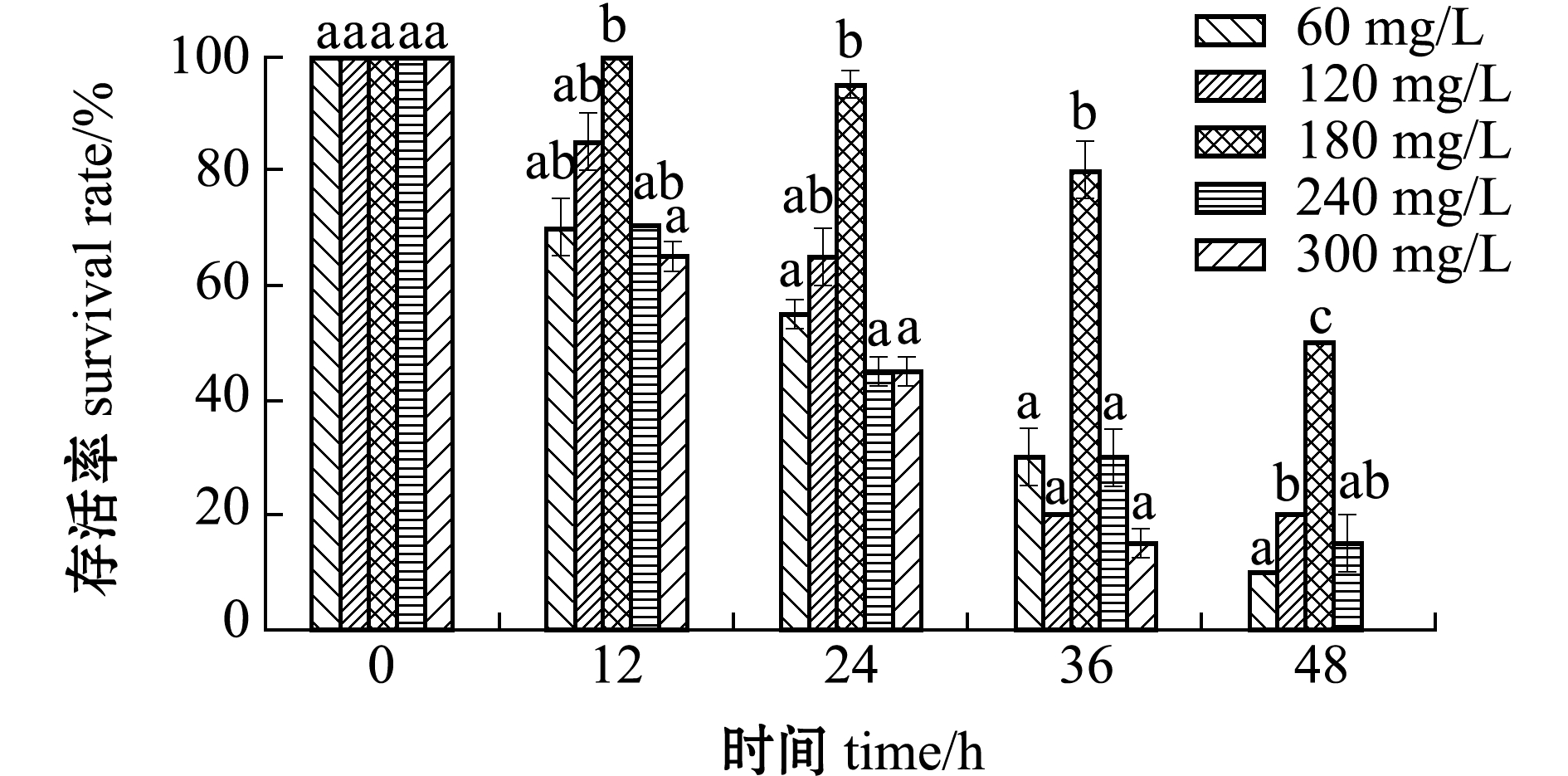
将麻醉后的虾放入温度为20 ℃、虾水质量比为1∶12的水体中保活,不同CO2麻醉质量浓度对罗氏沼虾保活时间和存活率的影响如图1所示。从图1可见:CO2质量浓度对罗氏沼虾的保活时间和存活率有显著性影响(P<0.05);CO2质量浓度为240、300 mg/L时,保活24 h后的存活率均低于50%;CO2质量浓度为60、120 mg/L时,在保活36 h后的存活率明显下降(P<0.05);而麻醉液质量浓度为180 mg/L时保活效果最好,保活48 h的存活率仍在50%以上,故选择CO2麻醉质量浓度为180 m/L较适宜。
表4 罗氏沼虾在不同CO2质量浓度麻醉液中的复苏情况
Tab.4 Recovery condition of giant freshwater prawn Macrobrachium rosenbergii exposed to different concentrations of CO2 anaesthetic fluid

CO2质量浓度/(mg·L-1)concentration复苏时间recovery time/sR1R2R3复苏率/%recovery rate60202±12a420±25a780±18a100120225±15a490±27ab830±25a100180238±11a503±20b855±25a100240315±16b550±13bc960±26b100300360±12c600±22c1020±19b100
标有不同字母者表示同一保活时间下不同组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。 The means with different letters in the same survival time are significant differences in different groups at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia.
图1 CO2质量浓度对罗氏沼虾存活时间与存活率的影响
Fig.1 Effects of different CO2 concentrations on the survival time and survival rate of giant freshwater prawn Macrobrachium rosenbergii
2.3 不同保活温度下罗氏沼虾的存活率
虾体经180 mg/L的CO2麻醉液麻醉后,放入虾水质量比为1∶12的水体中保活,不同保活温度对罗氏沼虾保活时间和存活率的影响如图2所示。从图2可见:20 ℃下,保活48 h的存活率依然达到70%以上;12、16 ℃下保活24 h已基本死亡;25 ℃下虽然在保活初期保持较高存活率,但保活36、48 h的存活率显著降低(P<0.05),故选择保活温度为20 ℃较为适宜。

图2 保活温度对罗氏沼虾存活时间与存活率的影响
Fig.2 Effects of preservation temperature on the survival time and survival rate of giant freshwater prawn Macrobrachium rosenbergii
2.4 不同虾水质量比下罗氏沼虾的存活率
虾体经180 mg/L的CO2麻醉液麻醉后,放入温度为20 ℃的水体中保活,不同虾水质量比对罗氏沼虾保活时间和存活率的影响如图3所示。从图3可见,随着水量增加,罗氏沼虾的保活时间和存活率均呈上升趋势;虾水质量比高于1∶9时,对其保活效果产生明显影响,虾水质量比在1∶9和1∶12时保活48 h内均有较高存活率且二者变化不显著(P>0.05),综合考虑实际应用成本,选择虾水质量比为1∶9较为适宜。

图3 虾水质量比对罗氏沼虾存活时间与存活率的影响
Fig.3 Effects of prawn to water ratio on the survival time and survival rate of giant freshwater prawn Macrobrachium rosenbergii
2.5 正交试验结果
根据单因素试验结果,选择CO2麻醉质量浓度(150、180、210 mg/L)、保活温度(18、20、22 ℃)、虾水质量比(1∶8、1∶9、1∶10)进行3因素3水平L9(34)[12]正交试验,并进行方差分析,结果见表5~表7,其中,CO2麻醉质量浓度、保活温度和虾水质量比对罗氏沼虾存活率及水体总氨氮质量浓度具有显著性影响(P<0.05),各因素影响不同参考指标的主次关系均为A(CO2质量浓度)>B(保活温度)>C(虾水质量比),影响存活率的最佳水平组合为A1B1C3,即CO2麻醉质量浓度为150 mg/L、保活温度为18 ℃、虾水质量比为1∶10。
表5 罗氏沼虾CO2麻醉保活正交试验设计及结果
Tab.5 Design and results of orthogonal experiment about CO2 anaesthetic to keep-alive of giant freshwater prawn Macrobrachium rosenbergii
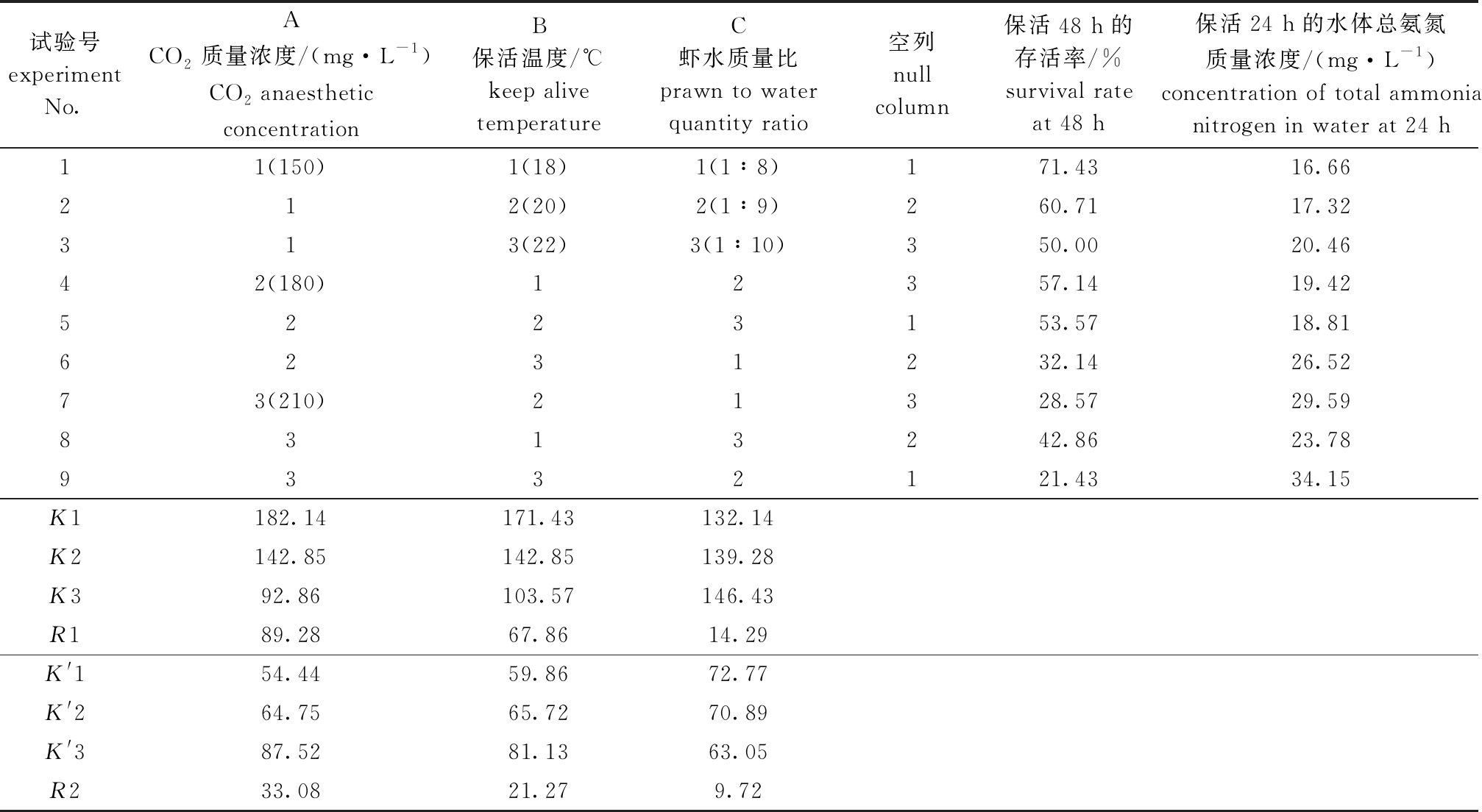
试验号experimentNo.A CO2质量浓度/(mg·L-1)CO2 anaesthetic concentrationB 保活温度/℃keep alive temperatureC 虾水质量比prawn to water quantity ratio空列null column保活48 h的存活率/%survival rate at 48 h保活24 h的水体总氨氮质量浓度/(mg·L-1)concentration of total ammonia nitrogen in water at 24 h11(150)1(18)1(1∶8)171.4316.66212(20)2(1∶9)260.7117.32313(22)3(1∶10)350.0020.4642(180)12357.1419.425223153.5718.816231232.1426.5273(210)21328.5729.598313242.8623.789332121.4334.15K1182.14171.43132.14K2142.85142.85139.28K392.86103.57146.43R189.2867.8614.29K'154.4459.8672.77K'264.7565.7270.89K'387.5281.1363.05R233.0821.279.72
注:K为保活48 h的存活率下的数值总和;K′为保活24 h的水体总氨氮质量浓度下的数值总和;R为极差。
Note: K,the sum of values of the survival rate in 48 hours; K′,the sum of values of the total ammonia nitrogen concentration in the water at alive for 24 hours; R, range.
表6 方差分析表(因变量:存活率)
Tab.6 ANOVA table (dependent variable: survival rate)

差异来源difference between the source偏差平方和deviation square自由度degrees of freedom平均偏差deviation from the meanF值F valueP值P value校正模型 correction model2 142.7386357.12327.9690.035*截距 intercept19 399.847119 399.8471 519.3270.001**A1 334.8472667.42352.2700.019*B773.8572386.92930.3030.032*C34.034217.0171.3330.429误差 error25.537212.769总误差 total error21 568.1229校正总误差corrected total error2 168.2768
注: *为影响显著(P<0.05); **为影响极显著(P<0.01),下同。
Note: *, significant impact(P<0.05); **, very significant impact(P<0.01), et sequentia.
表7 方差分析表(因变量:总氨氮质量浓度)
Tab.7 ANOVA table (dependent variable: total ammonia nitrogen concentration)
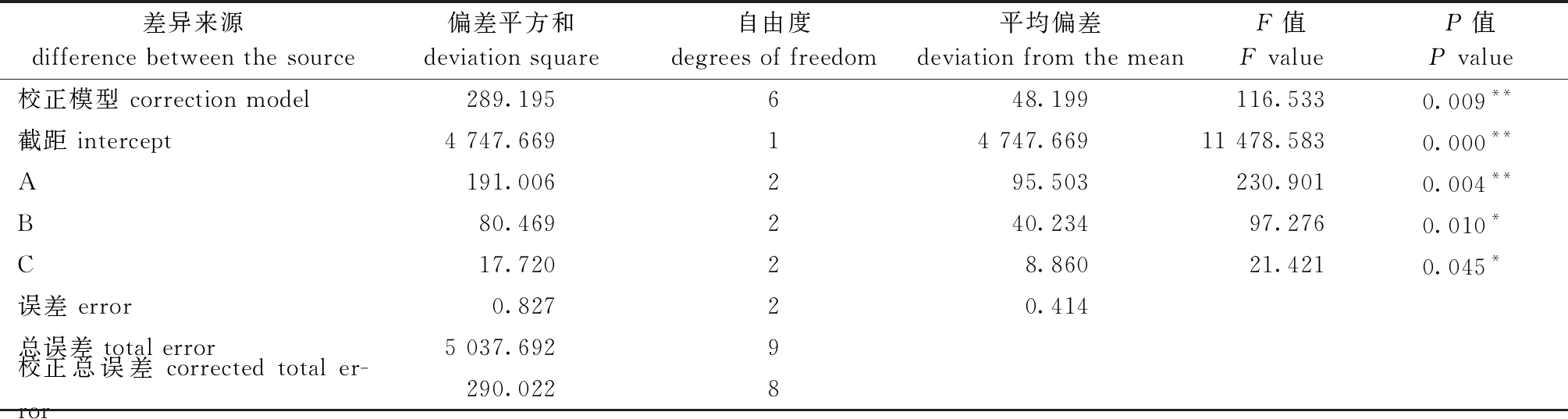
差异来源difference between the source偏差平方和deviation square自由度degrees of freedom平均偏差deviation from the meanF值F valueP值P value校正模型 correction model289.195648.199116.5330.009**截距 intercept4 747.66914 747.66911 478.5830.000**A191.006295.503230.9010.004**B80.469240.23497.2760.010*C17.72028.86021.4210.045*误差 error0.82720.414总误差 total error5 037.6929校正总误差 corrected total er-ror290.0228
2.6 最佳条件的验证试验
对正交试验结果进行验证,罗氏沼虾经质量浓度为150 mg/L CO2麻醉后,在保活温度为18 ℃、虾水质量比为1∶10的条件下进行保活试验,保活48 h内存活率达90%以上,水体总氨氮质量浓度控制在20 mg/L以下。存活率比对照组提高了40%,总氨氮质量浓度下降了44%。在此条件下,虾的麻醉和复苏效果最好,在一定程度上降低了新陈代谢、耗氧,减缓了排泄,抑制了微生物的快速生长和繁殖,并保持了水体环境。
2.7 影响罗氏沼虾保活因素的分析
2.7.1 水质指标的变化 在最佳CO2麻醉及保活条件下,考察水体理化指标及细菌总数的变化。从表8可见:试验过程中,麻醉组水体pH低于对照组;麻醉组48 h水体溶氧量为(6.45±0.53)mg/L,略高于对照组(5.86±0.63)mg/L(P>0.05);随保活时间延长,各组细菌总数和总氨氮浓度均显著上升(P<0.05),但其麻醉组均低于对照组。因此,水体中pH、溶氧量、总氨氮浓度和细菌总数均是影响虾体保活运输存活率的主要原因。
2.7.2 虾体肌肉、血液和肝脏指标的变化 在保活24~48 h内,对照组肌肉糖原、乳酸、pH和ATP均有显著性变化(P<0.05),而麻醉组的变化相对比较平缓,尤其是肌肉糖原、乳酸;保活48 h时,麻醉组和对照组肌糖原含量较0 h分别降低了48.97%和68.75%,麻醉组乳酸含量比对照组低,而pH和ATP含量较对照组高(图4A、B、C、D),因而麻醉组保活时间更长、存活率也更高。
麻醉组和对照组血液AST和ALT活力均显著上升(P<0.05),但麻醉组始终低于对照组(图4E、F)。麻醉组血液AST和ALT酶活力也不同程度地出现上升,这可能是由于急性温度胁迫使罗氏沼虾产生了应激反应所致。这表明,CO2麻醉保活能在一定程度上有效降低这种影响。
麻醉组和对照组肝糖原含量在0~24 h均显著下降(P<0.05),但麻醉组下降幅度小,48 h时麻醉组和对照组较保活前(0 h)分别降低了61.34%和75.78%(图4G)。
随保活时间延长,各组肝脏T-SOD活力呈先下降后上升趋势,而MDA含量则呈先上升后下降趋势,麻醉组比对照组均提前12 h变化(图4H、I)。这表明,虾体抗氧化防御系统能及时清除体内产生的自由基且抗氧化能力可恢复。
表8 保活过程中水质及细菌总数的变化
Tab.8 Changes in water quality and total bacterial count during keep-alive process
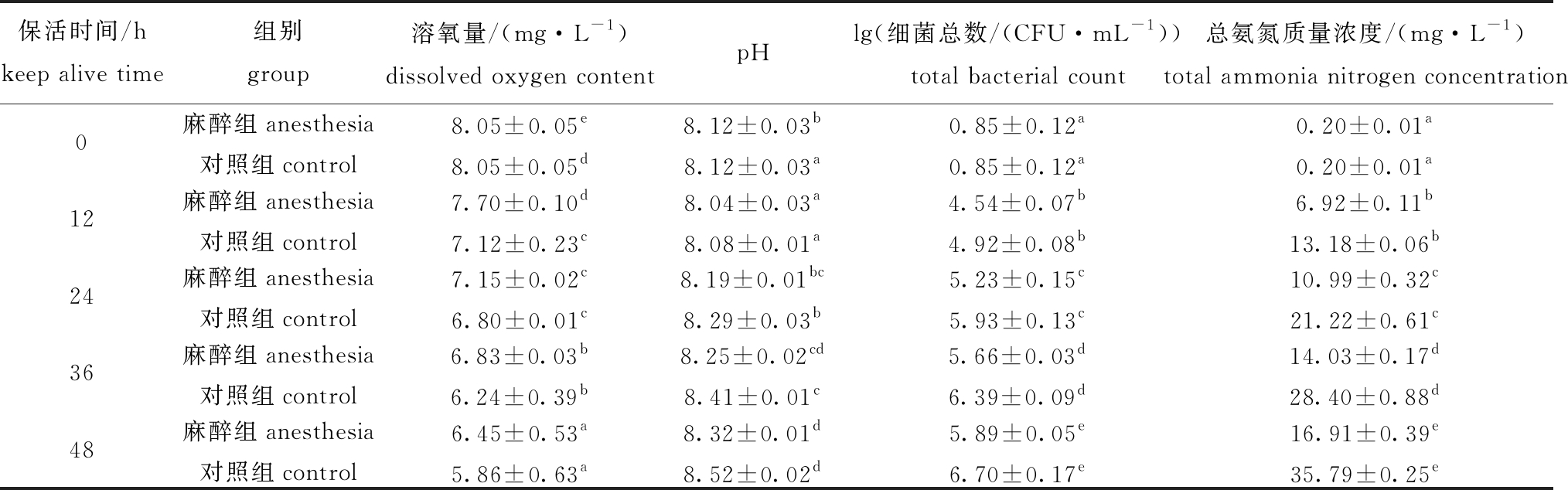
保活时间/hkeep alive time组别group溶氧量/(mg·L-1)dissolved oxygen contentpHlg(细菌总数/(CFU·mL-1))total bacterial count总氨氮质量浓度/(mg·L-1)total ammonia nitrogen concentration0麻醉组anesthesia8.05±0.05e8.12±0.03b0.85±0.12a0.20±0.01a对照组control8.05±0.05d8.12±0.03a0.85±0.12a0.20±0.01a12麻醉组anesthesia7.70±0.10d8.04±0.03a4.54±0.07b6.92±0.11b对照组control7.12±0.23c8.08±0.01a4.92±0.08b13.18±0.06b24麻醉组anesthesia7.15±0.02c8.19±0.01bc5.23±0.15c10.99±0.32c对照组control6.80±0.01c8.29±0.03b5.93±0.13c21.22±0.61c36麻醉组anesthesia6.83±0.03b8.25±0.02cd5.66±0.03d14.03±0.17d对照组control6.24±0.39b8.41±0.01c6.39±0.09d28.40±0.88d48麻醉组anesthesia6.45±0.53a8.32±0.01d5.89±0.05e16.91±0.39e对照组control5.86±0.63a8.52±0.02d6.70±0.17e35.79±0.25e

标有不同大写字母者表示麻醉组不同时间点间有显著性差异(P<0.05),标有不同小写字母者表示对照组不同时间点间有显著性差异(P<0.05),标有相同字母者表示不同时间点间无显著性差异(P>0.05)。 The means with different capital letters are very significantly different among the anesthesia groups in different time at the 0.05 probability level,means with different letters being significantly different at the 0.05 probability level, and the means with the same letter in different time are not significant differences.
图4 保活过程中虾体肌肉、血液和肝脏指标的变化
Fig.4 Changes in muscle, blood and liver indices during keep-alive process
3 讨论
3.1 CO2麻醉质量浓度、保活温度和虾水质量比对罗氏沼虾存活率的影响
本研究结果表明,CO2麻醉质量浓度、保活温度和虾水质量比均对罗氏沼虾的存活率有显著性影响,当CO2质量浓度高于150~210 mg/L时,虾体在麻醉阶段的生理耐受压力迅速上升,虾体本身因细胞能量代谢所产生的CO2不能及时排出体外,导致虾体在保活过程中长期处于酸碱环境失衡的状态,进而使虾体内血液的载氧能力下降,出现窒息甚至死亡[8];而较低CO2质量浓度也使虾体在保活过程中快速复苏,无法长期有效降低虾体新陈代谢,从而使水质逐渐变差,造成虾体能量的快速消耗。
保活温度控制在18~22 ℃可有效提高罗氏沼虾的存活率,这一结果与Coyle等[9]得出的有水运输罗氏沼虾适宜温度为21 ℃的结果基本相似。作为热带虾类的罗氏沼虾,其生存最适温度为22~30 ℃,适当的低温可有效降低虾体新陈代谢,尤其与CO2麻醉协同作用可一定程度上延缓虾体的复苏,使其在较长一段时间处于低氧耗、低能耗的状态,从而延长保活的时间和提高存活率。
当前实际水产品活运过程中,依然以有水运输为主,综合考虑经济效益、存活率和保活时间等各方面因素,在CO2质量浓度和保活温度既定的情况下,虾水质量比选择1∶8~1∶10较为适宜,此条件下可以较好地保持水体环境,一定程度上起到稀释水体氨氮浓度的作用。
3.2 CO2麻醉处理对保活过程中水质指标的影响
适宜罗氏沼虾正常生存的水体溶氧量≥4.0 mg/L,pH为7.0~8.5[10]。本试验中,水体溶解氧因保活期间持续充氧均在合理范围内变化,而对照组pH超标。麻醉组的pH、氨氮质量浓度、细菌总数均低于对照组,这与麻醉组虾代谢低于对照组、排泄物少、耗氧量低、微生物生长繁殖速度慢有一定关系。麻醉组保活48 h总氨氮质量浓度为(16.91±0.39)mg/L,显著低于对照组的总氨氮质量浓度(35.79±0.25)mg/L,这说明CO2麻醉处理结合温度控制能有效降低虾体代谢产生氨氮,延长保活时间和存活率。随着保活时间的延长,水体成分会继续发生变化,总氨氮质量浓度增加、溶氧量下降、细菌总数增加,而氨氮中的非离子氨对虾体有直接的毒性,会破坏虾鳃组织,使虾体血液和组织中氨浓度升高,从而降低血液载氧能力,导致代谢功能失常或组织机能损伤[11]。
3.3 CO2麻醉处理对保活过程中罗氏沼虾肌肉、血液和肝脏组织指标的影响
肌肉组织的糖原、乳酸、pH和ATP的变化能反映机体内能量代谢的消耗[12]。本试验在保活过程中,随着水体细菌大量滋生、氨氮浓度上升和溶解氧含量下降,引起机体有氧代谢强度逐渐降低,肌糖原酵解上升,乳酸增加,肌肉pH和ATP含量下降。这一结果与Barcellos等[13]研究克林雷氏鲇R.quelen的饥饿胁迫过程中糖原含量变化相似,均与水体氧分压下降而导致的机体肌糖原消耗有关[14-16]。Weber等[17]在使用不同麻醉剂麻醉Senegalese sole的应激反应研究中指出,麻醉剂能使乳酸浓度升高。Samet等[18]研究斑节对虾Penaeus japonicus及Bernardi等[19]研究美国龙虾Homarus americanus的无水保活时,均得到乳酸含量持续升高的结果,并认为乳酸是无氧代谢的最终产物。
血液中的酶活是反映虾体健康水平的重要生化指标,正常情况下,ALT主要存在于肝脏细胞中,是评判肝脏损伤水平的重要指标[20]。AST主要存在于心肌细胞中,可反映心肌的受损程度[21]。本研究结果显示,保活过程中,对照组罗氏沼虾AST和ALT活性明显高于麻醉组,说明对照组保活期间虾体新陈代谢旺盛促使水质恶化,造成肝脏细胞急剧损伤和心肌收缩力加强,负荷超重[22-23],进而导致细胞物理通透性增加[24],使AST和ALT大量释放到血液中。高权新等[25]研究银鲳幼鱼急性温度胁迫时也得到相同的结论。
本试验在保活过程中,虾体肝糖原和肌糖原下降趋势保持一致,但肝糖原的能量供给明显高于肌糖原,这可能因为由应激因子引起的糖原消耗主要来自肝脏,而肌糖原的变化主要与肌肉活动有关。MDA及T-SOD通常作为常用指标共同判断机体内氧化应激水平,MDA含量可反映机体自由基产生及脂质氧化的程度,并间接反映细胞损伤程度[26]。T-SOD活力可反映机体清除自由基的能力 具有保护细胞免受氧化损伤的作用[27]。本试验中,在保活12 h内,麻醉组罗氏沼虾肝脏T-SOD活力低于对照组,这可能是温度控制和CO2麻醉的双重作用,使虾体内氧化-抗氧化平衡得以维持良好,这也进一步说明CO2麻醉和低温所引起的应激未对虾体免疫功能造成破坏,而后麻醉组T-SOD活力的上升可能是由于耗氧量增加而产生大量超氧阴离子,以降低氧化损伤[28]。保活12 h后虾体肝脏MDA含量逐渐下降,说明随着虾体的复苏,水质恶化及虾体本身的代谢对机体产生一定的毒性作用,诱导机体肝脏抗氧化酶系统清除机体产生的活性氧。由此也进一步证实虾体在麻醉CO2阶段和保活前期并未受到损伤。
4 结论
1)在CO2麻醉结合温度控制的条件下,当CO2质量浓度为150 mg/L、保活温度为18 ℃、虾水质量比为1∶10时,罗氏沼虾保活48 h内的存活率为90%以上,保活过程中水质总氨氮质量浓度、细菌总数、pH和溶氧量均得到有效控制,且均为影响虾体保活存活率的主要因素。
2)虾体肌肉能量在一定范围内消耗,麻醉虽对虾体肝脏和心肌均造成一定程度损伤,但在一定时间内能保证虾体正常生存,尤其可使虾体内氧化-抗氧化平衡维持良好,在麻醉阶段和保活初期,CO2麻醉和低温所引起的应激未对虾体体液免疫造成破坏。因此,CO2麻醉处理对于提高罗氏沼虾保活过程中的存活率和延长其保活时间是一种可行有效的方法。
[1] 殷守仁.水生动物与人类健康[M].北京:中国农业出版社,2008:41.
YIN S R.Aquatic animals and human health[M].Beijing:China Agriculture Press,2008:41.(in Chinese)
[2] 胡发文,李莉,刘元文,等.丁香油和MS-222对大泷六线鱼幼鱼的麻醉效果[J].大连海洋大学学报,2017,32(6):671-675.
HU F W,LI L,LIU Y W,et al.The anesthetic effect of clove oil and MS-222 on juvenile Hexagrammos otakii[J].Journal of Dalian Ocean University,2017,32(6):671-675.(in Chinese)
[3] 李伟业,徐志进,柳敏海,等.MS-222对东海带鱼幼鱼的麻醉效果研究[J].大连海洋大学学报,2018,33(5):589-594.
LI W Y,XU Z J,LIU M H,et al.Anesthetic effect of MS-222 on largehead hairtail juvenile Trichiurus haumela[J].Journal of Dalian Ocean University,2018,33(5):589-594.(in Chinese)
[4] COYLE S D,DASGUPTA S,TIDWELL J H,et al.Comparative efficacy of anesthetics for the freshwater prawn Macrobrachiurn rosenbergii[J].Journal of the World Aquaculture Society,2005,36(3):282-290.
[5] 李全.乙醇对罗氏沼虾麻醉效果及虾肉品质的影响[J].黑龙江水产,2011(4):2-6.
LI Q.Effect of ethanol on the anesthesia effect of Macrobrachium rosenbergii and the quality of shrimp meat[J].Fisheries of Heilongjiangs,2011(4):2-6.(in Chinese)
[6] 周翠平.罗非鱼二氧化碳麻醉无水保活技术研究[D].湛江:广东海洋大学,2015:3.
ZHOU C P.Research on tilapia carbon dioxide anesthesia and waterless keeping alive technology[D].Zhanjiang:Guangdong Ocean University,2015:3.(in Chinese)
[7] 杨阳.南美白对虾保鲜工艺的优化[D].上海:上海海洋大学,2016:11.
YANG Y.Optimization of the preservation technology of Penaeus vannamei[D].Shanghai:Shanghai Ocean University,2016:11.(in Chinese)
[8] 丁晨雨.鲢对二氧化碳麻醉的生理响应及其机理研究[D].重庆:西南大学,2018:36.
DING C Y.Study on the physiological response of Hypophthalmichthys molitrix to carbon dioxide anesthesia and its mechanism[D].Chongqing:Southwest University,2018:36.(in Chinese)
[9] COYLE S D,TIDWELL J H,YASHARIAN D K,et al.The effect of biomass density,temperature,and substrate on transport survival of market-size freshwater prawn,Macrobrachium rosenbergii[J].Journal of Applied Aquaculture,2005,17(4):61-71.
[10] 叶金明,张朝晖.罗氏沼虾高效生态养殖新技术[M].北京:海洋出版社,2017:85.
YE J M,ZHANG Z H.New technology of efficient ecological breeding of Macrobrachium rosenbergii[M].Beijing:Ocean Press,2017:85.(in Chinese)
[11] 安治武.微生物制剂对养殖水体的净化效果初步研究[D].青岛:青岛理工大学,2016:4.
AN Z W.Preliminary study on the purification effect of microbial preparations on aquaculture water body[D].Qingdao:Qingdao Technological University,2016:4.(in Chinese)
[12] 王兴强,马甡,董双林.虾蟹类生物能量学研究进展[J].海洋科学,2005,29(10):65-69.
WANG X Q,MA S,DONG S L.Research progress of shrimp and crab bioenergetics[J].Marine Sciences,2005,29(10):65-69.(in Chinese)
[13] BARCELLOS L J G,MARQUEZE A,TRAPP M,et al.The effects of fasting on cortisol,blood glucose and liver and muscle glycogen in adult jundiá Rhamdia quelen[J].Aquaculture,2010,300(1/2/3/4):231-236.
[14] IVERSEN M,FINSTAD B,MCKINLEY R S,et al.Stress responses in Atlantic salmon (Salmo salar L.) smolts during commercial well boat transports,and effects on survival after transfer to sea[J].Aquaculture,2005,243(1/2/3/4):373-382.
[15] OLSEN Y A,EINARSDOTTIR I E,NILSSEN K J.Metomidate anaesthesia in Atlantic salmon,Salmo salar,prevents plasma cortisol increase during stress[J].Aquaculture,1995,134(1/2):155-168.
[16] 彭士明,施兆鸿,李杰,等.运输胁迫对银鲳血清皮质醇、血糖、组织中糖元及乳酸含量的影响[J].水产学报,2011,35(6):831-837.
PENG S M,SHI Z H,LI J,et al.Effects of transportation stress on serum cortisol,blood sugar,glycogen and lactic acid content in the tissues of Pampus argenteus[J].Journal of Fisheries of China,2011,35(6):831-837.(in Chinese)
[17] WEBER R A,PÉREZ-MACEIRA J J,PELETEIRO J B,et al.Effects of acute exposure to 2-phenoxyethanol,clove oil,MS-222,and metomidate on primary and secondary stress responses in Senegalese sole (Solea senegalensis Kaup 1858)[J].Aquaculture,2011,321(1/2):108-112.
[18] SAMET M,NAKAMURA K,NAGAYAMA T.Tolerance and respiration of the prawn (Penaeus japonicus) under cold air conditions[J].Aquaculture,1996,143(2):205-214.
[19] BERNARDI C,BAGGIANI L,TIRLONI E,et al.Hemolymph parameters as physiological biomarkers in American lobster (Homarus americanus) for monitoring the effects of two commercial maintenance methods[J].Fisheries Research,2015,161:280-284.
[20] SRIVASTAVA A R,KUMAR S,AGARWAL G G,et al.Blunt abdominal injury:serum ALT—a marker of liver injury and a guide to assessment of its severity[J].Injury,2007,38(9):1069-1074.
[21] 冀德伟,李明云,王天柱,等.不同低温胁迫时间对大黄鱼血清生化指标的影响[J].水产科学,2009,28(1):1-4.
JI D W,LI M Y,WANG T Z,et al.The effect of different low temperature stress time on serum biochemical indexes of Larimichthys crocea[J].Fisheries Science,2009,28(1):1-4.(in Chinese)
[22] 刘骁,谢晶,杨茜,等.无水保活条件下团头鲂生理应激及鱼肉品质的变化[J].农业工程学报,2016,32(3):295-300.
LIU X,XIE J,YANG Q,et al.Physiological stress and quality changes of Megalobrama amblycephala under the condition of keeping alive without water[J].Transactions of the Chinese Society of Agricultural Engineering,2016,32(3):295-300.(in Chinese)
[23] 何蓉,谢晶,苏辉,等.不同温度对无水保活条件下的中华鳖肌肉营养成分及血液生化指标影响[J].食品科学,2014,35(6):194-199.
HE R,XIE J,SU H,et al.The effect of different temperatures on the muscle nutrients and blood biochemical indexes of soft-shelled turtle under the condition of anhydrous preservation[J].Food Science,2014,35(6):194-199.(in Chinese)
[24] 纪利芹.连续降温对大菱鲆血液生理生化指标的影响及分子机制[D].青岛:中国海洋大学,2014:33.
JI L Q.The effect of continuous cooling on the blood physiological and biochemical indexes of turbot and its molecular mechanism[D].Qingdao:Ocean University of China,2014:33.(in Chinese)
[25] 高权新,谢明媚,彭士明,等.急性温度胁迫对银鲳幼鱼代谢酶、离子酶活性及血清离子浓度的影响[J].南方水产科学,2016,12(2):59-66.
GAO Q X,XIE M M,PENG S M,et al.The effects of acute temperature stress on the metabolic enzymes,ionase activities and serum ion concentration of juveniles Pampus argenteus[J].South China Fisheries Science,2016,12(2):59-66.(in Chinese)
[26] 彭士明,施兆鸿,高权新,等.增加饲料中VC质量分数对银鲳血清溶菌酶活性及组织抗氧化能力的影响[J].南方水产科学,2013,9(4):16-21.
PENG S M,SHI Z H,GAO Q X,et al.The effect of increasing VC content in feed on serum lysozyme activity and tissue antioxidant capacity of Pampus argenteus[J].South China Fisheries Science,2013,9(4):16-21.(in Chinese)
[27] 高勤,王守立,于燕妮,等.自由基在慢性氟中毒大鼠肾脏损伤中的作用[J].中国地方病学杂志,2001,20(2):94-97.
GAO Q,WANG S L,YU Y N,et al.The role of free radicals in the kidney injury of chronic fluorosis rats[J].Chinese Journal of Endemiology,2001,20(2):94-97.(in Chinese)
[28] 梁敏.低温与二氧化碳联合胁迫凡纳滨对虾无水保活技术研究[D].湛江:广东海洋大学,2018:20.
LIANG M.Low temperature and carbon dioxide combined stress on waterless preservation technology of Litopenaeus vannamei[D].Zhanjiang:Guangdong Ocean University,2018:20.(in Chinese)