红鳍东方鲀Takifugu rubripes隶属于硬骨鱼纲鲀形目鲀科,是一种具有重要经济和食用价值的鱼类,也是硬骨鱼中研究较多的模式物种,在中国、朝鲜、日本等亚洲地区均有分布[1],且有悠久的食用历史。中国对禁止食用红鳍东方鲀的解禁,为其养殖及加工业带来了巨大的机遇[2-3],红鳍东方鲀精巢因不含毒素且味道鲜美,在战国时期就有“西施乳”的美誉,是一种名贵的传统美食。由于红鳍东方鲀性成熟时间较长,且卵巢与精巢发育不同步,卵巢先于精巢发育[4-5],不利于育种工作的开展及其高价值精巢的产出,此外,研究性发育在物种的进化中具有深远的意义。目前,对鱼类性发育的研究虽然已经鉴定出许多与性别决定和性腺发育两个生物学过程[6]相关的基因,包括sox9、dmrt1、gsdf、dax家族、fox家族、抗苗勒管激素基因及其受体基因,而Kamiya等[7]对在红鳍东方鲀最新的一项研究中也显示,红鳍东方鲀的性别很可能是由amhr2的两个等位基因组合所决定。但是关于红鳍东方鲀性发育的研究依然不是很全面,育种方面的难题仍存在,因此,研究红鳍东方鲀性腺发育的过程,缩短其性成熟的时间,有利于促进育种工作的开展,改善养殖模式,进而提高养殖产量。
非标记定量技术(lable-free)是运用质谱进行蛋白分析,无须使用稳定的同位素化合物来标记蛋白,即通过基于光谱计数(spectrum counts)类或前体信号强度方法进行蛋白定量[8-9]。光谱计数类非标记以MS2的鉴定结果作为定量的基础,各种方法的差别在于后期算法在大规模数据上的修正。而前体信号强度方法适用于高精度质谱,以MS1为基础,计算每个肽段信号在液相色谱-质谱联用(LC-MS)上的积分。本研究中采用此方法,使用最新一代的Orbitrap质谱仪(Q-Exacitve HF)采集LC-MS/MS数据,结合Proteome Discoverer 2.0软件[10]并基于Sequest算法[11-12]对肽段的指纹谱图进行概率匹配[13-15]。
本研究中,通过非标记定量技术比较分析3龄红鳍东方鲀卵巢与精巢的蛋白质组,并从基因表达层面上比较这两个组织成熟时的蛋白差异。通过对组织间差异倍数高的蛋白进行分析,并运用GO、KEGG分析等富集方法将差异蛋白聚类,从而发现影响红鳍东方鲀性腺发育的蛋白及生物过程,旨在为红鳍东方鲀性腺发育过程及生产实践应用提供基础数据。
1 材料与方法
1.1 材料
试验用鱼于2017年5月采自大连天正有限公司,为养殖的3龄性成熟红鳍东方鲀健康成鱼,体质量约2.0 kg,分别随机选择性腺质量约为30 g的10 尾雌鱼卵巢和10 尾雄鱼精巢混合置于液氮中,作为卵巢样品及精巢样品[16-17]。
1.2 方法
1.2.1 蛋白提取及质检 称取适量样本,研磨成粉末,加入蛋白裂解液并进行超声破碎,然后进行Bradford蛋白定量,检测两种组织的蛋白总量,并计算出其相应蛋白浓度。其后进行SDS-PAGE电泳检验,发现两组织总蛋白在相对分子量15~220 000范围内得到有效分离且无降解,蛋白质量足够,并且蛋白电泳条带有一定的差异,能够进行后续试验。
1.2.2 质谱分析及蛋白注释 对蛋白还原烷基化,使用Trypsin酶将蛋白酶切成肽段,然后经毛细管高效液相色谱分离,根据肽段的疏水性、离子强度、等电点差异进行分离洗脱后用Q-Exactive HF质谱仪进行质谱分析。用Sequest HT和Proteome Discoverer 2.0软件在数据库Uniprot-takifugu rubripes.fasta(去除了uncharacteried protein)进行搜库定性及定量分析,并获得蛋白对应的UniProt ID。
1.2.3 差异表达蛋白富集
1)差异倍数分析。对映射到注释蛋白的肽段进行计数,在1.5差异倍数(FC=fold change)阈值条件下,进行卵巢与精巢组织的差异蛋白筛选。FC≥1.5为上调(up),FC≤0.667为下调(down),0.667<FC<1.5为表达量无明显变化。
2)GO注释。为了确定和比较这些差异蛋白的功能,使用基因本体(Gene Ontology,GO)术语(term)对其进行注释,这些术语描述涵盖了3个主要领域,即发挥的分子功能(Molecular function)、所属的细胞组分(Cellular component)和参与的生物过程(Biological process)[18]。对差异表达蛋白进行GO富集分析(http://www. geneontology.org),对基因产物进行富集,可避免单个蛋白注释的不同造成的冗余等问题,其能够概括差异蛋白在活细胞中的特殊作用[19]。
3)KEGG注释。在生物体内,不同蛋白相互协调使得生物体正常运转,基于京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路(Pathway)可进行蛋白通路网络的分析,有助于更进一步了解其生物学功能[20],以确定蛋白参与的最主要生化代谢通路和信号转导通路。使用KEGG PATHWAY数据库(http://www.kegg.jp/kegg/pathway.html)确定差异表达蛋白的生物学通路。
4)富集分析及COG分析。通过对应蛋白UniProt ID检索GO及KEGG数据库获得对应蛋白的GO注释及KEGG注释。GO富集分析及KEGG富集分析则使用R语言软件基于超几何分布计算出各数据库对应功能分类中差异蛋白与全部表达蛋白的显著性(P值)。用UniProt数据库对所鉴定出的差异表达蛋白进行蛋白聚类(Cluster of orthologous groups of proteins,COG),预测差异蛋白可能的功能并对其做功能分类统计。
2 结果与分析
2.1 蛋白鉴定及肽段质量
利用非标记定量质谱分析,在卵巢与精巢两个组织共获得了5 463个肽段,其中,鉴定出855个蛋白,搜库时将RAW文件通过Proteome Discoverer提交至 Sequest HT服务器,蛋白鉴定结果过滤参数为Peptide FDR≤0.01[14,21-22]。由于组织中获取的肽段过长或过短都无法在质谱仪中被检测到,因此,鉴定结果中如果肽段普遍过低或过高,则可能是蛋白酶选用不恰当,获得的结果不佳。本次鉴定的肽段长度集中于8~21 个氨基酸,长度适合。图1是不同蛋白鉴定所用的肽段数,一个肽段鉴定出的蛋白低于总鉴定蛋白数的三分之一,所以鉴定结果较好。
2.2 差异表达蛋白
在卵巢和精巢两种组织之间发现共有的蛋白561 个,并且有150 个蛋白为卵巢组织所特有,132个蛋白为精巢组织所特有,并筛选出了172 个在卵巢中上调表达的差异蛋白及161 个在精巢中上调表达的蛋白。差异蛋白包括组织特异性蛋白及差异表达蛋白共615 个。筛选出卵巢与精巢蛋白表达量差异倍数超过10倍的蛋白如表1所示,其中卵巢有15个蛋白表达较高,推测均为碱性蛋白;而精巢有9 个蛋白表达较高,其大多为酸性蛋白。
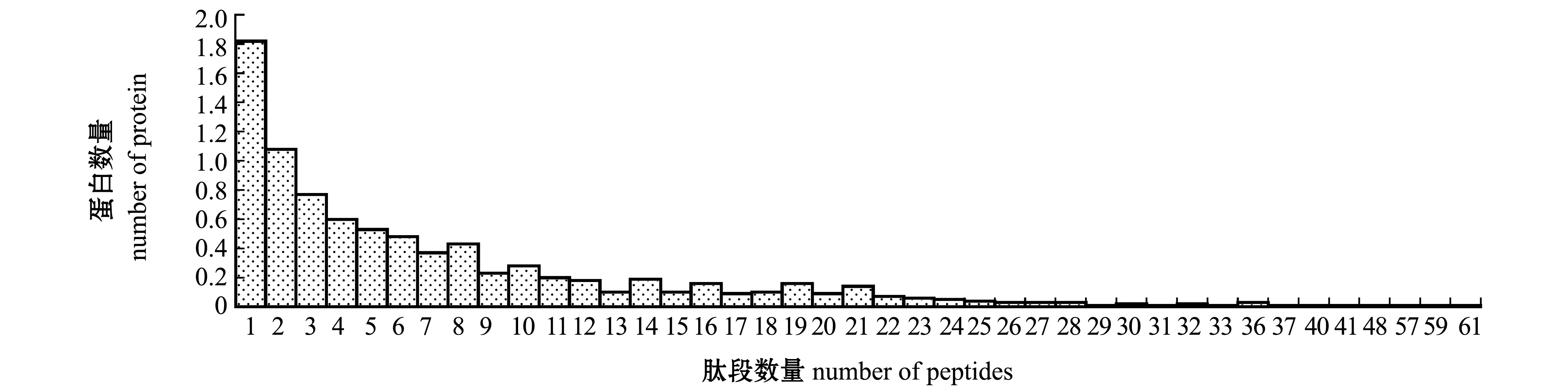
图1 鉴定蛋白对应肽段分布图
Fig.1 Identification map of peptide number distribution
1)差异倍数分析。在卵巢组织中较精巢差异倍数最高的蛋白为ELAVL2(HUR),其次为FRUYP1。在精巢中差异倍数最大的为β-微管蛋白(Uniprot ID:H2RTP9),并且在精巢中还有3个微管蛋白较卵巢差异倍数大。这些在组织间差异倍数较大的蛋白,可能是引起两组织分化或维持组织特异功能的功能蛋白,也可能是伴随这些组织间的功能蛋白使其发挥功能的蛋白。而同组织差异蛋白之间的关联可能显示出性发育的某个生物过程。这表明ELAVL2、FRUYP1蛋白可能与卵巢发育相关。而精巢上高表达蛋白为微管蛋白,由于α、β-微管蛋白是组成鞭毛的基本单位[23],故此高表达的微管蛋白可能与精子鞭毛的形成相关。
2)蛋白互作分析。通过蛋白互作网络预测分析网站(https://string-db.org/),使用STRING 11.0对卵巢及精巢组织中特有的蛋白分别进行网络预测,设置最低蛋白互作置信值为 0.7,使用k-means聚类方法分别聚成5类。将组织特异蛋白的Uniprot ID输入STRING,卵巢特异蛋白有132个,其中有124个可被识别,而在精巢中的150个蛋白中,则有136个能够被STRING注释。
在卵巢中蛋白有效聚集为4类(见电子版附录A图A1):第一类与翻译相关,包括核糖体蛋白L36A(RPL36A)、核糖体蛋白L19(ENSTRUG-00000011841)、核糖体蛋白L27(RPL27)、核糖体蛋白L36(RPL36)、核糖体蛋白L15(RPL15)、核糖体蛋白L7A(RPL7A)、核糖体蛋白S24(RPS24)、过量位点蛋白1(SURF1)、延伸因子-1α(ENSTRUG00000009006)和核糖体蛋白S26(RPS26);第二类与rRNA和tRNA加工相关,包括核糖体合成蛋白BOP1(BOP1)、tRNA(鸟嘌呤-N(7))-甲基转移酶非催化亚基WDR4(WDR4)、核仁蛋白(PES1)、N-乙酰基转移酶(NAT10)、类tRNA-二氢尿苷合酶3(DUS3L)和聚合酶(RNA)Ⅲ(DNA引导)肽A(POLR3A);第三类与氧化磷酸化相关,包括NADH脱氢酶5(ND5)、细胞色素C氧化酶亚基Ⅲ(COX3)、NADH脱氢酶[泛醌] 1亚基C2(NDUFC2)和泛醌-细胞色素C还原酶铁硫蛋白亚基1(ENSTRUG00000015996);第四类与DNA复制相关,包括微小染色体维持蛋白4(MCM4)、核糖核酸酶H2亚基A(RNASEH2A)、DNA聚合酶δ亚基1(POLD1)和DNA修复蛋白REV1(REV1)。
表1 卵巢与精巢间表达量差异倍数超过10倍的蛋白
Tab.1 Protein with more than 10 times of expression difference between ovary and testis
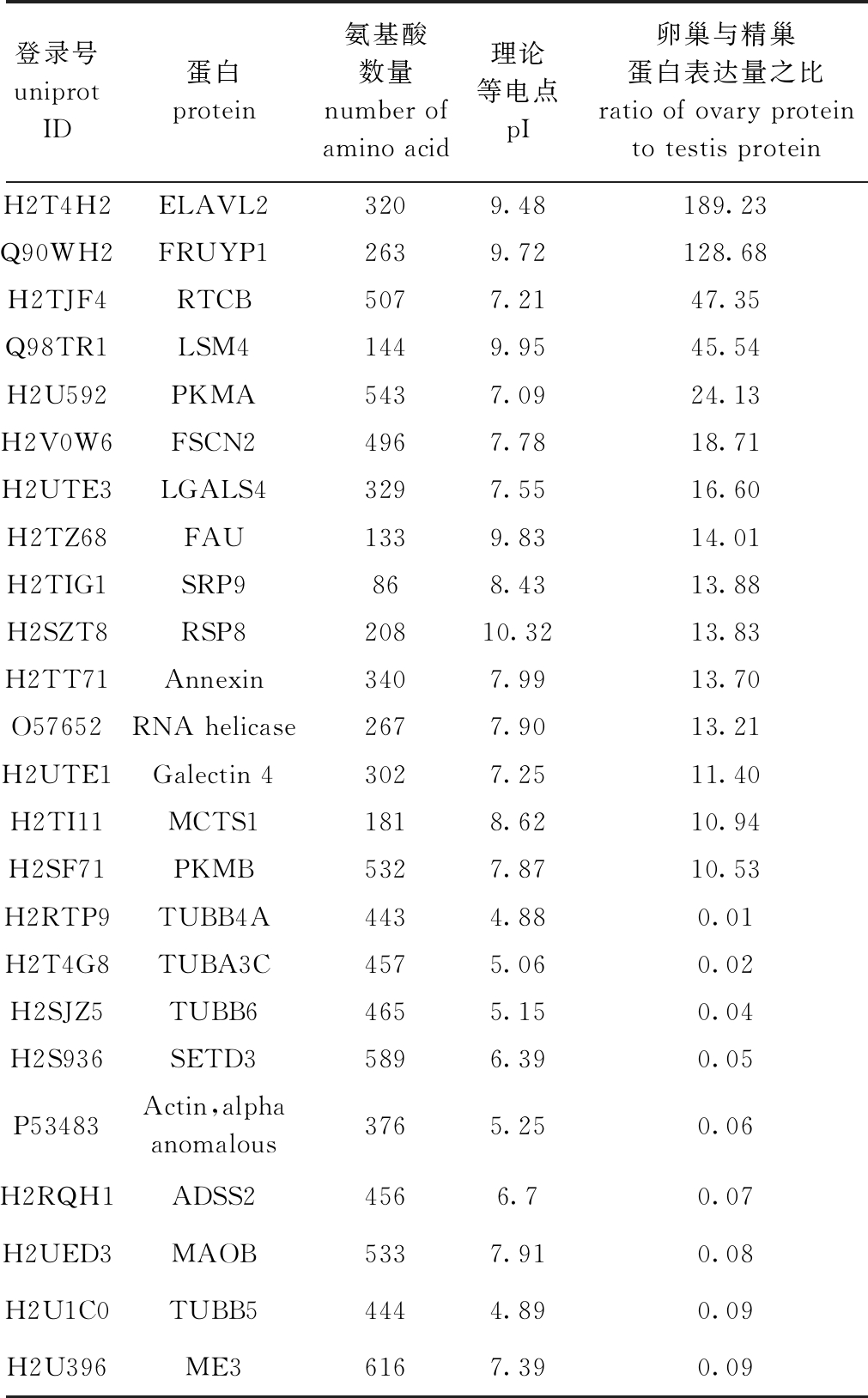
登录号uniprot ID蛋白protein 氨基酸数量number of amino acid理论等电点pI卵巢与精巢蛋白表达量之比ratio of ovary protein to testis proteinH2T4H2ELAVL2 3209.48189.23Q90WH2FRUYP12639.72128.68H2TJF4RTCB5077.2147.35Q98TR1LSM41449.9545.54H2U592PKMA5437.0924.13H2V0W6FSCN24967.7818.71H2UTE3LGALS43297.5516.60H2TZ68FAU1339.8314.01H2TIG1SRP9868.4313.88H2SZT8RSP820810.3213.83H2TT71Annexin3407.9913.70O57652RNA helicase2677.9013.21H2UTE1Galectin 43027.2511.40H2TI11MCTS11818.6210.94H2SF71PKMB5327.8710.53H2RTP9TUBB4A4434.880.01H2T4G8TUBA3C4575.060.02H2SJZ5TUBB64655.150.04H2S936SETD35896.390.05P53483Actin,alpha anomalous3765.250.06H2RQH1ADSS24566.70.07H2UED3MAOB5337.910.08H2U1C0TUBB54444.890.09H2U396ME36167.390.09
在精巢中蛋白也有效聚集为4类(见电子版附录A图A2):第一类与嘌呤代谢相关,包括腺苷酸激酶同工酶6(AK6)、GMP还原酶(ENSTRUG00000001414)、腺苷单磷酸脱氨酶3a(AMPD3)、腺苷琥珀酸合成酶(ENSTRUG- 00000003001)和胞质5’-核苷酸酶3A(NT5C3A);第二类与甘油磷脂代谢相关,包括溶血磷脂酸酰基转移酶β(ENSTRUG00000018530)、二酰甘油激酶α(ENSTRUG00000015424)、二酰基甘油激酶5(DGKE)和磷脂酸胞苷酰转移酶(ENSTRUG00000014429);第三类与内质网相关,包括内质网相关降解蛋白1(DERL1)、NADPH细胞色素P450氧化还原酶(POR)和网状蛋白4(RTN4);第四类与氧化磷酸化相关,包括ATP合酶偶联因子6(ATP5J)、细胞色素C氧化酶蛋白6A2(ENSTRUG00000007689)和泛醌-细胞色素C还原酶铁硫蛋白亚基1(ENSTRUG00000006531)。此外,在精巢中还发现,与性发育相关的特异性表达蛋白GSDF(Uniprot ID:A0A0H4LUC3)及POR(Uniprot ID:H2T154 )。
2.3 差异表达蛋白的富集
2.3.1 GO分析
1)生物过程(Biological process)。对差异蛋白进行GO分析,其中有591 个差异蛋白具有GO注释。在生物过程中,细胞内信号转导(GO:0035556)所富集的差异蛋白在两组织中均较多,翻译(GO:0006412)、细胞内蛋白转运(GO:0006886)和翻译预启动复合体的形成(GO:0001731)等在卵巢组织中的差异蛋白较多,而蛋白水解参与细胞蛋白分解代谢过程(GO:0051603)、ATP合成耦合质子运输(GO:0015986)及ATP水解耦合质子运输(GO:0015991)等在精巢组织中富集的差异蛋白较多,因此,卵巢组织主要发生蛋白合成过程,而精巢组织则发生水解过程,这与卵细胞及精子的形成过程相符,并伴随着不同的细胞内信号转导(图2)。
2)细胞组分(Cellular component)。在细胞组分中,卵巢组织中较多的差异蛋白发生在细胞质(GO:0005737)、细胞核(GO:0005634)、细胞溶质大核糖体亚基(GO:0022625)、细胞溶质小核糖体亚基(GO:0022627)及外被蛋白I(COP I)囊泡层(GO:0030126)上,COP I囊泡层主要介导蛋白从高尔基体运回内质网,包括从反面高尔基体运向顺面高尔基体,以及将蛋白从反面高尔基体运回到内质网,而在精巢组织中差异蛋白较多发生在膜组成部分(GO:0016021),卵巢组织差异蛋白富集较多的细胞组分与蛋白合成有关,精巢组织可能与精子形成有关(图3)。
3)分子功能(Molecular function)。在分子功能中,ATP结合(GO:0005524)及金属离子结合(GO:0046872)所富集的差异蛋白在两组织中均较多,卵巢组织中富集较多的差异蛋白发挥RNA结合(GO:0003723)、核糖体的结构成分(GO:0003735)等功能,而在精巢组织中差异蛋白具有苏氨酸型内肽酶活性(GO:0004298)(图4)。这表明,两种性腺组织中发生了非常活跃且不同的能量代谢,并伴随着不同的酶促反应,其中卵巢组织中RNA结合不仅与蛋白的合成相关,还可能与转录后调节有关。
对GO术语中显著富集的差异蛋白与该术语中所有鉴定到的全部蛋白相比较,进行GO功能显著性富集分析,以P≤0.05为阈值,满足此条件的GO 术语定义为在差异蛋白中显著富集,结果如图5所示,其中转移酶活性(GO:0016740)在两组织之间差异最显著(P=0.00072),其次为磷酸转移酶活性(GO:0016773)及蛋白激酶活性(GO:0004672)。
2.3.2 KEGG通路分析 对差异蛋白进行KEGG通路分析显示,仅有126 个差异蛋白富集到KEGG通路上。确定差异蛋白参与的最主要生化代谢通路和信号转导通路为核糖体(Ribosome)、吞噬体(Phagosome)、亨廷顿氏病(Huntington’s disease)等,其中,核糖体通路中差异蛋白最多(见电子版附录A图A3)。核糖体通路中注释到的蛋白如图6所示,该通路在两组之间的差异可从GO富集分析中反映出来,其大部分差异蛋白发生在卵巢。而吞噬体通路有10个差异蛋白,其中7个差异蛋白在精巢中高表达或特有,这些富集大量差异蛋白的通路有可能是引起组织差异的某些生物过程。
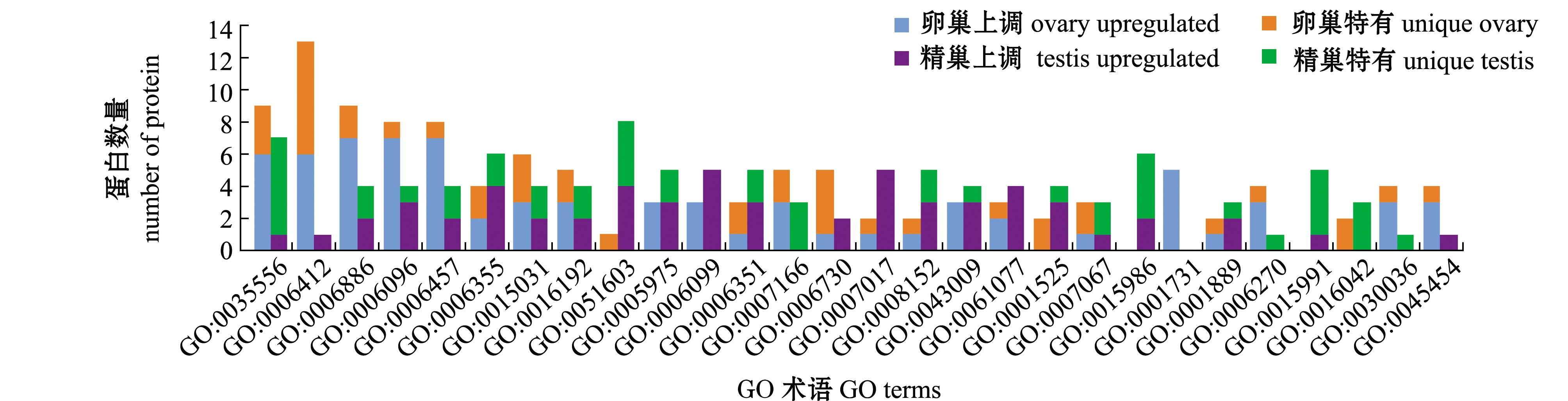
图2 生物过程中差异蛋白的GO富集
Fig.2 GO enrichment of differential p``roteins in biological processes

图3 细胞组分中差异蛋白的GO富集
Fig.3 GO enrichment of differential proteins in cellular component

图4 分子功能中差异蛋白的GO富集
Fig.4 GO enrichment of differential proteins in molecular function
同样对通路进行显著性富集分析,并与该通路所鉴定到的全部蛋白相比较,筛选在差异蛋白中显著性富集的通路。通过通路显著性富集能确定两组织之间差异最显著的生化代谢通路和信号转导通路,差异蛋白KEGG富集结果如图7所示,其中溶酶体(Lysosome)在两组织之间差异最大,其次为霍乱弧菌感染(Vibrio cholerae infection)、鞘脂信号通路(Sphingolipid signaling pathway),但这些通路在组织中均无显著性差异(P>0.05)。
2.3.3 COG分析 对所鉴定出的雌雄性腺差异表达蛋白进行COG分析,通过搜索与UniProt关联的KOG数据库预测功能并分类,其中,搜索到291 个差异蛋白,并相应地获得了25 个类别(图8)。其中出现频数最高的差异蛋白类型为[O]翻译后修饰、蛋白周转、伴侣蛋白(38 个,占13.06%),其次是[C]能量释放和转换(27 个,占9.28%)、[U]细胞内运输、分泌和囊泡运输(27 个,占9.28%),这表明,COG分析结果与GO、KEGG分析结果相吻合。
2.4 与转录组的比较
在与同为3龄的红鳍东方鲀卵巢与精巢转录组[24]相比,在转录组中显著差异表达的wnt、fgf、dmrt、gdf家族基因,在蛋白质组中只发现fgf3基因有表达,但在组织间无显著性差异。这可能是由于转录和翻译不同步或被转录后调节造成的。
其他被认为与性发育有关的基因包括sry、sox、amh、dmy、dax、fox、amhr、cyp450、piwi、jnk,在红鳍东方鲀成熟卵巢及精巢蛋白质组中均未发现它们的表达产物。造成这种情况的原因可能是由于本研究中使用的组织为3龄鱼的成熟性腺,不属于早期发育,也可能是其蛋白在组织间丰度低于Q-Exactive HF-质谱仪检测方法的灵敏度。
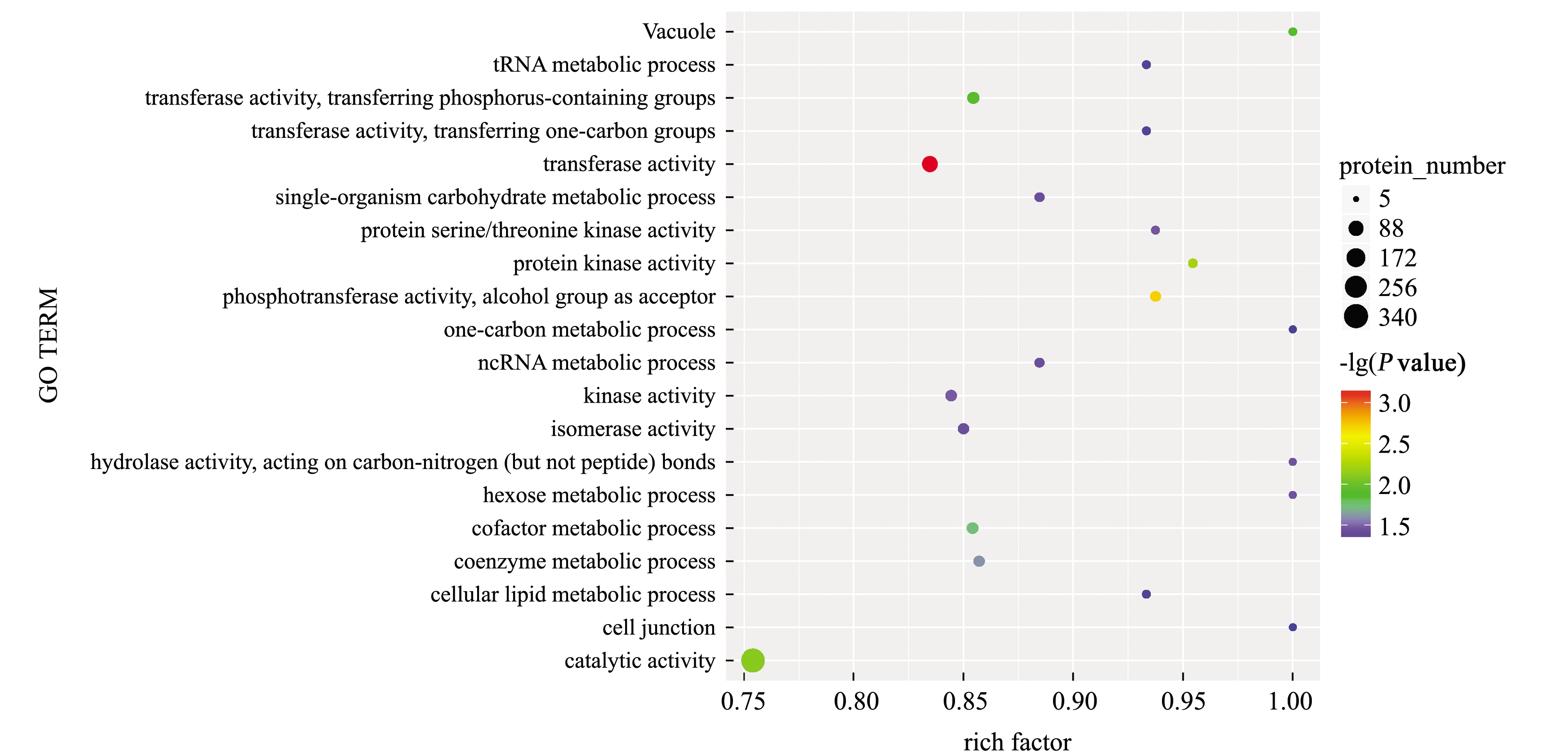
图5 差异蛋白GO富集气泡图
Fig.5 GO enrichment bubble chart of differentially expressed proteins

深红色—卵巢组织特异性蛋白;红色—卵巢上调蛋白;绿色—精巢上调蛋白;黄色—无组织差异性蛋白。 Deep red colo—ovarian tissue-specific proteins; red color—ovarian upregulated proteins;green color—testis upregulated protein;yellow color—no tissue-differentiated proteins.
图6 核糖体通路图
Fig.6 Ribosomal pathway diagram
3 讨论
3.1 卵巢、精巢组织中的关键差异蛋白
3.1.1 卵巢组织中的关键蛋白 本研究中红鳍东方鲀在卵巢组织中差异表达最高的蛋白为ELAVL2,ELAVL2是一种RNA结合蛋白[24-25],其与人类[26]、小鼠Mus musculus[25]等多个物种性发育相关,其家族基因已被应用于尼罗罗非鱼Oreochromis niloticus[27]、斑马鱼Danio rerio[28]的性腺发育研究中。Kato等[25]最新研究表明,RNA结合蛋白ELAVL2和DDX6对小鼠卵巢原始卵泡的形成至关重要,敲除ELAVL2的雌性小鼠不育。 ELAVL2与编码P颗粒(参与RNA衰变和存储的胞质RNP颗粒)成分的mRNA关联,并通过在原始卵泡形成之前促进DDX6在卵母细胞中的翻译来指导P颗粒的组装。本研究中卵巢高表达的RNA helicase(O57652)与DDX6(表1)同为RNA解旋酶,在红鳍东方鲀中ELAVL2与RNA helicase可能发挥着与小鼠中类似的作用。
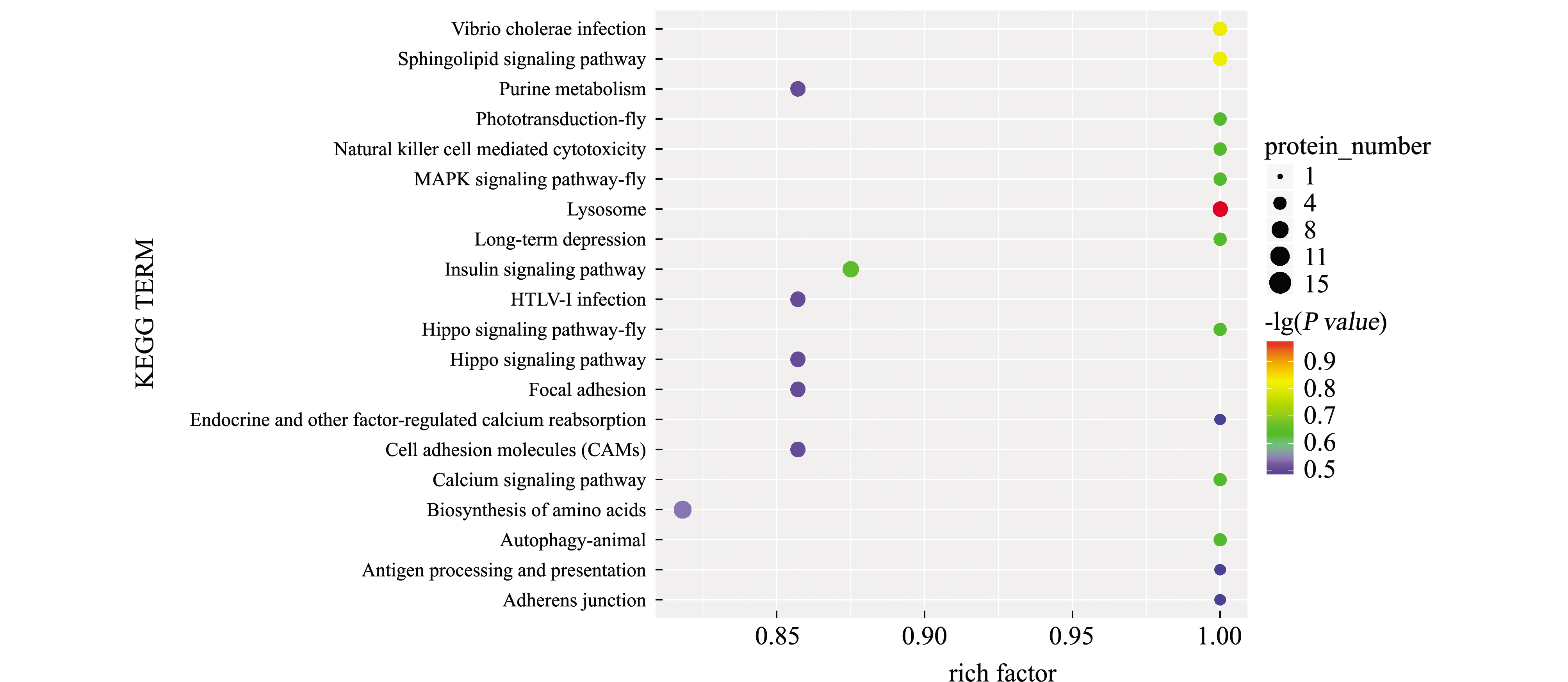
图7 差异蛋白KEGG富集主要通路气泡图
Fig.7 Bubble chart of main pathway of differential protein KEGG enrichment
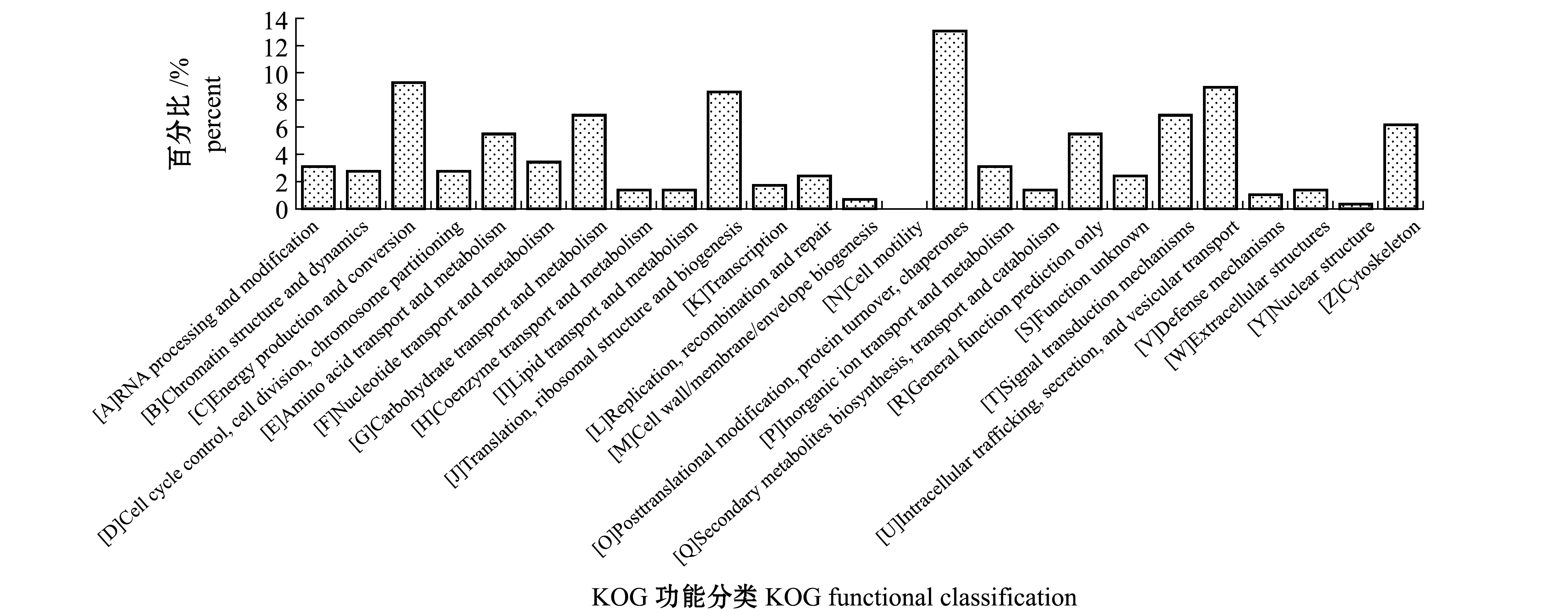
图8 差异蛋白KOG功能分类
Fig.8 Functional classification of differential protein KOG
Vindry等[29]使用人源HEK293细胞,用免疫共沉淀、免疫荧光与RNAi耦合的方法,证明DDX6、LSM蛋白与Pat1b基因的mRNA有效且特异性地相互作用,并且这种结合不受RNase处理的影响,PAT1 RNA结合蛋白是细胞质5′mRNA至3′mRNA衰变的关键参与者,在P颗粒中所富含,敲除Pat1b基因的小鼠,卵母细胞会发育缺陷[30]。由此推测,本研究中红鳍东方鲀卵巢高表达的LSM4蛋白(表1)可能参与卵巢成熟的过程。
FRUYP1(Q90WH2)有Y盒结合的功能,与小鼠中MSY2蛋白功能类似,Medvedev等[31]对小鼠卵母细胞的研究表明,MSY2是一种生殖细胞特异的RNA结合蛋白,与调节mRNA的稳定性有关,MSY2蛋白对发育至关重要,Msy2基因缺失的雌性小鼠不育。本研究中,将高表达的FRUYP1与MSY2(NP_058571.2)蛋白序列比对发现,两蛋白都包含69 个氨基酸的CSP(Cold shock protein,冷休克蛋白)保守结构域,两蛋白该结构域有97.10%的一致性,由此推测,FRUYP1蛋白可能影响着红鳍东方鲀卵巢的发育。
3.1.2 精巢组织中的关键蛋白 本研究中,在精巢组织中微管蛋白(TUBB4A、TUBA3C、TUBB5、TUBB6)表达量较大(表1),而由α-和β-微管蛋白的异二聚体排列成的微管是组成鞭毛的基本单位[23],对精子的运动由鞭毛驱动。Cao等[32]对人类运动能力弱的精子和正常精子尾部的蛋白表达谱比较显示,微管蛋白-2B(TUBB2B)是差异表达的蛋白之一,且在正常精子中含量较多,影响其运动性。因此,这种组织间的差异与精巢中大量精子的形成有关。
红鳍东方鲀精巢中特异性表达的蛋白GSDF(性腺体细胞衍生因子,Gonadal soma derived factor),其基因则被认为是鱼类性别决定及分化密切相关的重要基因[33],Shibata等[34]在青鳉Oryzias latipes上通过实时定量PCR及原位杂交证实了gsdf基因在精巢初期表达而在卵巢中表达非常低,本研究中从蛋白层面证实了这点,在精巢中具有而在卵巢中不具有。
同样在红鳍东方鲀精巢中特异表达的POR蛋白(又称CYP或CYPOR)亦与性腺发育相关。POR在人类研究中可为将雄激素代谢为雌激素的CYP19A1提供能量[16]。Fenske等[35]对斑马鱼的研究发现,在性腺分化期抑制CYP19A蛋白表达会使其雄性化,虽然CYP19蛋白在其他鱼类性腺有表达[36],然而本试验中并未发现其产物,可能是在性成熟阶段表达较低造成的。
综上所述,本研究差异蛋白中ELAVL2、RNA helicase、LSM4、FRUYP1与卵巢发育相关,其中ELAVL2、RNA helicase、LSM4可能共同发挥作用,而这些蛋白都是通过作用于mRNA在转录后层面影响卵巢发育,为后续红鳍东方鲀卵巢发育研究做出铺垫。而在精巢中则找出了几种可能组成精子鞭毛的微管蛋白,并且发现与精巢发育相关的GSDF蛋白。
3.2 关键蛋白的生物学聚类
3.2.1 GO分析 本研究中GO富集分析表明,卵巢中差异表达蛋白与精巢相比主要分布在细胞膜、细胞核部分,分子功能除了发挥能量代谢及酶促反应,还有RNA结合(包含ELAVL2蛋白、FRUYP1蛋白)及组成核糖体的结构成分的功能,卵巢组织主要进行有关蛋白合成的生物过程,这些过程与卵细胞发育及生殖质调节相关。而在精巢中差异表达蛋白与卵巢相比主要分布于膜组成部分,差异蛋白发挥不同于卵巢的能量代谢及酶促反应,其中苏氨酸型内肽酶活性较活跃,进行有关细胞蛋白分解代谢及ATP合成及运输的生物过程,与精子成熟相关。
3.2.2 KEGG通路 本研究中KEGG通路分析发现,差异蛋白最多的是核糖体通路,核糖体的不同大小亚基被认为与控制mRNA的机制相关[37]。其中,精巢中上调表达的核糖体蛋白L10A被证实与性别发育有关,虾和果蝇中发现的该核糖体蛋白在卵子发生中起作用,果蝇缺失l10a基因可引起卵腔周围的卵泡细胞丢失[38]。因此,卵巢和精巢两组织核糖体通路的差异可能是引起组织差异的原因之一。而在一项人工合成的孕激素(DDG)对斑马鱼的慢性影响研究中,使用微阵列分析确定了精巢中与精子发生有关的基因同样富集到吞噬体、溶酶体和鞘脂代谢通路,这些通路可能与精子成熟相关[32]。
综上所述,本研究中利用GO和KEGG富集分析法能够概括差异蛋白在细胞中的作用,卵巢中发生有利于卵细胞发育的核糖体通路,而精巢中发生则有利于精子成熟的吞噬体、溶酶体和鞘脂代谢通路,这些结果可为性腺发育的研究提供一定参考。
4 结论
1)本研究中,对红鳍东方鲀卵巢与精巢组织利用Lable-free蛋白质组学技术进行分析发现,有172个卵巢高表达蛋白和161个精巢高表达蛋白,其中卵巢高表达蛋白ELAVL2、RNA helicase、LSM4、FRUYP1与卵巢发育相关,而精巢高表达蛋白微管蛋白与精子鞭毛的形成相关,精巢特异性蛋白GSDF与精巢发育相关。
2)GO富集分析表明,卵巢中差异表达蛋白与卵细胞发育及生殖质调节相关,而精巢差异蛋白参与精子的分化过程。
3)KEGG通路分析表明,核糖体通路可能与性腺发育相关,其中核糖体蛋白L10A被证实与性别发育相关,而吞噬体、溶酶体和鞘脂代谢通路可能与精子成熟有关。
[1] 苟盼盼,王秀利,窦冬雨,等.红鳍东方鲀不同家系群体的形态性状差异与相关性分析[J].大连海洋大学学报,2019,34(5):674-679.
GOU P P,WANG X L,DOU D Y,et al.Analysis of morphological differences and correlation in three families of tiger puffer Takifugu rubripes[J].Journal of Dalian Ocean University,2019,34(5):674-679.(in Chinese)
[2] 廖章斌,徐后国,卫育良,等.河鲀营养研究进展及展望[J].动物营养学报,2018,30(4):1286-1296.
LIAO Z B,XU H G,WEI Y L,et al.Progress and outlook in nutrition study on puffers[J].Journal of Animal Nutrition,2018,30(4):1286-1296.(in Chinese)
[3] 刘延正.河鲀“解禁”规模化养殖将成主流[J].水产科技情报,2017,44(5):284-285.
LIU Y Z.“Unban” large-scale fish farming will become mainstream[J].Fisheries Science & Technology Information,2017,44(5):284-285.(in Chinese)
[4] 刘永新,周勤,张红涛,等.温度对红鳍东方鲀早期生长和性别分化的影响[J].南方水产科学,2014,10(5):24-29.
LIU Y X,ZHOU Q,ZHANG H T,et al.Effect of temperature on growth and sex differentiation at early developmental stage of redfin puffer(Takifugu rubripes)[J].South China Fisheries Science,2014,10(5):24-29.(in Chinese)
[5] RASHID H,KITANO H,HOON LEE K,et al.Fugu (Takifugu rubripes) sexual differentiation:CYP19 regulation and aromatase inhibitor induced testicular development[J].Sexual Development,2007,1(5):311-322.
[6] HAYES T B.Sex determination and primary sex differentiation in amphibians:genetic and developmental mechanisms[J].Journal of Experimental Zoology,1998,281(5):373-399.
[7] KAMIYA T,KAI W,TASUMI S,et al.A trans-species missense SNP in Amhr2 is associated with sex determination in the tiger pufferfish,Takifugu rubripes (Fugu)[J].PLoS Genetics,2012,8(7):e1002798.
[8] BRIDGES S M,MAGEE G B,WANG N,et al.ProtQuant:a tool for the label-free quantification of MudPIT proteomics data[J].BMC Bioinformatics,2007,8(S7):S24.
[9] MUELLER L N,BRUSNIAK M Y,MANI D R,et al.An assessment of software solutions for the analysis of mass spectrometry based quantitative proteomics data[J].Journal of Proteome Research,2008,7(1):51-61.
[10] Scientific T.Xcalibur Proteome Discoverer Version 1.3 User Guide[M].Thermo Fisher Scientific,2011:5.
[11] ENG J K,MCCORMACK A L,III J R Y.An approach to correlate tandem mass spectral data of peptides with amino acid sequences in a protein database[J].Journal of the American Society for Mass Spectrometry,1994,5(11):976-989.
[12] SADYGOV R G.Using SEQUEST with theoretically complete sequence databases[J].Journal of the American Society for Mass Spectrometry,2015,26(11):1858-1864.
[13] COX J,HEIN M Y,LUBER C A,et al.Accurate proteome-wide label-free quantification by delayed normalization and maximal peptide ratio extraction,termed MaxLFQ[J].Molecular & Cellular Proteomics,2014,13(9): 2513-2526.
[14] ZHOU T,LI C Y,ZHAO W E,et al.MaxReport:an enhanced proteomic result reporting tool for MaxQuant[J].PLoS One,2016,11(3):e0152067.
[15] GUAN F Y,ROBINSON M A,SOMA L R.Confirmatory analysis of etanercept in equine plasma by LC-MS for doping control[J].Drug Testing and Analysis,2017,9(9):1421-1431.
[16] CUI J,LIU S K,ZHANG B,et al.Transciptome analysis of the gill and swimbladder of Takifugu rubripes by RNA-Seq[J].PLoS One,2014,9(1):e85505.
[17] GAO K L,WANG Z C,ZHOU X X,et al.Comparative transcriptome analysis of fast twitch muscle and slow twitch muscle in Takifugu rubripes[J].Comparative Biochemistry and Physiology Part D:Genomics and Proteomics,2017,24:79-88.
[18] SUN P P,MAO Y X,LI G Y,et al.Comparative transcriptome profiling of Pyropia yezoensis (Ueda) M.S. Hwang & H.G. Choi in response to temperature stresses[J].BMC Genomics,2015,16(1):463.
[19] BLAKE J A,CHAN J,KISHORE R,et al.Geneontology consortium:going forward[J].Nucleic Acids Research,2015,43(D1):D1049-D1056.
[20] SANDBERG A,LINDELL G,K LLSTRÖM B N,et al.Tumorproteomics by multivariate analysis on individual pathway data for characterization of vulvar cancer phenotypes[J].Molecular & Cellular Proteomics,2012,11(7): M112.016998.
LLSTRÖM B N,et al.Tumorproteomics by multivariate analysis on individual pathway data for characterization of vulvar cancer phenotypes[J].Molecular & Cellular Proteomics,2012,11(7): M112.016998.
[21] PARK G W,HWANG H,KIM K H,et al.Integrated proteomic pipeline using multiple search engines for a proteogenomic study with a controlled protein false discovery rate[J].Journal of Proteome Research,2016,15(11): 4082-4090.
[22] ARANDA-ABREU G E,BEHAR L,CHUNG S,et al.Embryonic lethal abnormal vision-like RNA-binding proteins regulate neurite outgrowth and tau expression in PC12 cells[J].The Journal of Neuroscience,1999,19(16):6907-6917.
[23] PARAB S,SHETTY O,GAONKAR R,et al.HDAC6 deacetylates alpha tubulin in sperm and modulates sperm motility in Holtzman rat[J].Cell and Tissue Research,2014,359(2):665-678.
[24] WANG Z C,QIU X M,KONG D R,et al.Comparative RNA-Seq analysis of differentially expressed genes in the testis and ovary of Takifugu rubripes[J].Comparative Biochemistry and Physiology Part D:Genomics and Proteomics,2017,22:50-57.
[25] KATO Y,IWAMORI T,NINOMIYA Y,et al.ELAVL2-directed RNA regulatory network drives the formation of quiescent primordial follicles[J].Embo Reports,2019,20(12):e48251.
[26] JAN S Z,VORMER T L,JONGEJAN A,et al.Unraveling transcriptome dynamics in human spermatogenesis[J].Development,2017,144(20):3659-3673.
[27] ESHEL O,SHIRAK A,DOR L,et al.Identification of male-specific amh duplication,sexually differentially expressed genes and microRNAs at early embryonic development of Nile tilapia (Oreochromis niloticus)[J].BMC Genomics,2014,15:774.
[28] WISZNIAK S E,DREDGE B K,JENSEN K B.HuB (elavl2) mRNA is restricted to the germ cells by post-transcriptional mechanisms including stabilisation of the message by DAZL[J].PLoS One,2011,6(6):e20773.
[29] VINDRY C,MARNEF A,BROOMHEAD H,et al.Dual RNA processing roles of pat1b via cytoplasmic Lsm1-7 and nuclear Lsm2-8 complexes[J].Cell Reports,2017,20(5):1187-1200.
[30] MARIE C K,KHERRAF Z E, AMIR A Y,et al.PATL2 is a key actor of oocyte maturation whose invalidation causes infertility in women and mice[J].EMBO Molecular Medicine,2018:e8515.
[31] MEDVEDEV S,PAN H,SCHULTZ R M.Absence of MSY2 in mouse oocytes perturbs oocyte growth and maturation,RNA stability,and the transcriptome[J].Biology of Reproduction,2011,85(3):575-583.
[32] CAO X D,CUI Y,ZHANG X X,et al.Proteomic profile of human spermatozoa in healthy and asthenozoospermic individuals[J].Reproductive Biology and Endocrinology,2018,16(1):16.
[33] 闫红伟,田雨顺,姜丽楠,等.红鳍东方鲀gsdf基因的克隆及表达模式分析[J].大连海洋大学学报,2016,31(2):140-146.
YAN H W,TIAN Y S,JIANG L N,et al.Cloning and express profiling of the gsdf gene in redfin puffer Takifugu rubripes[J].Journal of Dalian Ocean University,2016,31(2):140-146.(in Chinese)
[34] SHIBATA Y,PAUL-PRASANTH B,SUZUKI A,et al.Expression of gonadal soma derived factor (GSDF) is spatially and temporally correlated with early testicular differentiation in medaka[J].Gene Expression Patterns,2010,10(6):283-289.
[35] FENSKE M,SEGNER H.Aromatase modulation alters gonadal differentiation in developing zebrafish (Danio rerio)[J].Aquatic Toxicology (Amsterdam),2004,67(2):105-126.
[36] FLÜCK C E,PANDEY A V.Impact on CYP19A1 activity by mutations in NADPH cytochrome P450 oxidoreductase[J].The Journal of Steroid Biochemistry and Molecular Biology,2017,165:64-70.
[37] ZHANG Y,O’LEARY M N,PERI S,et al.Ribosomal proteins Rpl22 and Rpl22l1 control morphogenesis by regulating Pre-mRNA splicing[J].Cell Reports,2017,18(2):545-556.
[38] Chaichanit N,Wonglapsuwan M,Chotigeat W.Ribosomal protein L10A and signaling pathway[J].Gene,2018,674:170-177.