水产动物免疫水平低,易患细菌性疾病,从而导致严重的生产损失。目前,水产养殖生产中为提高水产动物抗病力、降低死亡率最常采取的有效方式之一就是施用抗生素或一些化学合成药物。然而,化学药物安全性低,易产生药物残留,杀菌效果不理想,而抗生素的滥用又会造成细菌耐药性产生,故这些抗生素或化学药物现已被逐渐淘汰和限制使用,因此,寻求良好的抗生素替代品是水产养殖界最为关心的课题之一[1]。目前,抗菌肽作为新型抑菌物质,其功能、性质,及其在水产养殖中的应用前景均引起了人们的关注[2]。
乳酸菌(Lactic acid bacteria,LAB)广泛分布于人、畜、禽、水产等动物体内,研究发现,部分菌株可以作为水产益生菌,提高水产动物的抗病性能[3-4]。其作用机理包括:直接分泌抗菌物质、拮抗病原菌[5];刺激宿主免疫,增强宿主免疫相关酶和抗氧化酶活性,提高机体免疫水平[6-7]等。乳酸菌的抗菌代谢产物主要包括有机酸[8]、细菌素[9]和过氧化氢[10]等。L(+)-乳酸是一种乳酸菌利用糖类所产生的基本代谢产物,具有良好抑菌杀菌作用[11],易被人体代谢[12],美国食品药品管理局认定其为一般公认的安全食品添加剂(GRAS)。乳酸菌细菌素是部分乳酸菌产生的一类对革兰氏阳性菌具有显著抑杀作用的肽类(少数乳酸菌细菌素可抑制革兰氏阴性菌)[13]。Verschuere等[14]指出,细菌素有望成为水产养殖中抗生素的替代品。
水产动物的致病微生物多为革兰氏阴性菌,如嗜水气单胞菌Aeromonas hydrophila、维氏气单胞菌Aeromonas veronii、爱德华氏菌Edwardsiella tarda、副溶血弧菌Vibrio parahaemolyticus、鳗鱼弧菌Vibrio anguillarm、温和气单胞菌Aeromonas sobria、杀鲑气单胞菌Aeromonas salmonicida、荧光假单胞菌Pseudomonas fluorescens、水型点状假单胞菌Pseudomonas punctata和肠型点状气单胞菌Aeromonas punctata等。革兰氏阴性病原菌通常对有机酸敏感,但对低浓度酸具有一定耐受性[15]。由于水产动物肠道较短,且微生物数量较少,因此,益生乳酸菌在水产动物肠道内产生的乳酸浓度未必足以杀死全部致病菌。因此,产酸特征不足以保证乳酸菌提高宿主抗细菌病的能力。实际应用研究发现,各类乳酸菌在水产养殖中的应用效果具有明显的菌株特异性[16]。本团队前期研究证明,在产酸能力相当时,产细菌素的乳酸菌对革兰氏阴性菌具有更强的控制力[17]。Nykänen等[18]研究发现,乳酸链球菌素产生菌发酵物与乳酸对鱼源荧光假单胞菌Pseudomonas fluorescens及铜绿假单胞菌Pseudomonas aeruginosa有协同抑制。因此,本研究中提出假设:乳酸菌的两类抑菌产物,细菌素与乳酸具有协同抑制革兰氏阴性菌的作用。为证明这一假设,本研究中选用目前商业化的乳酸链球菌素(nisin),研究其与低浓度乳酸对水产养殖中的重要危害菌——维氏气单胞菌的抑杀作用与机理,并提出了乳酸菌提高水产动物抗病性的一种新机理,旨在为筛选产细菌素乳酸菌作为水产益生菌提供科学依据。
1 材料与方法
1.1 材料
维氏气单胞菌分离自患肠炎病的锦鲤Cyprinus carpio。
试剂:L-乳酸(以下简称乳酸,记为la),纯度>90%(西陇化工股份有限公司);食品级nisin(天津艾玛斯特生物科技有限公司),推荐使用量为0.03~0.20 g/kg;LB培养基(北京陆桥技术股份有限公司)。
仪器:全波长扫描式多功能读数仪Varioskan Flash(Thermo Fisher Scientific,美国);全自动生长曲线分析仪Bioscreen C(Bioscreen Company,芬兰);环境扫描电子显微镜Quanta 200FEG(FEI Company,荷兰)。
1.2 方法
1.2.1 nisin与乳酸对指示菌的生长抑制
1)比浊法测定生长抑制效果。将活化好的维氏气单胞菌接种于LB液体培养基,配制成活菌数为1×107 CFU/mL。在菌液中分别加入蒸馏水、乳酸或nisin溶液,试验设置对照组、4 mmol/L 乳酸处理组、0.05 g/L nisin处理组、4 mmol/L 乳酸+nisin(0.01、0.05 g/L)处理组。每组样品取100 μL,加入96孔板中,于30 ℃下培养12 h,以酶标仪测定OD600 nm值。
2)生长曲线及生长参数。将活化好的维氏气单胞菌接种于LB液体培养基,配制成活菌数为1×107 CFU/mL。在菌液中分别加入蒸馏水、乳酸或nisin溶液,分别制成对照组、4 mmol/L乳酸处理组、0.05 g/L nisin处理组、4 mmol/L乳酸+nisin(0.01、0.05 g/L)处理组。每组样品取200 μL,加入生长曲线仪专用培养板中,采用全自动生长曲线分析仪,于30 ℃下连续培养至48 h,期间每间隔30 min测定一次OD600 nm值,绘制生长曲线,以修正的Gomptz模型拟合[19],计算生长延滞期(lag time)、比生长速率(μmax)、平台期最大活菌数(OD600 nm max)等生长参数。
1.2.2 nisin与乳酸对指示菌的致死作用 将活化好的维氏气单胞菌重悬于生理盐水溶液中,配制成活菌数为1×105 CFU/mL,在菌液中分别加入蒸馏水、乳酸或nisin溶液,制成对照组、4 mmol/L乳酸处理组、0.05 g/L nisin处理组、4 mmol/L 乳酸+0.05 g/L nisin处理组。定时取样以平板计数法测定活菌数。
1.2.3 菌株运动能力测定 运动性检测培养基为0.5% NaCl、1%胰蛋白胨、0.25%琼脂,于121 ℃下灭菌15 min后制备平板。平板上分别加入 1 μL 经未处理、 4 mmol/L 乳酸处理、0.05 g/L nisin处理、4 mmol/L乳酸+0.05 g/L nisin处理8 h的维氏气单胞菌,30 ℃下培养24 h,观察菌落直径[20]。
1.2.4 生物被膜检测 用无菌生理盐水洗涤对数末期的维氏气单胞菌3次,用LB 重悬至 1×108 CFU/mL。试验设置4组,分别为对照组(蒸馏水)、 4 mmol/L乳酸处理组、0.05 g/L nisin处理组、4 mmol/L乳酸+ nisin (0.005 g/L、0.01 g/L、0.05 g/L )处理组。于 30 ℃下培养36 h 后,孔内加满结晶紫试剂[21]染色30 min后,结晶紫附着于生物被膜,弃去多余的结晶紫后,用等体积无水乙醇将附着于生物被膜的结晶紫洗脱,测定OD595 nm值(结晶紫的吸光值,吸光值大小反映体系中结晶紫的浓度高低,结晶紫浓度的高低反映生物被膜量的多寡)。
在加入爬片的24孔聚苯乙烯孔板中,分别设置对照组(400 μL菌液+100 μL生理盐水)、 400 μL菌液+50 μL 4 mmol/L乳酸+50 μL 生理盐水、400 μL菌液+50 μL 0.05 g/L nisin+50 μL 生理盐水、400 μL菌液+50 μL 0.05 g/L nisin+50 μL 4 mmol/L乳酸共4组,于30 ℃下培养72 h后,以无菌HEPES缓冲液清洗去除悬浮菌体。结晶紫染色1.0~1.5 min后,置于显微镜下观察并拍照。
1.2.5 质子动势和膜电动势 维氏气单胞菌(106~107 CFU/mL)悬于HEPES缓冲液,以葡萄糖能量化[22]。
1)nisin对膜电动势(ΔΨ)消散作用的测定。加入1 μmol/L尼日利亚菌素来处理菌体以消除跨膜pH梯度差(ΔpH),之后加入电动势荧光探针DisC3(5)孵育,分别设置空白对照组(蒸馏水)、4 mmol/L乳酸处理组、 0.05 g/L nisin处理组、 4 mmol/L乳酸+ 0.05 g/L nisin处理组,并以多功能酶标仪连续测定荧光强度的变化[23]。
2) nisin对ΔpH影响的测定。向能量化菌悬液中加入1 μmol/L缬氨霉素以彻底消除ΔΨ,并加入荧光染料BCECF-AM(终浓度为3 μmol/L)孵育。4个组别设置同上,使用多功能酶标仪连续记录荧光强度[24]。
1.2.6 扫描电镜 收集对数末期维氏气单胞菌,以生理盐水溶液重悬,4个组别设置同“1.2.5节”,处理12 h后取样,固定处理样品[25],利用环境扫描电子显微镜来采集细胞表面结构的图像。
1.3 数据处理
试验数据采用SPSS 13.0软件进行方差分析,用Duncan法进行多重比较,显著性水平设为0.05。利用Excel软件计算各组数据的标准偏差。
2 结果与分析
2.1 nisin和乳酸对维氏气单胞菌生长的协同抑制作用
从图1A可见:对照组维氏气单胞菌的OD600 nm值为1.37,nisin单独处理组为1.31,与对照组相比,单独添加nisin未影响OD600 nm值(P>0.05);乳酸处理组OD600 nm(0.90)显著降低(P<0.05);在加入乳酸的基础上添加 0.01 g/L nisin,维氏气单胞菌的OD600 nm值显著下降至0.38,且随着nisin质量浓度的升高,下降幅度更大,当nisin质量浓度达到0.05 g/L 时,OD600 nm显著低于所有处理组(P<0.05)。
从图1B可见:在培养的48 h内,对照组菌体快速增长,OD600 nm值迅速升高,很快进入对数期和平台期,nisin单独处理组的生长趋势与对照组类似;乳酸的存在明显干扰了菌体的生长,且在乳酸基础上进一步添加nisin对维氏气单胞菌的生长均表现出显著地抑制,并且抑制程度随着细菌素nisin质量浓度的增加而提高。
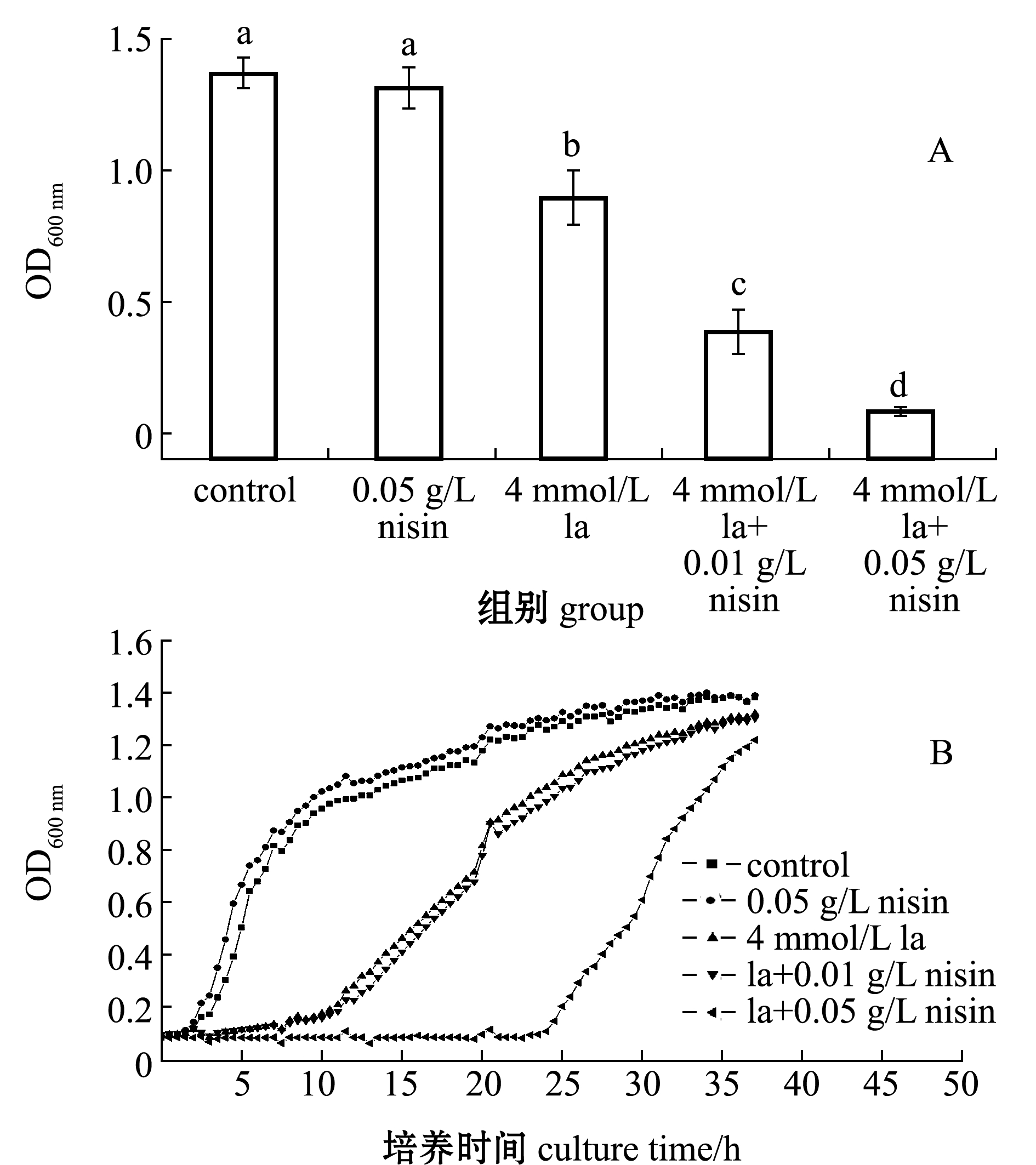
标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。 The means with different letters are significant differences in different groups at the 0.05 probability level, and the means with the same letter are not significant differences, et sequentia.
图1 nisin与乳酸对维氏气单胞菌的协同抑制
Fig.1 Synergistic inhibition of nisin and lactic acid against Aeromonas veronii
从表1可见:在乳酸和细菌素协同处理下,维氏气单胞菌的延滞期延长,μmax值和OD600 nm max值有所下降,且随着细菌素质量浓度升高,各参数也显著变化(P<0.05),证明nisin和乳酸对革兰氏阴性病原菌有联用抑制效果;在4 mmol/L乳酸处理下,0.05 g/L nisin的添加可将菌株延滞期从5.12 h延长至23.51 h,OD600 nm max 值由1.39降低至1.20,μmax值从对照的0.36降低至0.11。
2.2 nisin和乳酸对维氏气单胞菌的协同致死作用
从图2可见:与对照组相比,在处理的36 h内,nisin单独处理组对维氏气单胞菌并无致死作用,4 mmol/L乳酸处理组可造成菌体死亡;4 mmol/L乳酸和0.05 g/L nisin协同处理组,与同浓度乳酸或nisin单独处理组相比,活菌数量大大降低,致死效果最为明显,菌体在36 h 后已被全部杀死,表明二者协同作用发挥的抑菌效果比单独作用更显著。
表1 nisin及乳酸协同对维氏气单胞菌生长主要参数的影响(乳酸浓度4 mmol/L)
Tab.1 Effects of nisin and lactic acid synergy on main parameters of growth in Aeromonas veronii (4 mmol/L la)

nisin质量浓度/(g·L-1)concentration of nisin生长参数 growth parameter延滞期/hlag time比生长率μmax平台期最高活菌数OD600 nm max05.12a0.36a1.39a0.0112.40a0.23a1.20a0.0523.51b0.11b1.09b
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences.
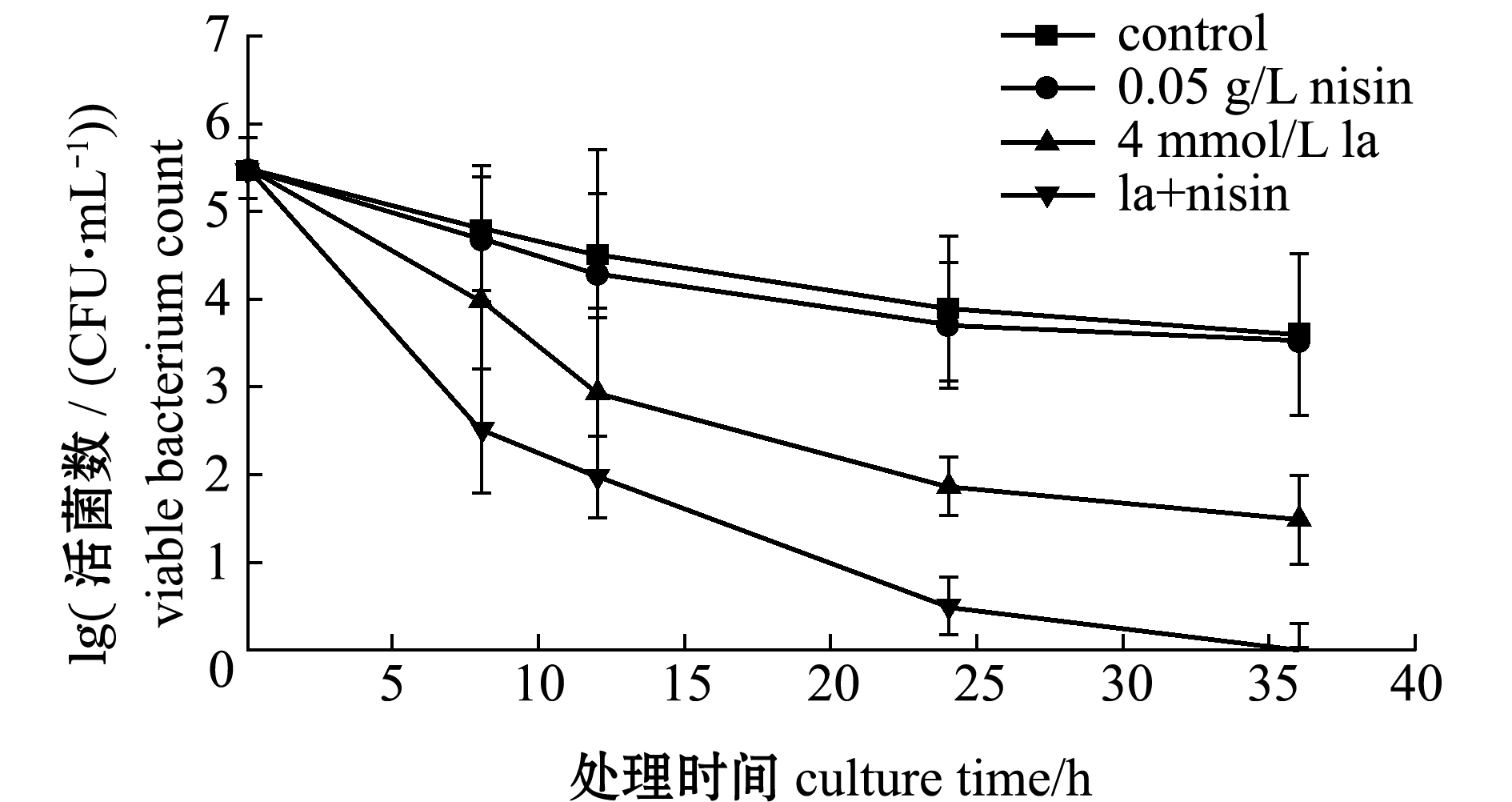
图2 乳酸与nisin对维氏气单胞菌的致死作用
Fig.2 Lethal effects of lactic acid and nisin on Aeromonas veronii
2.3 nisin与乳酸协同对维氏气单胞菌运动性影响
从图3可见:仅nisin组菌落扩散直径与对照组相比,无显著性差异(分别为18.24、17.63 mmol/L)(P>0.05);加入4 mmol/L 乳酸后的维氏气单胞菌的扩散直径显著减小至14.49 mmol/L(P<0.05),为对照组的79.44%,而nisin+乳酸处理组菌落的扩散直径为对照组的61.79%,这表明乳酸与nisin协同处理能够显著减弱维氏气单胞菌的运动性,其中,病原微生物扩散的直径大,表现了菌体的运动性强,反之即运动性弱。
2.4 nisin与乳酸协同对维氏气单胞菌生物被膜形成能力的影响
不同浓度nisin和乳酸协同处理108 CFU/mL的维氏气单胞菌,在培养第36 h时取样测定,其结果如图4所示。从图4A可见:nisin处理组和乳酸单独处理组的OD595 nm值与对照组相比无显著性差异(P>0.05),这表明单独的nisin 或者乳酸处理无法减少维氏气单胞菌生物被膜的生成;而乳酸+nisin的联用处理组与对照组相比,其生物被膜的生成量明显降低,且降低幅度随nisin含量的增加而提高,其中,4 mmol/L乳酸+0.05 g/L nisin处理组被膜生成量仅为对照组的27.43%。图4B直接显示了乳酸和nisin对维氏气单胞菌生物被膜结构的影响,乳酸和nisin协同处理显著降低了爬片上维氏气单胞菌的数量,说明协同处理抑制了菌体黏附。
2.5 nisin 与乳酸对维氏气单胞菌膜电动势的影响
膜电动势的大小由荧光探针DiSC3(5)的荧光强度反映。DiSC3(5)能够聚集在超极化的细胞膜表面,而进入胞内后荧光消失。荧光值减小即细胞膜ΔΨ上升,反之则消散。从图5A可见,乳酸处理组菌体反映ΔΨ的初始荧光值(4 h内)较对照组高,这一现象表明,经乳酸处理后的病原体细胞膜电动势降低,而且革兰氏阴性菌的荧光值此后持续降低也证明了病原微生物在反应过程中ΔΨ不断升高。与对照组及乳酸处理组相比,乳酸+0.05 g/L nisin处理时,维氏气单胞菌的最初荧光值较高,证明细胞膜在一刹那产生极化,荧光值此后持续增加,这表明细胞膜电动势在不断消散。由此推测,细菌素能够对经过乳酸处理的革兰氏阴性菌产生抑制作用,nisin会导致菌体ΔΨ消散;而nisin质量浓度越高,形成的孔洞也越多,其离子泄漏速率也越快,即膜电动势的消散速度越快。
从图5B可见:未经乳酸处理的维氏气单胞菌反映ΔpH的荧光值不断增加,说明菌体的膜质子动势在这一过程中不断上升;而经单独乳酸处理及在乳酸基础上加入 0.05 g/L nisin 后,菌体的初始荧光值均与对照组较低,这一现象表明细胞膜在一瞬间产生了极化。此后,不断降低的荧光值表明膜ΔpH持续消散,这一现象证明细菌素能够损伤经乳酸处理的维氏气单胞菌,并使膜质子动势消散;且la+nisin处理组荧光值下降幅度明显,这表明nisin 对维氏气单胞菌的抑制可能与其对敏感革兰氏阳性菌的抑制机理类似,在有乳酸的情况下,细菌素能够侵入细胞膜,进而导致离子泄漏,造成质子动势消散。
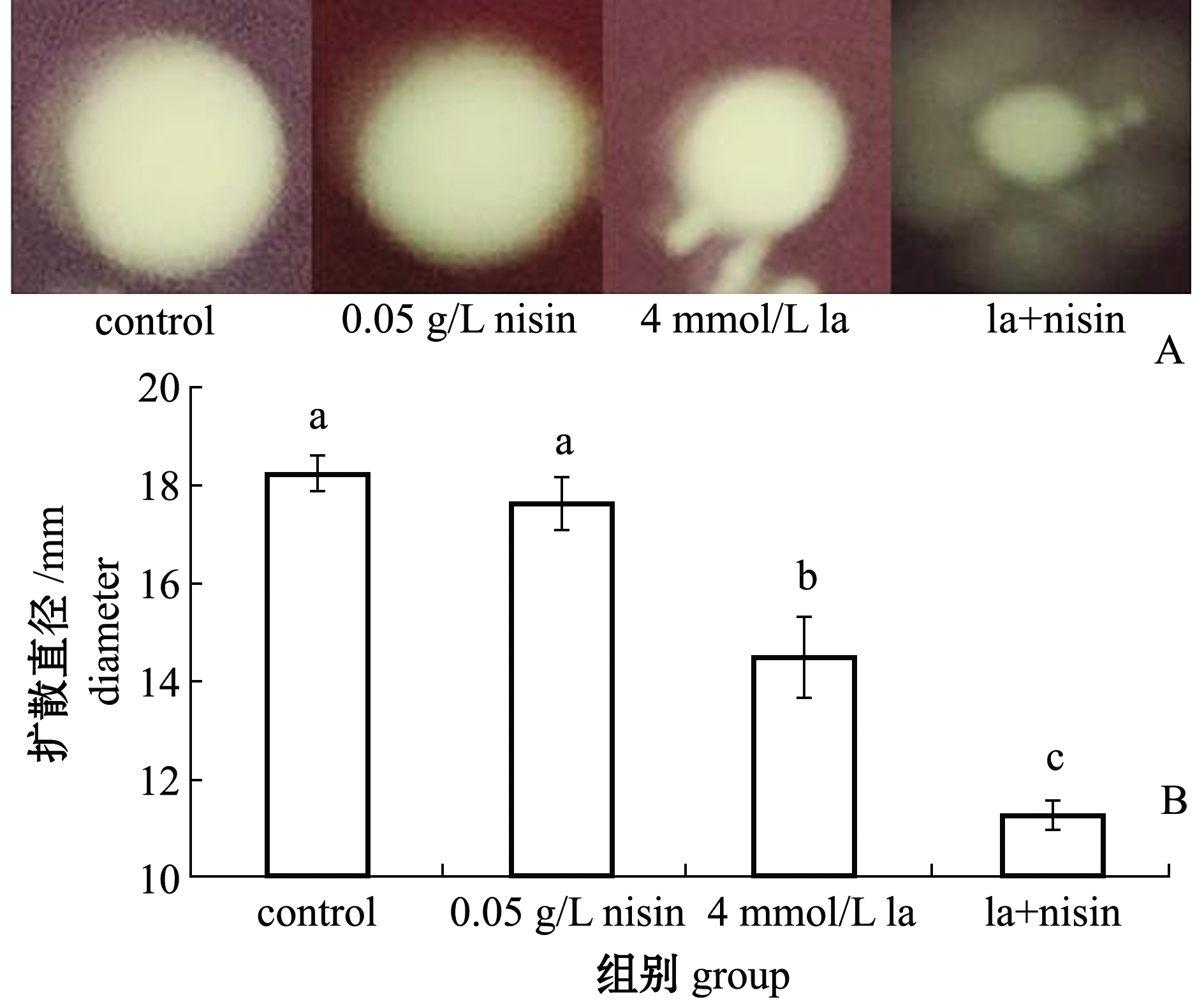
图3 nisin与乳酸处理对维氏气单胞菌运动能力的影响
Fig.3 Effects of nisin and lactic acid treatment on the motility of Aeromonas veronii
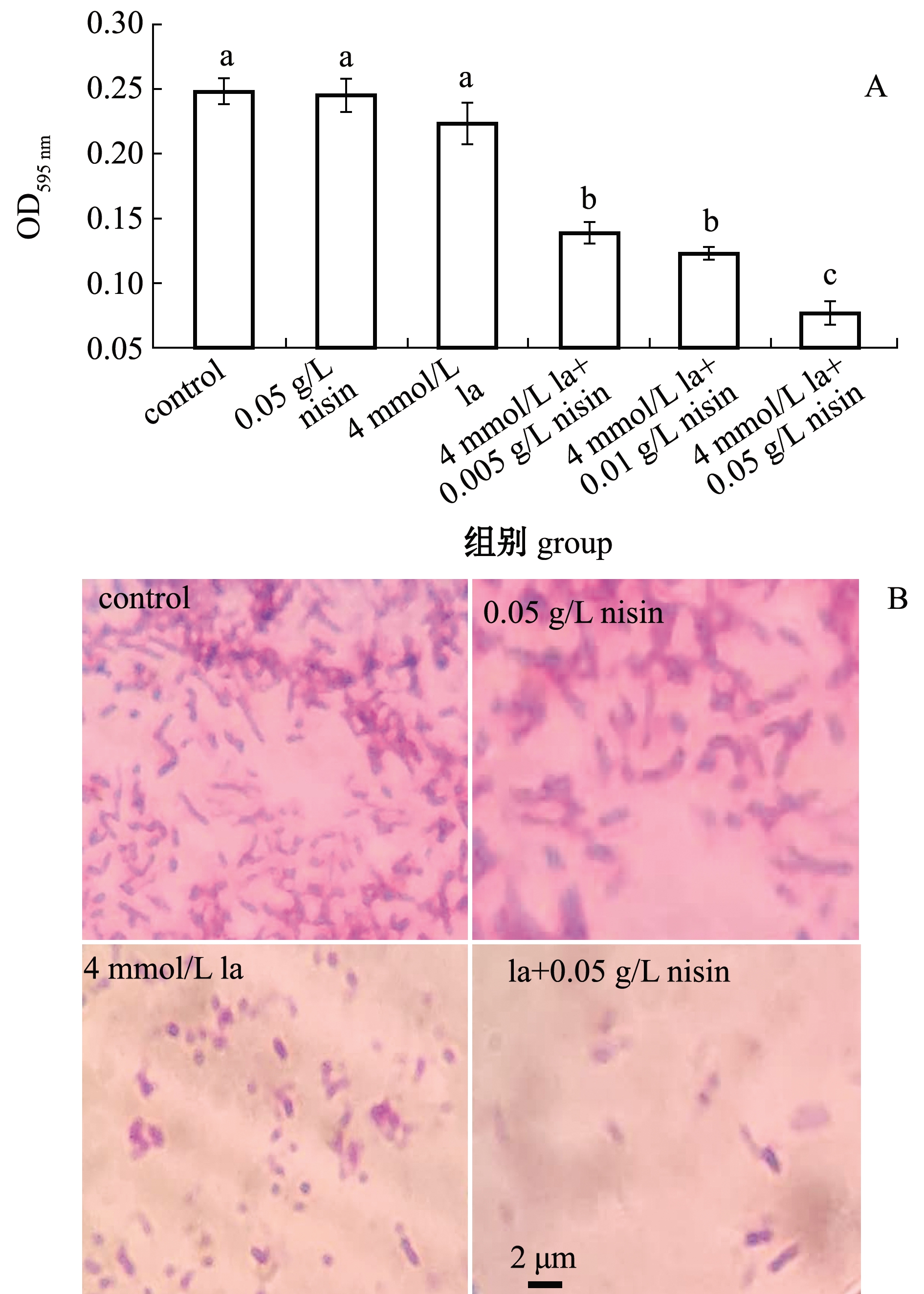
A为不同处理组96孔板中生物被膜的量;B为不同处理组维氏气单胞菌在细胞爬片上形成的生物被膜形态。 A, concentration of biofilm formation in 96-well plate when Aeromonas veronii cells are treated with L-lactic with or without nisin; B, biofilm formation in round coverslip when A.veronii cells are treated with L-lactic acid with or without nisin.
图4 乳酸和nisin协同处理后维氏气单胞菌生物被膜的形成
Fig.4 Biofilm formation of Aeromonas veronii exposed to lactic acid and nisin
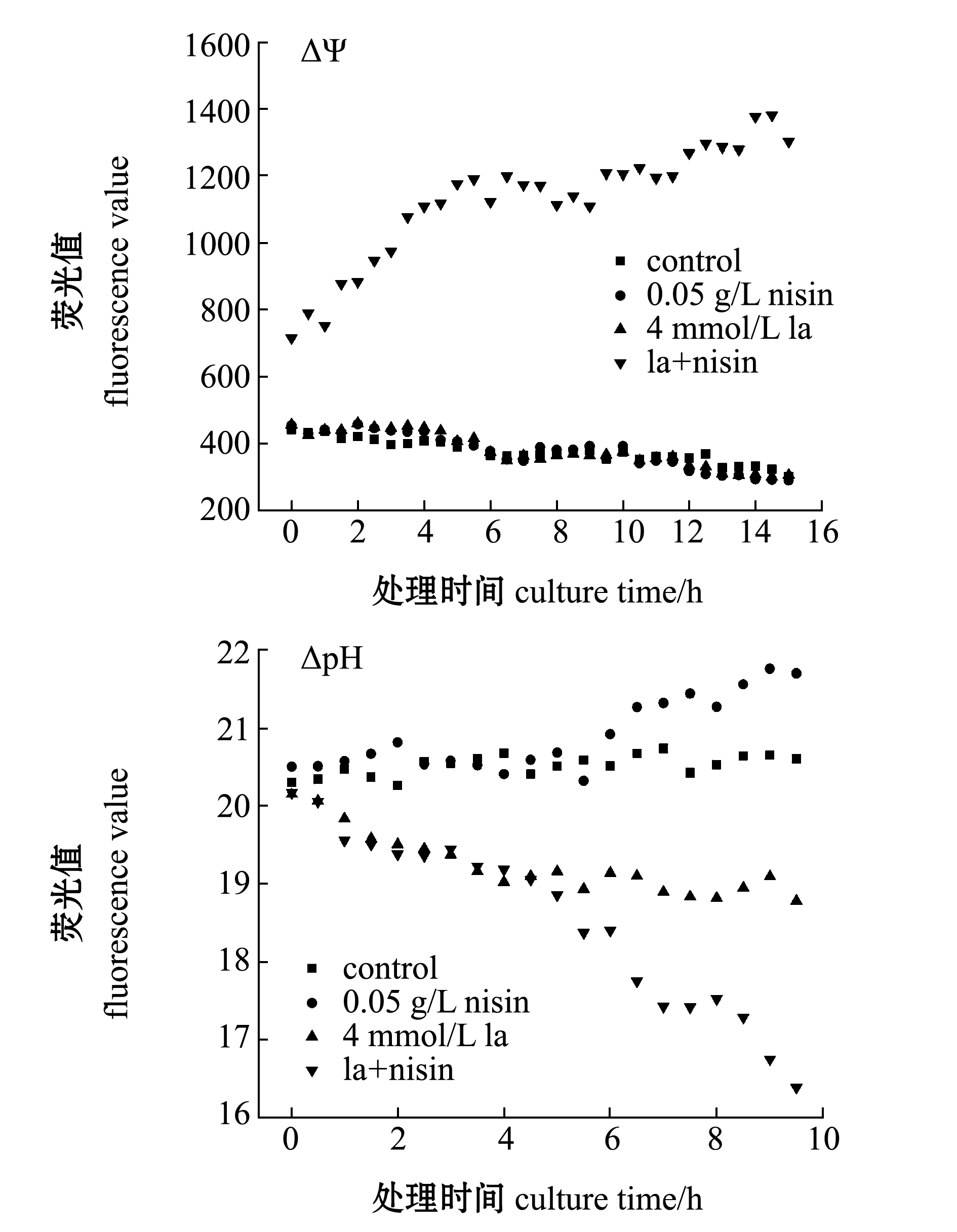
图5 nisin 与乳酸对维氏气单胞菌膜电动势的影响
Fig.5 Effects of nisin and lactic acid on electrodynamic potential of Aeromonas veronii membrane
2.6 nisin与乳酸对维氏气单胞菌膜菌体结构影响
图6为环境扫描电子显微镜拍摄的维氏气单胞菌表面形态特征,维氏气单胞菌在LB 培养基中呈现两端钝圆的杆状,菌体表面光滑饱满。乳酸处理组和协同处理组的菌体表面有明显缺失。其中,4 mmol/L乳酸环境培养的维氏气单胞菌表面破损,发生严重形变,菌体的大小不均一(白色实线箭头),这一现象验证了乳酸通过破坏细胞壁,增进细菌素效力的假设;乳酸与nisin 协同处理的维氏气单胞菌与对照组相比发生明显改变,菌体出现严重变形(黑色虚线箭头),菌体表面可见较多孔洞(黑色实线箭头)和裂解菌体碎片(白色虚线箭头)。试验结果表明,乳酸与nisin可以改变维氏气单胞菌的菌体形态。
3 讨论
3.1 nisin与乳酸对维氏气单胞菌有协同抑杀作用
本研究中通过生长抑制和致死试验证明,乳酸链球菌素nisin和乳酸对维氏气单胞菌有协同抑制和致死作用,且抑制效果随着nisin质量浓度的增加而提高。乳酸是乳酸菌中一类重要抗菌代谢产物,对大部分微生物具有良好的控制效果。nisin是I类乳酸菌细菌素的重要代表,对革兰氏阳性病原微生物如李斯特菌属Listeria、芽孢杆菌属Bacillus 和葡萄球菌属 Staphylococcus 等病原菌具有良好的抑杀效果,但对革兰氏阴性菌无效[26]。Roth等[27]曾报道过低浓度乳酸可造成革兰氏阴性菌非致死性损伤,并提高其对细菌素的敏感性。应用研究也发现,产细菌素的乳酸菌在水产动物体内对革兰氏阴性水产病原菌如嗜水气单胞菌具有良好的控制效果[28]。产细菌素的乳酸菌在食品体系中与同等产酸菌株相比对革兰氏阴性菌有更强的抑制能力[17]。本研究中证明,4 mmol/L乳酸和0.05 g/L的nisin协同可显著抑制维氏气单胞菌的生长,延长延滞期,降低最大比生长速率,这将有利于生产中控制或推迟病原菌的增殖,降低水产动物的患病风险。此外,本研究中还发现,nisin和乳酸可以协同降低维氏气单胞菌的运动性和生物被膜的形成。维氏气单胞菌普遍具有运动性[29],更有利于其生存、扩散及造成感染[30],因而抑制运动性能够有效控制维氏气单胞菌的扩散及毒力。生物被膜是维氏气单胞菌易造成持续感染的另一重要原因,被膜态对菌体有一定的保护作用,并有利于群体信息交流及产生毒力[31-32]。本研究中,在nisin与乳酸共同存在的条件下,维氏气单胞菌形成被膜的能力受到抑制,被膜结构变得松散。这不仅控制了群体的增殖,也能提高菌群对其他抑菌作用的敏感性[33]。nisin与乳酸协同抑菌效应的存在有利于提高乳酸菌在环境中对病原微生物的抗性。因此,在水产养殖中应用产细菌素乳酸菌,可能成为无抗养殖大环境下提高水产动物抗细菌性疾病的重要方式之一[34-37]。

白色箭头为菌体形变;黑色箭头为菌体表面孔洞;白色虚线箭头为菌体裂解碎片;黑色虚线箭头为菌体严重形变。 White narrow, deformation of cells; black narrow, hole of cells; white dashed line, fragment of cells; black dashed line arrows, severe deformation of cells.
图6 nisin和乳酸对维氏气单胞菌细胞表面结构影响的扫描电镜图
Fig.6 Scanning electron microscopy (SEM) showing the effects of nisin and lactic acid on cell surface structure of Aeromonas veronii
3.2 nisin与乳酸协同损伤维氏气单胞菌作用机制
nisin与乳酸对维氏气单胞菌的协同损伤作用,可能来源于二者对细胞结构的分别损伤及相互促进作用。革兰氏阴性菌对细菌素的抗性可能主要来源于细胞壁 (外膜) 保护[38]。去除细胞壁后抗性革兰氏阴性菌就会对细菌素敏感[39]。Alakomi等[40]研究发现,乳酸可以增加革兰氏阴性菌外膜(细胞壁)的通透性。本研究中发现,经乳酸处理后,nisin可以使维氏气单胞菌的膜电动势 (ΔΨ) 及pH梯度 (ΔpH) 消散,说明乳酸与nisin同时存在会对嗜水气单胞菌内膜完整性造成一定程度的影响,膜内环境稳态受到干扰,进一步降低膜内pH,影响膜内物质合成和分解代谢,这与nisin对敏感阳性菌的作用机制相似[41-42]。另一方面,扫描电镜观察到乳酸处理后,菌体表面有明显的损伤,nisin和乳酸共同处理后,菌体表面出现更严重的破损和孔洞,菌体周围也出现与nisin作用于革兰氏阳性菌类似的外膜小泡[43]。此外,nisin对内膜的损伤作用可能进一步促进乳酸进入细胞, 造成较同等浓度下乳酸单独存在时更为严重的损伤。后期深入解析nisin和乳酸对细胞内外膜的损伤过程及机理将有助于更好地理解二者协同抑菌的机制。
4 结论
1)本研究中证明了乳酸和细菌素nisin对革兰氏阴性病原菌有协同抑制和致死作用。
2)nisin和乳酸联用能够有效限制维氏气单胞菌的运动性,抑制其生物被膜产生。
3)对于被乳酸破坏外膜的维氏气单胞菌,nisin能够显著增加其膜通透性,并降低其膜电动势和pH梯度差,这与nisin作用于敏感革兰氏阳性菌的机制类似。
[1] VINCENT A T,GAUTHIER J,DEROME N,et al.The rise and fall of antibiotics in aquaculture[M]//DEROME N.Microbial Communities in Aquaculture Ecosystems.Cham:Springer,2019:1-19.
[2] 叶星,白俊杰.抗菌肽的研究及其在水产上的应用前景[J].大连水产学院学报,2000,15(4):274-279.
YE X,BAI J J.Researches on anti-microbial peptides and its application perspective in aquaculture[J].Journal of Dalian Fisheries University,2000,15(4):274-279. (in Chinese)
[3] RINGØ E,SCHILLINGER U,HOLZAPFEL W.Antimicrobial activity of lactic acid bacteria isolated from aquatic animals and the use of lactic acid bacteria in aquaculture[J].Biology of Growing Animals,2005,2:418-453.
[4] MASDUKI F,MIN C C,KARIM M.Developments of lactic acid bacteria as probiotic for bacterial diseases control in aquaculture[J].Pertanika Journal of Scholarly Research Reviews,2018,4(1):41-53.
[5] 崔磊,郭伟国.乳酸菌产生的抑菌物质及其作用机制[J].食品安全质量检测学报,2018,9(11):2578-2584.
CUI L,GUO W G.Antibacterial substances produced by lactic acid bacteria and their mechanism[J].Journal of Food Safety and Quality,2018,9(11):2578-2584.(in Chinese)
[6] LI C,REN Y C,JIANG S H,et al.Effects of dietary supplementation of four strains of lactic acid bacteria on growth,immune-related response and genes expression of the juvenile sea cucumber Apostichopus japonicus Selenka[J].Fish & Shellfish Immunology,2018,74:69-75.
[7] YANG Q H,LÜ Y L,ZHANG M,et al.Lactic acid bacteria,Enterococcus faecalis Y17 and Pediococcus pentosaceus G11,improved growth performance,and immunity of mud crab (Scylla paramamosain)[J].Fish & Shellfish Immunology,2019,93:135-143.
[8] CALO-MATA P,ARLINDO S,BOEHME K,et al.Current applications and future trends of lactic acid bacteria and their bacteriocins for the biopreservation of aquatic food products[J].Food and Bioprocess Technology,2007,1(1):43-63.
[9] VILLENA J,CHIBA E,VIZOSO-PINTO M G,et al.Immunobiotic Lactobacillus rhamnosus strains differentially modulate antiviral immune response in porcine intestinal epithelial and antigen presenting cells[J].BMC Microbiology,2014,14:126.
[10] BRUDZYNSKI K,ABUBAKER T,ST-MARTIN L,et al.Re-examining the role of hydrogen peroxide in bacteriostatic and bactericidal activities of honey[J].Frontiers in Microbiology,2011,2:213.
[11] DE KEERSMAECKER S C J,VERHOEVEN T L A,DESAIR J,et al.Strong antimicrobial activity of Lactobacillus rhamnosus GG against Salmonella typhimurium is due to accumulation of lactic acid[J].FEMS Microbiology Letters,2006,259(1):89-96.
[12] CONNOR H,WOODS H F,LEDINGHAM J G G.Comparison of the kinetics and utilisation of D (-)- and L (+)-sodium lactate in normal man[J].Annals of Nutrition and Metabolism,1983,27(6):481-487.
[13] ZACHAROF M P,LOVITT R W.Bacteriocins produced by lactic acid bacteria a review article[J].APCBEE Procedia,2012,2:50-56.
[14] VERSCHUERE L,ROMBAUT G,SORGELOOS P,et al.Probiotic bacteria as biological control agents in aquaculture[J].Microbiology and Molecular Biology Reviews,2000,64(4):655-671.
[15] KAREM K L,FOSTER J W,BEJ A K.Adaptive acid tolerance response (ATR) in Aeromonas hydrophila[J].Microbiology,1994,140(7):1731-1736.
[16] RINGØ E,LØVMO L,KRISTIANSEN M,et al.Lactic acid bacteria vs.pathogens in the gastrointestinal tract of fish:a review[J].Aquaculture Research,2010,41(5):451-467.
[17] WANG Y,SUN Y,ZHANG X,et al.Bacteriocin-producing probiotics enhance the safety and functionality of sturgeon sausage[J].Food Control,2015,50:729-735.
[18] NYK NEN A,VESANEN S,KALLIO H.Synergistic antimicrobial effect of nisin whey permeate and lactic acid on microbes isolated from fish[J].Letters in Applied Microbiology,1998,27(6):345-348.
NEN A,VESANEN S,KALLIO H.Synergistic antimicrobial effect of nisin whey permeate and lactic acid on microbes isolated from fish[J].Letters in Applied Microbiology,1998,27(6):345-348.
[19] ZWIETERING M H,JONGENBURGER I,ROMBOUTS F M,et al.Modeling of the bacterial growth curve[J].Applied and Environmental Microbiology,1990,56(6):1875-1881.
[20] CANALS R,RAMIREZ S,VILCHES S,et al.Polar flagellum biogenesis in Aeromonas hydrophila[J].Journal of Bacteriology,2006,188(2):542-255.
[21] O’TOOLE G A.Microtiter dish biofilm formation assay[J].Journal of Visualized Experiments,2011(47):e2437.
[22] JAHID I K,LEE N Y,KIM A,et al.Influence of glucose concentrations on biofilm formation,motility,exoprotease production,and quorum sensing in Aeromonas hydrophila[J].Journal of Food Protection,2013,76(2):239-247.
[23] 雷国华,朴英杰,朱代谟.受体介导内吞过程中巨噬细胞线粒体质子动力势的变化[J].中国医学物理学杂志,1997,14(3):133-135.
LEI G H,PIAO Y J,ZHU D M.Changes of macrophage mitochondrial proton motive force during receptor-mediated endocytosis[J].Chinese Journal of Medical Physics,1997,14(3):133-135.(in Chinese)
[24] MOLENAAR D,ABEE T,KONINGS W N.Continuous measurement of the cytoplasmic pH in Lactococcus lactis with a fluorescent pH indicator[J].Biochimica et Biophysica Acta (BBA) - General Subjects,1991,1115(1):75-83.
[25] WHEELER E E,GAVIN J B,SEELYE R N.Freeze-drying from tertiary butanol in the preparation of endocardium for scanning electron microscopy[J].Stain Technology,1975,50(5):331-337.
[26] RODR GUEZ J M.Review:antimicrobial spectrum,structure,properties and mode of action of nisin,a bacteriocin produced by Lactococcus lactis[J].Food Science and Technology International,2016,2(2):61-68.
GUEZ J M.Review:antimicrobial spectrum,structure,properties and mode of action of nisin,a bacteriocin produced by Lactococcus lactis[J].Food Science and Technology International,2016,2(2):61-68.
[27] ROTH L A,KEENAN D.Acid injury of Escherichia coli[J].Canadian Journal of Microbiology,1971,17(8):1005-1008.
[28] VIJAYABASKAR P,SOMASUNDARAM S T.Isolation of bacteriocin producing lactic acid bacteria from fish gut and probiotic activity against common fresh water fish pathogen[J].Biotechnology,2008,7:124-128.
[29] NAWAZ M,KHAN S A,KHAN A A,et al.Detection and characterization of virulence genes and integrons in Aeromonas veronii isolated from catfish[J].Food Microbiology,2010,27(3):327-331.
[30] GAV N R,RABAAN A A,MERINO S,et al.Lateral flagella of Aeromonas species are essential for epithelial cell adherence and biofilm formation[J].Molecular Microbiology,2002,43(2):383-397.
N R,RABAAN A A,MERINO S,et al.Lateral flagella of Aeromonas species are essential for epithelial cell adherence and biofilm formation[J].Molecular Microbiology,2002,43(2):383-397.
[31] TALAGRAND-REBOUL E,JUMAS-BILAK E,LAMY B.The social life of Aeromonas through biofilm and quorum sensing systems[J].Frontiers in Microbiology,2017,8:37.
[32] KOECHLER S,FARASIN J,CLEISS-ARNOLD J,et al.Toxic metal resistance in biofilms:diversity of microbial responses and their evolution[J].Research in Microbiology,2015,166(10):764-773.
[33] KOO H,ALLAN R N,HOWLIN R P,et al.Targeting microbial biofilms:current and prospective therapeutic strategies[J].Nature Reviews Microbiology,2017,15(12):740-755.
[34] VANDENBERGH P A.Lactic acid bacteria,their metabolic products and interference with microbial growth[J].EMS Microbiology Reviews,1993,12(1/2/3):221-237.
[35] INDIRA K,JAYALAKSHMI S,GOPALAKRISHNAN A,et al.Biopreservative potential of marine Lactobacillus spp.[J].African Journal of Microbiology Research,2011,5(16):2287-2296.
[36] 毛雪梅.乳酸菌作为一种替代抗生素的添加剂在韩国被广泛应用[J].湖南饲料,2016(5):5-8.
MAO X M.Widespread use of lactic acid bacteria as antibiotic alternatives in South Korea[J].Hunan Feed,2016(5):5-8.(in Chinese)
[37] LEISTNER L.Basic aspects of food preservation by hurdle technology[J].International Journal of Food Microbiology,2000,55(1/2/3):181-186.
[38] GAO Y,VAN BELKUM M J,STILES M E.The outer membrane of gram-negative bacteria inhibits antibacterial activity of brochocin-C[J].Applied and Environmental Microbiology,1999,65(10):4329-4333.
[39] ANDERSSON R.Inhibition of Staphylococcus aureus and spheroplasts of gram-negative bacteria by an antagonistic compound produced by a strain of Lactobacillus plantarum[J].International Journal of Food Microbiology,1986,3(3):149-160.
[40] ALAKOMI H L,SKYTT E,SAARELA M,et al.Lactic acid permeabilizes gram-negative bacteria by disrupting the outer membrane[J].Applied and Environmental Microbiology,2000,66(5):2001-2005.
E,SAARELA M,et al.Lactic acid permeabilizes gram-negative bacteria by disrupting the outer membrane[J].Applied and Environmental Microbiology,2000,66(5):2001-2005.
[41] BIERBAUM G,SAHL H G.Lantibiotics:mode of action,biosynthesis and bioengineering[J].Current Pharmaceutical Biotechnology,2009,10(1):2-18.
[42] MARTIN N I,BREUKINK E.The expanding role of lipid II as a target for lantibiotics[J].Future Microbiology,2007,2(5):513-525.
[43] PATTANAYAIYING R,H-KITTIKUN A,CUTTER C N.Effect of lauric arginate,nisin Z,and a combination against several food-related bacteria[J].International Journal of Food Microbiology,2014,188:135-146.