池塘循环流水槽养殖(in-pond raceway system, IPRS)是中国从美国大豆出口协会引进的一种新型养殖模式,由2%~5%的池塘水面建设具有气提推水增氧和集排污装备的系列水槽作为养殖区,剩余水面作为净化区对养殖尾水进行净化处理,此模式具有节水节地、产量高、渔药使用量低、养殖全程可控等优点,已被列入《农业绿色发展技术导则(2018—2030年)》,成为中国农业农村部主推的绿色健康养殖技术之一,目前对该模式研究主要集中在系统构建优化、养殖品种的筛选、肉质评价与浮游生物群落特征分析等[1-3]。国内已采用这种养殖模式成功养殖了大口黑鲈Micropterus salmoides、斑点叉尾鮰Ictalurus punctatus、罗非鱼Oreochromis niloticus、黄颡鱼Pelteobagrus fulvidraco等鱼类,并获得了良好的经济效益和生态效益[1]。
水产养殖过程中,提高养殖密度被认为是集约化养殖模式中提高鱼产量的重要手段之一。然而,大量研究表明,养殖密度过高会导致鱼类释放应激激素,进而改变鱼类的生长、血液参数及免疫功能[4-6],此外,养殖密度还会影响鱼类生长基因(生长激素GH和胰岛素样生长因子IGF-I)的表达,如王晓梅等[7]在革胡子鲶Clarias gariepinu幼鱼养殖密度试验中发现,养殖密度越高,鱼垂体GH基因的表达量越低。目前,有关养殖密度对鱼类生长性能影响的研究较多,但养殖密度对鱼体GH/IGF轴基因表达影响的研究较少。
大口黑鲈俗称加州鲈,来源于北美,是中国重要的淡水养殖经济鱼类之一[8],因其具有耐低氧、广温性、肉质肥美、营养价值高、易养殖等优点,深受养殖户青睐。在池塘工程化循环水养殖中,选择适宜养殖密度对于减少应激胁迫、提高养殖效益和鱼类福利极其重要,因此,本试验中研究了池塘工程化循环水养殖模式下养殖密度对大口黑鲈幼鱼生长、生理生化指标及GH、IGF-1基因表达的影响,以期为大口黑鲈池塘工程化循环水养殖模式标准化操作规程的建立提供科学数据和理论参考。
1 材料与方法
1.1 材料
养殖试验在中国水产科学研究院淡水渔业研究中心扬中基地工程化循环流水槽内进行,系统结构和水槽剖面图分别如图1和图2所示。在池塘环沟内建造的2排流水槽呈对角线布置,形成对角循环对流、能耗最低的循环流水设计模式。流水槽分为气提推水增氧区、养殖区(22.0 m×5.0 m×2.5 m) 和集污区。流水槽前端安装气提推水增氧装置,底部安装微孔增氧装置。流水槽养殖区域面积合计为1 320 m2,占池塘环沟总面积的3.19%,剩余的池塘区域为净化区域,通过物理沉淀法,种养空心菜、薄荷和鱼腥草,以及放养花白鲢和三角帆蚌对养殖尾水进行净化处理。养殖水源为长江水,水质清新无污染,符合《渔业水质标准》。
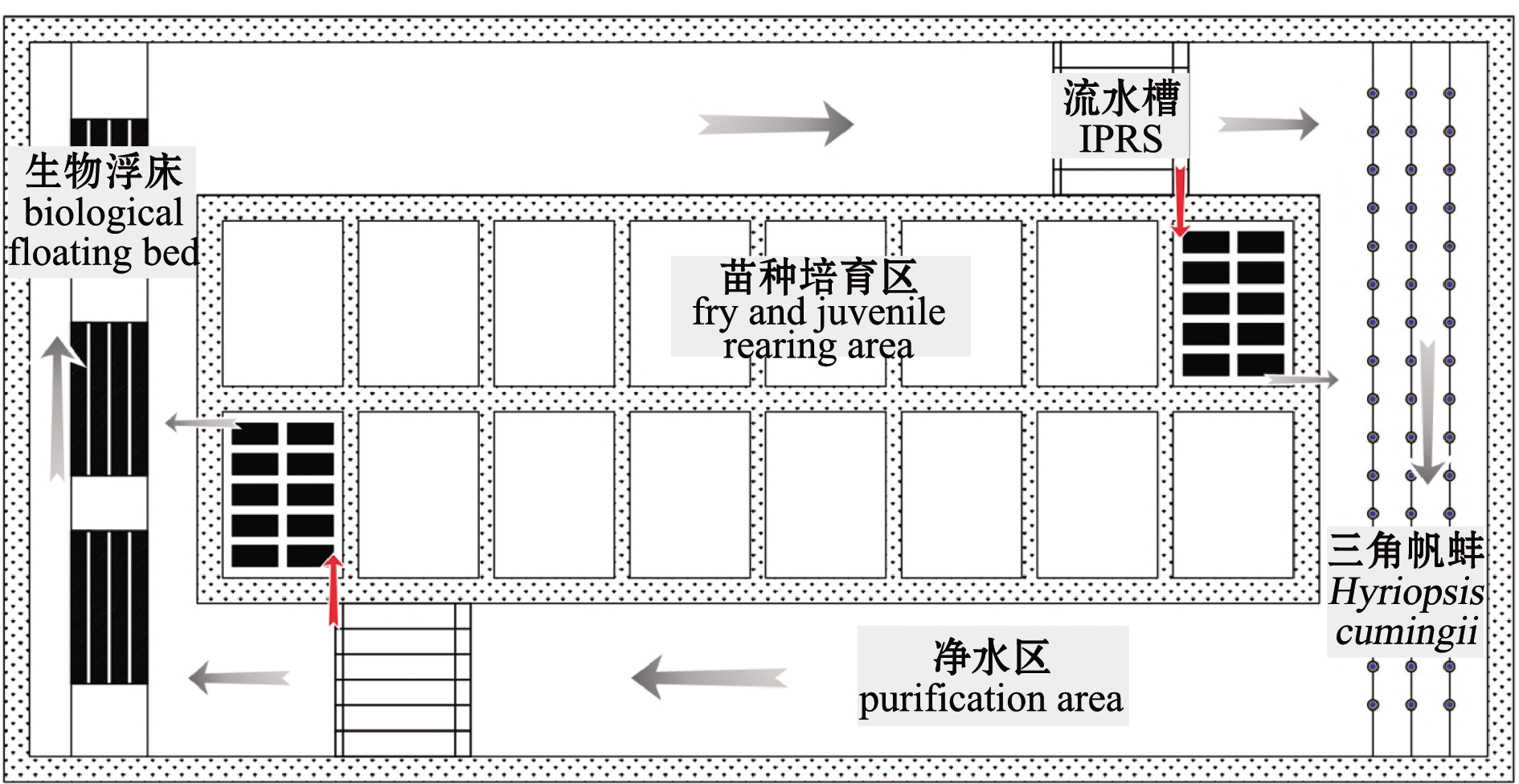
图1 池塘工程化循环水养殖系统结构示意图
Fig.1 Diagram of the in-pond raceway systems (IPRS)

图2 流水养殖槽剖面示意图
Fig.2 Profile diagram of in-pond raceway systems (IPRS)
1.2 方法
1.2.1 试验设计及饲养管理 将同一批次、健康活跃、大小一致的大口黑鲈幼鱼(初始体质量为4.50 g±0.23 g)随机分配到流水槽中。试验设置3个养殖密度组,记为SD1、SD2、SD3,初始养殖密度分别为0.2、0.4、0.6 kg/m3,每个密度组设3个重复,共设置9个水槽。不同养殖密度组的初始放养量分别为10 000、20 000、30 000尾,养殖试验持续120 d。
试验期间,投喂膨化颗粒饲料(粗蛋白质含量≥47%,粗脂肪含量≥5%,浙江欣欣天恩水产饲料有限公司),根据鱼体质量的变化投喂不同规格的饲料。采用饱食投喂法,每天投喂4次(6:00、10:00、14:00和17:00),并根据鱼体质量的增加、天气状况、生理状态、水质情况等,适当调整投喂量和投喂次数以满足鱼体生长的需求。每天观察并记录鱼的摄食及死亡情况。试验期间,24 h连续推水增氧以保证水体中溶解氧>5 mg/L,水流速度为2~3 cm/s,水温为22.6~30.5 ℃,氨氮含量为0.06~0.62 mg/L,pH为7.5~8.22,亚硝酸氮含量为0.18~0.33 mg/L。
1.2.2 样本采集 分别于试验的第30、60、90、120天采集样本。从每个水槽随机捞取20尾鱼,立即用MS-222(100 mg/L)麻醉,准确测量其湿质量、体长。然后取10尾鱼从尾静脉采血,分装于1.5 mL的离心管中,4 ℃冰箱中静置4 h后,以4 500 r/min离心15 min,吸取上清液,-80 ℃超低温冰箱中保存,用于血清生化指标测定。随后将鱼解剖,取其肝脏、脑、肌肉、肠道等组织,迅速放入液氮罐中带回实验室于-80 ℃冰箱中保存,用于后期组织生化指标和基因表达分析。另取10尾鱼于-30 ℃下保存,用于营养成分分析。
1.2.3 指标的测定与计算
1) 生长性能指标。试验鱼的存活率(SR,%)、增重率(WGR,%)、特定生长率(SGR,%/d)、日摄食量(FR,g)、肥满度(CF,%)、肝体指数(HSI,%)和脏体指数(VSI,%)计算公式如下:
SR=nt/n0×100%,
WGR=(Wt2-Wt1)/Wt1×100%,
SGR=(lnWt2-lnWt1)/t×100%,
FR=F/[n0(t2-t1)],
CF=W/L3×100,
HSI=WL/W×100%,
VSI= WI/W×100%。
其中:nt、n0分别为试验终末、试验初始时鱼的数量(ind.);Wt2为每次采样时测定的鱼体质量(g);Wt1为上次采样时测定的鱼体质量(g);t1、t2为两次试验时间(d);t为采样间隔时间(d);F为总投饵量(g);L为体长(cm);W为体质量(g);WL为肝脏质量(g);WI为内脏质量(g)。
2) 体成分。将全鱼样品放入烘箱中,烘干至恒重,根据烘干前后质量的变化计算水分含量。采用马弗炉550 ℃灼烧法(GB/T5009.4—1985)、索氏抽提法(T5009. 6—1985,济南海能仪器有限公司,SOX500脂肪测定仪)、凯氏定氮法(GB/T5009.5—1985,济南海能仪器有限公司,K1100全自动凯氏定氮仪)分别测定灰分、粗脂肪、粗蛋白质含量。
3) 血清生化指标和免疫参数。采用全自动生化分析仪(迈瑞BS-400,深圳)测定血清总蛋白(TP)、总胆固醇(TC)、血糖(Glu)、甘油三酯(TG)含量等指标;采用酶联免疫检测法(ELISA)测定血清皮质醇和溶菌酶含量。
4) GH、IGF-I基因表达量。根据NCBI上查找到的大口黑鲈GH、IGF-I基因序列(GenBank登录号分别为DQ666528.1、DQ666526.1),利用Primer Premier 5.0软件设计定量引物(表1),引物由苏州金唯智生物科技有限公司合成,其中以β-actin[9]与18S[10]为内参基因。参照施培松[11]的方法,根据TaKaRa公司的MiniBEST Universal RNA Extraction Kit提取鱼脑和肝脏的总RNA,并验证总RNA的完整性,使OD260 nm/OD280 nm值保持1.8~2.0。然后,采用TaKaRa PrimeSciptTM 1st Strand cDNA Synthesis Kit反转录合成cDNA,并将其保存在-20 ℃下待用。对引物GH-F、GH-R、IGF-I-F、IGF-I-R、β-actin-F、β-actin-R、18S-F、18S-R进行PCR扩增,计算出扩增效率在0.9~1.1。
GH、IGF-I、β-actin与18S的表达量使用TaKaRa公司的SYBR Prime Script TM RT-PCR Kit进行PCR反应。反应体系为:TB Green Fast qPCR Mix 7.5 μL,上、下游引物各为0.6 μL,cDNA 1 μL,灭菌水5.3 μL。反应程序为:95 ℃下预变性30 s;95 ℃下循环变性5 s,58.6 ℃(或58 ℃)下退火复性10 s,共进行40个循环。熔解反应条件为65 ℃到95 ℃,读板30 s记录荧光量。以β-actin与18S为内参基因,对得到的各样本的Ct值做均一化处理,应用2-ΔΔCt法计算低、中、高密度组鱼脑GH、肝脏IGF-I基因mRNA相对表达量。
表1 实时荧光定量PCR引物
Tab.1 Gene-specific real-time quantitative PCR primers

引物 primer引物序列(5'~3' )primer sequence (5'-3') 产物长度/bplength of product退火温度/℃annealing temperatureβ-actin-FATCGCCGCACTGGTTGTTGACβ-actin-RCCTGTTGGCTTTGGGGTTC18758.018S-FGGACACGGAAAGGATTGACAG18S-RGGACACGGAAAGGATTGACAG18258.0GH-FGAGCAGCGTCAACTCAACAAGH-RTCAAACGATACGAGATAGACAACA13058.6IGF-I-FCGGAGTCTCGTTCGTTATCGGIGF-I-RGCCTCTATCTCCACACACAAACT13658.6
1.3 数据处理
试验数据以平均值±标准误(means±S.E.) 表示。采用SPSS 19.0软件对试验数据进行单因素方差分析(One-way ANOVA),用LSD 法进行组间多重比较,差异显著性水平设为0.05。
2 结果与分析
2.1 大口黑鲈幼鱼生长性能的变化
120 d的养殖试验结束时,各养殖密度组存活率(91.45%~93.33%)无显著性差异(P>0.05)(图3A);30 d时,SD2组试验鱼的体质量、增重率和SGR均显著高于SD1组和SD3组(P<0.05),而SD1组与SD3组间无显著性差异(P>0.05);60~120 d时,各密度组大口黑鲈体质量、增重率、SGR随养殖密度的增加而降低;60~120 d时,SD1组鱼体质量均显著高于SD3组(P<0.05),而SD2与SD3组间无显著性差异(P>0.05)(图3B);60~90 d时,增重率变化趋势与体质量一致,而在120 d时,各养殖密度组间无显著性差异(P>0.05)(图3C);60 d时各密度组SGR有显著性差异(P<0.05),而在90 d和120 d时,各密度组间无显著性差异(P>0.05)(图3D);30 d时,SD3试验鱼日摄食量显著高于其他两组(P<0.05),而在90 d和120 d时,SD3组日摄食量则显著低于其他两组(P<0.05)(图3E)。试验结束时,3个密度组试验鱼平均产量分别为5.64 kg/m3 (SD1)、8.79 kg/m3 (SD2)和11.21 kg/m3 (SD3)。

标有不同字母者表示同一时间下不同密度组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同。 The means with different letters in same time are significant differences in different density groups at the 0.05 probability level, and the means with the same letter are not significant differences, et sequentia.
图3 不同养殖密度对大口黑鲈生长性能的影响
Fig.3 Effects of different stocking densities on growth performance of largemouth bass Micropterus salmoides in IPRS
2.2 大口黑鲈体成分和形体指数的变化
从表2可见:不同养殖密度对大口黑鲈体水分、灰分与粗蛋白质含量无显著性影响(P>0.05),而SD1和SD2组粗脂肪含量显著高于SD3组(P<0.05);SD1组试验鱼的肥满度显著高于SD2和SD3组(P<0.05),而肝体指数与脏体指数在各处理组间无显著性差异(P>0.05)。
表2 不同养殖密度对大口黑鲈体成分和形体指标的影响
Tab.2 Effects of stocking density on the body composition and somatic parameters of largemouth bass Micropterus salmoides in IPRS

组别group采样时间/dtime水分/%moisture粗灰分/%crude ash粗脂肪/%crude lipid粗蛋白质/%crude protein肥满度condition factor肝体指数/%hepatic-somaticindex脏体指数/%heart-somaticindexSD112069.65±0.14a4.27±0.44a7.24±0.52a16.41±0.36a2.49±0.04a1.98±0.13a6.74±0.23aSD212070.15±0.78a3.90±0.18a7.09±0.71a16.87±0.51a2.21±0.04b1.79±0.16a6.93±0.36aSD312069.53±0.66a3.85±0.01a5.81±0.30b16.26±0.34a2.27±0.06b2.12±0.15a7.43±0.54a
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05)。
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letter within the same column are not significant differences.
2.3 大口黑鲈血清生化和免疫指标的变化
养殖密度显著影响大口黑鲈血清皮质醇、血糖、甘油三酯和溶菌酶含量。前90 d内,大口黑鲈血清皮质醇与血糖含量未受养殖密度的影响(P>0.05),120 d时,SD3组皮质醇含量和血糖含量显著高于SD1组(P<0.05)(图4A、B);甘油三酯含量的变化趋势与血糖类似,120 d时,SD3组甘油三酯含量显著高于其他两组(P<0.05),其在整个养殖周期内变化幅度不大,维持在1.80~2.10 mmol/L(图4C);30 d时,大口黑鲈血清溶菌酶含量未受到养殖密度的影响(P>0.05),60~120 d时,SD1组显著高于SD3组(P<0.05)(图4D)。
2.4 大口黑鲈GH、IGF-I基因表达的变化
从图5可见:30 d时,各试验鱼脑GH和肝脏IGF-I基因mRNA相对表达量均较高,且SD2组两种基因的表达量显著高于SD1组(P<0.05),而与SD3组无显著性差异(P>0.05);随时间的延长,各基因表达量均有降低,60~90 d时各密度组间有显著性差异(P<0.05),其中60 d时,SD3组鱼脑GH表达量显著高于SD1组(P<0.05),而肝脏IGF-I基因相对表达量则显著低于SD1组(P<0.05),120 d时,GH和IGF-I基因的相对表达量在各密度组间均无显著性差异(P>0.05)。
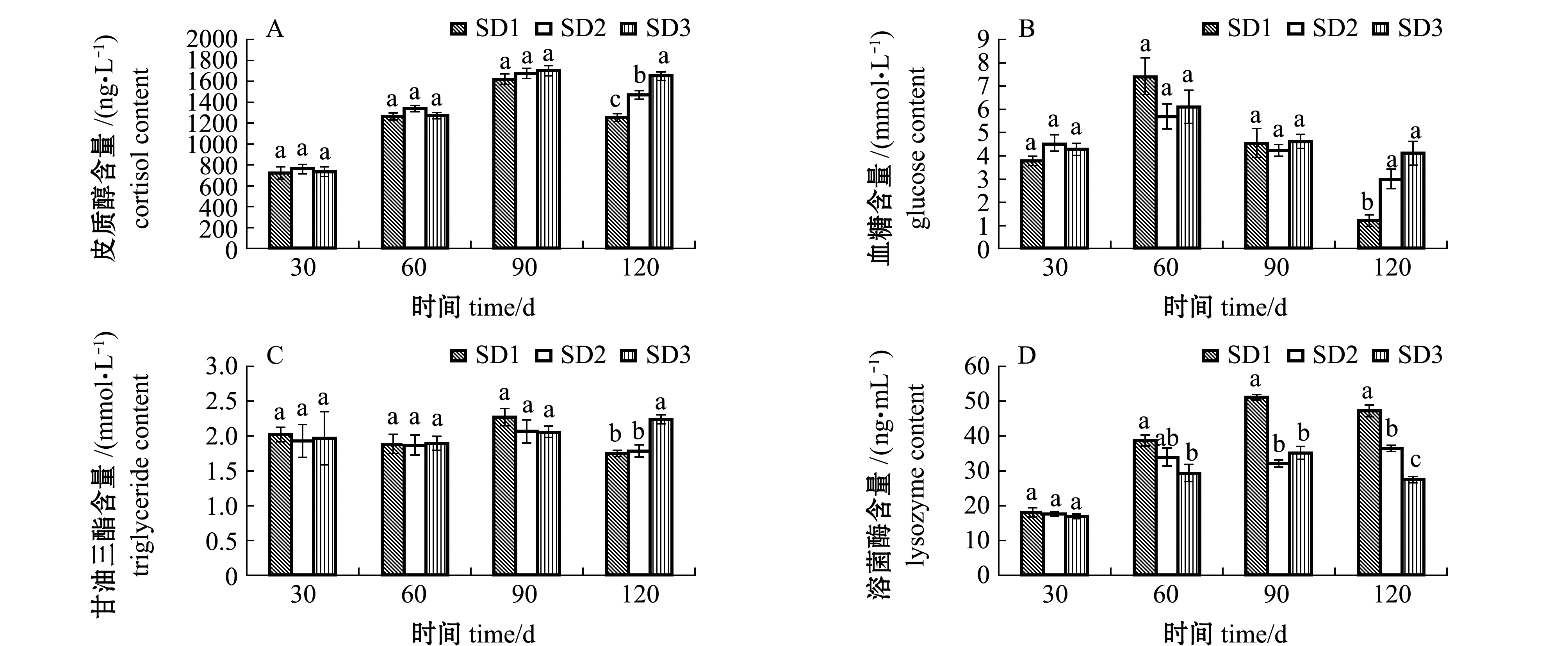
图4 不同养殖密度对大口黑鲈血清生化和免疫指标的影响
Fig.4 Effects of stocking density on the serum biochemical and immune indices of largemouth bass Micropterus salmoides in IPRS
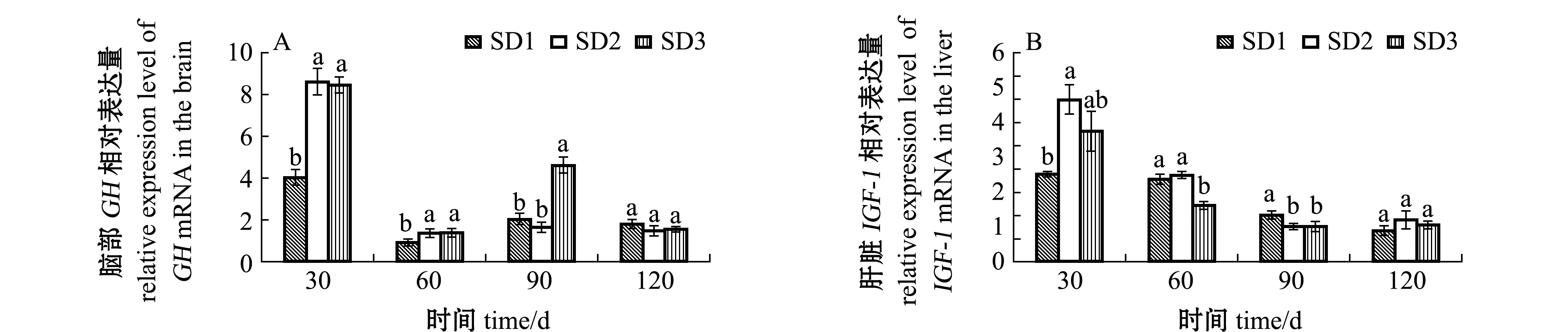
图5 不同养殖密度对大口黑鲈脑GH和肝脏IGF-I基因相对表达量的影响
Fig.5 Effects of stocking density on relative expression level in brain GH and hepatic IGF-1 of largemouth bass Micropterus salmoides in IPRS
3 讨论
3.1 养殖密度对大口黑鲈幼鱼生长性能的影响
在集约化水产养殖生产中,养殖密度被认为是决定鱼类生长和盈利的重要因素之一。高养殖密度作为一种慢性应激源,会使鱼类产生一级、次级、三级应激反应,其中,三级反应会引起个体生长速率、抗病能力、繁殖能力及行为等发生改变[12]。本试验中,120 d的养殖试验表明,池塘工程化循环水系统中养殖密度对大口黑鲈生长性能产生了显著的影响。30 d时,SD2组试验鱼的体质量、增重率、特定生长率均显著高于SD1与SD3组(P<0.05);60~120 d时,试验鱼的体质量、增重率和特定生长率变化规律均为SD1>SD2>SD3,这与对大菱鲆Scophthalmus maximus幼鱼[13]和厚唇鲻Chelon labrosus幼鱼[14]等的研究结果类似。虽然在试验结束时,试验鱼的平均产量变化规律均为SD3>SD2>SD1,但SD3组的高产量是以大的种群数量为基础,而不是以高的生长性能为前提[15],因此,结合试验结果和效益,建议此阶段的大口黑鲈合理的养殖密度为0.2~0.4 kg/m3。
养殖密度对鱼类生长性能的影响因水质条件、饲料摄入量、生存空间等因素的不同而存在差异[16-17]。本试验中,IPRS模式条件下,养殖用水的持续循环流动,以及净化区水生植物、滤食性鱼类和贝类的净化作用,使得pH、溶解氧等水质因子维持在恒定水平,良好的水质减弱了高密度组中排泄物及代谢物对大口黑鲈生长的影响,因此,水质不是造成各密度组生长差异的主要原因。养殖试验初期,笔者观察到SD1组试验鱼抢食不积极,SD1组鱼之间的相互作用减少从而导致其生长缓慢,而随着养殖时间的延长,试验鱼的体质量和体长增大,SD1组鱼类的相互作用增强,生长优势就体现出来。养殖后期(90 d和120 d),高养殖密度组鲈日摄食量显著降低,SD3组试验鱼生长受到抑制可能与摄食量下降有关,对虹鳟Oncorhynchus mykiss的试验中也发现类似结果[18]。Mechaly等[19]指出,拥挤胁迫使得鱼类不像在非拥挤环境中摄食那么舒适,5-羟色胺会降低刺激食物摄入基因的活性,从而导致高养殖密度组鱼食欲和摄食量下降。另一方面,拥挤应激引发了鱼类对能量的需求上升,激活鱼类应激下的生理反应,导致可用于生长的能量减少。本试验中,养殖后期SD3组鲈体脂肪含量显著降低,可以解释为鲈鱼受到拥挤胁迫时,会优先利用脂肪通过糖异生作用,以满足高放养密度应激时不断增长其对能量的需求,而用于生长的能量减少,从而导致大口黑鲈生长率降低和鱼体变瘦,SD3组鱼体肥满度显著降低印证了这一点。
3.2 养殖密度对大口黑鲈体成分的影响
当外界环境发生改变时,鱼类往往通过改变新陈代谢水平来适应不利环境。研究表明,养殖密度、饲料成分、盐度等都会对鱼体的生化组成造成影响[20-21]。在本试验中,养殖密度对大口黑鲈体水分、灰分和蛋白质含量无显著性影响,这与对俄罗斯鲟Acipenser gueldenstaedti幼鱼[21]的研究结论一致。放养密度对非洲鲶Clarias gariepinus体蛋白质含量无显著影响,而体灰分和粗脂肪含量随放养密度的增加而增加[22]。本研究中,高密度组试验鱼体脂肪含量显著低于低密度组,类似地,研究者对施氏鲟Acipenser schrenckii[23]和欧洲鳎Solea solea[24]的研究结果表明,鱼类对生存空间和食物的竞争随着养殖密度的增大而增强,从而减少了脂肪在鱼体内的积累,这可能是由于鱼类在受到拥挤胁迫时优先利用脂肪通过糖异生作用,以满足高放养密度应激下鱼类对能量不断增长的需求,导致体脂肪含量降低。而在俄罗斯鲟[19]和虹鳟[25]的试验中,鱼体脂肪含量随着放养密度的增加而增加。这些研究结果的差异可能是鱼的种类、年龄、大小、生理状态和拥挤胁迫暴露时间的差异造成的。
3.3 养殖密度对大口黑鲈生理指标的影响
鱼类在应对应激时,皮质醇、葡萄糖、甘油三酯等血清代谢产物的变化被称为主要的次级应激反应。皮质醇是硬骨鱼体内合成的主要类固醇皮质激素,应激状态下其含量会迅速升高,血糖水平是鱼类面对胁迫时一种常见的继发性反应[26]。Zahedi等[27]指出,葡萄糖和皮质醇通常会在受到应激后的最初几小时或几天内升高,随后由于体内平衡机制和下丘脑-垂体-肾间轴的适应而逐渐降低,这与本试验中的研究结果一致。本研究结果显示,养殖前90 d,养殖密度对血清皮质醇、甘油三酯和血糖含量无显著性影响,而在养殖末期,SD3组鱼的皮质醇含量显著高于SD1与SD2组,这说明随着鱼体的生长,高放养密度会激活试验鱼应激系统,导致血清皮质醇含量增加,长期的高皮质醇水平会抑制鱼类的生长、免疫力、脂肪的合成,造成鱼体瘦弱[28-29]。此外,拥挤胁迫造成的皮质醇水平的升高还会引起鱼类短期的急性适应性反应,如血糖水平的升高[30],在120 d时,SD3组血糖水平明显高于SD1组,这与对欧洲鲈Dicentrarchus labrax[5]和俄罗斯鲟幼鱼[31]的研究结果一致。本研究中大口黑鲈体成分分析结果显示,SD3组试验鱼体脂肪含量明显下降,说明养殖密度增加可能促进了大口黑鲈的能量代谢,导致鱼体内脂肪分解的增加,而血浆葡萄糖和甘油三酯水平的上升间接证明了这一点。相反的,de las Heras等[14]研究发现,在较高的放养密度下,厚唇鲻幼鱼血清中的皮质醇与血糖含量显著降低,但放养密度对杂交鲟血糖含量则无显著性影响[32]。
溶菌酶是鱼类血清中重要的非特异性免疫因子,溶菌酶活性提高,鱼类的免疫机能也相应增强。本研究中,养殖密度对大口黑鲈血清溶菌酶含量产生了显著的影响,60~120 d时,SD1组试验鱼溶菌酶含量显著高于SD3组,且随着养殖时间的延长,差异性越来越明显,表明密度胁迫抑制了试验鱼溶菌酶的活性,降低了其免疫性能,该结果与对俄罗斯鲟[31]、豹纹鳃棘鲈Plectropomus leopardus[33]的研究结果一致。但对赤鳟pagrus pagrus[34]和金头鲷Sparus aurata[35]的研究结果发现,养殖密度胁迫使得血清溶菌酶活性上升。血清生化指标研究结果的差异,可能是鱼的种类、生理反应的差异、养殖条件和养殖时间不同造成的,具体的原因有待进一步研究。
3.4 养殖密度对大口黑鲈GH、IGF-I基因表达的影响
GH/IGF-1轴是鱼体内重要的内分泌生理轴,在调节鱼类生长发育中发挥着重要的作用[36]。GH处在GH/IGF-I轴的中心位置,调节许多生理过程,包括体细胞生长、摄食行为、渗透调节、脂质和蛋白质代谢及免疫功能等;GH刺激肝脏IGF-I的合成和释放,IGF-I可介导GH的生理作用,加速细胞的分裂和分化,促进蛋白质的合成,从而促进动物的生长,反过来IGF-I通过负反馈机制特异性抑制GH基因的转录和分泌[37-38]。本研究中,30、60、90 d时,高密度组鲈脑GH mRNA表达量显著高于低密度组;同样,De las Heras等[14]研究发现,高放养密度组厚唇鲻垂体GH 表达量显著升高,而其生长率降低,鱼的生长速度与GH基因表达水平不成正相关关系,这说明在长期的拥挤胁迫下,大口黑鲈垂体GH可能不是密度胁迫的直接作用靶点。30 d时,高密度组肝脏IGF-I mRNA表达量显著高于低密度组,而60 d和90 d时,变化趋势正好相反,笔者推测这可归结于试验初期GH刺激了肝脏IGF-I的合成,而后期可能是由于IGF-I特异性抑制GH基因转录与分泌引起的,具体原因有待深入研究。
不同研究者关于放养密度对GH/IGF表达的影响结果存在差异。Valenzuela等[39]报道,放养密度直接影响多耙牙鲆Paralichthys adspersus肌肉生长,并下调GH/IGF系统;Long等[40]研究也证实,高密度组中华鲟皮肤中GH和IGF-I mRNA水平均显著下降,皮质醇降低了GH和IGF的血浆水平和垂体中的转录,从而导致应激下鱼类的生长抑制。然而,厚唇鲻肝脏IGF-I基因表达在高放养密度组显著增加[14]。Zahedi等[18]研究表明,虹鳟高密度组(高达44 kg/m3)IGF-I表达无明显变化。王晓梅等[7]对革胡子鲶的研究显示,在养殖前30 d内,养殖密度增加引起GH下游的生长调控因子IGF-I的合成与分泌减少,进而导致鱼体的生长降低,但是当养殖时间延长到60 d时,养殖密度增大到一定程度时则会导致垂体GH表达的下降。对于大口黑鲈而言,在120 d 的养殖时间内密度还不足以影响到生长轴中心位置的因子GH mRNA的表达。对于GH/IGF-I生长轴在大口黑鲈生长中的调控作用及在应激时两者间的关系还有待进一步研究。
4 结论
1)养殖前30 d,养殖密度为0.4 kg/m3组大口黑鲈生长率优于0.2 kg/m3和0.6 kg/m3组,而在养殖后期,养殖密度增加会引起大口黑鲈的生长下降、免疫性能降低。
2)养殖密度对大口黑鲈生长的影响与GH/IGF-1轴的调控有关。
[1] WANG Y Y,XU G C,NIE Z J,et al.Growth performance of bluntnose black bream,channel catfish,yellow catfish,and largemouth bass reared in the in-pond raceway recirculating culture system[J].North American Journal of Aquaculture,2019,81(2):153-159.
[2] HARIMANA Y,TANG X,LE G W,et al.Quality parameters of black carp (Mylopharyngodon piceus) raised in lotic and lentic freshwater systems[J].LWT,2018,90:45-52.
[3] 孟顺龙,徐跑,李丹丹,等.团头鲂池塘工业化生态养殖系统中浮游植物群落结构分析[J].上海海洋大学学报,2018,27(1):79-90.
MENG S L,XU P,LI D D,et al.Community structure of zooplankton in an industrial eco-aquaculture system in a blunt-snout bream Megalobrama amblycephala culture pond[J].Journal of Shanghai Ocean University,2018,27(1):79-90.(in Chinese)
[4] 庄平,李大鹏,王明学,等.养殖密度对史氏鲟稚鱼生长的影响[J].应用生态学报,2002,13(6):735-738.
ZHUANG P,LI D P,WANG M X,et al.Effect of stocking density on growth of juvenile Acipenser schrenckii[J].Journal of Applied Ecology,2002,13(6):735-738.(in Chinese)
[5] LUPATSCH I,SANTOS G A,SCHRAMA J W,et al.Effect of stocking density and feeding level on energy expenditure and stress responsiveness in European sea bass Dicentrarchus labrax[J].Aquaculture,2010,298(3/4):245-250.
[6] TOLUSSI C E,HILSDORF A W S,CANEPPELE D,et al.The effects of stocking density in physiological parameters and growth of the endangered teleost species piabanha,Brycon insignis (Steindachner,1877)[J].Aquaculture,2010,310(1/2):221-228.
[7] 王晓梅,陈成勋,邢克智,等.不同养殖密度下革胡子鲶幼鱼的生长和垂体GH基因mRNA表达分析[J].南方水产科学,2015,11(3):35-40.
WANG X M,CHEN C X,XING K Z,et al.Analysis of daily weight gain and GH mRNA expression in juvenile Clarias gariepinu reared at different stocking densities[J].South China Fisheries Science,2015,11(3):35-40.(in Chinese)
[8] 朱择敏,马冬梅,白俊杰,等.配合饲料、冰鲜杂鱼对大口黑鲈生长和LPL基因mRNA表达的影响[J].大连海洋大学学报,2014,29(4):360-363.
ZHU Z M,MA D M,BAI J J,et al.Effects of formulated diets and frozen trash fish on growth and expression of LPL gene mRNA in largemouth bass Micropterus salmoides[J].Journal of Dalian Ocean University,2014,29(4):360-363.(in Chinese)
[9] 陈乃松,周洁,靳利娜,等.禁食对大口黑鲈生长和肝脏IGF-I mRNA表达丰度的影响[J].中国水产科学,2010,17(4):713-720.
CHEN N S,ZHOU J,JIN L N,et al.Effects of fasting on growth and expression abundance of IGF-I mRNA in largemouth bass(Micropterus salmoides)[J].Journal of Fishery Science of China,2010,17(4):713-720.(in Chinese)
[10] 樊佳佳,白俊杰,李小慧,等.大口黑鲈生长激素促分泌素cDNA结构和早期发育阶段表达谱分析[J].水产学报,2010,34(11):1656-1663.
FAN J J,BAI J J,LI X H,et al.Ghrelin cDNA structure and expression profile in early development of largemouth bass(Micropterus salmoides)[J].Journal of Fisheries of China,2010,34(11):1656-1663.(in Chinese)
[11] 施培松.匙吻鲟和鳙的生长、肌肉品质比较及FAS基因克隆与表达[D].武汉:华中农业大学,2013.
SHI P S.Cloning and expression of fatty acid synthase gene and comparison on growth,muscle quality of Polyodon spathula and Aristichthys nobilis[D].Wuhan:Huazhong Agricultural University,2013.(in Chinese)
[12] YARAHMADI P,MIANDARE H K,FAYAZ S,et al.Increased stocking density causes changes in expression of selected stress- and immune-related genes,humoral innate immune parameters and stress responses of rainbow trout (Oncorhynchus mykiss)[J].Fish & Shellfish Immunology,2016,48:43-53.
[13] IRWIN S,O’HALLORAN J,FITZGERALD R D.Stocking density,growth and growth variation in juvenile turbot,Scophthalmus maximus (Rafinesque)[J].Aquaculture,1999,178(1/2):77-88.
[14] DE LAS HERAS V,MARTOS-SITCHA J A,YúFERA M,et al.Influence of stocking density on growth,metabolism and stress of thick-lipped grey mullet (Chelon labrosus) juveniles[J].Aquaculture,2015,448:29-37.
[15] 罗江,杜江,冷小茜,等.不同养殖密度对长江鲟稚鱼生长的影响[J].淡水渔业,2018,48(3):107-111.
LUO J,DU J,LENG X Q,et al.Effect of different stocking densities on growth of Acipenser dabryanus juveniles[J].Freshwater Fisheries,2018,48(3):107-111.(in Chinese)
[16] 薛宝贵,楼宝,徐冬冬,等.密度胁迫对黄姑鱼幼鱼生长、代谢及非特异性免疫的影响[J].渔业科学进展,2013,34(2):45-51.
XUE B G,LOU B,XU D D,et al.Impact of density stress on growth,metabolism and non-specific immune functions of juvenile Nibea albiflora[J].Progress in Fishery Sciences,2013,34(2):45-51.(in Chinese)
[17] MARCHAND F,BOISCLAIR D.Influence of fish density on the energy allocation pattern of juvenile brook trout (Salvelinus fontinalis)[J].Canadian Journal of Fisheries and Aquatic Sciences,1998,55(4):796-805.
[18] ZAHEDI S,AKBARZADEH A,MEHRZAD J,et al.Effect of stocking density on growth performance,plasma biochemistry and muscle gene expression in rainbow trout (Oncorhynchus mykiss)[J].Aquaculture,2019,498:271-278.
[19] MECHALY A S,RICHARDSON E,RINKWITZ S.Activity of etv5a and etv5b genes in the hypothalamus of fasted zebrafish is influenced by serotonin[J].General and Comparative Endocrinology,2017,246:233-240.
[20] BRECK J E.Body composition in fishes:body size matters[J].Aquaculture,2014,433:40-49.
[21] 宋志飞,温海深,李吉方,等.养殖密度对流水池塘系统中俄罗斯鲟幼鱼代谢机能的影响[J].大连海洋大学学报,2017,32(4):393-398.
SONG Z F,WEN H S,LI J F,et al.Influence of stocking density on physiological metabolism function of juvenile Russian sturgeon Acipenser gueldenstaedti in running water cultivation[J].Journal of Dalian Ocean University,2017,32(4):393-398.(in Chinese)
[22] OKÉ V,GOOSEN N J.The effect of stocking density on profitability of African catfish (Clarias gariepinus) culture in extensive pond systems[J].Aquaculture,2019,507:385-392.
[23] 王秋实,孙大江,赵春刚.放养密度对池塘养殖施氏鲟幼鱼生长和肌肉成分的影响[J].水产学杂志,2015,28(2):22-25.
WANG Q S,SUN D J,ZHAO C G.Effects of stocking density on growth and muscular composition in Amur sturgeon Acipenser schrenckii in pond culture[J].Chinese Journal of Fisheries,2015,28(2):22-25.(in Chinese)
[24] PICCOLO G,MARONO S,BOVERA F,et al.Effect of stocking density and protein/fat ratio of the diet on the growth of Dover sole (Solea solea)[J].Aquaculture Research,2008,39(16):1697-1704.
[25] SU REZ M D,GARC
REZ M D,GARC A-GALLEGO M,TRENZADO C E,et al.Influence of dietary lipids and culture density on rainbow trout (Oncorhynchus mykiss) flesh composition and quality parameter[J].Aquacultural Engineering,2014,63:16-24.
A-GALLEGO M,TRENZADO C E,et al.Influence of dietary lipids and culture density on rainbow trout (Oncorhynchus mykiss) flesh composition and quality parameter[J].Aquacultural Engineering,2014,63:16-24.
[26] BARTON B A.Stress in fishes:a diversity of responses with particular reference to changes in circulating corticosteroids[J].Integrative and Comparative Biology,2002,42(3):517-525.
[27] ZAHEDI S,MIRVAGHEFI A,RAFATI M,et al.Cadmium accumulation and biochemical parameters in juvenile Persian sturgeon,Acipenser persicus,upon sublethal cadmium exposure[J].Comparative Clinical Pathology,2013,22(5):805-813.
[28] GREGORY T R,WOOD C M.The effects of chronic plasma cortisol elevation on the feeding behaviour,growth,competitive ability,and swimming performance of juvenile rainbow trout[J].Physiological and Biochemical Zoology,1999,72(3):286-295.
[29] DEMERS N E,BAYNE C J.The immediate effects of stress on hormones and plasma lysozyme in rainbow trout[J].Developmental & Comparative Immunology,1997,21(4):363-373.
[30] BAYUNOVA L,BARANNIKOVA I,SEMENKOVA T.Sturgeon stress reactions in aquaculture[J].Journal of Applied Ichthyology,2002,18(4/5/6):397-404.
[31] 曹阳,李二超,陈立侨,等.养殖密度对俄罗斯鲟幼鱼的生长、生理和免疫指标的影响[J].水生生物学报,2014,38(5):968-974.
CAO Y,LI E C,CHEN L Q,et al.Effects of stocking density on growth,physiological and immune responses in juvenile Russian sturgeon[J].Acta Hydrobiologica Sinica,2014,38(5):968-974.(in Chinese)
[32] 程佳佳,李吉方,温海深,等.养殖密度对杂交鲟幼鱼生长、肌肉组分和血液生理生化指标的影响[J].中国水产科学,2015,22(3):433-441.
CHENG J J,LI J F,WEN H S,et al.Effect of stocking density on growth,muscle composition and blood parameters of hybrid sturgeon juveniles[J].Journal of Fishery Sciences of China,2015,22(3):433-441.(in Chinese)
[33] 林琳,孙学亮,邢克智,等.养殖密度对豹纹鳃棘鲈生长和血液生化指标的影响[J].水产科学,2017,36(1):83-87.
LIN L,SUN X L,XING K Z,et al.Effects of stocking density on growth and blood biochemical parameters in Plectropomus leopardus[J].Fisheries Science,2017,36(1):83-87.(in Chinese)
[34] ROTLLANT J,PAVLIDIS M,KENTOURI M,et al.Non-specific immune responses in the red porgy Pagrus pagrus after crowding stress[J].Aquaculture,1997,156(3/4):297-290.
[35] MONTERO D,MARRERO M,IZQUIERDO M S,et al.Effect of vitamin E and C dietary supplementation on some immune parameters of gilthead seabream (Sparus aurata) juveniles subjected to crowding stress[J].Aquaculture,1999,171(3/4):269-278.
[36] 李胜杰,白俊杰,叶星,等.加州鲈生长激素和胰岛素样生长因子I cDNA的克隆及序列分析[J].广东海洋大学学报,2007,27(3):1-5.
LI S J,BAI J J,YE X,et al.Cloning and sequence analysis of cDNA encoding growth hormone and insulin like growth factor I in largemouth bass(Micropterus salmoides)[J].Journal of Guangdong Ocean University,2007,27(3):1-5.(in Chinese)
[37] PÉREZ-S NCHEZ J.The involvement of growth hormone in growth regulation,energy homeostasis and immune function in the gilthead sea bream (Sparus aurata):a short review[J].Fish Physiology and Biochemistry,2000,22(2):135-144.
NCHEZ J.The involvement of growth hormone in growth regulation,energy homeostasis and immune function in the gilthead sea bream (Sparus aurata):a short review[J].Fish Physiology and Biochemistry,2000,22(2):135-144.
[38] REINECKE M,BJÖRNSSON B T,DICKHOFF W W,et al.Growth hormone and insulin-like growth factors in fish:where we are and where to go[J].General and Comparative Endocrinology,2005,142(1/2):20-24.
[39] VALENZUELA C A,ZULOAGA R,MERCADO L,et al.Chronic stress inhibits growth and induces proteolytic mechanisms through two different nonoverlapping pathways in the skeletal muscle of a teleost fish[J].American Journal of Physiology-Regulatory,Integrative and Comparative Physiology,2018,314(1):R102-R113.
[40] LONG L,ZHANG H G,NI Q,et al.Effects of stocking density on growth,stress,and immune responses of juvenile Chinese sturgeon (Acipenser sinensis) in a recirculating aquaculture system[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2019,219:25-34.