鱼类在养殖、捕捞、运输等过程中都会引起应激反应,应激将会导致鱼类血清生化指标变化、生长缓慢、抗氧化能力与机体抵抗力降低,进而影响水产品品质。应激条件下的鱼体血液葡萄糖、脂类及蛋白质等代谢底物浓度通常会发生变化[1],影响动物的生长性能及健康。空气暴露对于多数鱼类是一种极端的应激,其直接影响鱼类耗氧率和呼吸频率[2]、血液指标[3-5]、成活率[6]及肌肉品质[7]等,严重时还可直接导致鱼类死亡。因此,在捕捞、运输等应激前,可在饲料中添加抗氧化剂来防止肌肉氧化、改善肌肉品质。
目前,维生素E(Vitamin E,VE)作为一种有效的抗氧化剂,可使细胞膜上的不饱和脂肪酸免受氧化,保护含磷脂的生物膜如血红细胞血浆膜、线粒体膜和内质网免受脂质过氧化损伤的作用,对于鱼类的生长、发育和繁殖具有不可替代的重要作用。VE可促进点带石斑鱼Epinephelus coioides[8]和大菱鲆Scophthalmus maximus幼鱼[9]的生长并提高机体抗氧化能力,也可促进鲻Mugil cephalus幼鱼的生长与发育[10]并提高其抗氧化能力。研究表明,在饲料中添加600 mg/kg的VE可显著降低罗氏沼虾Macrobrachium rosenbergii肌肉丙二醛含量[11],也有研究表明,高剂量的VE可有效降低鲤肌肉滴水损失与渗出损失[12]。γ-氨基丁酸(Gamma aminobutyric acid,GABA)是一种非蛋白质氨基酸,可用于食品加工,也可作为饲料添加剂用于饲料生产。目前,GABA已被广泛应用于人类医药及保健食品中。然而,作为一种特殊的饲料添加剂,GABA在饲料中的应用还不够广泛,其很多作用机理也未深入研究。研究表明,在饲料中添加500 mg/kg的GABA可促进草鱼Ctenopharyngodon idella幼鱼的生长并提高其抗氧化水平[13]。硒是参与构成谷胱甘肽过氧化物酶(GSH-Px)的微量元素,其活性中心是硒半胱氨酸,GSH-Px能够把过氧化氢和脂质过氧化产物分别转换成水和脂醇,保护细胞膜和亚细胞膜。已有研究表明,添加一定剂量的亚硒酸钠可使杂交条纹鲈肝脏GSH-Px活性提高[14]。此外,添加0.2~1.0 mg/kg的富硒饲料能够明显提高刺参的生长率、出皮率和体壁硒含量[15]。
松浦镜鲤Cyprinus carpio Songpu是由德国镜鲤第四代选育系(F4)与散鳞镜鲤杂交成功得到的镜鲤新品种,其具有生长速度快、抗病力强、易垂钓、养殖经济效益高等优点。目前,已有不同环境胁迫对鱼类血液生理指标、生长性能影响的研究报道,但对鱼类受到胁迫后饲料中添加抗氧化剂缓解应激,以及抗氧化剂对鲤血清生化、肌肉抗氧化及品质影响的研究较少。本研究中,探究空气暴露及抗氧化剂对鲤血清生化、肌肉抗氧化及品质的影响,旨在为研究鱼类胁迫生理反应提供重要依据,同时为集约化养殖技术的发展提供宝贵资料。
1 材料与方法
1.1 材料
试验鱼松浦镜鲤225尾,体质量均为(1060±40)g,由哈尔滨肇东松浦镜鲤养殖场提供。
1.2 方法
1.2.1 试验饲料的制备 试验饲料以鱼粉、豆粕为蛋白源,以鱼油、豆油、大豆磷脂为脂肪源,各饲料原料均通过粉碎机过80目筛,先将粉状原料逐级混匀,再添加豆油,充分混合后使用饲料制粒机制成沉性颗粒饲料,室温条件下通风干燥,于-20 ℃冰柜中存放。基础日粮配方:鱼粉5.0%、豆粕52.0%、次粉35.0%、鱼油1.0%、豆油2.5%、磷脂1.0%、维生素预混料0.3%、矿物质预混料0.2%、氯化胆碱0.5%、磷酸二氢钠1.5%。其中,维生素预混料为每千克饲料提供VA 8 000 IU、VC 500 mg、VD3 3 000 IU、VE 60 mg、VK3 5 mg、VB2 30 mg、VB6 15 mg、VB12 0.5 mg、氯化胆碱5 000 mg、烟酸175 mg、D-生物素2.5 mg、肌醇1 000 mg、叶酸5 mg、泛酸50 mg。矿物质预混料为每千克饲料提供Zn 25 mg、Cu 3 mg、Fe 25 mg、Mn 15 mg、I 0.6 mg、Co 0.1 mg、Se 0.4 mg。基础日粮营养组成为粗蛋白质30.43%、粗脂肪5.84%,粗蛋白质和粗脂肪为实测值,其余为计算值。
1.2.2 试验设计及饲养管理 将试验鱼先在试验车间循环养殖池(长8.0 m × 宽8.0 m × 高1.2 m)中驯养7 d,驯养期间每日投喂3次。驯养结束后,挑选健康、规格较为一致的松浦镜鲤作为试验用鱼。试验共设5组,空白对照组饲喂基础饲料,其他组饲料为基础饲料中分别添加600 mg/kg 维生素E(VE组)、500 mg/kg γ-氨基丁酸(GABA组)、0.5 mg/kg亚硒酸钠(Se组)、600 mg/kg VE+500 mg/kg GABA+0.5 mg/kg亚硒酸钠组合(复合组),每组设3个重复,每个重复放15尾鱼,养殖试验共进行13 d。
试验在黑龙江水产研究所呼兰试验基地室内循环水网箱(长1.8 m × 宽1.8 m × 高1.0 m)中进行,养殖水环境溶氧>5 mg/L,pH 7.8,自然光照。试验期间每天8:00、13:00和17:00投喂,每次饱食投喂,投喂量约为鱼体质量的3%,每天投喂后吸取残饵和粪便,定期检测水质。
1.2.3 样品的采集 养殖试验结束后饥饿24 h,从每个重复随机取3尾鱼,将鱼用浓度为100 mg/L的MS-222(间氨基苯甲酸乙酯甲磺酸盐)麻醉后,从尾静脉采血并采集肌肉,即为空气暴露前样品。再从每个重复随机取3尾鱼,迅速置于光滑无水容器内暴露于空气中,气温为21 ℃,于空气中暴露15 min后,从尾静脉采血并采集肌肉,即为空气暴露后样品。
将采集的血液样品在常温下静置4 h后,用冷冻离心机以3500 r/min离心10 min,取上清液分装后及肌肉样品置于-80 ℃冰箱中保存,用于后续血清生化指标和抗氧化指标测定。
1.2.4 指标的测定与计算
(1)血清生化指标。将制备好的血清样品送黑龙江省电力医院,采用贝克曼Pro CX4全自动生化分析仪测定血清中葡萄糖(GLU)、钙离子(Ca2+)含量及谷丙转氨酶(ALT)、谷草转氨酶(AST)活性。采用R&D公司试剂盒的酶联免疫法测定血清中的皮质醇(COR)。
(2)肌肉抗氧化指标。利用南京建成生物工程研究所检测试剂盒测定肌肉样品的过氧化氢酶(CAT)、谷胱甘肽(GSH)、超氧化物歧化酶(SOD)活性及丙二醛(MDA)含量,操作步骤严格按照试剂盒说明书进行。
(3)肌肉系水力。样品采自试验鱼背部肌肉。将5 g肌肉放进充气塑料袋中,使肌肉不接触塑料袋,于4 ℃下吊挂48 h后称其质量计算滴水损失;将5 g肌肉放进自封袋中,于4 ℃下储存24 h后称量,计算储存损失;将5 g肌肉放进自封袋中,于-20 ℃下冷冻存放24 h后称质量,计算冷冻渗出率。为防止不同位置肌肉对肌肉系水力的影响,每个指标的测定所用肌肉样品采样位置基本相同。其计算公式为
滴水损失=(M0-M1)/M0 ×100%,
储存损失=(M0-M1)/M0 ×100%,
冷冻渗出率=(M0-M1)/M0 ×100%。
其中:M0为损失前质量(g);M1为损失后质量(g)。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 19.0进行单因素方差分析(One-way AVOVA),采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 血清生化指标
从表1可见:空气暴露前,各组鲤血清中皮质醇、葡萄糖、钙离子含量及谷丙转氨酶、谷草转氨酶活性均无显著性差异(P>0.05);空气暴露后,GABA、VE及复合组皮质醇含量显著低于对照组(P<0.05),各抗氧剂添加组葡萄糖含量及谷草转氨酶活性均显著低于对照组(P<0.05)。
表1 空气暴露及营养调控对鲤血清生化指标的影响
Tab.1 Effects of air exposure and antioxidants on serum biochemical profiles of mirror carp
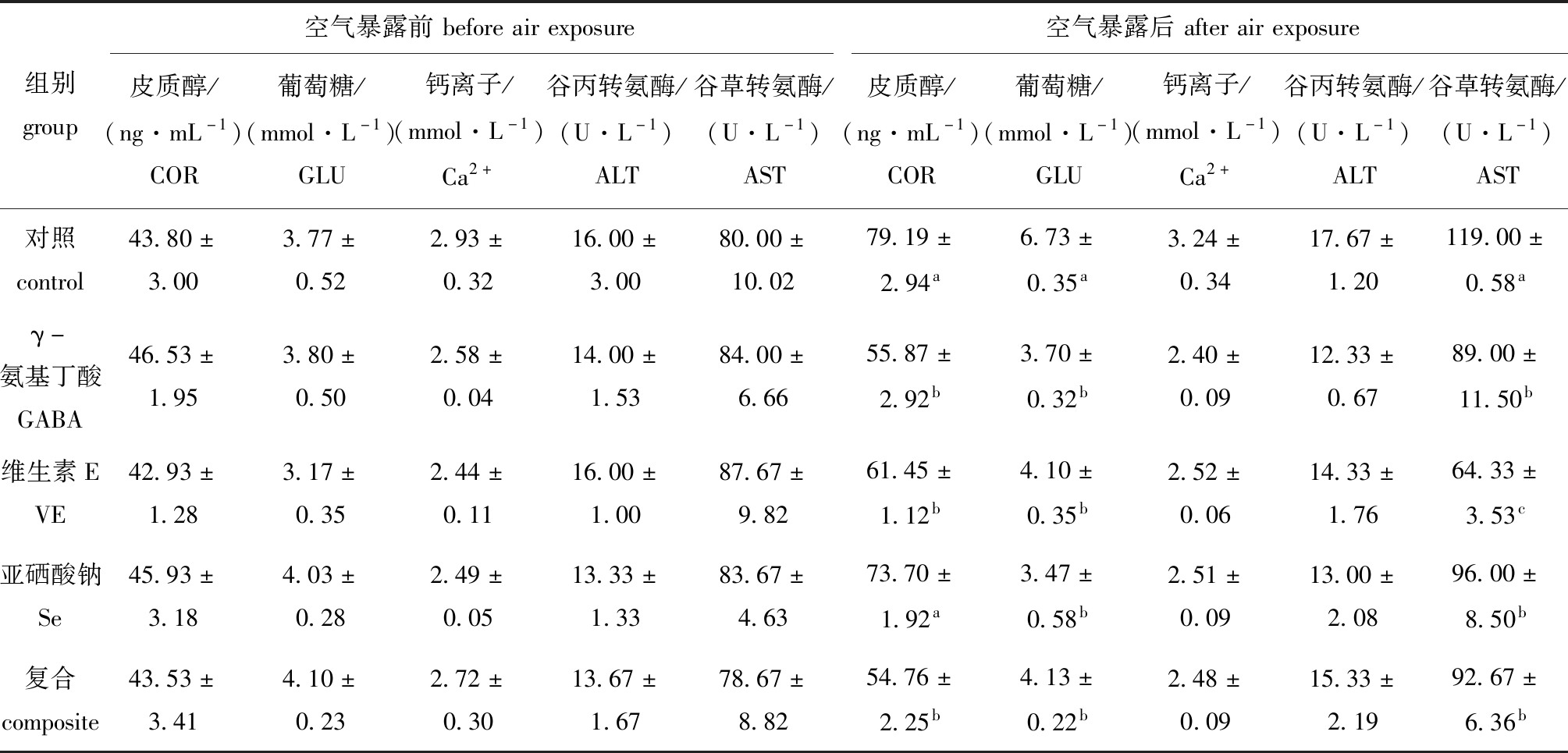
组别group空气暴露前beforeairexposure空气暴露后afterairexposure皮质醇/(ng·mL-1)COR葡萄糖/(mmol·L-1)GLU钙离子/(mmol·L-1)Ca2+谷丙转氨酶/(U·L-1)ALT谷草转氨酶/(U·L-1)AST皮质醇/(ng·mL-1)COR葡萄糖/(mmol·L-1)GLU钙离子/(mmol·L-1)Ca2+谷丙转氨酶/(U·L-1)ALT谷草转氨酶/(U·L-1)AST对照control43.80±3.003.77±0.522.93±0.3216.00±3.0080.00±10.0279.19±2.94a6.73±0.35a3.24±0.3417.67±1.20119.00±0.58aγ-氨基丁酸GABA46.53±1.953.80±0.502.58±0.0414.00±1.5384.00±6.6655.87±2.92b3.70±0.32b2.40±0.0912.33±0.6789.00±11.50b维生素EVE42.93±1.283.17±0.352.44±0.1116.00±1.0087.67±9.8261.45±1.12b4.10±0.35b2.52±0.0614.33±1.7664.33±3.53c亚硒酸钠Se45.93±3.184.03±0.282.49±0.0513.33±1.3383.67±4.6373.70±1.92a3.47±0.58b2.51±0.0913.00±2.0896.00±8.50b复合composite43.53±3.414.10±0.232.72±0.3013.67±1.6778.67±8.8254.76±2.25b4.13±0.22b2.48±0.0915.33±2.1992.67±6.36b
注:同列中标有不同字母者表示组间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significantly different in the groups at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
2.2 肌肉抗氧化功能
从表2可见:空气暴露前,与对照组相比,复合组CAT活性显著提高(P<0.05),GABA组、VE组及复合组SOD活性显著提高(P<0.05),Se组及复合组MDA含量显著降低(P<0.05);空气暴露后,与对照组相比,各抗氧剂添加组CAT活性均显著提高(P<0.05),VE组和复合组SOD活性显著提高(P<0.05),Se组和复合组GSH含量显著提高(P<0.05),VE组和复合组MDA含量显著降低(P<0.05)。
表2 空气暴露及营养调控对鲤肌肉抗氧化功能的影响
Tab.2 Effects of air exposure and antioxidants on antioxidant ability of muscle of mirror carp
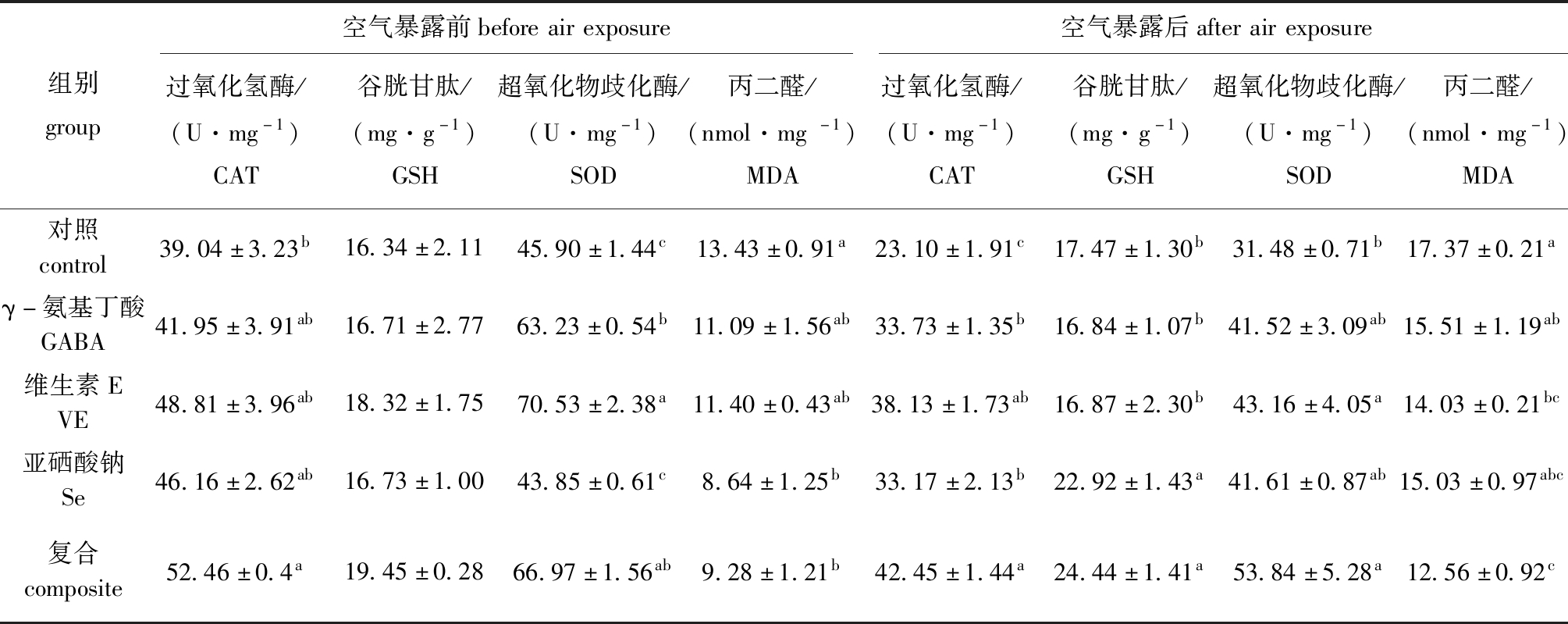
组别group空气暴露前beforeairexposure空气暴露后afterairexposure过氧化氢酶/(U·mg-1)CAT谷胱甘肽/(mg·g-1)GSH超氧化物歧化酶/(U·mg-1)SOD丙二醛/(nmol·mg-1)MDA过氧化氢酶/(U·mg-1)CAT谷胱甘肽/(mg·g-1)GSH超氧化物歧化酶/(U·mg-1)SOD丙二醛/(nmol·mg-1)MDA对照control39.04±3.23b16.34±2.1145.90±1.44c13.43±0.91a23.10±1.91c17.47±1.30b31.48±0.71b17.37±0.21aγ-氨基丁酸GABA41.95±3.91ab16.71±2.7763.23±0.54b11.09±1.56ab33.73±1.35b16.84±1.07b41.52±3.09ab15.51±1.19ab维生素EVE48.81±3.96ab18.32±1.7570.53±2.38a11.40±0.43ab38.13±1.73ab16.87±2.30b43.16±4.05a14.03±0.21bc亚硒酸钠Se46.16±2.62ab16.73±1.0043.85±0.61c8.64±1.25b33.17±2.13b22.92±1.43a41.61±0.87ab15.03±0.97abc复合composite52.46±0.4a19.45±0.2866.97±1.56ab9.28±1.21b42.45±1.44a24.44±1.41a53.84±5.28a12.56±0.92c
2.3 肌肉系水力
从表3可见:空气暴露前,与对照组相比,Se组鲤肌肉滴水损失显著降低(P<0.05);空气暴露后,与对照组相比,VE组和复合组滴水损失显著降低(P<0.05),GABA组和复合组储存损失显著降低(P<0.05),复合组冷冻渗出率显著降低(P<0.05)。
表3 空气暴露及营养调控对鲤肌肉系水力的影响
Tab.3 Effects of air exposure and antioxidants on water holding capacity of muscle of mirror carp %
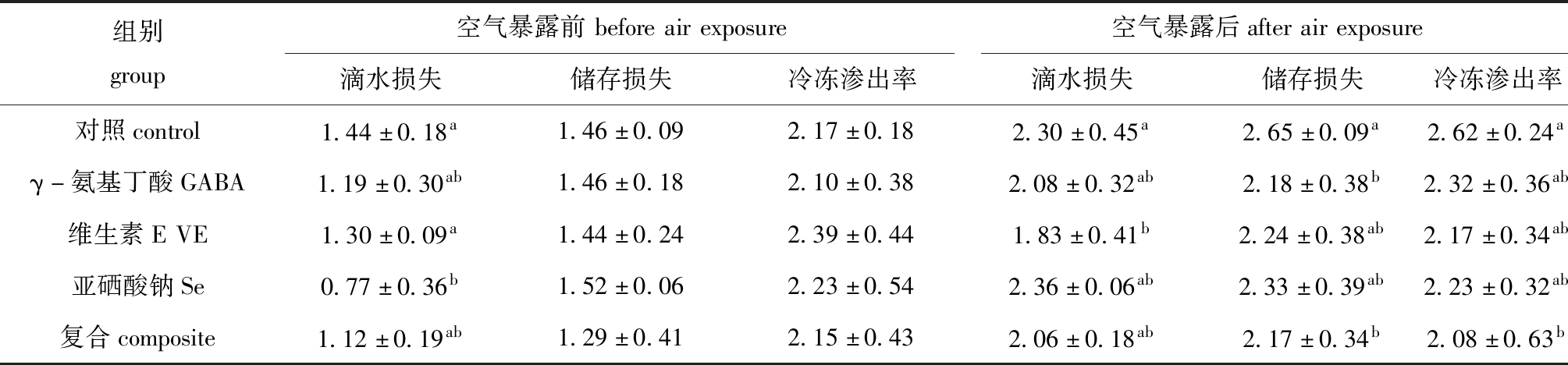
组别group空气暴露前beforeairexposure空气暴露后afterairexposure滴水损失储存损失冷冻渗出率滴水损失储存损失冷冻渗出率对照control1.44±0.18a1.46±0.092.17±0.182.30±0.45a2.65±0.09a2.62±0.24aγ-氨基丁酸GABA1.19±0.30ab1.46±0.182.10±0.382.08±0.32ab2.18±0.38b2.32±0.36ab维生素EVE1.30±0.09a1.44±0.242.39±0.441.83±0.41b2.24±0.38ab2.17±0.34ab亚硒酸钠Se0.77±0.36b1.52±0.062.23±0.542.36±0.06ab2.33±0.39ab2.23±0.32ab复合composite1.12±0.19ab1.29±0.412.15±0.432.06±0.18ab2.17±0.34b2.08±0.63b
3 讨论
3.1 空气暴露及营养调控对鲤血清生化指标的影响
动物机体遭受应激时其耗能增加,进而引发鱼类机体正常生理功能的紊乱。在应激因子作用下,鱼类机体发生生理性变化,各项生理指标随之发生变化[16-17]。血液皮质醇被认为是评价鱼类应激反应的敏感指标,应激会使鱼类的内分泌系统发生变化,引起血液皮质醇含量增加[18]。血液中的葡萄糖是鱼类机体重要的供能物质,也是衡量机体营养健康情况的重要指标。通常情况下,鱼类机体的血糖浓度较为恒定。急性应激会引发鱼类高血糖症,导致葡萄糖水平也会在胁迫后显著性升高并持续维持在较高水平。
本研究中,空气暴露前,各组松浦镜鲤血清中皮质醇、葡萄糖、钙离子、谷丙转氨酶及谷草转氨酶等指标浓度均无显著性差异,表明饲料中添加一定浓度的γ-氨基丁酸、维生素E、硒及复合抗氧化剂对正常状态下的松浦镜鲤血清生化指标无显著性影响。
空气暴露15 min后,与暴露前相比,各组松浦镜鲤血清中皮质醇、葡萄糖、钙离子、谷丙转氨酶、谷草转氨酶等指标浓度总体上有所升高,表明空气暴露在一定程度上引起了松浦镜鲤的应激反应。林艳华等[4]研究指出,在空气中暴露15 min后,南方鲇 Silurus meridionalis各项血液学指标均发生明显变化;Fast等[19]研究指出,在操作应激后,大西洋鲑Salmo salar血液内皮质醇水平显著升高;李学梅等[20]在研究操作胁迫对褐鳟Salmo trutta血液理化及养殖水体中皮质醇的影响时发现,操作胁迫1 h后,褐鳟血液皮质醇显著升高;赵建华[21]在圆口铜鱼Coreius guichenoti空气暴露试验时指出,试验鱼血浆皮质醇水平在刺激后发生显著变化;张勇[22]研究证实,美洲鲥 Alosa sapidissima亲鱼在空气中暴露后,鱼血清谷丙转氨酶、谷草转氨酶、皮质醇激素等指标均出现显著升高。当供氧有限时,动物体主要利用糖作代谢底物[23];在无氧条件下,三磷酸腺苷(ATP)则由糖的无氧酵解生成,从而导致动物机体动物血糖水平升高。本研究饲料中添加γ-氨基丁酸、维生素E、硒及复合抗氧化剂后则缓解了血糖的供能,从而使血糖浓度下降。
本研究中,空气暴露15 min后,与对照组相比,饲料中添加γ-氨基丁酸、维生素E及复合抗氧化剂后,鲤血清皮质醇含量显著降低,这说明抗氧化剂γ-氨基丁酸、维生素E及复合抗氧化剂可减缓空气暴露对松浦镜鲤的应激反应,有助于缓解鲤对抗环境的胁迫。这可能是由于维生素E的添加改变了动物机体内正常的维生素E含量,导致肾上腺素分泌发生变化,进而引起松浦镜鲤血清皮质醇含量的变化[24]。周显青等[25]在探究维生素E对中华鳖幼鳖血清皮质醇含量的影响时发现,高剂量的维生素E对中华鳖血清皮质醇有抑制作用;而Montero等[26]的研究也表明,维生素E缺乏会引起金头鲷Sparus aurata血浆皮质醇含量升高,这与本研究结果类似。也可能是由于γ-氨基丁酸抑制了下丘脑活动,减少促肾上腺皮质激素释放激素的分泌与合成,从而使动物在应激状态下的皮质醇分泌减少[25]。复合抗氧化剂对皮质醇、葡萄糖及谷草转氨酶的影响则可能是由γ-氨基丁酸及维生素E的协同作用引起的。
本研究中,当饲料中添加各种抗氧化剂后,葡萄糖及谷草转氨酶含量均显著降低。血液中谷丙转氨酶及谷草转氨酶的活性变化与细胞膜的完整性有关,当动物机体缺乏抗氧化剂时,细胞膜易受损,血清中酶活性易升高,导致体内酶含量增加;当添加γ-氨基丁酸、维生素E、硒及复合抗氧化剂时,可缓解机体细胞受损,从而减少体内酶含量。添加抗氧化剂后谷草转氨酶含量显著降低,而谷丙转氨酶及钙离子未发生显著变化,这表明松浦镜鲤的各血液学指标对空气暴露的敏感性存在一定差异,谷丙转氨酶及钙离子等指标敏感性较低。
3.2 空气暴露及营养调控对肌肉抗氧化功能的影响
超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等抗氧化酶活力是鱼体中最重要的抗氧化指标,其能够发生协同作用并有效清除超氧阴离子![]() 和过氧化氢(H2O2)等超氧化物自由基[27-28]。丙二醛(MDA)作为氧化反应过程中所产生的代谢产物,一般视作动物机体氧化应激反应损伤机体的代表性产物。谷胱甘肽(GSH)含量水平的过度消耗会进一步增加细胞及机体内部脂质过氧化作用,从而导致细胞及动物机体出现氧化损伤。
和过氧化氢(H2O2)等超氧化物自由基[27-28]。丙二醛(MDA)作为氧化反应过程中所产生的代谢产物,一般视作动物机体氧化应激反应损伤机体的代表性产物。谷胱甘肽(GSH)含量水平的过度消耗会进一步增加细胞及机体内部脂质过氧化作用,从而导致细胞及动物机体出现氧化损伤。
本研究中,空气暴露前,添加复合抗氧化剂可使CAT、SOD活性显著提高,添加γ-氨基丁酸和维生素E可使SOD活性显著提高,添加硒可使MDA含量显著降低,这说明添加复合抗氧化剂可有效提高松浦镜鲤的抗氧化能力;空气暴露后,与对照组相比,各试验组CAT活性显著提高,维生素E和复合抗氧化剂组SOD活性显著提高,硒和复合抗氧化剂组GSH含量显著提高,维生素E组和复合抗氧化剂组MDA含量显著降低。这表明维生素E及复合抗氧化剂抑制了鱼类机体出现氧化损伤。这与对虹鳟Oncorhynchus mykiss[29]、罗非鱼Oreochromis niloticus[30]的研究结果一致,这可能是由于在饲料中添加维生素E后,维生素E可与鱼细胞膜结合,并作为电子供体存在于细胞表面,拦截具有强氧化能力的![]() 和H2O2等自由基,使细胞不被氧化,从而达到保护细胞的目的[9,31-33]。添加亚硒酸钠未能引起松浦镜鲤血清MDA含量的显著变化,这可能是由于饲料中含量较多的抗氧化剂维生素E与活性氧发生反应,进而掩盖了硒水平的抗氧化作用,这也与Zhu等[34]的研究结果一致。
和H2O2等自由基,使细胞不被氧化,从而达到保护细胞的目的[9,31-33]。添加亚硒酸钠未能引起松浦镜鲤血清MDA含量的显著变化,这可能是由于饲料中含量较多的抗氧化剂维生素E与活性氧发生反应,进而掩盖了硒水平的抗氧化作用,这也与Zhu等[34]的研究结果一致。
此外,维生素E和硒除能够单独作用产生相似的抗氧化能力外,硒和维生素E还可相互补充,在防止脂质过氧化方面表现出更强的协同抗氧化能力。维生素E能够降低羟自由基和过氧亚硝基的生成,从而降低线粒体过氧化物的生成。而硒作为GSH-Px的组分,在机体抗氧化防御系统中发挥重要作用,可提高鱼类抗氧化应激能力,增强抗病力,促进动物健康生长发育,提高成活率[35]。
3.3 空气暴露及营养调控对肌肉系水力的影响
随着中国渔业发展,鱼类品质越来越被消费者所关注。鱼类品质是一种综合性状,不仅与人的感官有着密切联系,更由一系列品质评价指标所决定。
水分是鱼肉中最主要的成分,一般占肌肉的70%~80%,而水分含量能影响鱼肉的品质和加工过程。通常用持水力来衡量肌肉组织保持水分的能力,而肌肉持水力不仅影响肉的色、香、味、营养成分、多汁性、嫩度等食用品质,而且会直接影响其经济价值[36]。
本研究中,空气暴露前,硒组滴水损失较对照组显著降低,这说明添加抗氧化剂能降低松浦镜的滴水损失,改善鱼肉品质。空气暴露后,与对照组相比,维生素E组和复合抗氧化剂组滴水损失显著降低,γ-氨基丁酸组和复合抗氧化剂组储存损失显著降低,这表明添加维生素E和复合抗氧化剂能够改善肌肉的储存品质,这与王文娟等[12]的研究结果一致。这可能是因为维生素E能防止肉品储存期间的磷脂氧化,保持细胞膜的完整性,抑制胞浆液穿过细胞膜流失。肉品脂质氧化会降低膜的流动性,增强膜的通透性,胞液外流,再加上脂质氧化产物也会使蛋白质变性,进而降低肉品的保水性能,大量的液体流失,肉及肉制品变得干硬无味。日粮中添加维生素E可以提高鲤肌肉的系水力,并可明显地降低Ca2+的释放量,降低糖酵解速度,抑制线粒体中磷脂酶A2的活性,从而降低肌肉失水力,提高肌肉嫩度。
4 结论
空气暴露15 min后会对松浦镜鲤产生一定程度的应激。饲料中添加600 mg/kg 维生素E及600 mg/kg 维生素E+500 mg/kg γ-氨基丁酸+0.5 mg/kg亚硒酸钠复合抗氧化剂均可缓解空气暴露对松浦镜鲤产生的应激胁迫,提高松浦镜鲤的肌肉抗氧化能力,在一定程度上还可改善鲤肌肉品质。
[1] Kubokawa K,Watanabe T,Yoshioka M,et al.Effects of acute stress on plasma cortisol,sex steroid hormone and glucose levels in male and female sockeye salmon during the breeding season[J].Aquaculture,1999,172(3-4):335-349.
[2] 彭姜岚,曾令清,曹振东,等.驱赶和空气暴露对南方鲇耗氧率和呼吸频率的影响[J].淡水渔业,2007,37(5):7-10.
[3] Hur J W,Kang K H,Kang Y J.Effects of acute air exposure on the hematological characteristics and physiological stress response of olive flounder (Paralichthys olivaceus) and Japanese croaker (Nibea japonica)[J].Aquaculture,2019,502:142-147.
[4] 林艳华,罗毅平.空气暴露对南方鲇血液学指标的影响[J].西南大学学报:自然科学版,2011,33(6):69-73.
[5] 田照辉,朱华,王文峰,等.空气暴露对松浦镜血清生理指标的影响[J].江西农业大学学报,2017,39(1):140-144.
[6] Arlinghaus R,Hallermann J.Effects of air exposure on mortality and growth of undersized pikeperch,Sander lucioperca,at low water temperatures with implications for catch-and-release fishing[J].Fisheries Management and Ecology,2007,14(2):155-160.
[7] Meinertz J R,Greseth S L,Schreier T M,et al.Isoeugenol concentrations in rainbow trout (Oncorhynchus mykiss) skin-on fillet tissue after exposure to AQUI-STM at different temperatures,durations,and concentrations[J].Aquaculture,2006,254(1-4):347-354.
[8] 邢克智,郭永军,陈成勋,等.维生素E对点带石斑鱼生长及其组织抗氧化性能的影响[J].饲料研究,2015,(14):48-52,60.
[9] 魏玉婷,王小洁,麦康森,等.饲料中的维生素E对大菱鲆幼鱼生长、脂肪过氧化及抗氧化能力的影响[J].中国海洋大学学报,2011,41(6):45-50.
[10] Wassef E A,El Masry M H,Mikhail F R.Growth enhancement and muscle structure of striped mullet,Mugil cephalus L.,fingerlings by feeding algal meal-based diets[J].Aquaculture Research,2015,32(S1):315-322.
[11] 单凡,刘波,孙存鑫,等.饲料维生素E含量对罗氏沼虾生长性能、血清生化指标和肌肉品质的影响[J].动物营养学报,2019,31(1):214-225.
[12] 王文娟,汪水平,向枭,等.维生素E对鲤生长性能和肌肉品质的影响[J].中国粮油学报,2013,28(8):51-58.
[13] 吴凡.γ-氨基丁酸和丁酸钠对草鱼生长、抗氧化性能和肠道结构的影响[D].武汉:华中农业大学,2016.
[14] Cotter P A,Craig S R,McLean E.Hyperaccumulation of selenium in hybrid striped bass:a functional food for aquaculture?[J].Aquaculture Nutrition,2008,14(3):215-222.
[15] 周玮,胡晓洁,王祖峰,等.强化蛋氨酸硒对刺参富硒效果的初步研究[J].大连海洋大学学报,2015,30(3):281-284.
[16] Fevolden S E,Røed K H,Fjalestad K.A combined salt and confinement stress enhances mortality in rainbow trout (Oncorhynchus mykiss) selected for high stress responsiveness[J].Aquaculture,2003,216(1-4):67-76.
[17] Chen W H,Sun L T,Tsai C L,et al.Cold-stress induced the modulation of catecholamines,cortisol,immunoglobulin M,and leukocyte phagocytosis in tilapia[J].General and Comparative Endocrinology,2002,126(1):90-100.
[18] Trushenski J,Schwarz M,Takeuchi R,et al.Physiological responses of cobia Rachycentron canadum following exposure to low water and air exposure stress challenges[J].Aquaculture,2010,307(1-2):173-177.
[19] Fast M D,Hosoya S,Johnson S C,et al.Cortisol response and immune-related effects of Atlantic salmon (Salmo salar Linnaeus) subjected to short- and long-term stress[J].Fish & Shellfish Immunology,2008,24(2):194-204.
[20] 李学梅,杨德国.操作胁迫对褐鳟血液理化及养殖水体中皮质醇的影响[J].水产研究,2018,5(3):141-147.
[21] 赵建华.圆口铜鱼应激生理机制及缓解策略研究[D].武汉:华中农业大学,2014.
[22] 张勇.空气暴露及运输胁迫对美洲鲥亲鱼生理生化指标及hsp70基因表达的影响[D].南京:南京农业大学,2016.
[23] Nilsson G E,Renshaw G M C.Hypoxic survival strategies in two fishes:extreme anoxia tolerance in the North European crucian carp and natural hypoxic preconditioning in a coral-reef shark[J].Journal of Experimental Biology,2004,207(18):3131-3139.
[24] 周显青,牛翠娟,孙儒泳.维生素E对中华鳖幼鳖生长、肝脏维生素E以及血清皮质醇含量的影响[J].动物学报,2003,49(1):40-44.
[25] Montero D,Marrero M,Izquierdo M S,et al.Effect of vitamin E and C dietary supplementation on some immune parameters of gilthead seabream (Sparus aurata) juveniles subjected to crowding stress[J].Aquaculture,1999,171(3-4):269-278.
[26] 姜丹.氨基丁酸防治淮南麻黄鸡热应激效果及其机理的研究[D].合肥:安徽农业大学,2017.
[27] 周锴,吴莉芳,瞿子惠,等.饲料脂肪水平对鱼类生长、抗氧化及脂肪酸组成影响的研究[J].饲料工业,2018,39(8):26-31.
[28] 陈文燕.维生素E和磷对杂交鳢生长、抗氧化能力及血清生化指标的影响[D].重庆:西南大学,2016.
[29] Frigg M,Prabucki A L,Ruhdel E U.Effect of dietary vitamin E levels on oxidative stability of trout fillets[J].Aquaculture,1990,84(2):145-158.
[30] Prieto A I,Jos  ,Pichardo S,et al.Protective role of vitamin E on the microcystin-induced oxidative stress in tilapia fish (Oreochromis niloticus)[J].Environmental Toxicology and Chemistry,2008,27(5):1152-1159.
,Pichardo S,et al.Protective role of vitamin E on the microcystin-induced oxidative stress in tilapia fish (Oreochromis niloticus)[J].Environmental Toxicology and Chemistry,2008,27(5):1152-1159.
[31] Tocher D R,Mourente G,van der Eecken A,et al.Effects of dietary vitamin E on antioxidant defence mechanisms of juvenile turbot (Scophthalmus maximus L.),halibut (Hippoglossus hippoglossus L.) and sea bream (Sparus aurata L.)[J].Aquaculture Nutrition,2002,8(3):195-207.
[32] Li Jie,Liang Xufang,Tan Qingsong,et al.Effects of vitamin E on growth performance and antioxidant status in juvenile grass carp Ctenopharyngodon idellus[J].Aquaculture,2014,430:21-27.
[33] 肖涛,王维娜,王安利,等.维生素E对水生动物抗氧化作用的研究进展[J].海洋科学,2007,31(5):76-79,89.
[34] Zhu Yao,Chen Yongjun,Liu Yongjian,et al.Effect of dietary selenium level on growth performance,body composition and hepatic glutathione peroxidase activities of largemouth bass Micropterus salmoide[J].Aquaculture Research,2012,43(11):1660-1668.
[35] 许友卿,李文龙,丁兆坤.添加剂维生素E对鱼类的抗氧化作用及其机理[J].饲料工业,2010,31(18):6-10.
[36] 张文兵,马睿,孙瑞健,等.养殖鱼类品质评价指标体系的研究进展[J].饲料工业,2017,38(24):1-10.