 m的筛绢过滤,所得海藻干粉放入冰箱中冷冻保存。
m的筛绢过滤,所得海藻干粉放入冰箱中冷冻保存。摘要:为了研究海藻饲料对刺参Apostichopus japonicus幼参生长效果的影响,在水温(18±1)℃下,将体质量(1.25±0.02)g的幼参饲养在容积为25 L的塑料水槽中,每槽6头,投喂采用孔石莼Ulva pertusa、角叉菜Chondrus ocellatus、裙带菜Undaria pinnatifida干粉及其混合干粉、鲜孔石莼、鲜角叉菜、鲜裙带菜及其混合磨碎液与25%海泥制成的8种饲料,共饲养60 d,试验结束时测定幼参的生长情况和水体中的氨氮含量。结果表明:投喂不同海藻饲料的幼参存活率均在80%以上,组间无显著性差异(P>0.05);投喂鲜孔石莼饲料的幼参体质量增长最快,特定生长率为(1.38±0.13)%/d,显著高于其他组(P<0.05);投喂鲜孔石莼饲料的幼参饲料转化率显著高于其他组(P<0.05),而其他组间无显著性差异(P>0.05),此组的摄食率和排粪率均为最高,且与其他组有显著性差异(P<0.05);鲜孔石莼组水体的平均氨氮含量最低,为(0.005±0.003)mg/L,孔石莼干粉组最高,为(0.021±0.016)mg/L,两者有显著性差异(P<0.05)。研究表明,投喂鲜孔石莼时幼参的生长效果最好,对水体的氨氮含量影响较小,在刺参幼参培育中添加鲜孔石莼效果较好。
关键词: 刺参;海藻饲料;特定生长率;存活率;氨氮
刺参Apostichopus japonicus主要分布于潮间带至深海海域,绝大多数营底栖生活,附着在礁石、泥沙和海藻丛生的地带[1],主要以底质表面附着的单细胞藻类、海藻碎片、有机碎屑、微生物和腐殖质等为食[2],其中底栖硅藻是重要的食物来源[3]。
随着刺参育苗技术的提高,中国北方沿海刺参人工养殖迅速崛起,成为一种新兴的海洋产业[4-5]。刺参室内工厂化培育主要应用人工配合饲料,但人工配合饲料配方混杂、 营养不平衡,水质污染严重,养殖效果不稳定,已成为制约刺参产业发展的瓶颈之一[6]。近年来,海洋中的天然饵料(如大型海藻)广泛应用于鱼类、虾类、贝类和棘皮动物的海水养殖中,并取得了较好的效果[7],受到人们的关注[8-9]。此后,有学者陆续研究了大型海藻饲料对刺参苗种繁育及幼体生长的影响[10-14],但是,针对大型海藻碎屑对小规格幼刺参培育效果的研究尚未见报道。本研究中,分析了投喂不同海藻饲料对体质量为(1.25±0.02) g幼参的生长和养殖水环境中氨氮含量的影响,旨在为优化刺参配合饲料及提高其苗种培育的经济和生态效益提供参考。
1.1 材料
试验用刺参幼参购自大连市庄河宝发海珍品养殖公司, 体质量为(1.25±0.02)g,采回后暂养于实验室玻璃钢循环水槽中,温度保持在(18±1) ℃,盐度为28~31,暂养前2天不投喂,此后每天投喂适量“益参宝”幼参全价配合饲料,投喂量为幼参体质量的5%~8%,日投喂两次(9:00,17:00),暂养10 d,后2天停止投喂,选健康的个体进行试验。
1.2 方法
1.2.1 饲料的制备 试验用裙带菜Undaria pinnatifida购于水产品批发市场,孔石莼Ulva pertusa和角叉菜Chondrus ocellatus采自大连市黑石礁海区附近的潮间带。将新鲜的海藻用淡水反复清洗,清除其中的砂石粒、小型软体动物和甲壳动物、大型原生动物等,清洗干净后,将海藻置于自来水中煮沸1.5 min,以清除细菌及微生物的代谢产物[15]。
海藻碎屑悬浮液的制备:将新鲜海藻预处理后,取一定量藻体放入粉碎机(MX-J210GP)中,加入少量消毒海水(100 ℃,5 min)研磨,研磨后的海藻碎屑悬浮液分次通过孔径为60 μm的筛绢网过滤,将滤液(碎屑颗粒大小为1~15 μm)于4 ℃下保存。投喂前将饲料滤液进行抽滤,烘干(60 ℃,24 h)后称重,以确定海藻碎屑悬浮液中碎屑的干质量。测定3个重复样品,取平均值即为饲料浓度(干质量,g/mL)。
海藻干粉的制备:将新鲜海藻阴干后放入摇摆式粉碎机内(XY-280B)粉碎1 min后,再经孔径为60  m的筛绢过滤,所得海藻干粉放入冰箱中冷冻保存。
m的筛绢过滤,所得海藻干粉放入冰箱中冷冻保存。
用上述两种加工方法获得的海藻饲料须在7 d内使用。
1.2.2 试验设计与饲养管理 试验分为8组,投喂8种不同海藻饲料,饲料配方设计为干饲料组P1(75%孔石莼干粉+25%海泥)、P2(75%角叉菜干粉+25%海泥)、P3(75%裙带菜干粉+25%海泥)、干混合饲料组MP(25%孔石莼干粉+25%角叉菜干粉+25%裙带菜干粉+25%海泥)、鲜饲料组F1(75%孔石莼碎屑+25%海泥)、F2(75%角叉菜碎屑+25%海泥)、F3(75%裙带菜碎屑+25%海泥)、鲜混合饲料组MF(25%孔石莼碎屑+25%角叉菜碎屑+25%裙带菜碎屑+25%海泥)。每组设3个平行,每个平行放6头幼参。试验在容积为25 L的蓝色塑料水槽中进行,每个水槽加海水20 L,用100 W加热棒控温,水温为(18±1)℃,盐度为28~31,光照周期为10 L∶14D。
试验期间,连续充气,每天换水两次,日换水量为100%,投喂前换水,每天9:00和17:00投喂,过量投喂,投喂量为刺参总质量的4%~5%,共饲养60 d。换水前收集残饵和粪便,于65 ℃下烘干至恒重,干燥保存。每5天彻底清洗一次水槽,定期观察并记录刺参的生长状态及水体的氨氮变化。
1.2.3 指标的测定与计算 试验开始前随机选取30头幼参,置于65 ℃下烘干至恒重,作为试验初始样品的干质量。把刺参轻轻放在干滤纸上30 s后,由固定人员快速称重,以减少操作误差。
试验结束时,测定投喂不同海藻饲料条件下,幼参的特定生长率(SGR)、存活率(SR)、摄食率(IR)、排粪率(FPR)和饲料转化率(FCE),同时测定刺参培养水环境中氨氮的含量,其计算公式为
![]() ,
,
![]() ,
,
![]() ,
,
![]() 。
。
其中:W0和Wt分别为试验初始和结束时幼参的干质量(g);t为试验时间(d);C为摄食的饲料干质量(g);F为排出粪便的干质量(g)。
1.3 数据处理
用SPSS 19.0软件进行单因素方差分析(One-way ANOVA),检验不同饲料组刺参的特定生长率、摄食率、排粪率和饵料转化率的差异性,当差异显著时,用Duncan法进行组间多重比较,显著性水平设为0.05。
2.1 不同饲料组幼参的生长
从表1可见:试验初始各组的幼参湿质量和干质量均无显著性差异(P>0.05);试验结束时,鲜孔石莼饲料组(F1)幼参的湿质量最大,为(2.57±0.17)g,且显著高于其他组(P<0.05),其次为F2组和F3组,P2组幼参的湿质量最小,为(1.49±0.07)g;各组幼参干质量的差异性与湿质量相似,F1组幼参的干质量明显大于其他组(P<0.05);F1组幼参的SGR值最高,为(1.38±0.13)%/d,且显著高于其他组(P<0.05),P2组刺参的SGR值最小,为(0.63±0.11)%/d,且与MP和F2处理组有显著性差异(P<0.05)。
2.2 不同饲料组幼参的存活率
从表1可见:F1组和F3组幼参的存活率最高,均为100%,P1组存活率最低,为83.33%±13.61%;8个饲料组之间均无显著性差异(P>0.05)。总体来看,鲜海藻组幼参的存活率高于海藻干粉组。
表1 不同饲料组仿刺参幼参的特定生长率和成活率(mean±S.E.)
Tab.1 Specific growth rate and survival rate of juvenile sea cucumber Apostichopus japonicus in different diet treatment groups
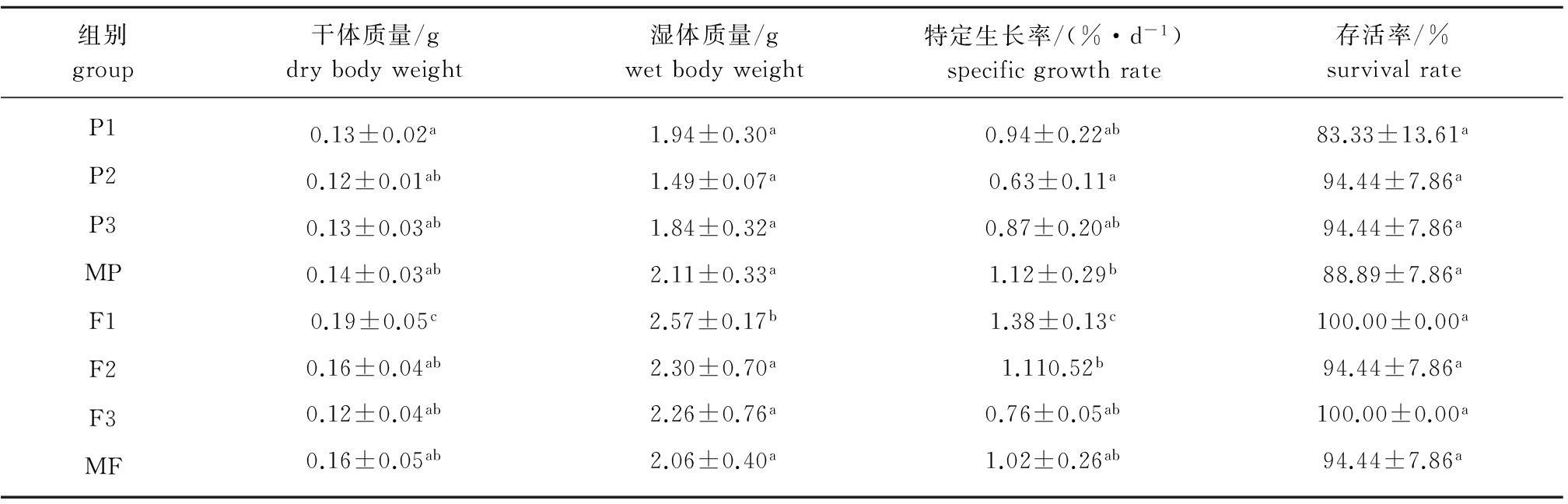
组别group干体质量/gdrybodyweight湿体质量/gwetbodyweight特定生长率/(%·d-1)specificgrowthrate存活率/%survivalrateP1P2P3MPF1F2F3MF0.13±0.02a0.12±0.01ab0.13±0.03ab0.14±0.03ab0.19±0.05c0.16±0.04ab0.12±0.04ab0.16±0.05ab1.94±0.30a1.49±0.07a1.84±0.32a2.11±0.33a2.57±0.17b2.30±0.70a2.26±0.76a2.06±0.40a0.94±0.22ab0.63±0.11a0.87±0.20ab1.12±0.29b1.38±0.13c1.110.52b0.76±0.05ab1.02±0.26ab83.33±13.61a94.44±7.86a94.44±7.86a88.89±7.86a100.00±0.00a94.44±7.86a100.00±0.00a94.44±7.86a
注:同列中标有不同小写字母者表示组间有显著性差异(P<0.05),标有相同小写字母者表示组间无显著性差异(P>0.05),下同
Note:The means with different letters within the same column are significant differences at the 0.05 probability level, and the means with the same letters within the same column are not significant differences, et sequentia
2.3 各组幼参的饲料转化率
从表2可见:F1组幼参的饲料转化率最高,为7.65%±1.38%,且显著高于其他组(P<0.05),饲料系数最小;F3组的饲料转化率最低,为3.97%±0.37%,但仅与F1组有显著性差异(P<0.05)。总体来看,无论是鲜海藻饲料组还是海藻干粉饲料组,孔石莼组的饲料转化率均较高。
2.4 各组幼参的摄食率和排粪率
从表2可见:F1组幼参的摄食率最高,为(0.088±0.007)g/(g·d),且显著高于其他组(P<0.05),其次为MP和MF组,P2组刺参的摄食率最小,为(0.051±0.004)g/(g·d),且与干粉饲料组中的P1组和P3组无显著性差异(P>0.05),但与MP组有显著性差异(P<0.05);鲜海藻处理组的F2、F3和MF组间摄食率无显著性差异(P>0.05)。总体来看,鲜海藻组幼参的摄食率高于海藻干粉组。
从表2可见,F1组幼参的排粪率最高,为(0.008±0.002)g/(g·d),且显著高于其他组(P<0.05),F2、F3组最低,均为(0.002±0.001)g/(g·d),且与MF组无显著性差异(P>0.05);孔石莼干粉组P1组与P2、P3组间有显著性差异(P<0.05),但与MP组无显著性差异(P>0.05)。总体来看,无论是鲜海藻饲料组还是海藻干粉饲料组,孔石莼组的排粪率均较高。
表2 不同饲料组刺参幼参的生长参数和水体中的氨氮含量(mean±S.E.)
Tab.2 Growth parameters of juvenile sea cucumber Apostichopus japonicus and ammonia nitrogen content in water in different diet treatment groups
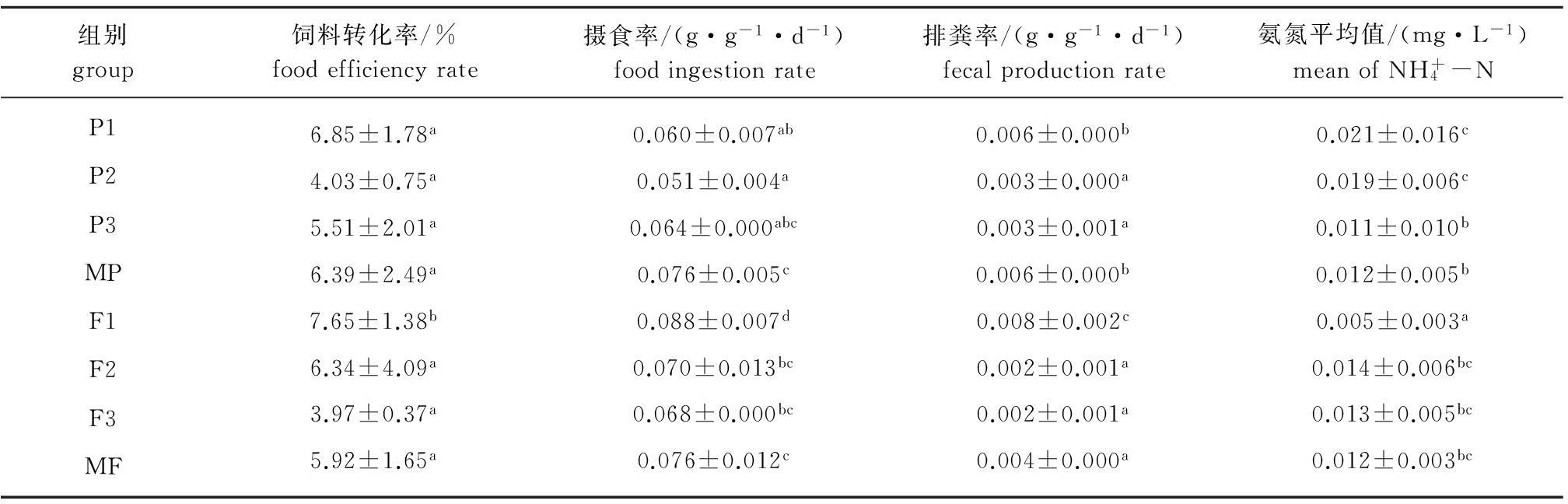
组别group饲料转化率/%foodefficiencyrate摄食率/(g·g-1·d-1)foodingestionrate排粪率/(g·g-1·d-1)fecalproductionrate氨氮平均值/(mg·L-1)meanofNH+4-NP1P2P3MPF1F2F3MF6.85±1.78a4.03±0.75a5.51±2.01a6.39±2.49a7.65±1.38b6.34±4.09a3.97±0.37a5.92±1.65a0.060±0.007ab0.051±0.004a0.064±0.000abc0.076±0.005c0.088±0.007d0.070±0.013bc0.068±0.000bc0.076±0.012c0.006±0.000b0.003±0.000a0.003±0.001a0.006±0.000b0.008±0.002c0.002±0.001a0.002±0.001a0.004±0.000a0.021±0.016c0.019±0.006c0.011±0.010b0.012±0.005b0.005±0.003a0.014±0.006bc0.013±0.005bc0.012±0.003bc
2.5 各组养殖水体中氨氮的含量
从表2可见,F1组水体中的平均氨氮含量最低,为(0.005±0.003)mg/L,且显著低于其他各组(P<0.05),而其他各组间均无显著性差异(P>0.05)。总体来看,鲜海藻饲料对氨氮含量的影响比海藻干粉要低,且随着幼参的生长,除MP和F1组外,各组水体的氨氮含量均呈下降趋势。试验结束时,各组水体中氨氮的含量分别为:P1(0.003±0.003)mg/L、 P2(0.016± 0.006) mg/L、 P3(0.002±0.002)mg/L、 MP(0.016±0.004)mg/L、F1(0.007±0.004)mg/L、F2 (0.015±0.005)mg/L、F3 (0.009±0.008)mg/L、MF(0.008±0.001)mg/L,均低于0.02 mg/L。
在刺参工厂化培育过程中,稚参和幼参阶段的饲料种类主要有海浮泥(含大量底栖硅藻)、大型海藻粉或者磨碎液、人工配合饲料和各种添加剂等,大型海藻主要有鼠尾藻Sargassum thunbergii、马尾藻 Sargassum kjellmanianwn、大叶藻Zostera marina、海带Laminaria japanica 等。目前, 关于不同饲料对刺参幼参生长和存活的影响研究较多[12-14,16]。大量研究表明,孔石莼能有效促进刺参的生长[17],且附着变态后的稚参期,投喂孔石莼碎屑效果最佳[10]。Liu 等[18]和Xia 等[19] 对刺参投喂不同大型海藻时发现,石莼组刺参的增长率和摄食率高于其他组。本研究中,幼参(1.25 g ±0.02 g )摄食鲜孔石莼时生长最快,这与以上研究结果基本一致。但是,本试验中发现,投喂孔石莼干粉饲料时,刺参幼参的生长和存活率处于中等水平,这可能是鲜孔石莼在加工成干粉过程中营养成分发生改变或者有一定程度的损失,因而不能很好地满足幼参的营养需求。
本研究中,幼参摄食鲜孔石莼时生长最快,饲料系数最低,表明鲜孔石莼比其他海藻饲料的促生长作用较大,刺参摄食鲜孔石莼能获得更多的营养物质。有研究指出,鲜孔石莼碎屑富含纤维素、碳水化合物、蛋白质、各种微量元素和多不饱和脂肪酸等,其中蛋白质和氨基酸的含量较高(接近干质量的40%)[20]。Fu等[21]研究认为,在刺参肠道中,消化酶种类较多,但活力最高的是蛋白酶。说明刺参消化蛋白质的能力较强,对食物中蛋白质的需求量也较高[22],如幼参的最适蛋白质需求量为18.21%~24.18%[23-24]。因此,在幼参培育过程中,营养丰富的孔石莼适宜作为幼参的主要饲料,但单一的海藻往往不能满足刺参的生长需求,添加一些富含蛋白质和脂肪的人工配合饲料能明显促进刺参的生长[22]。
刺参以摄食沉积物为主,能量分配模式与其他水产动物不同,排粪能较高,生长能较低[25-27]。本试验中,摄食鲜孔石莼的刺参摄食率明显高于其他饲料组,摄食所获取的能量除一部分用于较高的排粪率和其他活动外,大部分用于生长需求。除鲜孔石莼组外,鲜海藻饲料组刺参的摄食率较海藻干粉组高,而排粪率较低,投喂鲜孔石莼试验组水中的氨氮平均含量明显低于其他组,而投喂孔石莼干粉的水体氨氮含量最高。这种差异的原因,应从海藻和刺参自身的生理生态学分析,可能是海藻所含营养物质和刺参排氨不同所致。
综上所述,在几种常见且易获得的海藻饲料中,投喂鲜孔石莼磨碎液培育幼参的效果最佳。
参考文献:
[1] 廖玉麟.中国动物志 棘皮动物门 海参纲[M].北京:科学出版社,1997.
[2] 常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004.
[3] 隋锡林.海参增养殖[M].北京:农业出版社,1990.
[4] 张春云,王印庚,荣小军.国内外海参自然资源、养殖状况及存在问题[J].海洋水产研究,2004,25(3):89-97.
[5] 宋修武.大力发展海参健康养殖培育海洋渔业经济发展新亮点[J].齐鲁渔业,2005,22(1):1-2.
[6] 袁成玉.海参饲料研究的现状与发展方向[J].水产科学,2005,25(1):71-75.
[7] 常巧玲,孙建义.海藻饲料资源及其在水产养鱼中的应用研究[J].饲料工业,2006,27(2):62-64.
[8] 隋锡林,胡庆明.幼参人工配合饲料的研究[J].水产科学,1986,5(3):22-25.
[9] 唐黎,王吉桥,许重.不同发育期的幼体和不同规格刺参消化道中四种消化酶的活性[J].水产科学,2007,26(5):275-277.
[10] 殷旭旺,林华剑,闵文武,等.投喂不同饵料对刺参海上网箱育苗幼体培育效果的影响[J].大连海洋大学学报,2014,29(2):126-130.
[11] 于丽娜,鄢娜,鲁媛媛,等.刺参北方海区网箱生态繁育技术初步探讨[J].水产养殖,2013(3):11-13.
[12] 王吉桥,隋晓楠,顾公明,等.不同饵料搭配及投饵量对仿刺参稚、幼参生长和成活的影响[J].水产科学,2008,27(2):55-58.
[13] 朱建新,曲克明,李健,等.不同处理方法对浒苔饲喂稚幼参效果的影响[J].渔业科学进展,2009,30(5):108-112.
[14] 吕航,崔相东,王巧晗,等.不同饵料对刺参幼参的生长、耗氧和排氨的影响[J].中国海洋大学学报:自然科学版,2013,43(12):25-29.
[15] Yin X W,Min W W,Lin H J,et al.Population dynamics,protein content,and lipid composition of Brachionusplicatilis fed artificial macroalgal detritus and Nannochloropsis sp.diets[J].Aquaculture,2013,380/383:62-69.
[16] 王吉桥,丛文虎,姜玉声,等.底栖硅藻种类和密度对仿刺参幼体和稚参生长与成活的影响[J].大连海洋大学学报,2010,25(3):203-209.
[17] 朱建新,刘慧,冷凯良,等.几种常用饵料对稚幼参生长影响的初步研究[J].海洋水产研究,2007,28(5):48-53.
[18] Liu Y,Dong S L,Tian X L,et al.The effect of different macroalgae on the growth of sea cucumber (Apostichopus japonicus Selenka)[J].Aquaculture Research,2010,41:881-885.
[19] Xia S D,Yang H S,Zhang L L,et al.Effects of different seaweed diets on growth,digestibility,and ammonia-nitrogen production of the sea cucumber Apostichopus japonicus (Selenka)[J].Aquaculture,2012,338/341:304-308.
[20] Sargent J R,McEvoy L A,Estevez A,et al.Lipid nutrition of marine fish during early development:current status and future directions[J].Aquaculture,1999,179(1/4):217-229.
[21] Fu X Y,Xue C H,Miao B,et al.Characterization of proteases from the digestive tract of sea cucumber (Stichopus japonicus):high alkaline protease activity[J].Aquaculture,2005,246(1/4):321-329.
[22] 王吉桥,唐黎,许重,等.仿刺参消化道的组织学及其4种消化酶活力的周年变化[J].水产科学,2007,26(9):481-484.
[23] 朱伟,麦康森,张百刚,等.刺参稚参对蛋白质和脂肪需求量的初步研究[J].海洋科学,2005,29(3):54-58.
[24] Sun H,Liang M,Yan J,et al.Nutrient requirements and growth of the sea cucumber,Apostichopus japonicus[C]//Advances in sea cucumber aquaculture and management.Rome:FAO,2004:327-331.
[25] 崔奕波.鱼类生物能量学的理论与方法[J].水生生物学报,1989,13(4):369-383.
[26] Tian X L,Dong S L.The effect of thermal amplitude on the growth of Chinese shrimp Fenneropenaeus chinensis[J].Aquaculture,2006,251(2/4):516-524.
[27] Zheng Z H,Dong S L,Tian X L.Effects of intermittent feeding of different diets on growth of Litopenaeus vannamei[J].Journal of Crustacean Biology,2008,28:21-26.
Abstract: Juvenile sea cucumber Apostichopus japonicas with body weight of (1.25±0.02)g was reared in a 25 L plastic tank at a rate of 6 individuals each tank and fed 8 diets containing various proportions of fresh seaweeds (sea lettuce Ulva pertusa, chondrus Chondrus ocellatus, sea mustard Undaria pinnatifida) and powder and 25% sea mud for 60 days to evaluate the effects of different seaweed diets on the growth of sea cucumber juveniles at water temperature of (18±1)℃. Ammonia nitrogen level in water and growth were measured at the end of the feeding trial. The results showed that there were no significantly differences in survival rates (over 80%) of sea cucumber fed different diets (P>0.05). However, there were significant higher specific growth rate [(1.38±0.13)%/d] and food conversion efficiency in the sea cucumber juveniles fed fresh sea lettuce than those in the other diet groups (P<0.05), without significantly differences in food conversion efficiency among the other diet groups (P>0.05). There was the maximal food ingestion rate and fecal production rate in the sea cucumber fed fresh sea lettuce, significantly different from those in the sea cucumber fed other diets (P<0.05 ). At the end of the experiment, there was the minimal ammonia nitrogen concentration [(0.005±0.003)mg/L] in the water where the sea cucumber juveniles fed fresh sea lettuce were reared, and there was the maxima ammonia nitrogen concentration [(0.021±0.016)mg/L] in the water where the sea cucumber juveniles fed sea lettuce powder were reared, with significant difference between them (P<0.05). The findings indicate that the sea cucumber juveniles have good growth, and the ammonia nitrogen concentration in the water is kept low when they are fed fresh sea lettuce.
Key words: Apostichopus japonicus; seaweed diet; specific growth rate; survival rate; ammonia nitrogen
基金项目: 国家“十二五”科技支撑计划项目(2011BAD13B03);辽宁省高等学校优秀人才支持计划项目(LJQ2011079);大连市科学技术基金资助项目(2012J21DW013)
收稿日期: 2014-09-23
中图分类号:S968.9
文献标志码:A
文章编号:2095-1388(2015)03-0276-05
DOI:10.16535/j.cnki.dlhyxb.2015.03.008